La manzana (Malus domestica) es uno de los frutos de mayor producción en el mundo, con un volumen global de cosecha de aproximadamente 80.8 millones de toneladas en 2013 (FAO, 2013. El principal productor de esta especie es China, con una producción anual de 39.6 millones de toneladas (49% de la producción mundial; FAO, 2013). La Unión Europea y los Estados Unidos ocupan el segundo y tercer lugar respectivamente (FAO, 2013). La producción de estas cantidades de manzana demanda el uso de plaguicidas (Sauphanor et al., 2009; Simon et al., 2011) tanto en el campo como en el almacenamiento y transporte (Ticha et al. 2008). Uno de los fungicidas más ampliamente aplicados para extender la vida de anaquel de las manzanas es Tiabendazol (He et al., 2014). La tolerancia de residuos en frutos de este producto es de 5 μg/g en los Estados Unidos de Norteamérica (U.S. Government Publishing Office (GPO), 2015). Muchas veces, con la intención de lograr mejor control de enfermedades, se aplican fungicidas a dosis más altas de las recomendadas, sobrepasando la tolerancia máxima de residuos, y representando así un riesgo de daño a los consumidores. Varios fungicidas se han asociado a la causa de un gran número de enfermedades que afectan la salud humana tales como cáncer, daños reproductivos y disrupción endócrina (Baldi et al., 2001). Debido al conocimiento de esta información los consumidores son más conscientes de su alimentación y demandan productos más saludables, mínimamente procesados, y sin residuos químicos o que hayan sido tratados con productos alternativos a los productos sintéticos (Saucedo et al., 2009, Volk et al., 2015). Uno de los principales patógenos que afectan a la manzana en postcosecha es Penicillium expansum, conocido comúnmente como moho azul. Este microorganismo causa las mayores pérdidas en frutos de manzana (Sanzani et al., 2010), y es controlado principalmente mediante el uso de fungicidas sintéticos (Zhang et al., 2011). Una alternativa a los tratamientos químicos es el uso de protectantes vegetales con actividad antimicrobial, algunos de los cuales son efectivos en el control de enfermedades en postcosecha (Kim et al., 2004; Singh et al., 2007), tienen menos efectos ambientales, y no dañan o incluso mejoran la salud humana (Paranagama et al., 2003). La morera (M. alba) ha sido aprovechada en medicina humana para controlar patógenos fúngicos y bacterianos, y su composición química ha sido estudiada ampliamente (Park et al., 2003; Omidiran et al., 2012). Al respecto, Park et al. (2003) encontraron que un compuesto conocido como kuwanon extraído de raíces de morera inhibió significativamente el desarrollo de Streptococcus sobrimus y S. sanguinnis en infecciones bucales. Otros compuestos químicos que han sido identificados en hojas de esta misma especie son alcaloides, saponinas, taninos, compuestos fenólicos, terpenos, glucósidos y flavonoides, considerándose estos con actividad antimicrobial (Cushnie y Lamb, 2006; Soetan et al., 2006; Omidiran et al., 2012; Oh et al., 2013). El 2-arilbenzofuran es un compuesto encontrado en hojas de M. alba que se reporta como un agente efectivo de control de Escherichia coli y Pseudomona aeruginosa (Fukai et al., 2005).
Otras bacterias que han sido controladas con derivados de M. alba son Staphylococcus aureus, Micrococcus luteus, (Fukai et al., 2005, Rao et al., 2012), Pseudomonas aeruginosa, S. faecium, Escherichia coli, Neisseria gonorrheae, y Proteus vulgaricus (Omidiran et al., 2012). El efecto de algunos derivados de M. alba en hongos se ha estudiado en medicina humana en Candida albicans, Aspergillus niger (Rao et al., 2012), Aspergillus tamari, Fusarium oxysporum y P. oxalicum (Omidiran et al., 2012). No obstante, poco se sabe sobre el efecto de extractos de esta especie vegetal en el control de hongos fitopatógenos. En la literatura solo se reportan estudios sobre el control de a A. niger (Rao et al., 2012), F. guttiforme, Charala paradoxa (Cerqueira et al., 2016), F. oxysporum y P. oxalycum (Omidiran et al., 2012). El entendimiento del efecto de extractos de morera en el control de hongos fitopatógenos podría constituir una alternativa sustentable de control del moho azul en manzana en postcosecha así como en campo y en otros cultivos.
El presente trabajo tuvo como objetivo evaluar el efecto de extractos de hojas de morera (M. alba) en el control de P. expansum in vitro y en frutos de manzana en postcosecha (in vivo).
Materiales y métodos
El trabajo de investigación se realizó en el año 2015, en las instalaciones de la Universidad Politécnica de Francisco I. Madero, específicamente en el área de experimentación ubicada en 20.227044° de latitud y -99.089386° de longitud, en el municipio de Tepatepec, Hidalgo, México.
Aislamiento del patógeno y pruebas de patogenicidad. El hongo P. expansum fue aislado de frutos de manzana con síntomas característicos de moho azul colectados en la central de abasto de la Ciudad de México. Fragmentos (5 x 5 mm) de frutos con aproximadamente 20 % de tejido sintomático y 80 % de tejido sano se sembraron en cajas Petri con Papa Dextrosa Agar (PDA) y se incubaron a temperatura ambiente (26±2 °C) durante 10 días. Después de la incubación, una porción de micelio se transfirió a otra caja de Petri con PDA para purificar las cepas. Una vez confirmada la identidad de P. expansum mediante las claves morfológicas de Seifer et al., (2011), la cepa se sembró en medio de cultivo PDA, donde se desarrolló por un período de siete días a 28 °C en condiciones de oscuridad en una incubadora (Thermo scientific®). Al término del periodo de incubación, se preparó una suspensión de esporas (conidios) para inocular frutos de manzana sanos y para verificar la patogenicidad del aislamiento. La suspensión conidial se preparó raspando el micelio y los conidios, filtrando la suspensión, y ajustándola a una concentración de 1x106 conidios mL-1 mediante el uso de una cámara Neubauer. Frutos de manzana (M. domestica) variedad Golden Delicious fueron seleccionados de un comercio de frutas en el municipio de Actopan, Hidalgo, México. Todos los frutos seleccionados tuvieron más o menos el mismo tamaño y color y se encontraban libres de daños y signos de infección. Diez frutos se lavaron y desinfestaron con una solución de hipoclorito de sodio al 3 % v/v, y se les realizaron dos heridas de 2 mm de diámetro y 2 mm de profundidad con una aguja de disección esterilizada. Posteriormente, usando una micropipeta, se depositaron 20 μL de la suspensión conidial en la herida para reproducir los síntomas del moho azul y así corroborar la patogenicidad de P. expansum. A cinco frutos testigo se les depositó agua destilada-esterilizada. Varias cajas Petri en las que cultivó el hongo, se mantuvieron para usarse en los experimentos in vitro e in vivo que se describen este estudio.
Material vegetal y preparación de los extractos. Las hojas de morera usadas para los extractos se colectaron de plantas establecidas en el año 2012 en el área de cultivo de la Universidad Politécnica de Francisco I. Madero. De la parte media del dosel de las plantas se seleccionaron hojas visualmente sanas y uniformes en color y tamaño, y una vez colectadas se lavaron con agua destilada para eliminar cualquier residuo en la superficie. Se pesó 1 kg de hojas, y en varias porciones se trituraron en una licuadora durante un minuto hasta que se observó savia. Las trituraciones obtenidas se mezclaron y distribuyeron por peso en cuatro frascos de vidrio ámbar de un litro para evitar la luz. En cada frasco se vertieron 600 mL de agua destilada cubriendo todas las hojas trituradas. La mezcla se dejó reposar durante 72 horas para arrastrar los metabolitos mediante la polaridad del agua. Pasado este tiempo se eliminaron los sólidos con papel filtro Whatman® grado 54 y se obtuvo una solución madre del extracto (se mezclaron los extractos obtenidos de los cuatro frascos) que se consideró como el extracto acuoso o extracto sin solvente. Después se procedió a separar las fases de dicha solución usando dos solventes diferentes: metanol y acetato de etilo. Para esto, en un matraz de separación de fases, se vertieron 100 mL del extracto acuoso y 100 mL de acetato de etilo o metanol (de grado reactivo, con una pureza del 99 %). La solución se dejó reposar hasta que se observó la separación completa de dos fases. Empleando la válvula del matraz se eliminó la fase inferior y se obtuvo aquella que contenía el solvente con los posibles metabolitos antimicrobiales (Bresin et al., 2015). Las fracciones obtenidas con los respectivos solventes (metanol y acetato de etilo) fueron concentradas en un rotavapor a presión reducida (Ika®) para obtener el extracto libre de los solventes de extracción. Los extractos se almacenaron a una temperatura de 4 °C hasta que se requirieron para los experimentos. En lo sucesivo, por simplicidad y claridad los extractos se denominan extracto acuoso, extracto obtenido en metanol y extracto obtenido en acetato de etilo.
Control de P. expansum in vitro. En esta fase del experimento se probaron 11 tratamientos en medio de cultivo: PDA + extracto acuoso, PDA + extracto obtenido en metanol, y PDA + extracto obtenido en acetato de etilo (cada uno a concentraciones de 4, 8 y 12 %), PDA + Imazalil 500 mg L-1 como testigo químico, y PDA + agua destilada como testigo absoluto. Para preparar estas soluciones, en matraces separados conteniendo la cantidad complementaria de PDA sin solidificar se vertieron las cantidades correspondientes de los extractos para obtener las concentraciones deseadas (en la concentración al 4 % se vaciaron 4 mL de la solución madre obtenida con cada solvente en 96 mL de medio de PDA para completar 100 mL, y así sucesivamente con las otras concentraciones). Cada solución se vació en cajas Petri debidamente etiquetadas y se dejó solidificar el medio. Después, en el centro de cada caja se transfirió un disco de micelio de P. expansum de 5 mm de diámetro, el cual se obtuvo de las cajas que se prepararon anteriormente en las pruebas de patogenicidad. Los tratamientos se dispusieron en un diseño completamente al azar con cinco repeticiones. Las cajas Petri fueron incubadas a 28 °C (Incubadora Thermo Scientific®) durante ocho días, en oscuridad.
Para determinar la eficacia de cada tratamiento en el control de P. expansum, se midió el crecimiento radial de las colonias del hongo cada 24 horas, y se evaluó la esporulación del hongo (concentración de conidios en el medio de cultivo) a los 10 días. Cada caja Petri se enjuagó con agua destilada-esterilizada, la superficie se raspó con una varilla de vidrio y se filtró a través de una malla de algodón esterilizada. Alícuotas de 0.5 mL de cada caja fueron transferidas a una cámara de Neubauer y se contaron los conidios. El experimento completo se repitió una vez más a las 48 horas de haberse concluido el primero.
Control de P. expansum in vivo. Se seleccionaron frutos de manzana Var. Golden Delicious sin daño o signos de infección (aparentemente sanos) y de coloración y tamaño similar para inocularse artificialmente con P. expansum. Los frutos se desinfestaron con hipoclorito de sodio al 2 % durante tres minutos, se enjuagaron con agua destilada estéril y se secaron a temperatura ambiente sobre papel secante. De manera paralela se preparó una suspensión de esporas de P. expansum a concentración de 1x106 conidios mL-1, así como concentraciones a 4, 8 y 12 % del extracto acuoso y de los extractos obtenidos en metanol y acetato de etilo en agua esterilizada, para lo cual se determinó la cantidad total por tratamiento de solución requerida para cubrir las manzanas, y basado en ello se calculó la cantidad de cada extracto que debería mezclarse con el agua esterilizada para asperjar. Al igual que en el experimento in vitro, se incluyó Imazalil 500 mg L-1 como testigo químico, y agua destilada como testigo absoluto. Las soluciones se asperjaron sobre los frutos desinfestados en un diseño experimental completamente al azar con cinco repeticiones por tratamiento (cinco frutos, cada uno con dos heridas artificiales). Veinticuatro horas después de la aspersión se procedió a inocular el patógeno sobre los frutos. Para ello, con una aguja de disección esterilizada se hicieron dos heridas de 2 mm de profundidad (solo para asegurar el síntoma, ya que el hongo no necesita de heridas para penetrar) y sobre dichas heridas se depositaron 20 μL de la suspensión conidial (1x106 conidios mL-1) del patógeno con una micropipeta (20,000 esporas). Los frutos fueron colocados en cámara húmeda a temperatura de 26 ± 2 °C, y después de la incubación se calculó el diámetro de la lesión midiendo el radio de la herida cada 24 horas con un vernier digital. Todo el experimento se repitió 48 horas después de concluirse el primero. La efectividad fue calculada con la fórmula:
Cambio de color en frutos. Para determinar si hubo algún efecto de los extractos en la coloración de los frutos tratados, se tomaron diariamente fotografías de los frutos incubados en la cámara húmeda usando una cámara marca Fujifilm® de 12 megapixeles. Las fotografías se tomaron a una distancia de 30 cm con iluminación proporcionada por una lámpara fluorescente de 20 w. El ángulo entre la lente de la cámara y la fuente de la iluminación fue de aproximadamente 45°. La apertura del diafragma utilizada fue f/2.8 y la velocidad del obturador de 1/30 s. Estos parámetros se mantuvieron constantes durante la toma de todas las imágenes, y éstas se guardaron en formato JPEG. Las medias de los valores correspondientes a rojo, verde y azul (RVA) que conforman el color real del fruto de manzana, se analizaron estadísticamente mediante el programa Adobe® Photoshop® CS5 versión 12.0.4. Los valores más cercanos a los del testigo absoluto (sin tratar) corresponden a la coloración exigida en los mercados para la especie y variedad (Landero et al., 2013).
Análisis estadístico. Con los datos del experimento in vitro (longitud del crecimiento micelial) se calculó el área bajo la curva (ABC) usando el método de los polígonos (Liengme, 2013). El ABC de cada tratamiento se sometió a análisis de varianza. Para el crecimiento del hongo a través del tiempo, se obtuvieron medias de cada uno de los tratamientos por cada uno de los días en que se llevó a cabo la evaluación, sometiéndose a análisis de varianza y pruebas de separación múltiple de medias de Tukey. Para la variable cuyos datos no fueron normales, éstos se transformaron con la raíz cuadrada √. Con los datos de severidad (diámetro de la lesión) del experimento in vivo se determinó el ABC de la enfermedad mediante el método antes descrito. Los resultados fueron sometidos a análisis de varianza y pruebas de separación múltiple de medias de Tukey mediante el programa SAS v.9 para Windows®. Para evaluar el cambio de color en los frutos, los valores de R, G y B fueron evaluados por separado, y sometidos a análisis de varianza y pruebas de separación múltiple de medias de Tukey, empleando el programa mencionado previamente.
Resultados y discusión
Control de P. expansum in vitro. El crecimiento micelial del hongo en PDA varió significativamente (P<0.0001) entre tratamientos, siendo significativamente menor en las cajas que contenían la fase metanólica al 4 y 12 %, así como la fase acuosa a esos mismos porcentajes. El mayor crecimiento del hongo fue observado en el testigo absoluto (Cuadro 1). Según Chon et al. (2009), el mayor contenido de fenoles fue determinado cuando se empleó metanol como solvente para realizar el extracto en hojas de morera, lo cual es de importancia al considerar a los fenoles como metabolitos secundarios que poseen propiedades antimicrobiales (Wang et al., 2012). Sin embargo, en el presente trabajo, se obtuvieron resultados similares en los ensayos en los que se empleó el metanol y el agua como solventes, por lo que se infiere que otro u otros metabolitos desconocidos diferentes a los fenoles podrían ser los responsables del efecto antimicrobial observado. Al respecto Ayoola et al. (2011) mencionan que cuando emplearon agua y etanol como solventes para obtener extracto crudo de hojas de M. alba el análisis mostró la presencia de compuestos fenólicos y flavonoides, que han sido reportados con actividad antimicrobial (Cushnie y Lamb, 2006; Soetan et al., 2006). De acuerdo a Ayoola et al. (2011), el extracto crudo inhibió el crecimiento de los hongos A. niger, A. tamari, F. oxysporum y P. oxalycum. Es de importancia mencionar que para esta variable el testigo químico no tuvo control alguno, siendo similar al testigo absoluto.
Cuando la comparación de medias se llevó a cabo por el grupo de solventes empleados para la extracción, también se encontró diferencia estadística significativa entre tratamientos (P<0.0001); presentándose el menor desarrollo del micelio cuando éstos fueron preparados a base de extracto acuoso, así como cuando la extracción fue hecha con metanol (Cuadro 1). El testigo absoluto fue el único que mostró diferencia con todos los tratamientos, mostrando el mayor crecimiento micelial. Asli et al. (2014) reportaron que el extracto obtenido con metanol de hojas de M. alba exhibieron actividad antimicrobial en contra de C. albicans y A. niger, lo cual corrobora lo obtenido en el presente estudio.
Cuadro 1. Crecimiento micelial de Penicillium expansun in vitro bajo diferentes tratamientos a base de hojas de Morus alba como extracto acuoso, metanólico y con acetato de etilo.
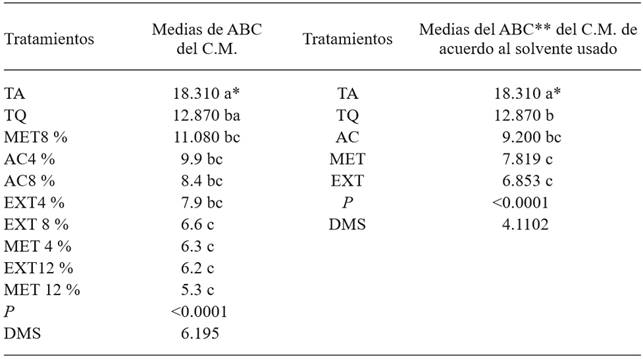
*Letras iguales indican ausencia de diferencia estadística significativa (Tukey, P≤0.05). **El área bajo la curva se presenta en valores adimensionales.
TA= control sin tratar, TQ= Testigo químico, MET8 %= Separación de fase con metanol, a una concentración de 8% en medio de cultivo PDA, AC4 %= Separación de fase empleando acetato de etilo, a una concentración de 4% en medio de cultivo PDA, AC8 %= Separación de fase empleando acetato de etilo, a una concentración de 8 % en medio de cultivo PDA, EXT4 %= Extracto de Morus alba a una concentración de 4 % en medio de cultivo PDA, EXT8 %= Extracto de Morus alba a una concentración de 8 % en medio de cultivo PDA, MET4 %= Separación de fase con metanol, a una concentración de 4 % en medio de cultivo PDA, EXT12 %= Extracto de Morus alba a una concentración de 12 % en medio de cultivo PDA, MET12 %= Separación de fase con metanol, a una concentración de 12 % en medio de cultivo PDA. C.M.=Crecimiento micelial. DMS=Diferencia mínima significativa.
Se puede observar que con los extractos acuosos y metanólicos se obtuvo la menor ABC (Cuadro 1), esto coincide con los tratamientos con los cuales se obtuvo el menor crecimiento micelial del patógeno. Omidirán et al. 2012, mencionan que al aplicar extractos acuosos de M. alba sobre hongos o bacterias, estos tuvieron un menor crecimiento que cuando se hicieron aplicaciones de extractos etanólicos, lo cual refuerza lo obtenido en el presente trabajo.
En el análisis del desarrollo del hongo a través del tiempo se observó que el incremento en intensidad de la enfermedad fue homogéneo. A partir de la segunda evaluación, todos los tratamientos mostraron diferencias estadísticas significativas entre ellas. El testigo absoluto mostró los mayores valores de crecimiento micelial en cada una de las lecturas tomadas (Figura 1). Los tratamientos a base me extracto acuoso y metanólico se mantuvieron como los que mostraron el menor desarrollo del patógeno a lo largo del tiempo, únicamente durante las lecturas tres y cinco todos los tratamientos fueron iguales, a excepción del testigo absoluto que presentó los mayores valores.
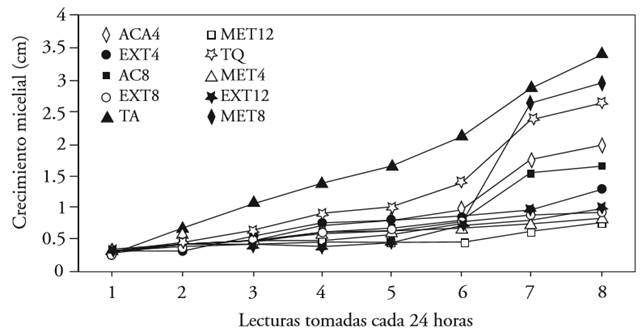
Figura 1. Crecimiento micelial por lectura de Penicillium expansum bajo diferentes concentraciones de extractos de Morus alba obtenidos con tres solventes. Cada línea con diferente color indica un tratamiento.
Los tratamientos en los que se observó el menor número de conidios por mL fueron aquellos para los cuales el medio de cultivo fue mezclado con extracto acuoso al 4%, acetato de etilo al 8% y extracto acuoso al 12%, igualando estadísticamente al testigo químico (DMS=63.01; Cuadro 2). Lo anterior es relevante, ya que las esporas son un mecanismo de dispersión e infección efectivo, y con la aplicación de los tratamientos mencionados anteriormente, estas disminuyen. Lo anterior puede deberse a que el metanol que fue el solvente con uno de los mejores resultados y utilizado para la extracción de hojas de M. alba presenta un arrastre de compuestos fenólicos, los cuales ya se ha mencionado previamente tienen actividad antimicrobial (Chon et al., 2009), esto se confirma también con la inhibición del crecimiento micelial del patógeno cuando se empleó el mismo solvente. Por otro lado, la mayor cantidad de conidios se observó en el testigo absoluto. En cuanto al favorable resultado con la aplicación del extracto acuoso, Cerqueira et al. (2016) encontraron que los mayores halos de inhibición sobre F. guttiforme se observaron precisamente con tratamiento a base de extracto acuoso de hoja de Bonetia stricta. Al respecto se puede mencionar que un extracto es la mezcla completa de los metabolitos que poseen las hojas de la planta, pudiendo ser esta condición lo que logra el menor crecimiento micelial o menor número de esporas del patógeno; mientras que la aplicación de un solo metabolito es posible que sea menos efectiva, esto no aplica en todos los casos de extractos.
Cuadro 2. Número medio de esporas de Penicillium expansum debido a diferentes tratamientos a base de hojas de Morus alba como extracto acuoso, metanólico y con acetato de etilo.
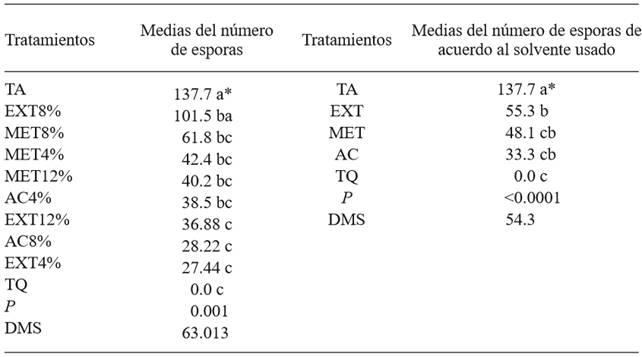
*Letras iguales no indican diferencia estadística significativa (Tukey, P≤0.05). Datos fueron transformados a √, se muestran los valores reales para una mejor comprensión.
La esporulación de P. expansum fue significativamente diferente entre los tratamientos con dos solventes (acetato de etilo y metanol). Sin embargo, en ambos solventes la esporulación fue menor comparada con el testigo sin tratar. En lo que respecta al extracto acuoso, los resultados indican que fue estadísticamente diferente al testigo absoluto pero no mejor que el extracto obtenido con metanol y con acetato de etilo (Cuadro 2). En este caso el testigo químico mostró la mayor efectividad, sin presentarse esporas.
Control de P. expansum in vivo. Los resultados mostraron diferencias estadísticas significativas entre tratamientos (P ˂0.0001). El tratamiento con la menor ABC del progreso de la enfermedad fue aquel donde se utilizó el extracto acuoso al 4 % (Cuadro 3), solo siendo superado por el testigo químico. El extracto de hojas de la especie en estudio fue probado en contra de A. niger y C. albicans, revelando que todas las concentraciones mostraron una notoria actividad antimicrobial (Rao et al., 2012). Cabe mencionar que M. alba ha sido ampliamente estudiada en cuanto a su composición fitoquímica, así como su efecto sobre microorganismos humanos patógenos (Cushnie y Lamb, 2006; Soetan et al., 2006; Rao et al., 2011 Omidiran et al., 2012; Oh et al., 2013); sin embargo, la información acerca de su efecto en microorganismos que causan pérdidas en la agricultura es precaria. El presente trabajo documenta información sobre el efecto de extractos de hoja en un fitopatogeno de importancia económica. De igual manera, actividad antibacterial también ha sido reportada, debida a Kuwanon G, compuesto aislado de raíces de M. alba (Rao et al.,2012).
Cuadro 3. Severidad media causada por Penicillium expansum en frutos de manzana tratados con extractos de hojas de Morus alba como extracto acuoso, metanólico y con acetato de etilo.
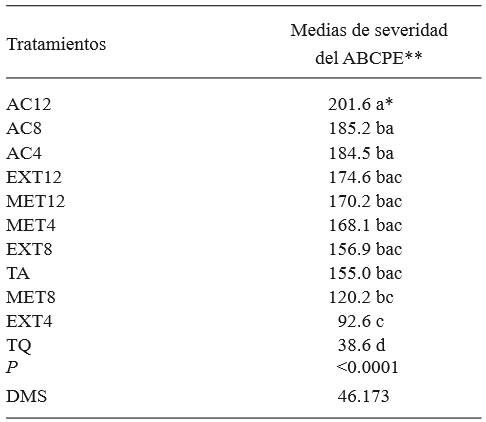
*Letras iguales no indican diferencia estadística significativa (Tukey, P≤0.05).
**Los valores mostrados para ABCPE son adimensionales. ABCPE= área bajo la curva del progreso de la enfermedad.
Por otro lado, el tratamiento en el que se observó un área mayor fue el extracto obtenido con acetato de etilo al 12 %, que favoreció el desarrollo del patógeno, el resto de los tratamientos así como el testigo sin tratar mostraron un comportamiento similar entre ellos, incluyendo extracto obtenido con metanol que en crecimiento micelial y producción de esporas fue de los tratamientos donde se obtuvieron los menores valores de crecimiento. El acetato de etilo es un solvente de mediana polaridad que extrae más compuestos que el metanol u otros solventes. Dentro de ellos se encuentran los carbohidratos (Mumammad et al., 2014) que sirven como fuente de alimento y crecimiento para microorganismos, tales como los hongos. El testigo químico mostró el menor desarrollo de la enfermedad (75.09 % de efectividad), seguido por el tratamiento en el cual se empleó extracto acuoso al 4 % para control de la enfermedad (40.26 % de efectividad), estos resultados concuerdan con lo obtenido por Omidiran et al. (2012), quien encontró que al aplicar extractos acuosos de M. alba sobre ciertos hongos y bacterias, estos se vieron inhibidos en su crecimiento.
El análisis de imágenes para evaluar el cambio de coloración en los frutos mostró que el tratamiento extracto obtenido con acetato de etilo al 8% causó decoloración de frutos comparado con testigo absoluto, el cual no indujo ningún cambio de color y tiene la coloración requerida por el mercado (Cuadro 4). El resto de los tratamientos se mostraron estadísticamente similar al testigo sin tratar, que indica que no se presentaron cambios en la coloración debida a los tratamientos. El cambio en la coloración en los frutos por el extracto obtenido con acetato de etilo al 8 % se explica por el uso de este solvente, que extrae compuestos diferentes que el metanol, como son antraquinonas, carbohidratos y flavonoides (Mumammad et al., 2014), posiblemente en cantidades mayores que otros solventes.
Cuadro 4. Penicillium expansum y medias de RVA sobre frutos de manzana después de aplicar tratamientos a base de hojas de Morus alba como extracto acuoso, metanólico y con acetato de etilo.
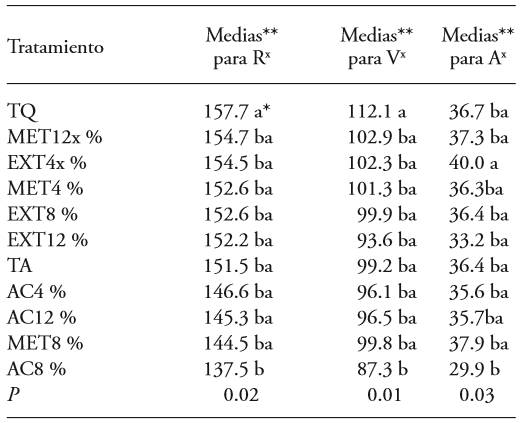
*Letras iguales no indican diferencia estadística significativa (Tukey, P≤0.05).
**Medias para RVA son adimensionales. R=rojo, V=verde, A=azul.
x Los valores más cercanos a los obtenidos para el testigo absoluto corresponden a la coloración normalmente exigida en los mercados para la especie y variedad, mientras que los más alejados podrían indicar cambio de coloración normal del fruto.
Lo anterior sugiere que si se usan extractos de hojas de morera para controlar el moho azul en frutos cosechados, no se recomienda el uso de acetato de etilo como solvente extractor, pues éste cambia la coloración del fruto y estimula el desarrollo del hongo (Cuadro 3). Los resultados demuestran que el uso de metanol o agua son menos influyentes en la coloración del fruto. Además, como se mencionó previamente, el metanol es el solvente con el cual se extrae la mayor cantidad de fenoles (Wang et al., 2012) y es preferible por ser menos contaminante y costoso que otros solventes.
Conclusiones
Los resultados de este estudio sugieren que los extractos de hojas de morera tienen potencial para usarse como una alternativa de control de P. expansum en frutos de manzana en postcosecha. En la extracción de los metabolitos antimicrobiales de esta planta, se recomienda usar metanol a 4% or 12% y no acetato de etilo, ya que éste último podría decolorar los frutos y estimular el desarrollo del hongo. Este trabajo motiva la realización de otros estudios sobre el efecto de extractos de M. alba en patógenos en otros cultivos de importancia económica. Es pertinente indicar que para un manejo más efectivo del moho azul, la aplicación del extracto de morera debe de complementarse con otras medidas sustentables de control, por ejemplo, con el manejo de las condiciones ambientales en atmósferas controladas. Otros solventes más efectivos para extraer metabolitos de M. alba y de menor riesgo de uso o toxicidad deben probarse para la extracción. El presente trabajo no consideró la determinación de la composición química de M. alba bajo las condiciones de clima, suelo y diversidad vegetal del lugar de estudio. Esta parte de investigación sería de interés para futuros trabajos en control de hongos con productos orgánicos. La decoloración de los frutos que se observó por el efecto del acetato de etilo es un tema de investigación para conocer que compuestos o metabolitos son responsables de tal efecto.











 texto en
texto en 



