La cebolla es un cultivo de importancia económica del cual se cosechan anualmente 53 millones de toneladas de bulbos de los casi 3 millones de hectáreas sembradas en todo el mundo (Gent et al., 2006). En Latinoamérica, México es el mayor productor de cebolla con 77,328 t cosechadas en 7,400 ha; además, es el décimo exportador a nivel mundial (FAO, 2011). Es el quinto cultivo más importante de las hortalizas; en Morelos se cosecha 10 % de la superficie sembrada en el país, lo que lo convierte en el cuarto mayor productor a nivel nacional (SIAP, 2012).
Entre las enfermedades que afectan al cultivo se encuentran las de índole viral, especialmente el Iris yellow spot virus (IYSV) (Gent et al., 2006).
El IYSV infecta a varias especies del género Allium incluyendo a la cebolla (Allium cepa) causando la mancha amarilla de la cebolla. Este virus pertenece al género Tospovirus de la familia Bunyaviridae (Gent et al., 2006). Su presencia se ha detectado desde 1981 en Brasil y Estados Unidos (Cortês et al., 1998.). El IYSV se ha propagado a importantes regiones productoras de cebolla a nivel mundial (Bulajić et al., 2009; Córdoba et al., 2005; Du Toit et al., 2004; Gent et al., 2006; Gera et al., 2004; Nischwitz et al., 2007; Pozzer et al., 1999; Schwartz et al., 2002; Smith et al., 2006).
En México este virus se ha identificado en plantaciones y viveros de cebolla de Zacatecas (Velásquez y Reveles, 2011; Velásquez et al., 2016).
El IYSV es trasmitido por Thrips tabaci, principal plaga de este cultivo (Riley et al., 2011). Kritzma et al. (2001) encontraron una relación entre las poblaciones de T. tabaci y la incidencia de la infección de IYSV, y demostraron que las concentraciones más elevadas del virus están en el área cercana al cuello de la planta, el cual es el sitio de alimentación y protección de trips.
La incidencia de IYSV aumenta después de la iniciación de la formación del bulbo con un incremento de 40 % comparado con 3 % antes de esta etapa (Fichtner et al., 2004; Hammon 2004), y a menudo alcanza niveles de 50 a 60 % (Kritzman et al., 2001), en países como Brasil ha llegado a niveles de 100 % provocando pérdidas totales de producción tanto de semilla como de bulbos (Pozzer et al, 1999).
El daño causado por el virus propicia el secado del follaje y la detención del crecimiento de los bulbos. Por lo tanto, el principal impacto económico de esta enfermedad está asociado con la reducción del tamaño de bulbo y en consecuencia la disminución del rendimiento (Gent et al., 2004). Además, la infección hace más susceptible a la planta de cebolla a condiciones adversas como sequía, exceso de riego, temperaturas altas, daño de minadores y trips, entre otros (Velásquez et al., 2016).
En México, el cultivo de esta hortaliza se realiza en dos ciclos agrícolas, el más importante es el de otoño-invierno donde se obtiene 60 % de la producción total, pero los síntomas de IYSV han sido observados en los dos ciclos mencionados (Osuna y Ramírez, 2013). El objetivo del presente trabajo fue detectar la presencia de IYSV, mediante RTPCR en tiempo real, en plantas de cebolla provenientes de Tepalcingo, Morelos.
Se realizó la extracción de RNA total a cinco plantas de cebolla en la fase de formación de bulbo con síntomas atribuidos a IYSV, como se observa en la Figura 1, utilizando TRIzol® Reagent (Invitrogen). La síntesis de cDNA se llevó a cabo con 1 μg de RNA total con el paquete QuantiTect Reverse Transcription kit® (QIAGEN) utilizando los iniciadores IYSV-465c e IYSV-239f, específicos para la detección de IYSV (Pappu et al., 2008). La reacción de PCR en tiempo real se realizó con el paquete QuantiFast® SYBR® Green PCR (QIAGEN) con 10 ng de cDNA. Cada muestra se analizó por triplicado. El programa de PCR en tiempo real consistió de un paso inicial a 95 °C durante10 min, seguido de 40 ciclos con tres pasos: 95 °C 10 s, 61 °C 15 s, 72 °C 10 s. La ganancia de optimización fue registrada entre los 72 y 95 °C para la curva de disociación. La secuenciación parcial del gen N de la nucleoproteína se realizó utilizando los iniciadores IYSV917L e IYSV56U (Robène-Soustrade et al., 2006). El programa CLC Sequence Viewer 6.7 se utilizó para realizar el análisis filogenético entre la secuencia parcial del gen de la nucleoproteína de IYSV identificada en Tepalcingo, Morelos, con otras muestras reportadas en las bases de datos del GenBank NCBI (National Center for Biotechnology Information). El análisis se realizó con el algoritmo UPGMA con 100 replicaciones.
Los síntomas encontrados en los cultivos de cebolla relacionados con IYSV fueron manchas cloróticas, amarillentas o blancas, secas y alargadas. Las hojas maduras con los síntomas antes descritos presentaban manchas alargadas de diferentes tamaños, las cuales ocuparon hasta 70 % de su superficie (Figura1).

Figura 1. Síntomas asociados a la infección por Iris yellow spot virus en plantas de cebolla: a) y b) manchas cloróticas al inicio de la infección; c) manchas alargadas de color pajizo; d) coalescencia de lesiones principalmente en la base de las hojas.
Para confirmar la presencia del IYSV, se hizo PCR en tiempo real en plantas con síntomas, obteniéndose una amplificación específica (Figura 2A). El análisis de disociación mostró un solo pico correspondiente a la amplificación de un fragmento del gen de la nucleocápside del virus (Figura 2B), lo cual demuestra que la amplificación fue específica para esta prueba.
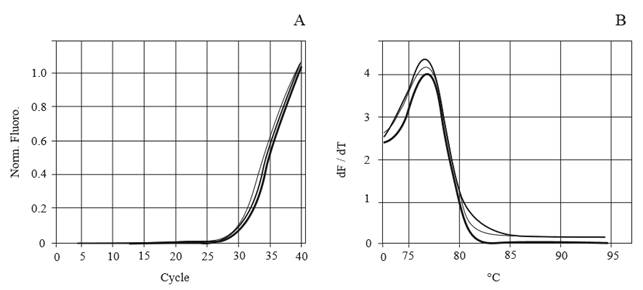
Figura 2. Detección de Iris yellow spot virus (IYSV) por PCR en tiempo real. A. Amplificación de un fragmento del gen de la nucleocápside del virus, a partir de lesiones en hojas de cebolla. B. Curva de disociación específica de la amplificación del gen de la nucleocápside del mismo virus.
La secuencia del gen de la nucleocápside del IYSV detectado en las plantas de cebolla, fue registrada en GenBank con el número de acceso JX946658. Mediante el análisis de homología se confirmó 99 % de identidad con secuencias previamente reportadas del gen de la nucleoproteína de IYSV. El análisis filogenético mostró que el aislamiento del virus en Tepalcingo, Morelos (JX946658) tiene mayor similitud con los reportados en Europa y Asía. El análisis muestra que no existe una asociación entre la secuencia del virus y su origen geográfico lo que limita su rastreabilidad (Figura 3). De manera natural los genomas virales de RNA presentan alta tasa de mutación durante el proceso de replicación (Elena et al., 2008). Sin embargo, hasta ahora el análisis global de IYSV muestra un flujo de genes restringido debido al confinamiento geográfico dando como resultado dos genotipos, IYSV-NL e IYSV-BR, siendo el primero hasta ahora el único presente en América, mientras que el segundo se encuentra principalmente en aislamientos asiáticos (Iftikhar et al., 2014).
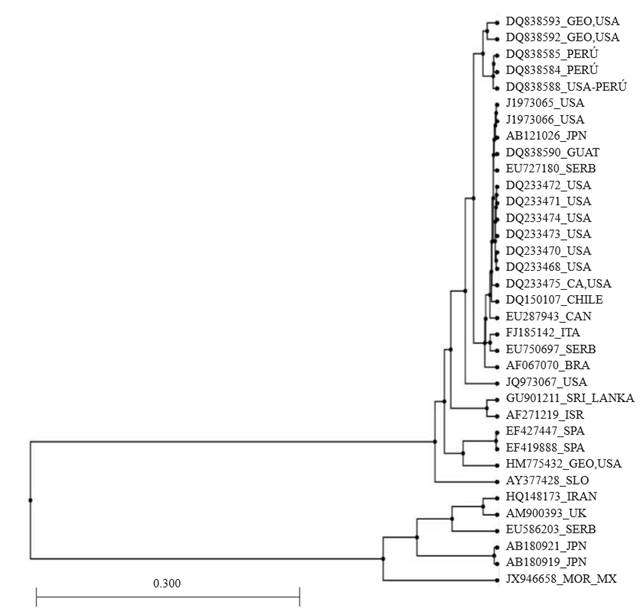
Figura 3. Relaciones filogenéticas de las secuencias registradas de Iris yellow spot virus en el GeneBank de diferentes partes del mundo, con respecto a la secuencia obtenida en plantas de cebolla de Morelos, México (JX946658_IYSV_MEX).
De acuerdo con Pappu et al. (2008), se ha comprobado que la técnica de RT-PCR en tiempo real es una técnica rápida y altamente confiable para detectar la presencia de IYSV en cebolla.











 texto en
texto en 


