Introducción
El tomate (Solanum lycopersicum L) es uno de los cultivos de mayor comercialización en el mundo, así como uno de los de mayor valor económico. México representa el décimo lugar a nivel mundial en la producción del tomate y el primero en su exportación, lo que en promedio da un ingreso al país de 1,000 millones de dólares. Se ha estimado que 1 de cada 3 tomates rojos se produce en Sinaloa, generando 867 mil toneladas del total nacional de 2.8 millones (SIAP, 2016). Durante la poscosecha, una de las enfermedades que se presentan en este fruto es la pudrición ácida, ocasionada por el hongo G. candidum, alteración común prácticamente en cualquier lugar donde se produzcan y exista preferentemente una temperatura de alrededor de 30 °C (Ruiz-Martínez et al., 2012). El daño inicia regularmente a través de lesiones ocasionadas por insectos o mecánicamente por el manejo del producto en el proceso de comercialización. Existen diversas alternativas para evitar el deterioro del tomate y preservar su calidad por más tiempo, entre las que se encuentra el control biológico empleando microorganismos antagonistas, tales como las levaduras, cuyos diferentes mecanismos de acción incluyen la antibiosis, la competencia por espacio y nutrientes, y la interacción directa (Bautista-Baños, 2006; Khaled & Sivasithamparam, 2006). Entre las levaduras antagonistas, se encuentran las denominadas levaduras killer, capaces de secretar metabolitos de naturaleza proteica y peso molecular variable, denominadas toxinas killer, con capacidad de inhibir otros microorganismos mediante alteraciones de la pared celular, membrana o núcleo de la célula susceptible (Buzzini et al., 2007). Actualmente existen numerosos reportes de la efectividad y potencial de las levaduras killer para el control de hongos causantes de deterioro de vegetales. El hongo Botrytis cinerea, uno de los patógenos más dañinos en el cultivo de uvas y fresas, logró ser inhibido empleando las toxinas parcialmente purificadas de la cepa Pichia membranifaciens CYC 1106 (Santos & Marquina, 2004). Este mismo hongo fue posteriormente inhibido con cepas de Pichia anomala y Debaryomyces hansenii, aumentando el arsenal biológico con potencial biocontrolador frente a este patógeno (Santos et al., 2004). Cepas de Issatcehnkia orientalis, Candida guilliermondii, P. ohmeri y Torulaspora globosa, entre otras, han sido reportadas para la inhibición exitosa de hongos fitopatógenos de importancia tales como Aspergillus cabonarius, A. niger, Penicillium expansum y Colletotrichum sublineolum en cultivos de uva, pera, manzana y sorgo, respectivamente (Bleve et al., 2006; Coelho et al., 2009; Rosa et al., 2010). En México, Hernández-Montiel et al., (2011) reportaron una reducción significativa de Geotrichum citri-aurantii en limón durante poscosecha, empleando levaduras epífitas de D. hansenii.
Las levaduras presentan una asociación ecológicamente diversa con los insectos; tan sólo de escarabajos se reportan más de 200 especies, así como 12 reportadas en termitas, 17 para hormigas, y otros insectos como los xilófagos, homópteros, dípteros, himenópteros, neurópteros, etc. (Rosa & Gábor, 2006). Carreiro et al., (2002) reportaron que 77 de 99 cepas de levaduras aisladas de hormigas del género Atta presentaron el fenotipo killer, incluyendo algunos géneros en los cuales no se encontraba previamente reportado este fenómeno. Para estudiar la aplicabilidad de este conocimiento en la prevención del daño poscosecha en tomate por G. candidum, se planteó el objetivo de evaluar la capacidad antagonista de cepas de levaduras killer obtenidas de hormigas, frente a aislamientos de G. candidum obtenidos de muestras de tomate con síntomas característicos de pudrición ácida.
Materiales y métodos
Aislamiento de levaduras
Las levaduras fueron aisladas de hormigas rojas (Atta spp.) con base en lo reportado previamente (Carreiro et al., 2002). Las hormigas fueron colectadas de diferentes localidades en bolsas de plástico y transportadas en frío al laboratorio. Para el aislamiento, se efectuó el procedimiento descrito por Torres-Mireles (2013); de forma individual, las hormigas fueron maceradas en un mortero estéril adicionando 1 ml de solución salina (0.85 % NaCl) estéril. A partir de cada homogeneizado obtenido, se realizaron 4 diluciones seriadas y 100 µl de cada dilución fueron inoculados por extensión en placas de Petri con agar dextrosa y papa (PDA) e incubadas a 25 °C hasta por 72 h. Las levaduras obtenidas, reconocidas macroscópicamente por su aspecto cremoso y color opaco, y microscópicamente por su tamaño celular observable al microscopio óptico a 400 aumentos, fueron preservadas en viales con agua destilada estéril a temperatura ambiente, hasta su empleo.
Determinación del fenotipo killer
Para evaluar la presencia del fenotipo killer en las levaduras aisladas, se emplearon las cepas de Saccharomyces cerevisiae ATCC 26609 y ATCC 38527 como levaduras sensibles a toxinas killer (Robledo-Leal et al., 2012), empleando el medio YEPD-MB (0.3 % de extracto de levadura, 0.3 % de extracto de malta, 0.5 % de peptona, 1 % de glucosa, 2 % de agar y 0.003 % de azul de metileno) ajustado a un pH de 4.5 con regulador de citratofosfato 0.1 M. Se prepararon inóculos de 1x106 células/ml a partir de cultivos de 24h de las cepas sensibles, de los cuales se depositaron 400 μl en placas con medio YEPD-MB empleando hisopos estériles, sembrando en 4 direcciones para generar un “césped” uniforme. Una vez eliminado el exceso de humedad, se inocularon las cepas de levaduras a evaluar a manera de estría gruesa y las placas fueron incubadas a 25 °C por 72h. El fenotipo killer se consideró positivo si se presentó una zona clara de inhibición delineado por un borde azul.
Aislamiento y selección de las cepas de G. candidum.
Se obtuvieron muestras de tomate rojo con síntomas compatibles con la pudrición ácida (reblandecimiento, exudado, micelio blanco, producción de gas). Las muestras fueron lavadas a chorro del agua de la llave, después se cortaron trozos del área dañada (1 cm2 aprox.) y se sumergieron durante 2 min en una solución de hipoclorito de sodio al 2 %. Posteriormente se pasaron a una caja Petri con agua destilada estéril y se lavaron; este proceso se realizó 2 veces. En condiciones de esterilidad, los trozos del tomate se transfirieron a placas con PDA. Las placas se incubaron a 30 °C hasta que aparecieran las colonias. Los aislamientos fueron identificados como G. candidum por sus características macroscópicas y miscroscópicas tales como rápido crecimiento, color blanquecino, aspecto colonial seco, hifas hialinas, septadas, ramificadas y la producción por fragmentación de artroconidias hialinas, unicelulares, sin conidióforos ni blastoconidios (Watanabe, 2002). Una vez obtenidos los aislamientos puros, se resguardaron en glicerol al 20 %, a una temperatura de -20 °C, hasta su utilización.
En condiciones de esterilidad, se inoculó por picadura una placa con PDA por cada cepa obtenida en la etapa de aislamiento y se incubaron a 28 °C, dejándolas crecer hasta que el área de la placa estuviera completamente cubierta. Posteriormente, empleando una aguja se tomó una muestra del micelio y se inoculó por picadura un tomate sano previamente sanitizado con hipoclorito de sodio al 2%. Cada tomate recibió 10 picaduras y posteriormente se colocó dentro de una cámara húmeda y después se incubó a 28 °C. Se observaron resultados a las 24 y 48 h. Estos experimentos se realizaron en dos ocasiones separadas con 2 réplicas por ensayo. La cepa más agresiva se seleccionó con base en la cantidad de picaduras infectadas (i.e. con crecimiento de micelio), el diámetro de las lesiones en las picaduras y el grado de ablandamiento establecido de forma visual.
Pruebas de antagonismo en fruto
Se realizaron 2 experimentos de forma independiente con 3 réplicas cada uno. Además de las cepas de levaduras killer, se incluyó un tratamiento control al que no se le adicionó levadura y otro en el que se empleó la cepa de Candida albicans ATCC 90028 como un control de levadura no antagonista. A partir de cultivos jóvenes de la cepa de G. candidum seleccionada como la más agresiva frente al tomate, se preparó una suspensión de 1 x 104 células/ml. Las levaduras de cada tratamiento, incluyendo el control de C. albicans, se ajustaron a 1 x 108 células/ml en solución salina estéril (Ren et al., 2012).
Una vez preparadas las suspensiones requeridas para las pruebas, se sanitizaron los tomates con algodón humedecido con hipoclorito de sodio al 2 % y empleando un bisturí se realizaron pocillos alrededor del pedículo haciendo incisiones de 1 cm2 x 0.5 cm de profundidad en el mesocarpo. En cada pocillo se inocularon 100 μl de la suspensión de levaduras, se colocó el tomate dentro de una cámara húmeda y se incubó a 28 °C por 3 horas, para permitir el pre-establecimiento de la levadura en el vegetal. Una vez transcurrido el tiempo, se inoculó en cada pocillo 50 μl de la suspensión de G. candidum, se colocó nuevamente en la cámara húmeda y se incubó a 28 °C. La efectividad de cada tratamiento fue evaluada a las 72h mediante la medición de las lesiones, las cuales fueron cuantificadas sumando su extensión en milímetros hacia ambos lados y el inferior de cada pocillo inoculado. Los valores promedio obtenidos para cada tratamiento fueron analizados mediante la prueba de Tukey utilizando el programa SPSS versión 20.0, a un nivel de significancia de (p<0.05).
Resultados y Discusión
A partir de las hormigas recolectadas, se obtuvieron 8 levaduras cuya actividad killer fue observable por la formación de un halo de inhibición rodeado de un borde azul más oscuro generado por el azul de metileno precipitado como indicador de muerte celular (Figura 1).
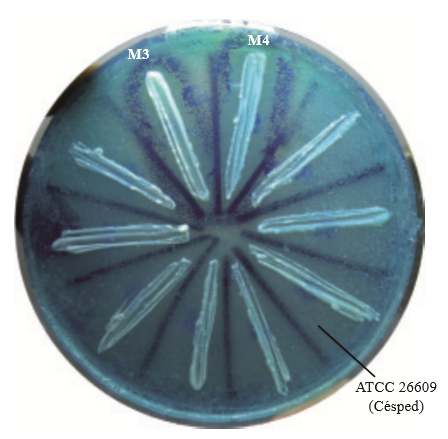
Figura 1. Determinación del fenotipo killer de levaduras aisladas a partir de hormigas del género Atta. El borde azul indica la muerte celular de la levadura susceptible en el “césped”.
A partir de las muestras de tomate, la cepa de G. candidum denominada MG2 fue la que generó el mayor daño a los tomates, por lo que se seleccionó como la más agresiva y se empleó en los ensayos de antagonismo en el fruto (Cuadro 1 y Figura 2). La comparación de medias mediante la prueba de Tukey mostró que todas las levaduras salvo M5 y M6, permitieron una reducción del daño significativamente mayor en comparación a la cepa de C. albicans y al control sin levadura. Las cepas M1 y M2 fueron las que permitieron el menor daño neto (mm) en los frutos, aunque sin diferencia significativa en comparación con M3, M4, M7 y M8 (Cuadro 2). La identificación de las 8 levaduras killer obtenida por la prueba API 20 C AUX indicó que todas correspondieron a Candida (Pichia) guilliermondii, especie en la cual la actividad killer se conoce desde hace más de 20 años (Polonelli et al., 1987), aunque no fue sino hasta 1991 que se reportó por primera vez su uso como agente de biocontrol (Wisniewski et al., 1991) y su actividad ha sido reportada en diversas ocasiones (Coelho et al., 2009; de Lima et al., 2013; Papon et al., 2013). La diferencia en el daño en presencia de las levaduras killer en comparación a los tratamientos sin levadura y con C. albicans, sugieren que el fenotipo killer en las levaduras M1 - M8 está asociado con su antagonismo frente a G. candidum. Las diferencias observadas en el daño al fruto permitido por cada levadura podrían explicarse por diferencias en el tipo de toxina killer secretado, que influye en la afinidad al sitio blanco del hongo susceptible y/o en diferencias en la expresión de la toxina, ya que en su mayoría se encuentran codificadas en el genoma nuclear (Buzzini et al., 2007). Por otro lado, es posible que además de las toxinas killer estas cepas presenten, de forma variable, mecanismos de acción adicionales previamente reportados en C. guilliermondii, tales como el ataque directo a las hifas y la competencia por nutrientes (Chanchaichaovivat et al., 2008; Nantawanit et al., 2010; Scherm et al., 2003). Esta diversidad en mecanismos representa un diverso intervalo de capacidades antagónicas para las levaduras killer frente a hongos fitopatógenos, con la posibilidad de que cepas con baja o nula actividad antagónica frente a un género o especie de hongos pueda mostrar una alta actividad antagónica frente a otros, lo que permite opciones amplias de estudio. El empleo de insectos como una fuente no convencional de levaduras resulta atractiva, dada la magnitud de la biodiversidad asociada a estos organismos (Rosa & Gábor, 2006) y a que al menos en algunos casos, las levaduras asociadas representan una relación en la que la levadura confiere protección al insecto de hongos entomopatógenos (Rodrigues et al., 2009) y con ello, la posibilidad de que este mecanismo antagonista sirva también contra hongos de importancia fitopatogénica.
Cuadro 1. Selección de la cepa más agresiva de G. candidum, de un total de 4 repeticiones. Se enlistan los resultados obtenidos por la inoculación del fitopatógeno por picadura en los frutos.
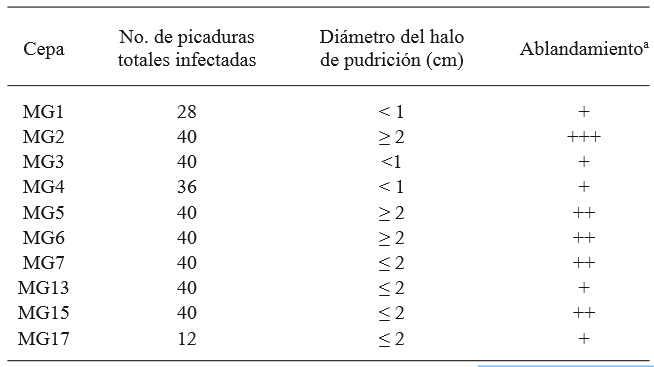
a + bajo, ++ medio, +++ alto, determinado visualmente

Figura 2. Evaluación de los daños ocasionados por diferentes cepas de G. candidum en tomate rojo. Se observa la presencia de micelio y ablandamiento en los frutos.
Cuadro 2. Valores promedio de la extensión del daño ocasionado por G. candidum en los tomates, en cada tratamiento.
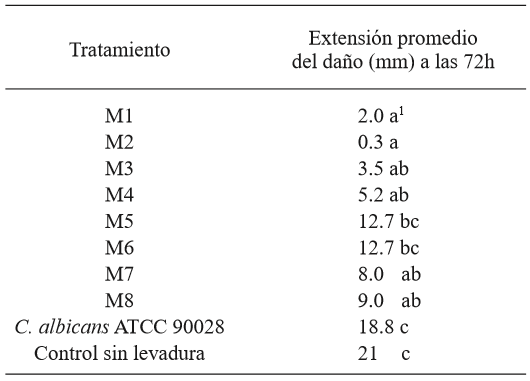
1 Cada valor representa el promedio de 6 tomates. Valores en cada fila con letras diferentes, son estadísticamente diferentes (p<0.05)
Si bien es claro que no representan una competencia directa con la eficiencia de los fungicidas químicos debido a la velocidad de su acción, son una alternativa que permitiría disminuir las dosis requeridas sin aumentar el daño a los vegetales, teniendo por resultado productos con menos concentraciones de químicos y con ello una disminución a los riesgos de toxicidad para el ser humano.
Conclusiones
Los resultados muestran que es posible aislar levaduras con el fenotipo killer a partir de hormigas del género Atta y estas levaduras exhiben un antagonismo variable frente a G. candidum. La sola presencia de una levadura no-killer no es suficiente para proteger al tomate del daño causado por G. candidum, siendo estadísticamente igual a no inocular ninguna levadura. La cuantificación del daño al fruto, mediante la medición acumulada (mm) del área afectada hacia los lados laterales y el inferior de la lesión, permiten evaluar la protección conferida por la presencia de levaduras antagonistas.











 text in
text in 


