El maíz continúa siendo el alimento básico de los mexicanos. Del total de 23.3 Mt que se producen en el país, aproximadamente 20 % de éste se produce en el altiplano, incluyendo los estados de México, Puebla y Michoacán (SAGARPA-SIAP, 2014), localidades en donde se presentan baja temperatura y alta humedad, condiciones idóneas para que se presente la enfermedad causada por el hongo Claviceps gigantea Fuentes et al. (anamorfo Sphacelia sp.) conocida por los agricultores como “diente de caballo”, debido a la forma que toman los granos infectados. Recientemente, la enfermedad ha aumentado su incidencia y distribución limitando la calidad del grano producido, afectando hasta 90 % de la cosecha, especialmente en híbridos comerciales. Además del daño al grano, el hongo produce toxinas alucinógenas del grupo del ácido lisérgico.
El primer reporte de la enfermedad diente de caballo en maíz (Zea mays L.), causada por C. gigantea lo realizaron Fuentes y De la Isla (1961) y Fuentes et al. (1964), quienes describieron el agente causal. Esos autores reportaron la enfermedad en los valles altos de Toluca y Amecameca en el estado de México y en la sierra Tarasca de Michoacán (Fuentes et al., 1964); en estos dos estados se produce aproximadamente 17 % del maíz para grano de todo el país (SAGARPA-SIAP, 2014). Los síntomas característicos de la enfermedad se observan al final del ciclo del cultivo, en el ápice de las mazorcas las brácteas se abren y dejan al descubierto estructuras fungosas de color castaño que corresponden a los esclerocios (Figura 1A), que remplazan a los granos (Fuentes y De la Isla, 1961; Osada et al., 1986).

Figura 1. Mazorcas de maíz infectadas con Claviceps gigantea, en el municipio de Almoloya de Juárez, México. A) parte apical de la mazorca con esclerocios que emergen rompiendo las brácteas y, B) daño en granos aledaños a los esclerocios.
En el Valle de Toluca, Moreno y Fucikovski (1972) documentaron incidencia de 42.3 a 61.5 % en tres híbridos comerciales de maíz. En cuantificaciones de pérdidas en grano causadas por la enfermedad en las zonas productoras de maíz en Metepec y Calimaya, México, los agricultores Sres. Alfredo Vásquez y Juan Manuel Pereyra, informaron que en sus parcelas, en el ciclo de cultivo de 2012, se registraron pérdidas de grano del 70 y 90 % en siembras con los híbridos comerciales Aspros 910 (Aspros) y Quetzal (De Kalb), respectivamente (Figura 2).

Figura 2. Incidencia de diente de caballo en mazorcas de maíz producidas en lotes de agricultores sembradas con híbridos comerciales susceptibles durante el ciclo de cultivo 2012. Se ha recomendado a los agricultores recoger y quemar las mazorcas afectadas para evitar la diseminación del inóculo en sus terrenos.
Según Fucikovsky y Moreno (1971), ésta enfermedad puede reducir significativamente la producción ya que el hongo reemplaza al grano afectando el aspecto y germinación de los granos cercanos al esclerocio (Figura 1B). Además, la contaminación del grano con esclerocios penaliza el precio del grano durante su comercialización pues contiene alcaloides tóxicos, como otras especies de Claviceps (Osada et al., 1986). Poco se sabe del ciclo biológico de C. gigantea y de las condiciones ambientales que lo afectan. De la Isla y Fuentes (1963), Fuentes et al. (1964), Agurell et al. (1963) y Osada (1984) reportaron la germinación de los esclerocios de C. gigantea después de haberlos sometido a desinfestación, incubación a altas y bajas temperaturas y períodos de luz-oscuridad simulando condiciones de campo, y utilizando como sustrato arena estéril, húmeda. Sin embargo, aun no se ha documentado el ciclo biológico del patógeno y el tiempo que requiere cada fase de desarrollo, lo que tiene importantes repercusiones en el manejo integrado del patógeno. Los objetivos del presente estudio fueron: 1) determinar el tiempo de germinación de los esclerocios y la formación de peritecios, ascas y liberación de ascosporas de C. gigantea en condiciones de laboratorio y en campo, 2) crecimiento de ascosporas en medio de cultivo y, 3) confirmar la identidad del patógeno mediante morfología y técnicas moleculares.
Materiales y métodos
Colecta de esclerocios
Para inducir la germinación de esclerocios en laboratorio se usaron esclerocios colectados en los municipios de Almoloya de Juárez (19° 33’ 01’’ N - 99° 56’ 13’’ O), Calimaya (19° 10’ 25’’ N - 99° 37’ 02’’ O) y Villa Victoria (19° 26 ́00 ́ ́ N - 100° 00’ 00’’ O), en el estado de México, durante noviembre - diciembre del 2012. Los esclerocios colectados se almacenaron a 4 °C durante tres meses. Los esclerocios se clasificaron por tamaño, se lavaron con detergente, se desinfestaron con hipoclorito de sodio (NaClO) 1.5 % por 2 min, se enjuagaron tres veces con agua destilada y se secaron sobre papel absorbente durante 24 h (CMI, 1974).
Germinación de esclerocios en laboratorio
Se desinfestaron botellas de polietileno tereftalatoglicol (PET, producido por Amacor Plastic Containers de México, S. A. de C. V) de 500 mL con alcohol etílico 96 %. A éstos frascos se agregaron 20, 35, 40 y 70 g de cada uno de los siguientes sustratos: 1) suelo de Almoloya, Calimaya o Villa Victoria, 2) carbón comercial, 3) carbón residual, 4) avena, y 5) testigo sin sustrato. A todos los frascos se adicionaron 75 ml de agua destilada estéril. En cada frasco se colocaron tres esclerocios. Los frascos se colocaron en un cuarto frío a 4 °C durante 1, 2, 3, 4 y 6 meses. Después, se incubaron a temperatura ambiente (22-24 °C) por 2 meses y todas las variables se monitorearon diariamente.
Las variables evaluadas fueron el tiempo a la emisión de los estípites (germinación), tiempo para desarrollo de los estípites y tiempo para la formación de cabezuelas. La descarga de ascosporas se monitoreó mediante tres métodos: 1. Observación directa cada 2 h utilizando un microscopio estereoscópico (Olympus SL2 ILST), 2. Observación cada 8 h de ascosporas capturadas en un portaobjetos (Corning 75x25 mm) cubiertos de azul de lactofenol colocados en la tapa de frascos PET y, 3. Observación cada 24 h de esporas capturadas en 6 ml de agua destilada estéril contenida en la tapa de una caja Petri (6 cm de diametro) colocada en el fondo de los frascos PET invertidos fijando los esclerocios en la base usando paraplast.
El diseño experimental fue de un ensayo factorial 5x3 con sustratos y tiempos de incubación a 4 °C como los factores. Cada tratamiento tuvo tres repeticiones. La unidad experimental fue un frasco cilíndrico con el sustrato y tres esclerocios. El experimento completo se repitió dos veces.
Germinación de esclerocios en campo
En junio de 2013, los esclerocios almacenados a 4°C durante tres meses, se colocaron sobre suelo de cultivo del rancho El Rosedal (Km 13.5 carretera Toluca-Atlacomulco, municipio de Atlacomulco, estado de México. (19° 24’ 19.28’’ N y 99° 43’ 12.84” O), cuando el cultivo de maíz (Aspros HC8) tenía tres semanas de siembra. Cuatro armazones de 40x40x40 cm con paredes de malla de alambre (1 cm2) se distribuyeron al azar en la parcela. Cada armazón contenía 30 esclerocios (Pedroza-Sandoval, 2010). Las variables en los esclerocios colocados en el campo se monitorearon semanalmente. Una vez germinados, los esclerocios se transfirieron a un frasco de PET de 2 L que contenía 3 cm de suelo en la base del frasco donde las variables se observaron diariamente. Los datos climatológicos se obtuvieron de la estación Arroyo, municipio Almoloya de Juárez, México (19° 24’ 34.92’’ N, 99° 44’ 12.12’’ O) perteneciente a la Red Nacional de Estaciones del INIFAP. Las variables evaluadas diariamente fueron tiempo de emisión de estípites, desarrollo completo de los estípites, formación de cabezuelas y peritecios y descarga de ascosporas con los métodos descritos anteriormente.
Cortes histológicos de cabezuelas estromáticas
Con la finalidad de observar las estructuras sexuales (peritecios, ascas y ascosporas) formadas en las cabezuelas obtenidas se realizaron cortes histológicos a mano con navaja de afeitar. Los cortes obtenidos se colocaron en un portaobjetos con azul de lactofenol para ser documentados utilizando un fotomicroscopio III Carl Zeiss adaptado con una cámara digital PAXcam3. Adicionalmente, las cabezuelas se fijaron en FAA (formaldehído : ácido acético glacial : alcohol, 1:1:1) por 24 h (Kulkarni, 1963). Las muestras se enjuagaron con agua corriente por 20 min para eliminar el fijador y se deshidrataron en una serie de concentraciones de etanol (10 %, 20 %, 30 %, 50 %, 70 %, 80 %, 90 % y 100 %) durante 3 h en cada concentración. Para la deshidratación e inclusión en parafina se siguió el protocolo descrito por López et al. (2005). Los cortes de tejido se realizaron con un micrótomo de rotación (American Optical Mod. 820) a 10 μm de grosor. Las secciones fueron fijadas en los portaobjetos, se removió la parafina y se tiñeron con safranina-verde rápido (López et al., 2005). Los cortes se documentaron y midieron usando un microscopio óptico (VELAB modelo: VE-B6) equipado con una cámara digital Moticam 2300 (3.0 M Pixel USB 2.0) y el software de procesamiento de imágenes Motic MC Camara 1.1. Las medidas del largo y ancho de las ascas, ascosporas y peritecios se evaluaron en una muestra de 30 individuos (Pedroza-Sandoval, 2010) y las dimensiones fueron comparadas con las reportadas en la literatura (Fuentes et al., 1964).
Crecimiento en medio de cultivo
Para evaluar el crecimiento in vitro del hongo, las cabezuelas estromáticas en plena descarga de ascosporas se lavaron con detergente en polvo, se enjuagaron con agua destilada estéril, se desinfectaron con hipoclorito de sodio 1.5 % por 2 min y se enjuagaron con agua destilada estéril. Las cabezuelas se cortaron con navaja de afeitar esterilizada y las secciones se colocaron en 5 mL de agua destilada estéril. Con el propósito de observar el efecto de tratamiento térmico en la germinación de las ascosporas, una vez verificada su presencia, la muestra se dividió en dos partes iguales utilizando una pipeta Pasteur esterilizada, una parte se sometió a calor (50°C por 3 min), mientras que la otra no tuvo tratamiento térmico. Se tomaron 100 μL de la suspensión de ascosporas de cada tratamiento, y se dispersaron en los siguientes medios de cultivo: 1) papa dextrosa agar (PDA; Bioxon®), 2) agar harina de maíz (AHM; Bioxon®), 3) extracto de malta agar (EMA; Difco®), 4) agar-agar (Difco®), 5) agar-agar con dextrosa (Difco®) y 6) agar (Difco®) con una mezcla de granos de maíz frescos y estigmas. Las cajas se incubaron a 22 °C y se revisaron diariamente para determinar el efecto de los tratamientos en la germinación y el desarrollo del hongo in vitro. El experimento se estableció en condiciones de laboratorio siguiendo un diseño factorial 6x2 (medios de cultivo y tratamiento térmico), con tres repeticiones.
Identificación morfológico-molecular
La extracción del ADN total del hongo se obtuvo de cabezuelas y estípites utilizando el kit de extracción QIAGEN DNeasy Plant Minikit (50) de acuerdo con el protocolo descrito por el fabricante (Dneasy® Plant Handbook, 2012). Las muestras de ADN secuenciadas fueron KJ543564 (celes1), KJ543565 (celes2), KJ543566 (onesi1) y KJ543567 (onesi2). Para verificar la calidad del ADN total, las muestras se colocaron en un gel de agarosa 1 % y se sometieron a electroforesis a 88 volts por 30 min. El ADN total extraído se envió a Macrogen Inc., Korea, para la amplificación de la región del ITS y su secuenciación simultanea utilizando los iniciadores ITS1 (5´TCCGTAGGTGAACCTGCGG 3´) e ITS 4 (5´TCCTCCGCTTATTGATATGC 3´) de acuerdo con el protocolo descrito por White et al. (1990), Glass y Donaldson (1995) y Pazoutová (2001). Los fragmentos amplificados fueron secuenciados y las secuencias obtenidas se depositaron en el NCBI (National Center for Biotechnology Information) para posteriormente compararlas con las disponibles en el banco de datos, utilizando la herramienta “Nucleotide BLAST”. Para el análisis filogenético, las secuencias obtenidas en este estudio fueron comparadas con las reportadas por Pazoutová para Claviceps gigantea y C. sorghi utilizando el programa Mega 7 y el procedimiento UPGMA.
Resultados y discusión
Germinación de esclerocios en laboratorio
La germinación de esclerocios se observó únicamente en el tratamiento que contenía carbón residual, con un período de incubación de tres meses a 4 °C y dos meses a 22-24 °C (Figura 3C), por lo que no se realizó análisis estadístico. El 55.5 % de los esclerocios germinaron en este tratamiento. Osada (1984) indica que solamente obtuvo 47 y 48 yemas preformadoras de estípites a partir de esclerocios colocados a 18oC con pretratamiento de 4 oC por 8 y 16 d, respectivamente. En C. purpurea, Hadley (1968) reportó una germinación de 50%, limitado principalmente por baja humedad en la tierra durante la germinación del esclerocio. El tratamiento en frío (4°C) durante 3 meses, la humedad del carbón residual y el cambio de temperatura a 22 - 24°C por 2 meses simulan las condiciones naturales del campo donde se encuentran los esclerocios, facilitando su germinación.

Figura 3. Claviceps gigantea: A) inicio de la germinación donde se observan primordios de las cabezuelas estromáticas 64 d después del establecimiento en campo, B) estípites y cabezuelas estromáticas, C) esclerocios con estípites completamente desarrollados, D) esclerocios con estípites y cabezuelas delgadas y marchitas después de la liberación de ascosporas (Escala 1 cm).
En el presente experimento en laboratorio, el único sustrato que facilitó la germinación de esclerocios fue el carbón residual. Según Villamagua et al. (2008), en trabajos en invernadero con jitomate (Solanum lycopersicum L.), el carbón vegetal añadido al suelo mostró un incremento en la producción de frutos debido al incremento en la porosidad y la estructura del suelo y en la disponibilidad de N, P, K, Zn, Ca, Mg, Mn y Cu, que pueden actuar como nutrientes en la germinación de las semillas y nutrición de la planta, los que probablemente tuvieron el mismo efecto sobre los esclerocios en el presente estudio.
Germinación de esclerocios en campo
En la muestra colocada en el Rancho El Rosedal para determinar la germinación de esclerocios en campo, se determinó un porcentaje de germinación de 46.6 %. Estos promedios de germinación son bajos, pero coinciden con lo señalado por Pazoutová et al. (2011), quienes mencionaron que la germinación para la formación de cabezuelas estromáticas es difícil en la mayoría de las especies de Claviceps, ya que requieren diferentes tratamientos para eliminar la dormancia (Kunfer and Seckring, 1977). Entre los tratamientos se observó que las temperaturas bajas tienen efectos importantes en los procesos fisiológicos del esclerocio al aumentar: 1) la absorción del agua proveniente del medio ambiente, 2) aumentar la tasa de respiración y, 3) incrementar el metabolismo de los lípidos almacenados. La presencia de lípidos en el esclerocio sugiere que inmediatamente después, o durante el tratamiento de activación por frío, se activan enzimas que hidrolizan los lípidos posiblemente para su conversión en manitol (Mitchell y Cooke, 1968).
En el campo, la aparición de primordios en los esclerocios se observó después de 3 meses de incubación a 4 °C y 64 d después de que se colocaron en el campo a temperatura promedio de 14° C, humedad relativa de 76 % y una precipitación acumulada de 705 mm durante junio-septiembre, 2013 (Figura 3A). Las estructuras completamente desarrolladas se observaron 23 d después de aparecer los primordios (Figura 3B). Fucikovsky y Moreno (1971) reportaron una temperatura anual en el municipio de Almoloya de Juárez de 13-15 °C y una precipitación anual de 1000 mm cuando observaron el diente de caballo en el estado de México, mientras que en el presente estudio la humedad relativa promedio anual fue 65.26 % y la precipitación acumulada total fue 832.8 mm. Según Cooke y Mitchell (1967), en la naturaleza transcurre aproximadamente una semana desde los inicios de la germinación de los esclerocios de C. purpurea a la maduración de los estromas.
En campo, al final de la cosecha del maíz, los esclerocios caen al suelo entre el otoño y el invierno. Desde el otoño hasta primavera, los esclerocios están expuestos a temperaturas bajas y heladas frecuentes por un período de 6 a 9 meses. Al terminar éste período, la temperatura y humedad aumentan y el hospedante se encuentra disponible, sincronizando el ciclo biológico del patógeno y el hospedante para el desarrollo de la enfermedad.
Tiempo de emisión y desarrollo de estípites y formación de cabezuelas
Los primeros indicios de germinación de los esclerocios, tanto en laboratorio como en campo, fue la observación de los primordios de las cabezuelas estromáticas que ocurrió cinco meses después de iniciado el experimento (tres meses a 4 °C y dos a 22-24 °C) (Figura 3A). Los primordios se observaron cómo protuberancias globosas de color claro emergiendo de los esclerocios. Este tiempo de germinación fue al menos 6 meses más rápido comparado con el reportado por De la Isla y Fuentes (1963) y Fuentes et al. (1964), quienes observaron la germinación de esclerocios de C. gigantea después de 12 meses con un tratamiento de temperatura alternada (4- 2 °C y de 22-28 °C, por períodos de una a dos semanas por 8 meses) y constante (12 °C por 4 meses en oscuridad).
Cooke y Mitchell (1967), mencionan que en la naturaleza el potencial de inóculo de una población de esclerocios depende del número de cabezuelas que puede producir lo cual se relaciona con el tamaño del esclerocio. En el presente estudio los esclerocios produjeron de tres a nueve cabezuelas, con un promedio de cinco por esclerocio. Las protuberancias se constriñeron en la base para formar el cuerpo del estípite. En la punta del estípite se formaron cabezuelas estromáticas que maduraron después de 15 d en condiciones de laboratorio y 23 d en campo, después de la aparición de los primordios (Figuras 3B y C). Durante el proceso de maduración de la cabezuela estromática ésta mostró un cambio en la coloración de café claro a obscura y la presencia de puntos o papilas que correspondían a los ostiolos de los peritecios inmersos en la cabezuela de la que sobresalen ligeramente. Estas observaciones son similares al proceso de germinación de esclerocios de C. purpurea, C. sorghicola y C. africana descritas por Hadley (1968), Loveless y Peach (1986) y Tsukiboshi et al. (2001).
Se observó que los esclerocios no tienen sincronización en su germinación, formación de primordios, estípites ni cabezuelas, lo que sugiere que existe un amplio rango de tiempo en la liberación de ascosporas (Figura 3D).
Producción y descarga de ascosporas
Se logró grabar por primera vez en video (Sony Cyber-shot (modelo DSC-W120) (Figura 4F) la liberación de ascosporas. En microscopio estereoscópico se observó la liberación de ascosporas emergiendo de los ostiolos de peritecios como estructuras muy delgadas y alargadas que flotaban en el espacio, debido a su falta de peso o un posible fenómeno de geotropismo.
Según Loveless y Peach (1986), las ascosporas de C. purpurea se observan a simple vista en el aire sobre la cabezuela estromática. Lutrell (1977) y Prakash et al. (1983) reportaron la descarga de ascosporas de C. paspali y C. fusiformis directamente con un microscopio, enfocando en los ostiolos de los peritecios (Figura 4C), mientras que Pazoutová y Parbery (1999) también observaron las puntas de las ascas emergiendo del ostiolo. Los ascomicetos pueden descargar las ascosporas ya sea expulsándolas al aire a una distancia de varios centímetros o son lentamente exudadas en una masa mucilaginosa acumulada alrededor del ostiolo (Loveless y Peach, 1986).
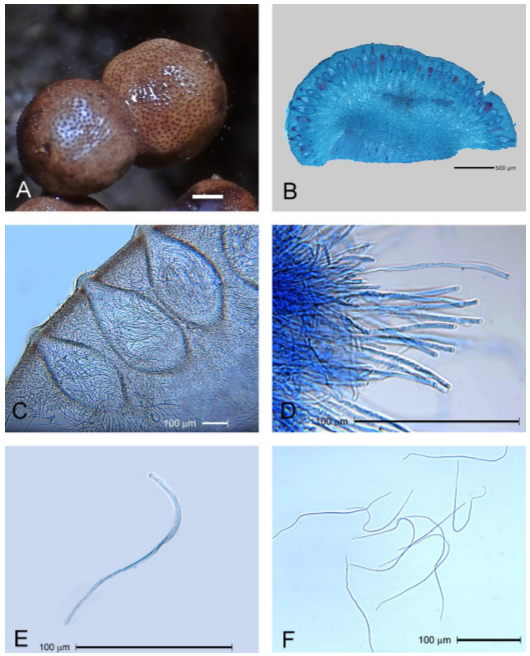
Figura 4. Estructuras sexuales resultado de la germinación de esclerocios en condiciones de laboratorio. Cortes longitudinales de cabezuelas estromáticas muestran: A) Peritecios con diferente grado de desarrollo, B) Peritecios con ascas y ascosporas teñidos con azul de lactofenol, C) Ascas intercaladas con parafisos, D) Ascas con ascosporas y E) Ascosporas expulsadas de los peritecios.
No se observaron ascosporas de los esclerocios invertidos con agua destilada estéril en la base que se utilizaron para el monitoreo nocturno. Cuando los estromas germinados y diferenciados en estípite y estroma se colocaban invertidos en los frascos, estas estructuras tomaban un color oscuro y una apariencia rugosa sin continuar su desarrollo normal y madurez. Sin embargo, no se logró captura de ascosporas en portaobjetos con azul de lactofenol o agua destilada aun cuando la distancia entre las cabezuelas y los portaobjetos fue de aproximadamente 10 cm.
De acuerdo con los resultados de éste estudio, en C. gigantea el proceso de germinación, formación de estípites, cabezuelas estromáticas, peritecios, ascas y hasta la expulsión de las ascosporas se logró en un total de aproximadamente 175 d.
Crecimiento de ascosporas en medio de cultivo
No se observó ningún crecimiento en los 6 medios probados en este estudio (PDA, AHM, EMA, AA, AAD y Agar-Maíz) y el tratamiento térmico a 50 °C. Deacon (2006) mencionó que para la germinación de ascosporas y su crecimiento in vitro son necesarios algunos estímulos como, la presencia de carbohidratos y los choques de calor para interrumpir la dormancia de las ascosporas e inducir su germinación, pero en el presente estudio no se logró obtener cultivos puros a partir de ascosporas.
Identificación morfológico - molecular
Las secciones longitudinales de los cortes hechos a mano y los cortes finos de las cabezuelas revelaron numerosos peritecios piriformes embebidos en la región periférica del tejido. En los peritecios se observaron ascas, parafisos y ascosporas. El ostiolo de los peritecios alcanzaba la superficie de la cabezuela (Figuras 4A, B). Pazoutová y Parbery (1999) mencionaron que el tamaño y forma de los peritecios dependen de su grado de madurez. Los peritecios jóvenes son pequeños, oblongos a ovales, mientras que los maduros generalmente son elipsoides a piriformes, lo que igualmente se muestra en los resultados del presente estudio (Figura 4B).
Los peritecios (Figura 4C) midieron de 404.9-569.3 x 151.3-284.4 μm, con ascas de 187-265.3 μm de largo, que contenían 8 ascosporas de 169.6-263.7 x 1.0-2.1 μm. Las dimensiones de éstas estructuras observadas fueron mayores a las reportadas por Fuentes et al. (1964). Según Loveless (1964) y Pazoutová y Parbery (1999), la longitud de las ascosporas filiformes del género Claviceps es un carácter taxonómico confiable, condicionado a que las medidas se realicen después de ser expulsadas del asca (Figuras 4E, F). El tamaño de los peritecios también se considera otro criterio taxonómico confiable, ya que es un carácter constante de un estroma maduro (Loveless, 1967).
El análisis de la secuencia de la región parcial del gen 18s, ITS1 completo, 5.8s completo, ITS2 completo y parcial del 28s, mostró que las cuatro secuencias depositadas en NCBI No. KJ543564 (celes1), KJ543565 (celes2), KJ543566 (onesi1) y KJ543567 (onesi2) tienen un porcentaje de identidad de 99 % con AJ133394.2 (Claviceps gigantea Pazoutová). Estas cinco muestras se compararon contra Claviceps sorghi que perteneció a otro grupo filogenético (Figura 5) (Pazoutová, 2001). Tanto las características morfológicas (Fuentes et al., 1964) como moleculares confirmaron la especie como Claviceps gigantea Fuentes, De la Isla, Ullstrup y Rodríguez.
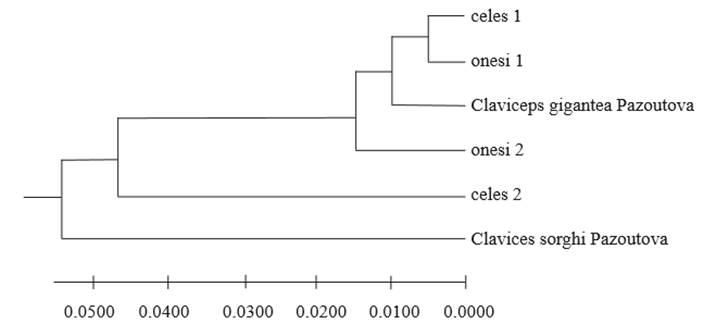
Figura 5. Relación filogenética de secuencias de cuatro muestras de ADN de C. gigantea comparadas con las secuencias de C. gigantea y C. sorghi reportadas previamente por Pazoutová (2001) en el NCBI.
Conclusiones
- En laboratorio, se logró la germinación de esclerocios y formación de estípites después de incubación en carbón residual por 90 d a 4 °C y 60 d a 22 °C, formación de cabezuelas en 15-23 d y liberación de ascosporas en 15 d.
- No se encontró sincronización en la germinación de esclerocios, formación de estructuras reproductivas y liberación de ascosporas.
- No hubo efecto del tratamiento con temperaturas ni medios de cultivo en la germinación de las ascosporas.
- Por primera vez, la expulsión de ascosporas en esta especie se documentó electrónicamente (en video).
- Las características morfológicas y moleculares permitieron identificar al hongo como C. gigantea.
- De las secuencias de ADN que se obtuvieron a partir de las estructuras sexuales, en los análisis de ADN (AJ133394.2) se confirmó la identidad de C. gigantea a nivel molecular; este primer reporte quedó consignado en el Banco de Genes.
- Estos resultados facilitarán el establecimiento de programas de manejo integrado de la enfermedad y el estudio de la biología del patógeno.











 texto em
texto em 


