El cultivo de plátano es una actividad importante para México, se siembran más de 75 mil hectáreas, con un valor de la producción de más de 5 mil millones de pesos (SIAP, 2014). En el estado de Veracruz, la principal zona de producción de este cultivo es el distrito de Martínez de la Torre (SIAP, 2014). Durante los últimos cinco años en algunas plantaciones de plátano pertenecientes a este distrito se han registrado síntomas característicos de deficiencia de nutrimentos, además se ha observado poco desarrollo y necrosis del sistema radical, lo que ocasiona la caída de las plantas. Estos últimos síntomas se han asociado con los inducidos por nematodos fitoparásitos, sin embargo, no se han realizado estudios para detectar su presencia en esta importante zona productora. El objetivo del presente trabajo fue identificar las especies de nematodos fitoparásitos asociados a raíces de plátano (Musa acuminata Colla AA), sub grupo Pisang Mas con síntomas de afectación en los municipios de Atzalan y Tlapacoyan ubicados en la zona centro del Estado de Veracruz, México. Para el estudio se eligieron 3 plantaciones de plátano en cada municipio con reportes previos de afectaciones en la raíz (Cuadro 1). En cada una de las plantaciones se tomaron 5 muestras (N=30) de raíces (500 g) a una profundidad de 15 a 20 cm y a una distancia de 20 cm alrededor del pseudo tallo de las plantas seleccionadas (Adriano-Anaya et al., 2008).
Cuadro 1 Datos geográficos de los sitios de colecta y especies de nematodos identificados en las plantas de plátano (Musa acuminata).

*Musa acuminate AA Sub gurpo Pisang Mas localmente llamado Dominico.
Los nematodos se extrajeron de 100 g de raíz mediante la técnica de maceración, flotación y centrífugación (van Bezooijen, 2006), se fijaron y aclararon de acuerdo a Seinhorst (1962) para posteriormente realizar la identificación taxonómica y la cuantificación. Paralelamente, hembras del género Meloidogyne se extrajeron con la técnica de disección del material vegetal (100 g de raíz) para realizar cortes perineales. Asimismo se extrajeron huevos de Meloidogyne spp. con el método de maceración en hipoclorito de sodio (NaOCl), flotación y centrífugación de 200 g de raíz, la extracción resultante se preservó en ultracongelador (Thermo Scientific) a -80 °C para la posterior extracción de ADN (Carneiro et al., 2004). Los nematodos recuperados de la primera extracción se observaron y cuantificaron (100 gr raíz) en un microscopio óptico (Leica ICC50). Con el fin de identificar los nematodos, se eligieron los mejores especímenes adultos para realizar montajes (van Bezooijen, 2006) y seguir las claves taxonómicas especializadas para el orden Tylenchida (Siddiqi, 1973; Orton-Williams, 1973; Orton-Williams y Siddiqi, 1973; Orton-Williams, 1975; Siddiqi, 2000). Debido a la similitud en las caracteristicas morfológicas de algunas especies de Meloidogyne (Carneiro y Cofcewicz 2008) se realizó también la determinación con marcadores moleculares específicos. Para esto se extrajo el ADN de los huevos y J2 previamente extraídos de la raíz y congelados siguiendo el protocolo de extracción de ADN del kit DNATissue and Insect MiniPrep Isolation Kit (Zymo Research) y se realizó una reacción en cadena de la polimerasa (PCR) utilizando marcadores SCAR (secuencia caracterizada de la región amplificada) (Sigma-Aldrich) específicos para las cuatro especies de Meloidogyne más distribuidas en el cultivo de plátano en Latinoamerica: M. arenaria (F5´-TCGGCGATAGAGGTAAATGAC-3` y R5´-TCGGCGATAGACACTACAACT-3´ 420 pares de bases), M. incognita (F5´-GGGATGTGTAAATGCTCCTG-3´ y R 5´-CCCGCTACACCCTCAACTTC-3´ 399 pb), M. javanica (F5´-GGTGCGCGATTGAACTGAGC-3´ y R 5´-CAGGCCCTTCAGTGGAACTATAC-3´ 670 pb) y M. paranaensis (F 5´- GCCCGACTCCATTTGACGGA-3´ y R 5´-CCGTCCAGATCCATCGAAGTC-3´ 208 pb) (Zijlstra et al., 2000; Randig et al., 2002). Cada PCR se realizó en un volumen final de 30 µL conteniendo 6.3 µL de H2O destilada estéril, 6 µL de buffer de reacción a una concentración de 5X (Promega), 3 µL de dNTP´s a 10 µM, 1.5 µL de MgCl2 a 25 µM (Promega) 6 µL de los primer SCAR correspondientes (10 µM), 0.2 µL de Taq polimerasa a 5 u/µL (Promega) y 1 µL de ADN de cada población. Adicionalmente se preparó un PCR con ADN de M. arenaria y M. incognita proporcionado por el Instituto de Ecología, A.C. (INECOL) como control positivo y un PCR sin ADN como control negativo. La PCR se llevó a cabo en un termociclador (Applied Biosystems) con las siguientes condiciones de amplificación: 5 min a 94 °C, 30 ciclos de 30 s a 94 °C, 45 s a 64 °C, 1 min a 70 °C; y una extensión final de 8 min a 70 °C (Randig et al., 2002). Los productos de la amplificación fueron separados por electroforesis en un gel de agarosa al 2 % teñido con bromuro de etidio (0.02 %) y visualizados bajo luz UV.
La densidad de población de nematodos de diferentes géneros y especies en la misma localidad se analizaron con la prueba no paramétrica de Kruskal-Wallis y la prueba de comparaciones múltiples (P ≤ 0.05) utilizando el programa STATISTICA 8.0 para Windows.
En los seis sitios de muestreo, las plantas de plátano presentaron síntomas característicos de falta de nutrimentos como raquitismo (tallos delgados), amarillamiento, estrés hídrico y poca producción o racimos con plátanos de menor tamaño. Debido a la afectación del sistema radical, algunas plantas se encontraron volcadas (Figura 1A) o a punto de caer, estas plantas presentaban necrosis en la mayoría de las raíces y en algunas partes del cormo (Gowen et al., 2005). Al examinar las raíces en el laboratorio, se observaron lesiones rojizas en la epidermis en forma de líneas longitudinales y necrosis (Figura 1B), acordes con la sintomatología de nematodos del género Helicotylenchus (Orion et al., 1999). Asimismo se encontraron abultamientos y agrietamientos (Figura 1C) y se pudieron observar hembras y masas de huevos correspondientes a Meloidogyne spp. (Figura 1D).

Figura 1 Síntomas de afectación por nematodos en las plantas de plátano A) Planta volcada por debilitamiento de la raíz, B) Lesiones causadas por Helicotylenchus spp. (H) en las raíces, C) Abultamiento y agrietamiento de la raíz causado por Meloidogyne spp. (M) y lesiones causadas por Helicotylenchus spp., D) Hembra (h) y masas de huevos (m) insertadas en las raíces de plátano.
Los nematodos identificados fueron: Criconema sp., Helicotylenchus sp., Helicotylenchus multicinctus, Meloidogyne arenaria, Meloidogyne incognita y Radopholus similis (Cuadro 1). El PCR utilizando los marcadores SCAR mostró que M. arenaria esta presente en cinco localidades y M. incognita esta presente en las seis localidades (Figura 2). M. javanica y M. paranaensis no fueron detectadas en las muestras analizadas. A continuación se hace una descripción de las caracteristicas morfológicas observadas en los nematodos examinados:
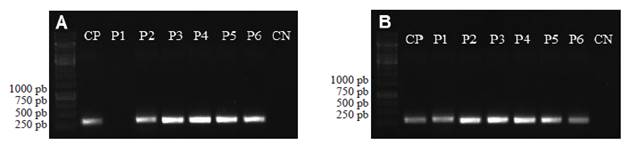
Figura 2 Pruebas de amplificación utilizando el marcador específico para A) Meloidogyne arenaria de 420 pares de bases (pb) y B) M. incognita de 399 pb en las seis poblaciones provenientes de raíz de Musa acuminata. Los números de las poblaciones indican el sitio de muestreo resumido en el Cuadro 1. CP= control positivo con ADN de poblaciones de M. arenaria y M. incognita previamente identificadas. CN= control negativo para el PCR. Las franjas del lado izquierdo son el marcador de peso molecular GeneRuler 1kb (Thermo Scientific).
Criconema sp. Hembras: Cutícula ornamentada, 39 a 44 anulaciones de 4-4.8 μm de largo desde la base, redondeadas, levemente dirigidas hacia atrás con una ligera proyección de 2.4-3.2 μm de largo en la parte terminal de cada anulación. De 343 a 571 μm de largo y 46.8 a 62.4 μm de ancho. Dos anulaciones cefálicas diferenciadas del cuerpo, la anulación anterior es mayor que la posterior. Estilete robusto de 70.2 -78 μm de largo. Vulva localizada en el último cuarto del cuerpo, en la anulación 33. Labios de la vulva cerrados, de forma cónica que sobresalen ligeramente del contorno corporal. Vagina recta, cauda conoide a redondeada (Figura 3A y B).

Figura 3 Fotografías al microscopio óptico de algunos especímenes examinados A) Región cefálica de hembra de Criconema sp., B) Cauda de hembra de Criconema sp., C) Región cefálica de hembra de Helicotylenchus multicintus, D) Cauda de hembra de Helicotylenchus multicintus, similis donde se observa el estilete degenerado, H) Cauda de macho de Radopholus similis. E) Cauda de hembra de Helicotylenchus sp. con proyección ventral (mucrón), F) Cauda de hembra de Radopholus similis, G) Región cefálica de macho de Radopholus
Helicotylenchus sp. Hembras: Enrolladas o arqueadas después de la fijación con formol, 398 a 671 μm de largo y 16 a 23 μm de ancho. Región labial semiesférica ligeramente diferenciada del resto del cuerpo, con 3 a 4 anulaciones. Estilete de 16 a 24 μm de largo con nódulos basales prominentes. Bulbo medio del esófago ovalado (8 μm de ancho por 12 μm de largo) con un pequeño aparato valvular en el centro. Glándula esofágica traslapada con el intestino. Poro excretor cerca de la unión del esófago con el intestino. Vulva bien desarrollada, deprimida trasversalmente, se encuentra en el tercer cuarto con relación a la longitud del cuerpo. Didelfico, ovarios y espermatecas simétricas (10 a 12 μm de diámetro). Cauda de la hembra corta, semiesférica, dorsalmente convexa, con proyección ventral (mucrón) (Figura 3E). Campos laterales con 4 incisuras, aproximadamente una cuarta parte del ancho del cuerpo.
Helicotylenchus multinctus. Hembras: Arqueadas después de la fijación con formol, de 480 a 640 μm de largo y 16 a 20 μm de ancho. Estilete de 20 a 22 μm de largo con nódulos basales prominentes (Figura 3C). Región labial semiesférica con 4 anulaciones. Bulbo medio del esófago ovalado (8 μm de ancho por 10 μm de largo) con un pequeño aparato valvular en el centro. Glándula esofágica traslapada con el extremo frontal del intestino. Poro excretor cerca de la unión del esófago con el intestino. Didelfico, ambas ramas de los órganos reproductores bien desarrolladas y funcionales. Ovarios simétricos, espermatecas redondeadas, con un diámetro de 10 μm. Vulva prominente, ligeramente deprimida trasversalmente, se encuentra en el tercer cuarto con relación a la longitud del cuerpo. Cauda de la hembra corta, semiesférica, dorsalmente convexa, sin proyección ventral o terminal (Figura 3D). Campos laterales con 4 incisuras no areoladas, aproximadamente una cuarta parte del ancho del cuerpo. Machos: de 460 a 686 μm de largo por 16 a 20 μm de ancho. Estilete de 18 a 20 μm de largo. Espícula de 18 a 22 μm de largo, gubernaculum de 4 a 6 μm. Cola con terminación cónica con una proyección ventral hialina.
Radopholus similis. Hembras: Vermiformes, de 530 a 772 μm de largo y 15 a 31 μm de ancho en la parte media. Cutícula ligeramente anillada. Región labial redondeada de 3 a 4 anulaciones. Estilete de 12 a 14 μm de largo con nódulos basales bien desarrollados. Bulbo medio bien desarrollado, ovalado de 10 a 12 μm de diámetro. Aparato valvular bien desarrollado. Glándulas esofágicas traslapadas dorsalmente sobre el intestino. Vulva prominente, ligeramente debajo de la mitad del cuerpo. Didélfico, dos órganos reproductores funcionales. Espermatecas esféricas. Cola en forma de cono elongado con terminación ovalada (Figura 3F). Campos laterales con 4 incisuras no areolados. Macho: Vermiformes ligeramente arqueado ventralmente, de 515 a 632 μm de largo y 16 a 23 μm de ancho. Región labial bien definida del resto del cuerpo con 4 o 5 anulaciones y elevada de 4 a 6 μm. Esófago y estilete degenerado sin nódulos basales visibles (Figura 3G). No se logran apreciar el bulbo medio y aparato valvular. Espícula fuerte de 18 a 20 μm de largo (Fig. 3H). Gubernáculo alargado de 8 a 10 μm de largo afilado en la parte anterior.
Meloidogyne arenaria. Hembra: Blanca, cuerpo en forma de pera, 510-1000 μm de largo y 400-600 μm de ancho. Cuello con forma cónica. Estilete robusto, 14 - 16 μm de largo. Orificio de la glándula dorsal esofágica en la base del estilete. El patrón perineal tiene un arco dorsal bajo y redondeado, comprimido dorso-lateralmente, con estrías separadas, onduladas y lisas (Figura 4A).
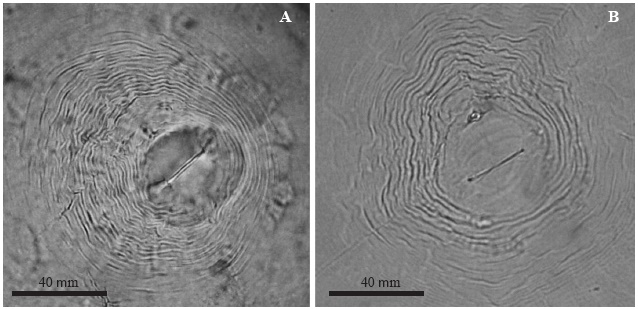
Figura 4 Fotografías al microscopio óptico de los patrones perineales de las hembras de Meloidogyne spp., A) M. arenaria, B) M. incognita.
Meloidogyne incognita. Hembra: Blanca, cuerpo esférico de cuello corto de 500 a 723 μm de largo y 331 a 520 μm de ancho. Estilete de 12 a 15 μm de largo. Vulva con forma alargada, orientada transversalmente en el centro del cuerpo. El patrón perineal presenta forma de pera con un arco dorsal alto y trapezoidal, formado por estrías poco espaciadas, relativamente gruesas, lisas, levemente onduladas o en forma de zig-zag (Figura 4B).
Los géneros de nematodos encontrados coinciden con los registrados en plantas de Musa spp. en diversos países, aunque el número de especies encontradas es bajo en comparación con otros estudios (Kamira et al., 2013; Chitamba et al., 2013; Lima et al., 2013). Asimismo, la identificación de Helicotylenchus spp., Meloidogyne spp. y Radopholus similis sobre plátano coinciden con lo reportado anteriormente para México (Montes-Belmont, 2000; Cid del Prado-Vera et al., 2001; Adriano-Anaya et al., 2008; López-Lima et al., 2015). Es el primer registro de Criconema sp., Helicotylenchus multicinctus, M. arenaria y Radopholus similis en el cultivo de plátano en Veracruz. En trabajos anteriores se registró a Helicotylenchus microcephalus, Meloidogyne incognita, M. paranaensis y Tylenchus spp. (Montes-Belmont 2000; López-Lima et al., 2015).
En todos los sitios de muestreo se encontraron a Helicotylenchus sp. y Helicotylenchus multicinctus, los cuales fueron los más abundantes (Cuadro 2). Este género de nematodo, en particular las especies H. multicinctus y H. dihystera se consideran una fuerte limitante para el cultivo de plátano en diversas partes del mundo (Das et al., 2014), aunque H. dihystera no se encontró en este estudio. Las dos especies de nematodos agalladores encontradas en este estudio son las más distribuidas en los cultivos de plátano (Cofcewicz et al., 2005). Recientemente M. incognita fue registrada en raíces de plátano en asociación a M. paranaensis en una localidad cercana a la zona de estudio en el municipio de Atzalan (López-Lima et al., 2015), sin embargo en el PCR no se detectó amplificación para esta especie. La presencia de poblaciones de Helicotylenchus multicinctus en asociación con poblaciones de M. arenaria y M. incognita pueden representar un riesgo para la producción del plátano en esta zona, como ha ocurrido en otros lugares donde estos dos géneros de nematodos causa fuertes daños al cultivo (Brentu et al., 2004; Subbotin et al., 2011).
Cuadro 2 Número de nematodos fitoparásitos encontrados en 100 g de raíz ± desviación estandar.

Los valores representan el promedio de cinco muestras en cada sitio de colecta § = Prueba de Kruskal-Wallis (H). Letras diferentes en las columnas indican diferencias significativas entre géneros y especies de nematodos con la prueba de comparaciones múltiples (p≤ 0.05).
El nematodo parásito más perjudicial y distribuido en el mundo en raíces de plátano es Radopholus similis (Chabrier y Queneherve, 2003; Quénéhervé et al., 2011), este se encontró en cuatro de los seis sitios examinados, aunque en bajas poblaciones, esto puede deberse al origen y la variedad de las plantas cultivadas en esta zona (Musa acuminata AA subgrupo Pisang Mas) ya que se ha demostrado que muchas accesiones diploides como las plantas estudiadas en este trabajo, son menos susceptibles a R. similis (Quénéhervé et al., 2009). Asimismo el rango de temperaturas de la zona de estudio (14-26 °C) es bajo para el óptimo desarrollo de R. similis (24-32 °C) (Pinochet et al., 1995; Gowen et al., 2005) lo que puede influir en la mayor presencia de Helicotylenchus y Meloidogyne. En la zona de producción en Chiapas, México R. similis se ha registrado como el nematodo dominante sobre Musa AAA del sub grupo Cavendish (Adriano-Anaya et al., 2008).
La densidad de población de los nematodos endoparásitos encontrados en las raices fue relativamente baja (Cuadro 2) en comparación con otros estudios realizados en el estado de Chiapas donde han alcanzado densidades mayores a 10,000 individuos en 100 g de raíz (Adriano-Anaya et al., 2008). Los pocos ejemplares encontrados de Criconema sp., puede deberse a que es un nematodo ectoparasito, por lo que su ciclo de vida se desarrolla fuera de la raíz (Yeates et al., 1993). Las especies de Helichotylenchus fueron las más abundantes en todos los sitios de estudio y su población fue significamente mayor a la población de Radopholus similis debido, a que su población fue baja en las cuatro localidades donde se encontró. La densidad de población de J2 de Meloidogyne spp. fue baja en todas las localidades con exepción de El Zapotal. En esta localidad se encontró el mayor número de nematodos totales, esto podría deberse a que es la localidad ubicada a menor altitud sobre el nivel del mar, y las condiciones climaticas podrían ser más favorables para su reproducción. Sin embargo es necesario realizar estudios sobre varios aspectos relacionados a la dinámica poblacional y su influencia en la producción.
Los síntomas observados en las plantas de plátano estudiadas de los municipios de Atzalan y Tlapacoyan son causados por nematodos fitoparásitos, los cuales se reportan por primera vez en la principal zona de producción de este cultivo en el Estado de Veracruz. Se registraron los géneros de nematodos que a nivel mundial causan los mayores daños al cultivo. La información generada en este trabajo es básica para iniciar acciones de control y evitar la dispersión de estos fitoparásitos a otras áreas, ya que la propagación del plátano se hace de manera vegetativa. Es necesario realizar estudios donde se cuantifique el daño económico causado por estos nematodos al cultivo de plátano, y donde se realicen estudios a nivel de campo para probar estrategias de control.











 texto en
texto en 


