El piñón (Jatropha curcas L.) se utiliza como cerco vivo en predios agrícolas debido a su fácil propagación, manejo y rápido crecimiento. A nivel mundial se estudia como cultivo bioenergético para la obtención de biodiesel, lo que contribuye a disminuir la emisión de gases efecto invernadero y mitigar el calentamiento global (Zamarripa y Solís, 2013). En Arriaga, Chiapas, desde el 2009 se observan plantaciones comerciales con muerte de plantas de piñón de 1 y 2 años de edad, las plantas afectadas presentan síntomas de marchitez y pudrición basal del tallo. El objetivo del presente trabajo fue determinar la etiología de la marchitez y pudrición basal del tallo del piñón en Arriaga, Chiapas.
Se colectaron muestras de plantas con síntomas de marchitez y pudrición basal del tallo en dos plantaciones de piñón, ubicadas en Arriaga, Chiapas: 1) Lote de 90 ha de piñón originario de la India, sembrado a partir de semilla en 2008, en el Rancho San Jacinto, ubicado a 16° 13' 18" de latitud norte y 94° 01' 07" longitud oeste, con una altitud de 50 msnm; 2) Lote de 3 ha de piñón de Chiapas, sembrado a partir de semilla en 2010, propiedad de la Universidad Autónoma de Chiapas, ubicado a 16° 11' 05" de latitud norte y 93° 55' 57" longitud oeste, con una altitud de 38 msnm. Las muestras se procesaron y se analizaron en condiciones de laboratorio. De material vegetal enfermo se obtuvieron secciones de 5 mm, desinfectadas superficialmente en hipoclorito de sodio al 1 %, se lavaron con agua destilada estéril y se sembraron en cajas Petri con medio B de King, las cajas se incubaron a 28 °C durante 48 horas, de las colonias formadas con una asa bacteriológica se realizaron transferencias a nuevo medio de cultivo mediante la técnica de estría cruzada. Con colonias puras se realizaron diferentes pruebas, las cuales incluyeron: prueba de reacción de hipersensibilidad, mediante la infiltración de una solución bacteriana a 1.2x109 UFC/mL en hojas de tabaco (Nicotiana tabacum L. cv. Xanthi) de plantas de 60 días de edad, la concentración fue estimada con la escala de McFarland (1907); prueba de pudrición en tubérculo de papa del cv. Alpha, mediante inoculaciones de crecimiento bacteriano en incisión en rodajas bajo condiciones asépticas; pruebas bioquímicas auxiliares para la identificación en medio de cultivo cloruro de trifenil tetrazolio (TTC), tinción de Gram, prueba de KOH, producción de la enzima citocromo oxidasa, producción de la enzima catalasa con agua oxigenada (H2O2), producción de la enzima ureasa en medio de cultivo de Christensen, metabolismo oxidativo y/o fermentativo de la glucosa en medio de cultivo Hugh y Leifson (Denny y Hayward, 2001).
Las plantas que fueron colectadas en campo (predios comerciales) presentaron síntomas de marchitamiento en hojas, pudrición bacteriana en la base del tallo y raíz, lo anterior coincide con la descripción de síntomas reportados por Hendroko et al. (2008), Ginting y Maryono (2009) y Hidayah y Yulianti (2009). Se observó hasta 85% de muerte de plantas afectadas de entre 1 y 2 años de edad, en un lapso de 20 a 30 días después del inicio del brote epidémico. La incidencia de la enfermedad disminuyó notablemente cuando el cultivo alcanzó el tercer año de edad. A partir de las muestras colectadas en campo se obtuvieron 16 cepas, 11 de las cuales, se descartaron mediante la prueba de hipersensibilidad en tabaco y las pruebas bioquímicas aplicadas. Las cepas 1 y 3B, presentaron resultados positivos en la prueba de hipersensibilidad en tabaco a las 48 h (Figura 1), también, la cepa P3 presentó resultados positivos o variables a las 72 h; en este sentido, Ji et al. (2007) mencionaron que R. solanacearum muestra variabilidad en la respuesta de la reacción de hipersensibilidad. Finalmente, se obtuvieron resultados negativos para esta prueba con las cepas P1 y P2.

Figura 1 Resultado positivo a las 48 h, de la prueba de hipersensibilidad en tabaco (Nicotiana tabacum L.) cv. Xanthi, realizado con la cepa 1 aislada de piñón.
En las pruebas de pudrición en tubérculo de papa los resultados obtenidos fueron positivos para las cinco cepas bacterianas, lo cual coincide con Rodríguez (2012) quien mencionó que para bacterias aisladas de organismos con pudrición, la patogenicidad se puede valorar con esta prueba.
Las cinco cepas bacterianas aisladas de piñón dieron positivas en medio TTC, con el desarrollo de colonias de color rojo y bordes blancos, características distintivas de colonias virulentas de R. solanacearum (Figura 2), estos resultados coinciden con lo reportado por Perea et al. (2011), quienes reportaron que el crecimiento de colonias bacterianas de R. solanacearum en medio de cultivo TTC se caracterizan por una coloración rojiza con bordes blanquecinos. La tinción de Gram y pruebas bioquímicas de oxidasa, catalasa, ureasa coincide con lo reportado por Yabuuchi et al. (1995), Denny y Hayward (2001), Dhital (2001), EPPO (2004), Rahman et al. (2010), Perea et al. (2011), Marques et al. (2012) y Rodríguez (2012) (Cuadro 1).
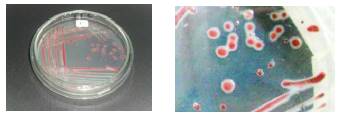
Figura 2 Crecimiento en medio TTC de la cepa P1 aislada de Jatropha curcas con síntomas de marchitez y pudrición bacteriana; se observa el color rojo rodeado de una zona blanca, típico de las colonias de R. solanacearum.
Cuadro 1 Pruebas bioquímicas y de patogenicidad realizadas a cinco cepas bacterianas aisladas de Jatropha curcas.
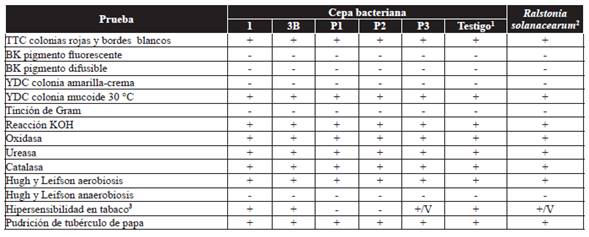
1Testigo = Cepa de referencia aislada de tomate (solanum lycopersicum L.) identificada y proporcionada por el Lab. De Fitopatología, Depto. Fr Microbiología, Esc. Nacional de Ciencias Biológicas, Instituo Politécnico Naicional, México, D.F.
2Respuesta de R. solanacearum, según Denny y Hayward (2001), Dhital (2001), EPPO (2004), Rahman et al. (2010), Perea et al. (2011), Marques et al. (2012), Rodríguez (2012).
3V = Variable.
Se caracteriza a la marchitez y pudrición basal de Jatropha curcas en Arriaga, Chiapas, México con síntomas de flacidez de pecíolos, marchitamiento y caída de hojas; pudrición de raíz y base del tallo, producción de raíces adventicias y senescencia entre 20 a 30 días después de los primeros síntomas. De 16 cepas bacterianas aisladas de piñón, al someterlas a la prueba de hipersensibilidad de tabaco y pruebas bioquímicas, tres cepas coinciden con las características para R. solanacearum. Aunque los postulados de Koch no fueron realizados, este es el primer reporte de la asociación de Ralstonia solanacearum en la marchitez y pudrición basal del piñón en Chiapas, México.











 texto em
texto em 


