Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.34 no.1 Texcoco 2016
https://doi.org/10.18781/R.MEX.FIT.1507-3
Notas fitopatológicas
Toxicidad in vitro de micromicetos del trópico mexicano en juveniles infectivos de Meloidogyne incognita
1Unidad de Biotecnología, Centro de Investigación Científica de Yucatán; Mérida, Yucatán, México
2Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, INIFAP; Mocochá, Yucatán, México
3Instituto Tecnológico de Conkal, Conkal, Yucatán, México
4Red de Biodiversidad y Sistemática, Instituto de Ecología A.C., Xalapa, Veracruz, México
Filtrados de cultivos y extractos de micelio (acetato de etilo y metanol) de nueve cepas fúngicas Mexicanas tropicales se evaluaron en condiciones in vitro contra juveniles de segundo estadio (J2) de Meloidogyne incognita. Los micromicetos Acremonium kiliense TA31, Aspergillus sp. 2XA5, Gliocladium sp. MR41, Selenosporella sp. MR26, Stagonospora sp. TA34 y cuatro cepas no identificadas (TA13, 2TA6, 2TA7 y 2XA7) se cultivaron en medio Czapeck-Dox durante 14 días y la masa micelial se separó por filtración para la extracción de metabolitos. Aspergillus sp. 2XA5 y Selenosporella sp. MR26 mostraron la mayor actividad nematóxica, tanto en filtrados de cultivo (100% de mortalidad) como en extractos metanólicos (> 90% de mortalidad). La CE50 más baja (0.08 mg mL-1) se obtuvo con el extracto de metanol de la cepa 2XA7 no identificada. Los resultados obtenidos indican que la micobiota tropical tiene potencial como agentes de control biológico de nematodos fitopatógenos.
Palabras clave: Aspergillus sp.; nematóxico; Micromycetes; nematodos agalladores; Selenosporella sp.
Culture filtrates and mycelia extracts (methanol and ethyl acetate) from nine selected Mexican tropical fungal strains were tested against second stage juveniles (J2) of Meloidogyne incognita, in vitro conditions. The micromycetes Acremonium kiliense TA31, Aspergillus sp. 2XA5, Gliocladium sp. MR41, Selenosporella sp. MR26, Stagonospora sp. TA34, and four unidentified strains (TA13, 2TA6, 2TA7, and 2XA7) were cultured on Czapeck-Dox medium for 14 days and mycelial mat was separated by filtration for metabolites extraction. Aspergillus sp. 2XA5 and Selenosporella sp. MR26 showed the highest nematotoxic activity both in culture filtrates (100 % mortality) and methanol extracts (> 90 % mortality). The lowest EC50 (0.08 mg mL-1) was exhibited by the methanol extract of the unidentified strain 2XA7. The results obtained indicate that tropical mycobiota have potential as biological control agents of plant parasitic nematodes.
Key words: Aspergillus sp.; nematotoxic; Micromycetes; root-knot nematodes; Selenosporella sp
Meloidogyne incognita es el nematodo inductor de agallas en la raíz más importante en la agricultura mexicana. En Yucatán, afecta a varios cultivos importantes entre los que destacan: chile habanero (Capsicum chinense Jacq.), sábila (Aloe vera L.) y tomate (Solanum lycopersicum L.), entre otros (Herrera-Parra et al., 2011). Numerosos estudios reportan que metabolitos secundarios producidos por algunos hongos podrían aplicarse como parte de una estrategia para su manejo (Xalxo et al., 2013; Bhattacharjee y Dey 2014). Estos metabolitos incluyen caryospomycinas (Dong et al., 2007), quitinasas, glucanasas, peroxidasas, viridinas, gliotoxinas, trichoderminas, entre otros (Szabo et al., 2013).
Sin embargo, es necesario realizar más investigaciones relacionadas con el uso potencial de hongos para estos propósitos (Hernández-Carlos y Gamboa-Angulo, 2011). En este sentido, nuestro grupo de investigación de productos naturales, se ha centrado en la detección potencial de fuentes regionales de compuestos naturales para desarrollar compuestos ecológicos, con efecto nematicida para el control de este nematodo. Como resultado, la cepa Selenosporella sp. MR26 ha demostrado efectividad contra M. incognita (Reyes-Estébanez et al., 2011). Sin embargo, en este estudio el efecto nematotóxico detectado disminuyó (2 %), cuando la cepa del hongo se cultivó en arroz fermentado.
Se tienen reportes que indican que la biosíntesis de metabolitos por microorganismos, están en función del sustrato y las condiciones de su cultivo (Shinya et al., 2008; Regaieg et al., 2010). Para continuar con la prospección de nuestras colección de hongos, nueve cepas seleccionadas se activaron: Acremonium kiliense TA31, Aspergillus sp. 2XA5, Gliocladium sp. MR41, Selenosporella sp. MR26, Stagonospora sp. TA34 y cuatro cepas no identificadas (TA13, 2TA6, 2TA7 y 2XA7). Éstas se cultivaron en medio líquido Czapeck Dox (Gamboa-Angulo et al., 2012; Reyes-Estébanez et al., 2011).
Por lo anterior, el objetivo de este estudio consistió en evaluar in vitro filtrados de cultivos y extractos miceliales (acetato de etilo y metanol) de estos hongos contra el segundo estadio juvenil (J2) de M. incognita, asimismo estimar la concentración efectiva media de los filtrados o extractos con mayor efectividad antagónica.
Materiales y métodos
Material fúngico
Cepas fúngicas (Cuadro 1) se activaron; de la colección de la Unidad de Biotecnología del Centro de Investigación Científica de Yucatán, A.C., las cuales originalmente se aislaron de hojas y agua muestreadas en Tabasco, Veracruz y Yucatán, México (Reyes-Estébanez et al., 2011; Gamboa-Angulo et al., 2012).
Cuadro 1 Efecto del filtrado de cultivo fúngico (1 mL) y extractos metanólicos miceliales (0.3 mg mL-1) a partir de cepas de micromicetos contra J2 de Meloidogyne incognita.
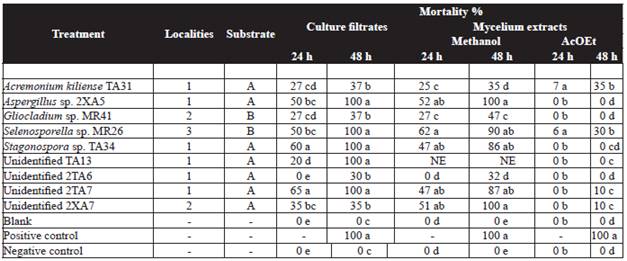
Medias con la misma letra (s) en la columna no son significativamente diferentes a P = 0.05 de acuerdoa la prueba de rango múltiple deTukey. Control positivo: Vydate (Oxamil 1 mL L-1 de agua). Blanco: medio Czapeck-Dox/ extracto orgánico.
Control negativo: agua. NE = no evaluados.
1: Yucatán 2: Veracruz 3: Tabasco. A: agua B: hojas.
Condiciones de cultivo y extracción de metabolitos de hongos
Todas las cepas se activaron en papa dextrosa agar (PDA) en condiciones de temperatura y luz controlada (25 ± 2 °C, 16/8 horas de luz / oscuridad) durante una semana, para después obtener una suspensión de fragmentos hifales o de esporas (Reyes-Estébanez et al., 2011). Un mL de la suspensión se transfirió a un medio líquido Czapek-Dox (200 mL) contenido en botellas Roux, con tres repeticiones por aislamiento. Estos cultivos se incubaron durante dos semanas a temperatura ambiente en condiciones estacionarias. Enseguida, los cultivos se filtraron a través de papel filtro (Whatman(r) No. 42), para separar el filtrado del micelio y obtener metabolitos polares. El material micelial se liofilizó (Labconco) y se pulverizó en un mortero de vidrio, para obtener el extracto respectivo mediante acetato de etilo (3 × 100 mL durante 24 h por tiempo), seguido de metanol (3 ×, 100 mL para 24 h, por tiempo) y extraer metabolitos no polares. El disolvente se eliminó a presión reducida hasta deshidratarlos completamente y obtener extractos orgánicos crudos, los cuales se almacenaron a 4 °C en oscuridad. Los filtrados de los cultivos y los extractos miceliales, sirvieron para su evaluación nematotóxico (Reyes-Estébanez et al., 2008).
Ensayo Nematotóxico
El inóculo de nematodos se preparó previamente (Cristóbal-Alejo et al., 2006). Los extractos de acetato de etilo y metanólicos de los hongos se disolvieron (300 mg mL-1) en 0.25 % de Tween 20, y se esterilizaron (1 mL) mediante filtración a través de papel filtro (Millipore) de 0.45 micras antes de su uso en los bioensayos (Cristóbal-Alejo et al., 2006; Candelero-de la Cruz et al., 2015). Para los estudios de mortalidad se realizaron con J2, (10 cada réplica) recién eclosionados los cuales se colocaron en siracusas especiales de vidrio con los extractos y se incubaron a temperatura ambiente. Se utilizó como control positivo un nematicida; Vydate (Oxamil l mL-1), un tratamiento control negativo que incluyó agua destilada y un control blanco (el medio Czapeck-Dox). Cada extracto se repitió cuatro veces y se mantuvo bajo condiciones de laboratorio distribuidos en un diseño experimental completamente al azar. Después de 24 y 48 h, bajo un microscopio estereoscópico, los J2 que no mostraron movilidad a través de un movimiento cuando se les estimuló la región cefálica se consideraron inmovibles. Después de evaluarse los tratamientos, los J2 se clasificaron como móviles e inmóviles. Posteriormente después de 72 h, de exposición a los extractos, la mortalidad de los J2 se confirmó al transferirlos en agua destilada sin los extractos por un periodo de observación de 24 h.
Se emplearon diferentes dosis inhibitoria utilizando diluciones (0, 50, 100, 200, 300, 400 y 500 mg mL-1) para tres extractos y filtrados con mayor actividad (Aspergillus sp. 2XA5, Selenosporella sp. MR26 y no identificados 2XA7). En el caso de los filtrados, éstos se diluyeron a 50 y 25 % (v: v).
Los resultados de mortalidad de los J2 de M. incognita, se expresaron en porcentajes. Para los análisis de varianza se tuvieron que trasformar mediante la función de arco seno [y = arcosin (sqrt (s/100))] y cuando se detectaron diferencias significativas entre tratamientos, se hizo la comparación de medias mediante la prueba de Tukey (P=0.05) (Steel y Torrie, 1988). Las concentraciones letales (CE50 y CE95) se obtuvieron mediante la transformación a logaritmos "Probit" base diez con los datos del porcentaje de mortalidad haciendo un segundo ensayo (Trono et al., 1995).
Resultados y discusión
La actividad nematotóxica de los filtrados y de los extractos con acetato de etilo y metanolicos fúngicos contra M. incognita se resume en la Tabla 1. Los extractos con acetato de etilo no mostraron efecto nematotóxico (<50 %). Los resultados indicaron que los extractos de seis cepas (67 %) inmovilizaron a los J2 de M. incognita. Cinco filtrados sin diluir provenientes de Aspergillus sp. 2XA5, Selenosporella sp. MR26, Stagonospora sp. TA34, y dos cepas no identificadas (TA13 y 2TA7), dos extractos metanólicos (Aspergillus sp. 2XA5 y no identificados 2XA7) mostraron efectos significativos en la inmovilidad de los J2 de los nematodos (mortalidad de 85-100 %). El efecto nematotóxico más significativo se observó con los filtrado y los extractos metanólicos de Aspergillus sp. 2XA5, seguido por Selenosporella sp. MR26. La toxicidad de los filtrados en medios líquidos y de los extractos metanólicos de Selenosporella sp. MR26 fue mayor que cuando éstos se obtuvieron en medio solido (Reyes-Estébanez et al., 2011).
Cuando los juveniles se expusieron en filtrados en tres concentraciones diferentes de Aspergillus sp. 2XA5, Selenosporella sp. MR26 y la cepa no identificados 2XA7 (Figura 1), el efecto dependió de la concentración. El número de J2 inmóviles fue superior al 50 % en la más alta concentración de los extractos y al término de 48 h la mayoría de los nematodos se inmovilizaron con promedio de muerte del 75. 8 %. La toxicidad más alta se observó con todos los filtrados sin diluir. Resultados similares se reportaron contra juveniles de M. incognita con filtrados de Nigrospora sp., cultivado en medio Czapeck (Amin, 2013). La acción nematicida de los filtrados se atribuye a la producción de enzimas y otros metabolitos tóxicos; en Fusarium solani, la acción tóxica fue asociado por la presencia de toxinas del hongo y no por los compuestos de sales y azúcares que constituyen el medio de cultivo donde creció (Jain et al., 2008; Regaieg et al., 2010). También, por la presencia de enzimas que desempeñan un papel importante en los procesos de infección de los hongos, las cuales se relacionan con su efecto antagónico (Segers et al., 1994). En este sentido, enzimas hidrolíticas extracelulares tales como; lipasas, quitinasas y proteasas en hongos entomopatógenos se consideran determinantes de virulencia, ya que están involucradas en los procesos de penetración de la cutícula y de la digestión celular (Regaieg et al., 2010).
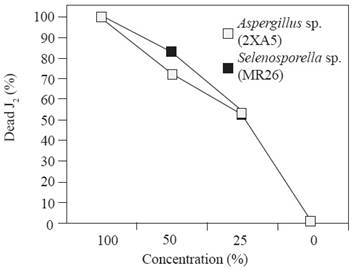
Figura 1 Efecto nematotóxico de filtrados de cultivos fúngicos a diferentes diluciones (0, 25, 50, 100 % v/v) contra J2 de Meloidogyne incognita a las 48 h.
Los resultados de los ensayos nematotóxicos con los filtrados y los extractos metanólicos de micelio contra M. incognita mostraron eficacia solo en cinco cepas, y los extractos con actividad son de tipo polar (Cuadro 1). A las 48 h de exposición, el mejor efecto lo causaron los extractos provenientes de Aspergillus sp. 2XA5 y la cepa no identificada 2XA7 (100 % de mortalidad), seguido por Selenosporella sp. MR26 (90 % de mortalidad). Otras cepas como Stagonospora sp. TA34 y la cepa 2TA7 no identificada, fueron menos activos que los mencionados anteriormente con un 47 % de mortalidad de nematodos a las 24 horas y hasta un 80 % a las 48 h. Este efecto nematotóxico fue particularmente interesante ya que las cepas fúngicas que causan la inmovilidad del nematodo, es resultado de la acción de metabolitos intracelulares (endotoxinas) y extracelulares (exotoxinas). El efecto nematotóxico de la cepa no identificado 2XA7, sólo se produjo en el extracto micelial metanólico y no en el filtrado, lo que indica que la sustancia tóxica no es secretada por hifas fúngicas (endotoxina).
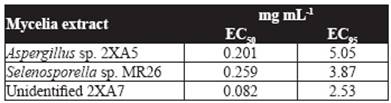
De acuerdo con la Tabla 1, los extractos metanólicos miceliales ejercieron la actividad nematotóxico más alta y se obtuvieron con Aspergillus sp. 2XA5, Selenosporella sp. MR26, y la cepa no identificada 2XA7. Éstas al estimarse la CE50 y CE95 (Cuadro 2), la cepa no identificada 2XA7 fue más efectiva con una CE50 de 0.08 mg mL-1, seguido por los extractos Aspergillus sp. 2XA5 y Selenosporella sp. MR26 (CE50 de 0.20 y 0.26 mg mL-1, respectivamente). Estos valores se consideran buenos en comparación con la efectividad de compuestos aislados de otros hongos como Paecilomyces lilacinus 6029 (con valores de CE50 de 3.03 mg mL-1) y Verticilllium chlamydosporum (500 mg L-1) (Khambay et al., 2000; Sharma et al., 2014). Aunque el aislamiento y la identificación de los metabolitos de Selenosporella sp. MR26 están en progreso de identificación, es importante mencionar que Selenosporella sp. MR26 produce metabolitos nematotóxico no polares, cuando se cultiva en medios sólidos fermentado de arroz (CE50 de 0.91 mg mL-1) y metabolitos polares, cuando se desarrolla en medio líquido Czapeck-Dox (Reyes-Estébanez et al., 2011).
Cuadro 2 Concentraciones efectivas (CE50 y CE95) de extractos metanólicos de las cepas con la mayor actividad nematotóxica contra J2 de Meloidogyne incognita a 48 h.
Por otra parte, Aspergillus es un género ampliamente conocido con una producción altamente polifacética, cuyos metabolitos activos de varias especies han demostrado propiedades nematotóxicas, como A. awamori y A. niger contra M. incognita y A. quadrilineatus contra M. javanica (Bath y Wani, 2012). En A. niger se identificaron; brevianamide A, itaconitina, ácidos canadensico y micofenólico, y en A. quadrilineatus producción de flavoskyrina, dehydrocanadensolida y α-ácido Collatolico (Siddiqui y Futai, 2009; Akhtar y Panwar, 2013).
Conclusiones
En el presente estudio, los datos obtenidos indican que Aspergillus sp. 2XA5 y Selenosporella sp. MR26 son promisorios para controlar J2 de M. incognita. Ambos hongos producen en sus filtrados y en sus extractos metanólicos miceliales, metabolitos de naturaleza polar; responsables de la actividad nematotóxica. Se requiere de investigaciones adicionales para identificar y caracterizar las moléculas de los metabolitos potenciales; responsables de la actividad detectada en este estudio. También es necesario realizar ensayos en invernadero y verificar la seguridad ambiental de su uso.
Agradecimientos
Los autores agradecen a Irma L. Medina-Baizabal, Manuela Reyes, Narcedalia Gamboa y Sergio Pérez, por su valiosa asistencia técnica. Esta investigación fue apoyada por el CONACyT (Proyectos Nº 47549 y 2009 / CB131256) y por la beca otorgada a Jaime Pérez Cruz.
REFERENCIAS
Akhtar MS, and Panwar J. 2013. Efficacy of root-associated fungi and PGPR on the growth of Pisum sativum (cv. Arkil) and reproduction of the root-knot nematode Meloidogyne incognita. Journal of Basic Microbiology 53:318-326. http://dx.doi.org/10.1002/jobm.201100610 [ Links ]
Amin N. 2013. Investigation of culture filtrate of endophytic fungi Nigrospora sp. isolate RS 10 in different concentrations towards root-knot nematode Meloidogyne spp. Indian journal of Science and Technology 6:5177-5181. http://dx.doi.org/10.17485/ijst/2013/v6i9/37130 [ Links ]
Bhat MY, and Wani AH. 2012. Bio-activity of fungal culture filtrates against root-knot nematode egg hatch and juvenile motility and their effects on growth of mung bean (Vigna radiata L. Wilczek) infected with the root-knot nematode, Meloidogyne incognita. Archives of Phytopathology and Plant Protection 45:1059-1069. http://dx.doi.org/10.1080/03235408.2012.655578 [ Links ]
Bhattacharjee R, and Dey U. 2014. An overview of fungal and bacterial biopesticides to control plant pathogens/diseases. African Journal of Microbiology Research 17:1749-1762. http://dx.doi.org/10.17485/ijst/2013/v6i9/37130 [ Links ]
Candelero-De la Cruz J, Cristóbal-Alejo JRA, Reyes-Ramírez A, Tun-Suárez JM, Gamboa-Angulo MM, and Ruíz-Sánchez E. 2015. Trichoderma spp. promotoras del crecimiento en plántulas de Capsicum chinense Jacq. y antagónicas contra Meloidogyne incognita. Phyton International Journal of Experimental Botany 84:113-119. Disponible en línea: http://www.revistaphyton.fund-romuloraggio.org.ar/vol84.html [ Links ]
Cristóbal-Alejo J, Tun-Suárez JM, Moguel-Catzin S, Marbán-Mendoza N, Medina-Baizabal IL, Simá-Polanco P, Peraza-Sánchez SR, andGamboa-Angulo MM. 2006. In vitro sensitivity of Meloidogyne incognita to extracts from native yucatecan plants. Nematropica 36:89-97. Disponible en línea: http://journals.fcla.edu/nematropica/article/view/69732/67392 [ Links ]
Dong J, Zhu YA, and Song HB. 2007. Nematicidal resorcylides from the aquatic fungus Caryospora callicarpa YMF1.01026. Journal of Chemical Ecology 33:1115-1126. http://dx.doi.org/10.1007/s10886-007-9256-7 [ Links ]
Gamboa-Angulo M, De la Rosa-García SC, Heredia-Abarca G, Medina-Baizabal IL. 2012. Antimicrobial screening of tropical microfungi isolated from sinkholes located in the Yucatan peninsula, Mexico. African Journal of Microbiology Research 6:2305-2312. http://dx.doi.org/10.5897/AJMR11.1129 [ Links ]
Hernández-Carlos B, Gamboa-Angulo MM. 2011. Metabolites from freshwater aquatic microalgae and fungi as potential natural pesticides. Phytochemistry Reviews 10:261-286. http://dx.doi.org/10.1007/s11101-010-9192-y [ Links ]
Herrera-Parra E, Cristóbal-Alejo J, Tun-Suárez JM, Góngora-Jiménez JA, y Lomas-Barrie CT. 2011. Nematofauna nociva (Meloidogyne spp.) en cultivos hortícolas tropicales: Distribución y perspectivas de manejo en Yucatán. In: Gamboa AM, Rojas HR (eds.). Recursos genéticos microbianos en la zona Golfo-Sureste de México. Vol 1. México: Subnargem, Sagarpa. Morevalladolid S. de R.L. de C.V., 138-150. http://www.researchgate.net/publication/256458732_Recursos_genticos_microbianos_en_la_Zona_Golfo-Sureste_de_Mexico [ Links ]
Jain A, Mohan J, Singh M, and Goswami BK. 2008. Potentiality of different isolates of wilt fungus Fusarium oxysporum collected from rhizosphere of tomato against root-knot nematode Meloidogyne incognita. Journal of Environmental Science and Health B 43:686-691. http://dx.doi.org/10.1080/03601230802388777 [ Links ]
Khambay BPS, Bourne JM, Cameron S, Kerry BR, and Zaki MJ. 2000. A nematicidal metabolite from Verticillium chlamydosporium. Pest Management Science 56:1098-1099. http://dx.doi.org/10.1002/1526-4998(200012)56:12<1098::AID-PS244>3.0.CO;2-H [ Links ]
Regaieg H, Ciancio A, Raouani NH, Grasso G, and Rosso L. 2010. Effects of culture filtrates from the nematophagous fungus Verticillium leptobactrum on viability of the root-knot nematode Meloidogyne incognita. World Journal of Microbiology and Biotechnology 26:2285-2289. http://dx.doi.org/10.1007/s11274-010-0397-4 [ Links ]
Reyes-Estebanez M, Heredia-Abarca G, y Gamboa-Angulo MM. 2008. Perfil biológico de hongos anamórficos del sureste de México. Revista Mexicana de Micología 28:49−56. Disponible en línea http://revistamexicanademicologia.org/wp-content/uploads/ 2009/10/RMM_2009_28_049-056.pdf [ Links ]
Reyes-Estebanez M, Herrera-Parra E, Cristóbal-Alejo J, Heredia-Abarca G, Canto-Canché B, Medina-Barizabal BI, and Gamboa-Angulo M. 2011. Antimicrobial and nematicidal screening of anamorphic fungi isolated from plant debris of tropical areas in Mexico. African Journal of Microbiology Research 5:1083-1089. http://dx.doi.org/10.5897/AJMR11.121 [ Links ]
Segers R, Butt TM, Kerry BR, and Peberdy JF. 1994. The nematophagous fungus Verticillium chlamydosporium produces a chymoelastase-like protease which hydrolyses host nematode proteins in situ. Microbiology 140:2715-2723. http://dx.doi.org/10.1099/00221287-140-10-2715 [ Links ]
Sharma A, Sharma S, and Dalela M. 2014. Nematicidal activity of Paecilomyces lilacinus 6029 cultured on Karanja cake medium. Microbial Pathogenesis 75:16-20. http://dx.doi.org/10.1016/j.micpath.2014.08.007 [ Links ]
Shinya R, Aiuchi D, Kushida A, Tani M, Kuramochi K, and Koike M. 2008. Effects of fungal culture filtrates of Verticillium lecanii (Lecanicillium spp.) hybrid strains on Heterodera glycines eggs and juveniles. Journal of Invertebrate Pathology 97:291-297. http://dx.doi.org/10.1016/j.jip.2007.11.005 [ Links ]
Siddiqui ZA, and Futai K. 2009. Biocontrol of Meloidogyne incognita on tomato using antagonistic fungi, plant-growth-promoting rhizobacteria and cattle manure. Pest Management Science 65:943-948. http://dx.doi.org/10.1080/09583150801896043 [ Links ]
Steel RDG, and Torrie JH. 1988. Bioestadística. Principios y procedimientos. Segunda edición. McGraw-Hill. DF, México. 662 p. [ Links ]
Szabó M, Urbán P, Virányi F, Kredics L, and Fekete C. 2013. Comparative gene expression profiles of Trichoderma harzianum proteases during in vitro nematodes egg-parasitism. Biological Control 67: 337-346. http://dx.doi.org/10.1016/j.biocontrol.2013.09.002 [ Links ]
Throne JE, Weaver DK, and Baker JE. 1995. Probit analysis: Assessing goodness-of-fit based on block transformation and residuals. Journal of Economic Entomology 88:1513-1516. http://jee.oxfordjournals.org/content/88/5/1513 [ Links ]
Xalxo PC, Karkur D, and Poddar A.N. 2013. Rhizospheric fungal association of root knot nematode infested cucurbits: in vitro assessment of their nematicidal potential. Research Journal of Microbiology 2: 81-91. http://dx.doi.org/10.3923/jm.2013.81.91 [ Links ]
Recibido: 06 de Julio de 2015; Aprobado: 10 de Diciembre de 2015











 texto en
texto en 


