La lignina es un polímero tridimensional complejo cuyas subunidades aromáticas son sintetizadas a través de la ruta de los fenilpropanoides (Dixon et al., 2002), es además un componente fundamental que refuerza y proporciona rigidez a los tejidos vegetales (Dixon et al., 2002; Weng y Chapple, 2010) y se deposita de manera abundante en células específicas de las plantas como las esclereidas, traqueidas, elementos de los vasos, y fibras del xilema y floema (Vance et al., 1980; Dixon et al., 2002). La lignina se considera también un mecanismo de defensa importante, su biosíntesis y deposición en paredes celulares se incrementa cuando las plantas son sometidas a estrés de tipo biótico o abiótico (Weng y Chapple, 2010). Por si misma, la lignina constituye una barrera física inicial contra el ingreso de fitopatógenos en el hospedante y en algunos casos limita su crecimiento o los confina (Wuyts et al., 2006). Al depositarse en las paredes celulares incrementa su resistencia a la degradación por enzimas (Wuyts et al., 2006; Menden et al., 2007), limita la difusión de toxinas secretadas por el patógeno y la de nutrientes del hospedante hacia el patógeno, constituye además una fuente para la producción de precursores tóxicos y radicales libres (Nicholson y Hammerschmit, 1992).
En las interacciones planta-nematodo, el estilete de los nematodos participa en la penetración de las paredes celulares de su hospedante, ayuda a ingerir el contenido celular y sirve además como canal conductor de los efectores producidos en sus glándulas esofágicas, los cuales inducen la modificación de las células de alimentación de los nematodos, en el caso de los nematodos agalladores se conocen como células gigantes y básicamente son producto de divisiones nucleares repetidas sin citocinesis, mientras que los inducidos por nematodos enquistadores se conocen como sincitios, y son producto de la fusión de protoplastos y la disolución gradual de las paredes de las células que los integran; ambos sitios especializados de alimentación (SEA) constituyen células de alimentación altamente metabólicas y multinucleadas, que serán la única fuente de alimentación del nematodo y le aportarán los nutrientes requeridos para su crecimiento y desarrollo (Hussey, 1989; Ithal et al., 2007; Gheysen y Mitchum, 2011; Mitchum et al., 2013). Una modificación importante que ocurre en las células hospedantes es la alteración en la lignificación de las paredes celulares; de la formación exitosa del SEA dependerá que el nematodo pueda establecerse y completar su ciclo de vida. En la presente revisión se describe la biosíntesis, estructura y composición de la lignina y el conocimiento que a la fecha se tiene de su función en la interacción planta-nematodo, tanto compatible como incompatible.
Biosíntesis y composición de la lignina
La lignina es un componente fundamental de la pared celular (PC) vegetal; la PC es un complejo extracelular dinámico, que además de la lignina, está básicamente formada por celulosa, hemicelulosa, pectina, proteínas, cutina, suberina y sales minerales, entre otros (Bonawitz y Chapple, 2010).
La biosíntesis de lignina implica la participación de dos rutas metabólicas comenzando por la ruta del shikimato para la producción de L-fenilalanina y L-tirosina, y la ruta fenilpropanoide desde la L-fenilalanina hasta la biosíntesis final de los alcoholes cinamílicos (Figura 1) (Boerjan y Baucher, 2003); en esta última ruta, además de la lignina, también se sintetizan otros compuestos fenólicos, como estilbenos, coumarinas, flavonoides y algunas fitoalexinas (Dixon et al., 2002).
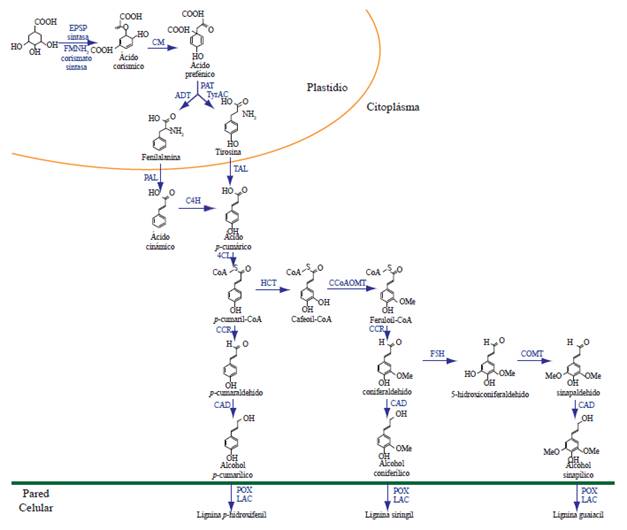
Figura 1 Rutas del shikimato (plastidio) y fenilpropanoide (citoplasma) para la biosíntesis de lignina. EPSP sintasa: ácido 5-enolpiruvilshikímico 3-P sintasa; FMNH2 corismato sintasa: flavin mononucleótido corismato mutasa; CM: corismato mutasa; PAT: prefenato aminotransferasa; ADT: arogenato deshidratasa; TyrAC: arogenato deshidrogenasa; PAL: fenilalanina amonio liasa; TAL: tirosina amoniaco liasa; C4H: cinamato-4-hidroxilasa; 4CL: 4-cumarato:CoA ligasa; HCT: hidroxicinamoil transferasa; CCoAOMT: cafeoil CoA-O-metiltransferasa; CCR: cinamoil-CoA reductasa; F5H: ferulato 5-hidroxilasa; COMT: ácido caféico O-metiltransferasa; CAD: cinamil alcohol deshidrogenasa; POX: peroxidasas; LAC: lacasas. Modificado de Liu (2012).
La síntesis de los monómeros de lignina (monolignoles) comienza con la des-aminación de la fenilalanina para formar ácido cinámico, posteriormente una serie de hidroxilaciones y subsecuentes reacciones de O-metilación modifican los anillos aromáticos del ácido cinámico reduciendo su cadena lateral de un ácido a un alcohol. Esto da como resultado la producción de los monolignoles: alcohol p-coumarílico (4-hidroxicinamílico), alcohol coniferílico (3-metoxi 4-hidroxicinamílico) y alcohol sinapílico (3,5-dimetoxi 4-hidroxicinamílico); éstos difieren en su grado de metoxilación, el alcohol coniferílico presenta un grupo metoxilo (-OCH3) en la posición 3 del anillo aromático, el sinapílico dos metoxilos en sus posiciones 3 y 5, y el p-coumarílico carece de sustituyentes en su anillo aromático. Después de su incorporación al polímero de lignina, estos monómeros se refieren como unidades p-hidroxifenil (H), guaiacil (G) y siringil (S), respectivamente, y su disposición y abundancia determinan las propiedades físicas de la PC (Rastogi y Dwivedi, 2007; Vanholme et al., 2008; Bonawitz y Chapple, 2010; Vanholme et al., 2010). En general, los monómeros G y S son los principales componentes de la lignina en dicotiledóneas angiospermas, mientras que en gimnospermas la lignina consiste principalmente de monómeros de G con bajos niveles de unidades H, en cambio los pastos contienen mayor cantidad de unidades H que las dicotiledóneas (Bonawitz y Chapple, 2010). Aunque la lignina generalmente se compone de las unidades H, G y S, en plantas transgénicas en las que se han alterado los genes que codifican para las dos enzimas O-metiltransferasas: CCoAOMT y COMT también se han identificado unidades atípicas de lignina como catecol (C) y 5-hidroxiguaiacil (5H) (Marita et al., 2003; Vanholme et al., 2010; Weng y Chapple, 2010).
Para la biosíntesis de monolignoles se requiere de la participación de 10 enzimas: fenilalanina amonio liasa (PAL), tres citocromo P450-monoxigenasas (cinamato-4-hidroxilasa, p-cumarato-3-hidroxilasa y ferulato-5-hidroxilasa, C4H, C3H y F5H, respectivamente), dos metiltransferasas (cafeoil-CoA-O-metiltransferasa y ácido caféico-O-metil-transferasa, CCoAOMT y COMT, respectivamente) y dos oxidoreductasas (cinamoil-CoA-reductasa y cinamoil alcohol deshidrogenasa, CCR y CAD, respectivamente), además de las enzimas 4-cumarato CoA ligasa (4CL) e hidroxicinamoil-CoA shikimato (HCT), las cuales son requeridas para la síntesis de los diferentes intermediarios que sirven como sustratos en reacciones posteriores (Bonawitz y Chapple, 2010).
Los monómeros de lignina se unen covalentemente a hemicelulosas y proveen de fuerza y rigidez a la PC de la planta y al sistema vascular le confieren la hidrofobicidad necesaria para el transporte de agua y solutos (Vanholme et al., 2008); la lignina puede clasificarse en condensada y no condensada con base en el tipo de enlace que se establece entre los monolignoles y entre éstos y otros componentes de la PC (Cuadro 1). En la composición de la PC también participan los ácidos p-hidroxicinámicos (principalmente p-cumárico y ferúlico), los cuales contribuyen a la unión de la lignina con la hemicelulosa mediante enlaces éster y éter; el ácido ferúlico, es el principal responsable de los puentes entre la lignina y los polisacáridos, mientras que las uniones entre monómeros dan lugar a la conformación de una estructura tridimensional (Sun et al., 2002).
Cuadro 1 Características de la lignina condensada y no condensada.

C-C: enlaces carbon-carbono; H: p-hidroxifenil; G: guaiacyl; S: siringil.
Tanto la lignificación de la PC como la incorporación de cada monómero están reguladas en el espacio y en el tiempo y varían de acuerdo a la especie de planta, edad y tejido, y de si se trata de paredes celulares primarias o secundarias. En etapas tempranas de lignificación, el alcohol coniferílico se copolimeriza con pequeñas cantidades de p-coumarílico en la pared primaria para formar ligninas G y H y durante el desarrollo de la PC secundaria, se incrementa el contenido de alcohol sinapílico que se copolimeriza con el coniferil alcohol para formar lignina S y G (Grabber, 2005).
Los monolignoles precursores de la lignina, se sintetizan en el retículo endoplásmico del citosol y posteriormente se transportan a la PC en donde finalmente se depositan (Santiago et al., 2013). Dada su relativa toxicidad a la célula, se ha sugerido que se exportan en forma de monolignoles-glucósidos y ya en la PC son convertidos, mediante la acción de peroxidasas y/o lacasas, a las unidades H, G o S. La deposición de cada unidad en el tejido de la planta se controla espacial y temporalmente; primero se depositan las unidades H, enseguida las G y al final las S (Dixon et al., 2002; Bonawitz y Chapple, 2010; Santiago et al., 2013). La composición y características de la lignina, son determinadas por la abundancia de cada uno de los monolignoles y varían considerablemente entre taxones, tipos de células, e incluso entre capas de las paredes celulares; también contribuyen los factores ambientales y el desarrollo mismo de la planta (Boerjan y Baucher, 2003; Bonawitz y Chapple, 2010; Vanholme et al., 2010; Weng y Chapple, 2010).
La lignificación es un proceso altamente coordinado y regulado por un conjunto de eventos metabólicos armonizados, hasta ahora se ha identificado la acción de 10 enzimas durante el proceso de síntesis de monolignoles (Sattler y Funnell-Harris, 2013). En las diferentes especies de plantas, la síntesis de la mayoría de estas enzimas es dirigida por la acción de diversos genes y las proteínas presentan múltiples isoformas que varían en sus propiedades cinéticas y en su distribución en la planta; sin embargo, la gran cantidad de sustratos, así como la extensa familia de genes ha dificultado la identificación y caracterización de las isoformas que están específicamente involucradas en el proceso de lignificación (Bonawitz y Chapple, 2010).
La PAL, participa en la síntesis de diferentes compuestos del metabolismo primario y secundario, cataliza la des-aminación no oxidativa de la L-fenilalanina a ácido trans-cinámico y está involucrada en la biosíntesis de ácido salicílico (SA) y otros compuestos fenólicos como el ácido clorogénico y las fitoalexinas, flavonoides con propiedades antimicrobianas, todos ellos implicados en la defensa en las plantas (Huang et al., 2010). Consecuentemente, alteraciones en la expresión del gen PAL tiene un impacto fundamental durante las interacciones planta-patógeno (Sattler y Funnell-Harris, 2013), ya que participa en la formación de complejos enzimáticos, conocidos como metabolones o compartimentos metabólicos, responsables de la canalización metabólica para la síntesis de los diversos compuestos fenólicos (Rasmussen y Dixon, 1999). La síntesis de la enzima es inducida por diferentes tipos de estrés biótico y abiótico (Dixon y Paiva, 1995; MacDonald y D'Cunha, 2007).
La enzima C4H cataliza la hidroxilación del cinamato para producir 4-Coumarato, también conocido como p-coumarato (Fraser y Chapple, 2011), ésta y las enzimas F5H y C3H son monooxigenasas dependientes del citocromo P450 que están involucradas en la biosíntesis de monolignoles (Ehlting et al., 2006; Boudet, 2007).
La enzima 4CL cataliza la formación de ATP dependiente del CoA tioester 4-coumaril CoA (p-coumaroil CoA). Esta enzima además de representar el punto de entrada para la biosíntesis de compuestos fenilpropanoides, también lo es para otro tipo de metabolitos secundarios, como las proantocianidinas, taninos, flavonoides, isoflavonoides y fitoalexinas (Allina et al., 1998; Ehlting et al., 1999; Ehlting et al., 2001; Fraser y Chapple, 2011). Al igual que PAL y C4H, 4CL existe como una familia de multigenes y aunque sus isoformas resultantes no han sido del todo caracterizadas parecen tener diferentes funciones en el metabolismo secundario de las plantas; pues su actividad en diferentes sustratos y patrones de expresión espacio-temporales, sugieren distintas funciones fisiológicas (Ehlting et al., 1999; Ehlting et al., 2001; Raes et al., 2003; Costa et al., 2005). Por ejemplo, en Arabidopsis las isoformas At4CL1 y At4CL2 parecen estar involucradas en la lignificación, mientras que At4CL3 actúa en la biosíntesis de flavonoides (Ehlting et al., 1999) y At4CL4 probablemente participa en la activación de sinapato (Hamberger y Hahlbrock, 2004). Durante la última etapa de la biosíntesis de monolignoles en gimnospermas, los aldehídos p-coumarílico, coniferílico y sinapílico, son transformados a su correspondiente alcohol por la enzima CAD (Fraser y Chapple, 2011), mientras que en angiospermas SAD (sinapil alcohol deshidrogenasa) es requerida para la biosíntesis de unidades S (Li et al., 2001).
Modificaciones de la PC durante la formación del SEA inducido por nematodos endoparásitos sedentarios
Aunque en etapas tempranas las células que dan lugar a la formación de las células gigantes y los sincitios sufren cambios similares, a lo largo del periodo de formación de los SEA, el diálogo molecular progresivo entre el nematodo y su hospedante, presenta particularidades dependiendo de si se trata de un nematodo que induce la formación de células gigantes o de sincitio; esto a su vez genera diferencias estructurales entre ambos tipos de SEA. Los cambios en la PC incluyen modificaciones en el engrosamiento y extensión de la PC, así como la formación de invaginaciones en zonas contiguas a los vasos del xilema, tanto en células gigantes como en sincitios.
En la diferenciación de las células gigantes primero se forman zonas iniciales de expansión donde comienza el engrosamiento de la PC, estos cambios se extienden para abarcar grandes regiones de la misma (Rodiuc et al., 2014). Los mecanismos mediante los cuales se regula la deposición de nuevo material a la PC así como su engrosamiento son variables, y a medida que la formación de la células gigantes progresa, a partir de esas zonas de expansión se generan regiones altamente reticuladas que asemejan laberintos de PC llamadas "invaginaciones", a través de las cuales se intensifica el transporte de solutos hacia adentro y afuera de la célula gigante (Vieira et al., 2012; Rodiuc et al., 2014). Dichas invaginaciones se desarrollan a lo largo del proceso de maduración del nematodo y degeneran una vez que éste alcanza su madurez y completa su ciclo de vida (Rodiuc et al., 2014).
Existen reportes que revelan la importancia de los plasmodesmos durante la formación de los SEA. Los plasmodesmos son canales de membrana localizados en las paredes celulares y aportan continuidad citoplasmática entre las células, conformando una red de intercambio intercelular. De manera natural estos plasmodesmos se encuentran distribuidos en la PC de forma dispersa, mientras que en el caso de las células gigantes se forma una gran cantidad de ellos entre las paredes de las células gigantes y también en las paredes de las células que las rodean (Hofmann et al., 2010). Lo anterior sugiere la existencia de un sistema de transporte masivo de solutos vía simplasto (Hofmann et al., 2010; Vieira et al., 2012). Adicionalmente, el flujo de nutrientes fuera y dentro de las células gigantes también puede estar mediado por proteínas de transporte especializadas localizadas en la membrana (Rodiuc et al., 2014).
Durante el inicio de la formación del sincitio son evidentes la disolución de las paredes celulares, las alteraciones en su configuración y los incrementos en su síntesis. Estos cambios son necesarios tanto para la formación de invaginaciones en regiones próximas al xilema, como para el engrosamiento de la PC que rodea al sincitio (Golinowski et al., 1996; Rodiuc et al., 2014); pues aunque las paredes de las células que integran el sincitio se rompen, las paredes celulares que lo delimitan se extienden y engrosan para resistir el aumento de presión generado dentro del SEA (Golinowski et al., 1996). Adicionalmente la deposición de nuevo material obstruye los plasmodesmos existentes, algunas células vecinas se dividen y fusionan y otras se diferencian en nuevo tejido de xilema (vasos) y floema (elementos cribosos) (Hoth et al., 2008; Rodiuc et al., 2014). Al igual que en las células gigantes, durante la conformación del sincitio ocurre la formación de invaginaciones de PC cerca del xilema y floema, las cuales son elongadas, ramificadas y forman sofisticadas reticulaciones que se expanden apicalmente, haciendo que las partes basales de las invaginaciones se fusionen, conformándose amplios engrosamientos de PC; sin embargo, éstas invaginaciones sólo son evidentes a los 5 ó 7 días después de ocurrida la infección, una vez que el proceso de formación del SEA está avanzado (Golinowski et al., 1996). Parece ser que en los sincitios la formación de invaginaciones en PC es una respuesta secundaria y sin relación con la diferenciación del sincitio y podría ser causada por un aumento en el flujo de solutos al SEA (Golinowski et al., 1996; Rodiuc et al., 2014).
La PC de los sincitios inmaduros se engrosa de manera uniforme, excepto en aquellos fragmentos de pared que están en contacto directo con los tubos cribosos, cuyas paredes permanecen delgadas hasta que las de las células vecinas al tubo se engrosan (Grundler et al., 1998). Los plasmodesmos representan importantes puntos de inicio de degradación de paredes celulares, por lo que son esenciales para la formación y expansión del sincitio (Hofmann et al., 2010); en etapas tempranas de formación del sincitio, debido a la deposición temporal de calosa, los nutrientes son transportados desde el floema de forma apoplástica a través de transportadores transmembranales (Hofmann y Grundler, 2006; Rodiuc et al., 2014); entre los 4 y 7 después de la inoculación (ddi), incrementa la cantidad de plasmodesmos y disminuye la deposición de calosa (Hofmann y Grundler, 2006), y en etapas posteriores, después de los 10 ddi, los sincitios se conectan a través de los plasmodesmos haciendo posible la transferencia de nutrientes (Hofmann y Grundler, 2006; Hofmann et al., 2010).
Las modificaciones que se suscitan durante la formación del SEA podrían ser el resultado de alteraciones coordinadas inducidas por el nematodo a través de la manipulación de la expresión de genes de su hospedante que codifican para proteínas tales como: extensinas (EXT), expansinas (α- y β expansinas), pectin acetilesterasas (PAE), pectato liasas (PEL) y endoglucanasas (endo-β-1,4-glucanasas), que participan en la modificación de paredes celulares en células gigantes, mientras que en el caso de los sincitios se atribuye la participación de genes que codifican para expansinas (α- y β expansinas), endoglucanasas (endo-β-1,4-glucanasas), EXT, poligalacturonasas (PG) y pectin acetilasas (PE) (Rodiuc et al., 2014).
Modificaciones en la síntesis y acumulación de lignina en los SEA
Los SEA constituyen la única fuente de alimentación para los nematodos endoparásitos sedentarios y resultan esenciales para su crecimiento y reproducción, por ello los nematodos, a través de la inducción de cambios extensivos en la expresión de genes, deben inducir complejos cambios en la morfología, metabolismo y fisiología de las células hospedantes, para su conformación. Los SEA se localizan en el cilindro vascular, asegurando el contacto necesario con el xilema y floema para proveer al SEA de nutrientes, por lo tanto, alteraciones en la morfología, grosor y composición de la PC, son un requisito necesario para la formación y mantenimiento del SEA y por consiguiente, para el establecimiento exitoso de los nematodos endoparásitos sedentarios.
Los efectores, sintetizados en las glándulas esofágicas y secretados a través del estilete de los nematodos inducen la des-diferenciación y re-diferenciación de las células de la raíz en SEA, sin embargo la identificación de estas secreciones es limitada (Mitchum et al., 2013). Se sabe que de las tres glándulas esofágicas, las dos subventrales tienen mayor actividad durante la invasión de la raíz y la migración de los nematodos en etapas tempranas, mientras que la glándula dorsal incrementa su actividad durante la formación y mantenimiento del SEA, es decir, en la etapa sedentaria del nematodo (Davis et al., 2008; Mitchum et al., 2013).
Nematodos como Rotylenchulus spp., Tylenchulus spp., Nacobbus spp. y Xiphinema spp. también inducen la formación de SEA en las raíces de sus hospedantes, aunque han sido poco estudiados en comparación con aquellos inducidos por los nematodos agalladores Meloidogyne spp. (células gigantes) y los que se enquistan (Globodera spp. y Heterodera spp., sincitios). Ambos tipos de SEA comparten algunas características estructurales pero su ontogenia es diferente (Jones y Northcote, 1972; Rodiuc et al., 2014). Los nematodos agalladores inducen la formación de las células gigantes cuando los J2 se alojan en la zona de diferenciación del cilindro vascular y cada individuo induce la diferenciación de cinco a siete células parenquimatosas en células gigantes multinucleadas (Abad et al., 2009). El sincitio en cambio es formado cuando los J2 se alojan cerca del cilindro vascular y a partir de una sola célula ocurre el ensanchamiento o dilatación progresiva de los plasmodesmos, hasta que la célula a partir de la cual se inició la formación del SEA, se fusiona con sus células vecinas por la disolución de las paredes celulares para constituir un gran sincitio multinucleado (Turner y Rowe, 2006). En ambos sitios de alimentación existe un incremento en la actividad metabólica y densidad citoplásmica, numerosas vacuolas pequeñas, proliferación de organelos, particularmente del aparato de Golgi, mitocondrias, plastidios, ribosomas y retículo endoplásmico (Rodiuc et al., 2014).
La infección por nematodos promueve la síntesis de compuestos fenilpropanoides (Edens et al., 1995; Balbridge et al., 1998). La inducción de la biosíntesis de lignina ocurre como respuesta a estrés biótico y abiótico y se la considera un importante mecanismo de defensa durante la interacción planta-patógeno; si bien es cierto que en toda interacción planta-nematodo ocurrirá su inducción, también es cierto que la regulación de su síntesis variará dependiendo de sí la interacción es compatible o incompatible. Para que ocurra la reestructuración de las células del hospedante durante la formación de los SEA, son esenciales cambios en la expresión de una gran cantidad de genes. Al respecto, Jammes et al. (2005) realizaron un análisis global del transcriptoma de A. thaliana durante su interacción compatible con M. incognita y encontraron que de 22089 genes monitoreados, el 15% de ellos desplegaron una expresión diferencial durante el desarrollo de las células gigantes; la expresión de genes involucrados en la regulación del ciclo celular, procesamiento de DNA, energía y síntesis de proteínas presentaron altos niveles de expresión así como la expresión de aquellos genes asociados al metabolismo de la pared celular que codifican para pectato liasas, expansinas, glucósido hidroxilasas, xiloglucano endotransglucosilasas y una glucosil oxidasa; en contraste, dos genes relacionados con defensa, patatina y una proteína similar a la germina, resultaron ser los más fuertemente reprimidos; sin embargo, no reportan el monitoreo de genes específicamente involucrados en la biosíntesis de lignina.
Ithal et al. (2007) reportaron que en plantas de soya inoculadas con el nematodo Heterodera glycines se estimuló la actividad de genes implicados en la vía de los fenilpropanoides, favoreciendo la síntesis de una amplia variedad de metabolitos secundarios en las plantas, como flavonoides y antocianinas, y lignina y suberina componentes de las paredes celulares secundarias. La acumulación de fitoalexinas, la deposición de lignina y la acumulación de compuestos fenólicos caracterizan la respuesta de defensa de las plantas; sin embargo, las funciones de estos metabolitos secundarios en las interacciones planta-nematodo no están del todo claras, pues aunque su sobreexpresión podría ser parte de la respuesta de la planta a la infección por los nematodos en una interacción incompatible, estos componentes podrían desempeñar otro papel en una interacción compatible (Ithal et al., 2007).
Durante el desarrollo de sincitios ocurre el engrosamiento extensivo de las paredes celulares del mismo, y aunque la composición del nuevo material depositado no ha sido caracterizado, estudios histológicos muestran que el centro de las paredes corticales externas, así como en el centro de algunos fragmentos de pared celular, dentro de los sincitios, se tiñen con azul de toluidina, indicando la presencia de lignina y algunos polifenoles (Jones y Northcote, 1972). Así el incremento en la síntesis y acumulación de la lignina, no sólo forma parte de la defensa de la planta contra la infección por nematodos, sino que también puede contribuir a la formación de pared celular de novo, para ayudar a proteger y fortalecer el sincitio (Ithal et al., 2007). Se ha reportado que la transcripción de genes POX que codifican para peroxidasas, se incrementa durante la formación de sincitios; las peroxidasas, además de eliminar las especies reactivas de oxigeno producidas típicamente como respuesta de defensa temprana de las plantas, contra una amplia variedad de patógenos (Marrs, 1996; Blokhina et al., 2003), también parecen estar involucradas en el fortalecimiento de la pared celular del sincitio a través del entrecruzamiento entre polímeros de pared celular (Schopfer, 1996; Darley et al., 2001), o por su contribución a la polimerización de extensinas y al entrecruzamiento de polisacáridos mediante la dimerización de fenoles (Darley et al., 2001).
El hecho de que la mayoría de los genes que codifican para enzimas involucradas en la biosíntesis de lignina (PAL, C4H, C3H, F5H, CCoAOMT, COMT, CCR y CAD) se hayan sobre-expresado en soya, durante la formación del sincitio a los 2, 5, y 10 días posteriores a la infección con H. glycines, indica que estos genes también tienen una importante función para la formación de los SEA (Ithal et al., 2007). En plantas de Arabidopsis thaliana en las que se sobre-expresaron las enzimas C4H (enzima temprana en la ruta de los fenilpropanoides) y F5H (enzima que cataliza la hidroxilación irreversible de precursores G hacía la biosíntesis de unidades S), hubo un incremento del 50 % en el contenido de unidades S, en comparación con las plantas silvestres; mientras que la producción de unidades G se inhibió, ocasionando que en las plantas modificadas la reproducción del nematodo M. incognita fuera menor en comparación con las plantas silvestres (Wuyts et al., 2006). Posiblemente el incremento de lignina S en los haces vasculares, impidió el flujo de nutrientes hacia las células gigantes o que los nematodos se alimentaran de las células gigantes (Wuyts et al., 2006). De manera similar cuando el contenido de unidades S se redujo en 10 %, en plantas de tabaco en las que se bloqueó la expresión de la enzima isoflavona O-metiltransferasa (OMT), disminuyó el tiempo en que M. incognita completó su ciclo de vida y hubo un mayor número de juveniles en comparación con las plantas en las que no se bloqueó al gen OMT (Wuyts et al., 2006). En contraste con lo anterior, Quentin et al. (2009) encontraron que en plantas de A. thaliana en las que el nivel de lignina S se redujo debido al bloqueo de la actividad de la enzima COMT, el desarrollo del nematodo y el tiempo que le llevó completar su ciclo de vida fue similar al observado en plantas testigo, en las que no se bloqueó a la enzima; esto es, la reducción del sirigil no agregó ni positiva ni negativamente el establecimiento del nematodo. Se menciona que A. thaliana es por naturaleza susceptible a M. incognita, lo que podría explicar porque en este caso las diferencias en el contenido de los monómeros de lignina (G o S) en los tejidos de la planta, no influyó en la infección y ciclo de vida del nematodo. Sin embargo, puede ser que en otras plantas modificaciones en la actividad de la enzima COMT determinen el tipo de interacción (compatibilidad o incompatibilidad) (Pegard et al., 2005).
Con base en las investigaciones referidas se infiere que es muy probable que el tipo y predominancia de los monolignoles que forman a la lignina, específicamente el tipo de unidad monomérica (S, G o H) depositada, puede influir en la infección y reproducción de los nematodos endoparásitos sedentarios durante su interacción con su hospedante, ya que estos nematodos establecen sus SEA dentro del cilindro vascular, sitio en el que ocurre abundante deposición de polímeros para la formación de paredes secundarias y alta lignificación de raíces.
Por otro lado Wuyts et al. (2007) señalan que es posible que la ruta de los fenilpropanoides se re-direccione hacia la síntesis de compuestos relacionados con la resistencia. Así los ácidos hidroxicinámicos unidos covalentemente a los polisacáridos de la PC, constituyen una posible segunda barrera física (y química) para la alimentación y migración de los nematodos en el cortex de las raíces. Dada la importancia fisiológica de los productos de la ruta de los fenilpropanoides, en las interacciones planta-nematodos endoparásitos sedentarios, la ruta parece ser dirigida, durante la síntesis nueva de PC, hacia la formación de los monómeros que forman un tipo de lignina que favorece la formación de SEA funcionales. En contraste en las incompatibles, la ruta se dirige hacia la biosíntesis de lignina que constituye una barrera física de defensa y de metabolitos secundarios con propiedades antimicrobianas.
Conclusiones
Los cambios que se suscitan en las células vegetales, resultado de la reprogramación de la expresión génica inducida por el nematodo en la raíz de su hospedante, están perfectamente coordinados y sincronizados; las alteraciones metabólicas, fisiológicas y estructurales también incluyen la modificación de los componentes de la PC vegetal. Con más frecuencia se concibe a la lignina como una barrera física potencial contra la invasión por fitopatógenos; en la interacción planta-nematodos endoparásitos sedentarios su biosíntesis, deposición y composición, son parte de las modificaciones involucradas en la reestructuración de las paredes de las células de la raíz del hospedante. Este proceso es fundamental para la formación del sitio especializado de alimentación funcional, que le permitirá al nematodo completar su ciclo de vida. En el caso particular de la lignina, el nematodo modifica la abundancia y disposición de los monolignoles que la integran, y dependiendo del diálogo que se establezca entre el nematodo y la planta (interacción compatible o incompatible) la lignina contribuirá a la creación de un medio favorable para el establecimiento exitoso del nematodo o un ambiente que le impida desarrollarse y completar su ciclo de vida. A la fecha se tiene conocimiento del potencial que tienen los nematodos para modificar importantes rutas metabólicas durante la interacción con su hospedante, como la de los fenilpropanoides. No obstante, dada la complejidad de la ruta, debido por un lado, a la existencia de múltiples isoformas de los genes responsables de codificar a las enzimas involucradas y por el otro, a la abundante variación de metabolitos que son producidos a través de ella, ha resultado difícil elucidar el comportamiento y función de los genes implicados en la ruta durante la interacción plata-nematodo. La caracterización funcional de estos genes y el esclarecimiento del papel que juegan en la biosíntesis y deposición de monolignoles constituye un reto que se ha empezado a abordar mediante técnicas como la espectroscopía infrarroja, separación por cromatografía gaseosa (GC) e identificación por espectrometría de masa (MS); así mismo, técnicas moleculares como la hibridación con microarrreglos, que permite la comparación de la expresión génica de un conjunto de genes en condiciones distintas, y la disponibilidad de nuevos equipos de secuenciación pueden contribuir a la identificación y caracterización de las isoformas implicadas en la biosíntesis de monolignoles. De esta manera se podrá avanzar en el conocimiento del papel de lignina en las interacciones planta-nematodo, mismo que podría aportar elementos para el diseño de nuevas formas de control de estos fitopatógenos.











 texto en
texto en 


