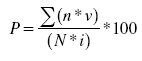Introducción
La Rosa spp., es una de las especies ornamentales de mayor importancia económica a nivel mundial (Debener y Linde, 2009) con una producción anual estimada de 18 billones de tallos cortados, 60-80 millones de rosas en maceta y 220 millones de rosas para jardín (Pemberton et al., 2003). No obstante, es susceptible a un gran número de enfermedades (Horst y Cloyd, 2007) como la cenicilla causada por Podosphaera pannosa (Wallr.: Fr) de Bary, una de las enfermedades más destructivas que se presenta tanto en rosas cultivadas al aire libre como en invernadero (Leus et al., 2006; Suthaparan et al., 2012). El hongo puede infectar todas las partes aéreas de la planta y bajo condiciones favorables provoca la distorsión de hojas y defoliación prematura (Shetty et al., 2012), lo que ocasiona pérdidas económicas significativas en la productividad, calidad y por ende en la comercialización (Suthaparan et al., 2010).
El control de P. pannosa se basa principalmente en la aspersión de fungicidas a intervalos de 7-14 días (Debener y Byrne, 2014). Aplicaciones continuas de estos químicos incrementan los costos de producción y pueden generar selección de poblaciones resistentes de P. pannosa (Daughtrey y Benson, 2005); además la necesidad de minimizar el uso de fungicidas conduce a la búsqueda de alternativas de control como el uso de inductores de defensa; tal es el caso del silicio, que ha mostrado su potencial para mejorar los componentes estructurales y bioquímicos de resistencia a enfermedades como la cenicilla en diferentes cultivos como pepino (Liang et al., 2005), fresa y uva (Botta et al., 2011) y en rosas para maceta (Shetty et al., 2012). Así mismo, los fosfitos tienen la capacidad de controlar enfermedades en diversos cultivos, actuando directamente sobre el patógeno e indirectamente mediante la estimulación de respuestas de defensa del hospedante (Deliopoulos et al., 2010); al respecto, se reportó que el fosfito de potasio induce resistencia en el cultivo de papa a Phytophthora infestans (Mont) de Bary (Machinandiarena et al., 2012) y reduce significativamente la incidencia y severidad de Oidium sp. en pepino (Cucumis sativus L.) (Yañez et al., 2012), en plántulas de cacao (Theobroma cacao L.) tuvo un efecto antifúngico inhibiendo la germinación de conidios de Verticillium dahliae Kleb. (Ribeiro et al., 2006). Otra molécula inductora es el quitosano, un derivado de la desacetilación de la quitina, considerado como un biopolímero eficaz en la prevención de enfermedades fúngicas, al interferir directamente sobre el crecimiento de los hongos o mediante la activación de defensas en las plantas (Iriti et al., 2011). Borkowski y Szwonek (2004), reportan que el quitosano presenta una alta efectividad en el control de la cenicilla del tomate (Oidium lycopersicum Cooke & Massee), y cuando se aplica sobre follaje de cebada (Hordeum vulgare L.), induce resistencia contra Blumeria graminis (DC.) Speer. f. sp. hordei (Faoro et al., 2008). Por su parte, Moret et al. (2009) reportan que la aplicación de quitosano a concentraciones de 1 y 2.5 % reducen la severidad de Sphaerotheca fuliginea Schlecht ex Fr. Poll. y Erysiphe cichoracearum DC. ex Merat en pepino (Cucumis sativus L.).
A pesar de que estos compuestos han mostrado potencial en el control de enfermedades, la información de estos productos en el manejo de la cenicilla en plantas ornamentales, y especialmente sobre el cultivo de rosa, es limitada. Por lo que los objetivos de este estudio fueron verificar la identidad morfométrica y molecular del agente causal de la cenicilla del rosal, evaluar el efecto del silicio, fosfito de potasio, quitosano y acetato de dodemorf sobre la incidencia y severidad del patógeno en estudio y cuantificar su efecto en la longitud y diámetro del tallo y botón floral.
Materiales y Métodos
Caracterización morfométrica
En abril de 2014 se colectaron en invernadero, hojas jóvenes de plantas de rosa var. Samourai(r) con síntomas y signos de cenicilla en el municipio de Tenancingo, México. Estructuras de la reproducción asexual como hifas, conidióforos y conidios, fueron desprendidos de la superficie de hojas jóvenes y con ellas se realizaron preparaciones permanentes y temporales con cinta Scotch en agua destilada e hidróxido de potasio al 3 % (Braun y Cook, 2012), en estas se observaron y midieron en el microscopio compuesto ( marca Carl Zeiss(r) ) con el objetivo de 40X, las características morfométricas de 30 repeticiones para cada estructura: diámetro del micelio, tamaño y forma de los conidios, presencia de cuerpos de fibrosina en conidios, características del conidióforo (tamaño y forma del pie de la célula, posición del septo basal), forma de los apresorios sobre las hifas y la posición de los tubos germinativos conidiales, siguiendo la clave taxonómica de Braun y Cook (2012). Para la observación de los tubos germinativos conidiales se inocularon catáfilas de cebolla con conidios del hongo (To-anun et al., 2005).
Microscopia electrónica de barrido (MEB)
Fragmentos de hojas jóvenes (0.5 cm2) de rosa con signos de cenicilla se fijaron en glutaraldehído al 3 % durante 24 h, posteriormente se lavaron con buffer de fosfato Sorensen᾽s (0.2 M). Las muestras se deshidrataron mediante la inmersión en etanol a concentraciones graduales (30, 40, 50, 60, 70, 80, 90 %) por 40 min cada uno y al 100 % tres veces por 20 min. Posteriormente se secaron con CO2 en un desecador de punto crítico Samdri-780A(r) por 40 min, se montaron en portamuestras de cobre y se recubrieron con oro en una ionizadora JFC-1100(r) por 1 min. Finalmente, las preparaciones se observaron y fotografiaron en un microscopio electrónico de barrido JEOL(r) JSM-6390.
Caracterización molecular
La extracción de ADN se realizó a partir de hojas con signos del hongo, mediante el kit de extracción Plant DNAzol Reagent(r) (Invitrogen(tm)) de acuerdo al protocolo descrito por el fabricante, con modificaciones para evitar el efecto de fenoles, por lo que se realizaron cinco lavados con 300 µL de etanol al 75 %. La integridad del ADN se observó en un gel de agarosa (Ultrapure (tm)) al 1 %, las bandas de ADN se visualizaron en un transiluminador Syngene(r) modelo GVM20, la calidad y la concentración se determinaron en un biofotómetro Eppendorff(r) modelo D-5000-3000. El ADN obtenido se resuspendió en 50 µL de agua grado biología molecular y se almacenó a -20 °C para su uso posterior.
Reacción en cadena de la polimerasa (PCR)
Para la prueba de PCR se utilizaron los primers ITS1F (5'-CTTGGTCATTTAGAGGAAGTAA-3') (Gardes y Bruns, 1993) e ITS4 (5'-TCCTCCGCTTATTGATATGC-3') (White et al., 1990). Las reacciones de PCR se realizaron en un volumen final de 20 μL de la mezcla: 6.60 μL de agua estéril desionizada (Gibco(r)), 10 μL de 2X Phire Plant PCR Buffer (incluye 200 μM de cada dNTP y 1.5 mM de MgCl2), 1 μL de cada primer ITS1F e ITS4 a 10 ρmol, 1 μL de ADN, 0.4 μL de DNA Polimerasa (Phire(r) Hot Start II). La amplificación se realizó en un termociclador MJ ResearchThermal(r), modelo PTC-100, de acuerdo al procedimiento descrito por Leus et al. (2006). El producto de la amplificación se verificó mediante electroforesis a 90 V por 30 min en gel de agarosa al 1 % y tinción con 1 µL de bromuro de etidio, la visualización se realizó en un transiluminador Syngene(r), modelo GVM20. El ADN se purificó con el kit comercial DNA Clean & Concentrator TM-5 (Zymo Research(r)). Posteriormente, los fragmentos amplificados mediante la PCR fueron secuenciados en ambas direcciones en un analizador genético ABI Prism 3130XL. La secuencia obtenida fue alineada en la base de datos del National Center for Biotecnology Information. La secuencia se depositó en la base del GenBank. Un cladograma se obtuvo utilizando el método Neighbor-Joining con el programa Mega 6.0.
Experimentos en invernadero
En plantas de rosa var. Samourai(r), cultivadas bajo condiciones de invernadero se realizaron dos ensayos: el primero en los meses de febrero-abril y el segundo de mayo-julio de 2014, ambos se condujeron bajo un diseño de bloques al azar con cinco tratamientos y cuatro repeticiones, se utilizaron 20 unidades experimentales; cada unidad experimental consistió de una parcela de 2.70 m de largo por 1 m de ancho con 27 plantas de rosa distribuidas en hilera. Mediante una poda se estimuló la producción de brotes de forma homogénea, sobre los cuales se evaluaron los tratamientos.
Tratamientos
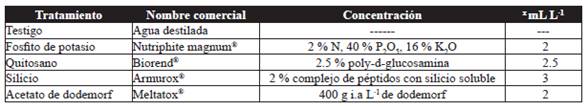
Estos fueron: fosfito de potasio, quitosano, silicio como inductores de resistencia; el fungicida acetato de dodemorf y un testigo (agua destilada) (Cuadro 1). Los tratamientos se asignaron al azar a cada unidad experimental, su aplicación inicio ocho días después de la poda, y posteriormente a intervalos semanales hasta llegar al punto de corte. La aplicación se realizó con una bomba de aspersión motorizada (Maruyama, MS072H) con boquilla de abanico, durante las primeras horas de la mañana, realizando una cobertura total del follaje (gasto 0.5 L por parcela).
Variables
Se seleccionaron 10 tallos al azar por unidad experimental para la evaluación de la incidencia y severidad de la enfermedad, longitud y diámetro del tallo y botón floral
Evaluación de incidencia y severidad de P . pannosa
Para favorecer el desarrollo natural de la cenicilla durante el experimento se incrementó la temperatura (25-33 °C) durante el día y la humedad relativa por la noche (70-90 %) mediante el manejo de las ventilas del invernadero. La incidencia y severidad se evaluaron inmediatamente después de la aparición de los síntomas y signos, evaluaciones posteriores se realizaron semanalmente. El porcentaje de incidencia se calculó contabilizando el número de tallos con síntomas y signos con relación a los 10 tallos evaluados por unidad experimental.
La severidad de la enfermedad se determinó mediante la escala de Horsfall y Barratt (1945), con las clases: 0= No síntomas, 1=1-2.5 %, 2=2.6-5 %, 3=6-10 %, 4=11-25 %, 5=26-50 %, 6=51-75 % y 7=76-100 % de la superficie dañada de la hoja. Los valores se transformaron a porcentaje de severidad mediante la ecuación de Townsend y Heuberger:
Donde: P= porcentaje de daño; n= número de hojas por cada clase en la escala; v= grado respectivo de la escala; N= número total de hojas evaluadas y i= mayor grado de la escala.
Los datos de incidencia y severidad se transformaron a área bajo la curva del progreso de la enfermedad (ABCPE), aplicando el método de integración trapezoidal (Campbell y Madden, 1990), partiendo directamente de los porcentajes de los tallos y hojas enfermas en cada fecha de evaluación.
Evaluación de longitud y diámetro de tallo y de botón floral
Al término del experimento se midió la longitud del tallo (cm), desde la base hasta el ápice del mismo. El diámetro se determinó con un vernier digital CALDI-6MP mediante la toma de la lectura a un centímetro por arriba de la base del tallo. La longitud y diámetro del botón floral se midieron en punto de corte con vernier digital.
Resultados
Caracterización de síntomas
Los síntomas se caracterizaron por el desarrollo esporádico de manchas de color rojizo a púrpura en el envés de las hojas; en el segundo ensayo las hojas fueron colonizadas totalmente por los signos del patógeno, lo que provocó la deformación de foliolos presentando una apariencia curveada y/o retorcida (Figura 1A). Algunos tallos y pedúnculos presentaron los signos de la enfermedad (Figura 1B).
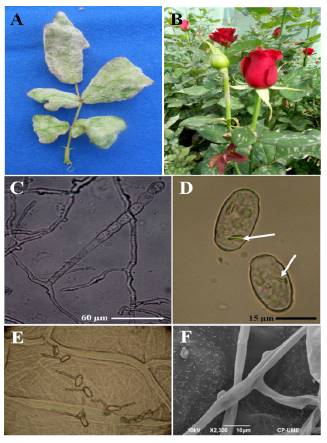
Figura 1 A). Deformación de foliolos causados por P. pannosa en rosa var. Samourai(r). B). Hojas y pedúnculo con signos del hongo. C). Conidióforo emergiendo de la célula madre de la hifa con catenulación de conidios. D). Conidios elipsoidales a doliformes con cuerpos de fibrosina. E). Patrón de germinación conidial sobre catáfilas de cebolla. F). Apresorios casi indistintos como protuberancias sobre las hifas.
Caracterización morfométrica
El agente causal de la enfermedad se caracterizó por producir micelio, superficial y hialino, de 3-8 µm de diámetro; apresorios casi indistintos como protuberancias; conidióforos erectos, de hasta 115 µm de largo, surgiendo de la superficie de las células madres hifales, central o no centralmente; células basales rectas, subcilíndricas, de 31-88 x 7-11 µm, seguidas por 1-2 células basales cortas, formando conidios catenescentes, elipsoidales a doliformes, de 20-35 x 11-18.7 µm con cuerpos de fibrosina; tubos germinativos ± terminales a laterales, de 3.75-4 µm de ancho, del tipo Fibroidium, subtipo Orthotubus (Figura 1C -1F). De acuerdo a lo anterior, las características corresponden a P. pannosa.
Microscopía electrónica de barrido (MEB)
La superficie de la pared de los conidios de P. pannosa fue lisa (Figura 2A), presentando en algunas ocasiones ondulaciones finas; en la parte terminal de los mismos, la cual representa la ubicación del septo que separa a los conidios cuando forman cadenas, se observaron anillos concéntricos tenues (Figura 2B y 2C). En conidios parcialmente colapsados, la pared externa presentó un arrugamiento que dio origen a líneas sinuosas longitudinales y transversales (Figura 2D).
Caracterización molecular
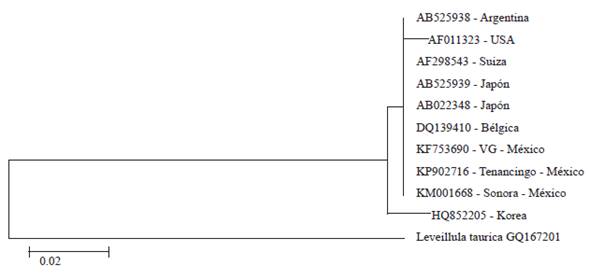
Mediante la amplificación por PCR con los primers ITS1F e ITS4, se obtuvo una secuencia de nucleótidos de 574 pb. Al comparar la secuencia de nucleótidos de este estudio (Número de depósito KP902716), con las depositadas en el GenBank, el análisis BLAST mostró un 100 % de identidad con las accesiones AB525939 (P. pannosa en Rosa maltiflora), AB022348 (P. pannosa en Rosa sp.), DQ139410 (P. pannosa en Rosa sp.) y KF753690 (P. pannosa en Rosa sp.) y 99 % con las accesiones AF011323 (P. pannosa en Rosa sp.), AF298543 (P. pannosa en Rosa sp.), AB525938 (P. pannosa en Rosa rubiginosa), HQ852205 (P. pannosa en Rosa rugosa) y KM001668 (P. pannosa en Rosa sp.) (Figura 3).
Evaluación de incidencia y severidad de P. pannosa
El ABCPE de la incidencia varió significativamente (P˃0.05) entre los diferentes tratamientos. En el primer ensayo, las plantas tratadas con quitosano, silicio y fosfito de potasio presentaron índices bajos de incidencia significativamente diferentes respecto al testigo. Para el segundo ensayo, únicamente las plantas tratadas con silicio y fosfito de potasio fueron significativamente diferentes (P˃0.05) al testigo. El mejor tratamiento para reducir la incidencia de la enfermedad fue el acetato de dodemorf el cual presentó un ABCPE de 70.0 y 1400.0 para el primer y segundo ensayo, respectivamente (Cuadro 2).
Cuadro 2 Área bajo la curva del progreso de la enfermedad (ABCPE) para la incidencia y severidad de la cenicilla (P. pannosa) en el cultivo de rosa.
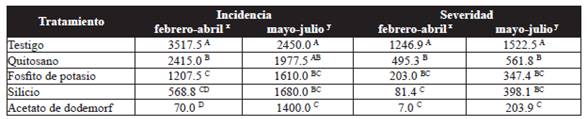
Medias con una letra en común no son significativemente diferentes, Tukey (P > 0.05) xPrimer ensayo, ySegundo ensayo.
En lo que se refiere a la severidad, las plantas tratadas con quitosano, fosfito de potasio y silicio; mostraron una reducción del 60.3, 83.7 y 93.5 % respectivamente, en el primer ensayo y 63.1, 77.2 y 73.9 % en el segundo ensayo, esto comparando con el testigo (Cuadro 2). En ambos ensayos, las plantas tratadas con silicio y fosfito de potasio fueron estadísticamente iguales (P˃0.05) con el fungicida acetato de dodemorf, quien presentó la menor severidad.
Evaluación de la longitud y diámetro del tallo y botón floral
El tratamiento con quitosano mostró un incremento en la longitud de tallos de 9.4 % y 20.1 % en el primer y segundo ensayo respectivamente, contrastando con el fosfito de potasio, que indujo la menor longitud con 66.7 y 64.7 cm para el primer y segundo ensayo respectivamente. Sin embargo, el tratamiento con quitosano no fue significativamente diferente respecto al testigo (Cuadro 3). En lo que respecta al diámetro del tallo, con el testigo se obtuvo el mayor diámetro con 8.0 mm y fue estadísticamente diferente (P˃0.05) al diámetro de las plantas tratadas con fosfito de potasio (7.3 mm) en el primer ensayo. Para el segundo ensayo, las plantas tratadas con fosfito de potasio y silicio presentaron los menores diámetros del tallo con 6.4 mm, por otra parte, el tratamiento con quitosano mostró el mayor diámetro de tallo con 7.8 mm sin diferencias significativas (P˃0.05) respecto al testigo (Cuadro 3).
Cuadro 3 Efecto de los tratamientos en la longitud y diámetro de tallo floral en rosa variedad Samurai(r).
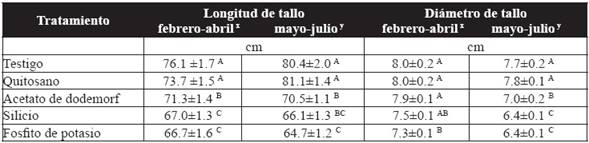
Los resultados son el promedio de 10 plantas por tratamiento. ± Error estándar. Valores con una letra en común no son significativamente diferentes, Tukey (P > 0.05). xPrimer ensayo, ySegundo ensayo.
Respecto a la longitud de botón floral, el fosfito de potasio y silicio fueron significativamente diferentes (P˃0.05) con el resto de los tratamientos y presentaron la menor longitud de botón con 35.6 y 37.1 mm respectivamente, en el primer ensayo. Pero en el segundo ensayo, el quitosano mostró un incremento sobre la longitud del botón de hasta 29.5 %, con relación al fosfito de potasio que indujo la menor longitud de botón con 34.6 mm (Cuadro 4). El diámetro de botón floral, con el tratamiento de fosfito de potasio fue de 21.6 mm para el primer y 21.2 mm en el segundo ensayo, y fué estadísticamente significativo (P˃0.05) con el quitosano que mostró diámetros de 27.8 y 26.5 mm para el primer y segundo ensayo respectivamente. Sin embargo, el quitosano no presentó diferencia estadística con el testigo en ambos ensayos (Cuadro 4).
Cuadro 4 Efecto de los tratamientos en la longitud y diámetro de botón floral en tallos florales de rosa variedad Samurai(r).
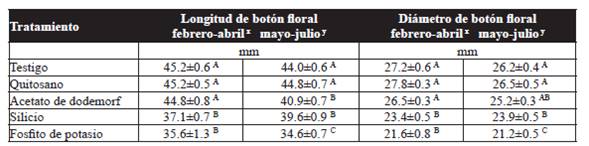
Los resultados son el promedio de 10 plantas por tratamiento. ± Error estándar. Valores con una letra en común no son significtivamente diferentes, Tukey (P> 0.05). xPrimer ensayo, ySegundo ensayo.
Discusión
En base a los resultados de la presente investigación se identificó a Podosphaera pannosa (Wallr. Fr.) de Bary como el agente causal de la cenicilla del rosal, las características morfométricas fueron similares a las reportadas por Braun y Cook (2012). Sin embargo, el número de células basales que se observaron en este estudio fueron de 1-2 células cortas, lo que difiere con lo reportado por Havrylenko (1995) y Félix-Gastélum et al. (2014). Las diferencias pueden deberse a diversos factores incluyendo la temperatura y humedad, el hospedero (variedad), edad de las hojas y el periodo de muestreo (Salmon, 1900). Los primers ITS1F e ITS4 amplificaron un producto de 574 pb que corresponde a P. pannosa; de manera similar, Félix-Gastélum et al. (2014) y Romberg et al. (2014) utilizaron los mismos primers para la identificación y detección de P. pannosa en el cultivo de Rosa spp. y Catharanthus roseus (L) G. Don, respectivamente. La comparación de la secuencia de nucleótidos obtenida (KP902716), con las depositadas en el GenBank, mostró una identidad del 99 al 100 % con accesiones de P. pannosa presentes en Rosa sp. en México, Bélgica, EE.UU., Japón y Suiza (Saenz y Taylor, 1999; Mori et al., 2000; Cunnington et al., 2003; Leus et al., 2006; Félix-Gastélum et al., 2014), en Rosa maltiflora Thunberg ex Murray de Japón, Rosa rubiginosa L. de Argentina (Takamatsu et al., 2010) y en Rosa rugosa Thunb. de Korea (Lee et al., 2011).
Con la aplicación de los inductores silicio (Si), fosfito de potasio (K3PO3) y quitosano se obtuvo una reducción de la incidencia y severidad de la cenicilla en condiciones de invernadero; sin embargo, estos tratamientos no fueron efectivos como el fungicida acetato de dodemorf que mostró los valores más bajos de incidencia y severidad de la enfermedad en ambos ensayos. Su efecto se debe a que es un fungicida sistémico con absorción acropétala que actúa inhibiendo la síntesis del ergosterol y la síntesis de proteínas, afectando la permeabilidad de la membrana (Brent y Hollomon, 2007). Así mismo Benyagoub y Bélanger (1995), reportan que la aplicación de acetato de dodemorf afecta la integridad de las hifas, resultando en un colapso de conidióforos y conidios. Por otra parte, se reporta que la aplicación de acetato de dodemorf puede generar fitotoxidad en plantas de rosa (Bélanger et al., 1994), pero en nuestros resultados el fungicida mostró un excelente control de la enfermedad sin causar perdida en el vigor de las plantas.
Dentro de los inductores, el tratamiento con Si a dosis de 3 mL L-1 redujo significativamente la incidencia y severidad de P. pannosa y fue estadísticamente igual con el fungicida acetato de dodemorf. Al respecto, Shetty et al. (2012), reportaron que la aplicación de 3.6 mM de Si (100 ppm) suministrado en solución nutritiva, reduce la severidad de P. pannosa hasta un 48.9 % dependiendo del genotipo del hospedante, de igual forma Datnoff et al. (2006), demostraron que la aplicación de Si reduce significativamente la severidad de la cenicilla hasta en un 57 % en rosas de maceta. Estos reportes sugieren que la aplicación de Si desempeña un papel importante en la supresión de la cenicilla del rosal, lo cual puede ser explicado por un incremento en la concentración de compuestos fenólicos antimicrobianos y flavonoides en respuesta a la infección por P. pannosa (Shetty et al., 2011).
También se ha demostrado que la aplicación de Si tiene efectos benéficos sobre el crecimiento y calidad de las rosas (Hwang et al., 2005; Reezi et al., 2009). Sin embargo, en el presente estudio, la aplicación de Si indujo una reducción sobre la longitud y diámetro de los tallos y del botón floral, en relación con el testigo, lo cual puede estar relacionado con la dosis de aplicación, tal como lo reportan Reezi et al. (2009), quienes observaron que a dosis altas de Si (150 ppm), hubo notable reducción sobre la longitud y diámetro de tallos en rosa. Así también, se ha documentado que la aplicación de silicato de potasio (200 mg L-1) en girasol (Helianthus annuus L.) provoca la deformación de flores y retrasa el crecimiento (Kamenidou et al., 2008), mientras que cuando se aplica silicato de sodio (150 mg L-1) disminuye la longitud de tallos y causa deformación en flores de gerbera (Kamenidou et al., 2010). Otra posible explicación es que el suministro de Si en las plantas puede beneficiar en la mejora a la resistencia al estrés biótico o abiótico o altera la morfología de las mismas (Ma y Yamaji, 2006), tal como se observó en este estudio.
Los fosfitos se usan comúnmente para el control de oomicetes en diferentes cultivos, su eficacia ha sido demostrada contra numerosas especies, como, Oidium sp. (Yáñez et al., 2012), Erysiphe polygoni D.C. (Salamanca-Carvajal y Alvarado-Gaona, 2012), Penicillium expansum Link. (Amiri y Bompeix, 2011), Phytophthora cactorum (Lebert y Cohn) Scröt (Rebollar-Alviter et al., 2010) y Peronospora sparsa Berkeley (Rebollar-Alviter et al., 2012). En este estudio, el tratamiento con K3PO3 a dosis de 2 mL L-1 disminuyó significativamente la incidencia y severidad de P. pannosa. Resultados similares han sido reportados por Chavarro-Carrero et al. (2012), quienes demostraron que aplicaciones periódicas de fosfito de potasio sobre rosa variedad Bingo White(r) reducen la incidencia hasta un 35 % y la severidad en 6.3 % de P. sparsa, con una efectividad biológica del 93.4 % contra el 14.8 % de un fungicida a base de cymoxanil + hidróxido de cobre + mancozeb. Es importante destacar que el éxito que tienen los fosfitos en el control de algunas enfermedades se debe a su acción sistémica, por lo que actúan en todas las partes de la planta. Varios autores reportan que el fosfito exhibe un complejo modo de acción, actuando directamente en el desarrollo del patógeno, inhibiendo el crecimiento del micelio y la síntesis de la pared celular (King et al., 2010), o indirectamente mediante la estimulación de respuestas de defensa de las plantas como la producción de fitoalexinas (Lovatt y Mikkelsen, 2006; Lobato et al., 2011), deposición de calosa, especies reactivas de oxígeno y la inducción de proteínas relacionadas con la patogénesis (Eshraghi et al., 2011; Machinandiarena et al., 2012).
Se ha documentado que además del efecto fungistático, los fosfitos pueden incrementar floración, rendimiento, tamaño de fruta, total de sólidos solubles y concentración de antocianinas en algunos cultivos (Lovatt y Mikkelsen, 2006). Sin embargo, en este estudio el fosfito de potasio redujo la longitud y diámetro de tallos y de botón floral respecto al testigo, esto en ambos ensayos, lo cual pudo deberse a la dosis de aplicación, debido a que existe evidencia que demuestra que a altas concentraciones de fosfitos se induce fitotoxicidad, lo cual afecta el rendimiento (Lovatt y Mikkelsen, 2006). Resultados similares fueron reportados por Yáñez et al. (2012), quienes documentaron que la aplicación de sales minerales incluyendo al fosfito de potasio, no mostraron efectos significativos que repercutieran en la longitud y el número de hojas en plantas de pepino.
Por otra parte el quitosano, un polisacárido catiónico de alto peso molecular extraído de la desacetilación de los exoesqueletos de cangrejos, es un biopolímero biodegradable y no tóxico, eficaz en la prevención de enfermedades de hongos al interferir directamente en su desarrollo (Bautista-Baños et al., 2006) o en la activación de procesos biológicos en tejidos del hospedante (Bautista-Baños et al., 2006; Iriti et al., 2011). En este trabajo la aplicación de quitosano a 0.013 % disminuyó la incidencia hasta un 31.2 y 19.3 % en el primer y segundo ensayo respectivamente, la severidad también fue reducida en 60.3 % en el primer y 63.1 % en el segundo ensayo con relación al testigo. Wojdyla (2001), reportó que la aplicación de quitosano a una concentración de 0.025 a 0.2 % redujo el desarrollo de la cenicilla del rosal en un rango de 43.5 a 85.4 % similar al tratamiento químico con triforine (0.03 %). Cuando se aplicó contra P. sparsa su eficacia varió del 50 a 73 % y al utilizarlo contra Botrytis cinerea Pers: Fr. a concentraciones de 0.1 y 0.2 % se redujo la severidad en un 5 y 35 %, respectivamente. Resultados relacionados indican que aplicaciones semanales de quitosano (Biochikol 020 PC), incrementan la tolerancia contra Diplocarpon rosae Wolf de un 18 a 60 %, pero en crisantemo a una concentración de 0.01 a 0.05 % el control de Oidium chrysanthemi DC. fue de 69 a 79 %, mientras que con Puccinia horiana Henning fue de 54 a 97 % (Wojdyla, 2004).
En el presente estudio queda evidenciado que aplicaciones de quitosano incrementan la longitud y diámetro de tallo y de botón floral en relación con el silicio y fosfito de potasio. Algunos reportes han demostrado la eficacia del quitosano para proteger plántulas contra plagas y enfermedades, mejorar la germinación de semillas, promover el crecimiento de plantas y por ende aumentar el rendimiento del cultivo. En ornamentales, la aplicación de quitosano influyó positivamente en gladiola (Gladiolus spp.) al incrementar la brotación de cormos, mayor número de flores por espiga y extendió la vida de florero (Ramos-García et al., 2009), en cormos de fresias (Freesia spp.) mostró una rápida emergencia y disminuyó su ciclo vegetativo (Startek et al., 2005), mientras que en orquídeas (Dendobrium phalaenopsis Fitzg.) influyó en el crecimiento de brotes meristemáticos en cultivo de tejidos (Nge et al., 2006) y en Lilium spp. mostró un incremento en la vida de florero cuando los tallos fueron sumergidos o asperjado con una solución de quitosano + nano partícula coloidal pura AG + ion (Kim et al., 2005). Otras evidencias, tales como la descrita por Ohta et al. (2001), quienes reportaron que semillas de lisianthus (Eustoma grandiflorum (Raf.) Shinners) sumergidas en quitosano al 1 % durante una hora y su aplicación en suelo aumentó significativamente el número de flores y la longitud y diámetro del tallo.
Conclusiones
La caracterización morfométrica y molecular, confirmaron que Podosphaera pannosa es el agente asociado con la cenicilla del rosal en el municipio de Tenancingo, México. Las aplicaciones con silicio y fosfito de potasio redujeron la incidencia y severidad de Podosphaera pannosa, por lo que se consideran alternativas viables que pueden ser incorporadas en el manejo integrado de esta enfermedad. El quitosano puede ser una alternativa en el manejo del cultivo de rosa puesto que tiene efectos positivos sobre la longitud y diámetro del tallo y botón floral. El acetato de dodemorf mostró un excelente potencial para el control de P. pannosa y buena selectividad en el cultivo.











 text in
text in