El estado de Guanajuato cuenta con un potencial hortícola excepcional; se encuentra dentro de los primeros lugares en producción de 70 especies de importancia agrícola, entre las que destacan cultivos hortofrutícolas como ajo (Allium sativum L.), lechuga (Lactuca sativa L.) y papa (Solanum tuberosum L.) (SIAP, 2013).
Las enfermedades constituyen uno de los factores de mayor riesgo para la producción de las hortalizas. En los últimos años, las enfermedades fungosas han ocasionado fuertes pérdidas económicas en la producción de diferentes especies hortícolas en México y en el mundo (Fisher et al., 2012). Estas se han incrementado en las zonas productoras del país, siendo el Bajío una de las zonas de mayor incidencia de enfermedades de origen fúngico (Montes et al., 2003).
Las estructuras de resistencia de algunos hongos fitopatógenos del suelo, como los esclerocios, pueden permanecer viables en el suelo por más de 20 años, como es el caso de S. cepivorum (Pérez et al., 2009), originando diferentes patrones de distribución espacio-temporal, producto de la reincorporación de los esclerocios y restos de plantas enfermas por las prácticas culturales inadecuadas realizadas por los agricultores, y de igual forma por procesos naturales. De esta forma, el inóculo de S. cepivorum Berk., S. sclerotiorum y S. minor, puede ser dispersado en los campos de producción y permanecer latente dentro de los terrenos agrícolas, dificultando el manejo de las enfermedades (Adams y Papavizas, 1986; Ibarra et al., 2010).
La mayoría de los agricultores utilizan los fungicidas como método de control de enfermedades; sin embargo, el uso excesivo puede inducir el desarrollo de resistencia en los patógenos, a la vez que se generan residuos tóxicos en alimentos y medio ambiente, poniendo en riesgo la salud humana (Fisher et al., 2012); ésto ha llevado a la búsqueda de nuevos fungicidas, que en algunos casos se encuentran en otros organismos (biofungicidas) (Angulo et al., 2009). El control biológico (CB) de fitopatógenos se presenta como una alternativa eficaz, económica y libre de riesgo frente a los numerosos y crecientes problemas derivados del uso indiscriminado de agroquímicos (Agrios, 2005). La mayoría de los agentes antagonistas utilizados en control biológico son saprófitos debido a su facilidad de adaptación al medio y a su alta capacidad de competencia por nutrientes frente a otros organismos (Nelson, 1991; Michel et al., 2009).
Con base en la problemática antes descrita, se planteó como objetivo determinar la sensibilidad in vitro a agentes de control biológico y fungicidas de aislados de S. minor, S. sclerotiorum, y S. cepivorum en cultivos de ajo, fríjol, lechuga, papa y radicchio.
La investigación se realizó en campos de producción comercial de hortalizas del estado de Guanajuato y en el laboratorio de Fitopatología de la División de Ciencias de la Vida del Campus Irapuato-Salamanca de la Universidad de Guanajuato.
Obtención de aislados. S. minor se aisló de plantas sintomáticas de lechuga (L. sativa) de San Miguel de Allende y de Salamanca, Gto., S. sclerotiorum se aisló de plantas sintomáticas de lechuga (L. sativa) en Salamanca e Irapuato, de radicchio (Cichorium intybus) en Celaya, de frijol (Phaseolus vulgaris) en Guasave, y de papa (S. tuberosum) en Tangamandapio. Finalmente, S. cepivorum se aisló de plantas sintomáticas de ajo (A. sativum) de Salamanca, Gto., y de Córdoba, España.
De cada aislado se tomaron esclerocios y parte de tejido que presentó síntomas de la enfermedad, se desinfestaron con hipoclorito de sodio al 1 %, y se cultivaron en Papa Dextrosa Agar (PDA) durante ocho días a 20±2 °C para S. minor; y a temperatura ambiente de laboratorio para S. sclerotiorum y S. cepivorum.
Agentes de control biológico y fungicidas. Los agentes de control biológico y fungicidas que se evaluaron (Cuadros 1, 2 y 3 ) se aplicaron con base en las recomendaciones comerciales.
xCada valor representa el promedio de dos aislados. Valores en cada columna con letras diferentes, son estadísticamente diferentes. Comparación Múltiple de Medias DSH Tukey P≤0.05.
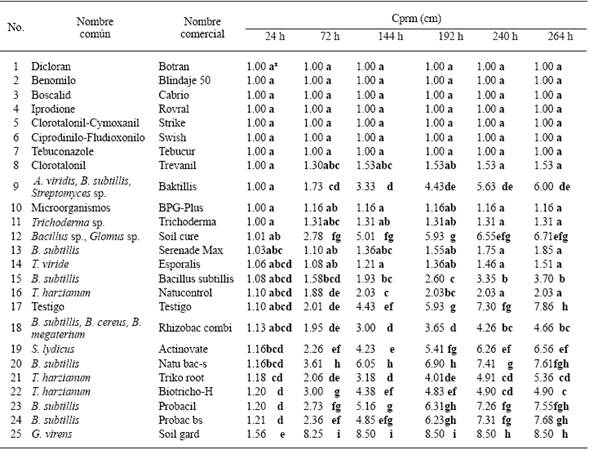
Cuadro 1 Crecimiento promedio radial micelial (Cprm) in vitro de dos aislados de S. minor, obtenidos del cultivo de lechuga (Lactuca sativa) con respecto a 24 tratamientos de productos de control biológicos (16) y fungicidas (8).
xCada valor representa el promedio de dos aislados. Valores en cada columna con letras diferentes, son estadísticamente diferentes. Comparación Múltiple de Medias DSH Tukey P≤0.05.
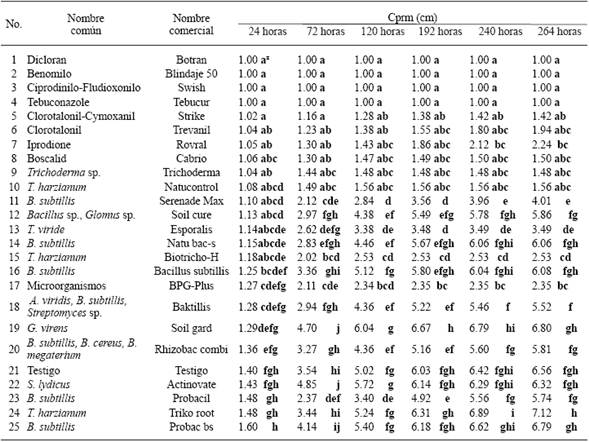
Cuadro 2 Crecimiento promedio radial micelial (Cprm) in vitro de cinco aislados de S. sclerotiorum, obtenidos de los cultivos de lechuga (L. sativa), fríjol (Phaseolus vulgaris), papa (Solanum tuberosum) y radicchio (Cichorium sp.) con respecto a 24 tratamientos de productos biológicos (16) y fungicidas (8).
xCada valor representa el promedio de dos aislados. Valores en cada columna con letras diferentes, son estadísticamente diferentes. Comparación Múltiple de Medias DSH Tukey P≤0.05.
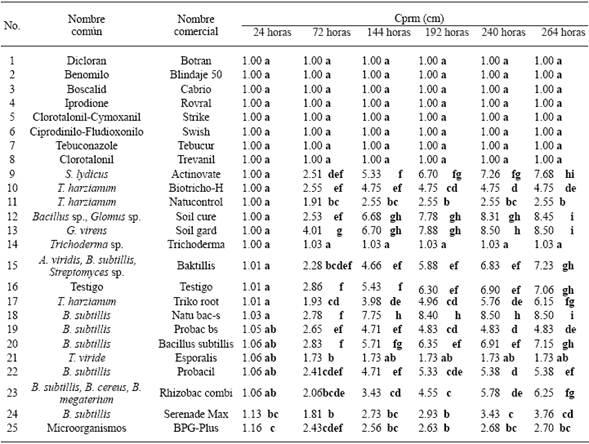
Cuadro 3 Crecimiento promedio radial micelial (Cprm) in vitro de dos aislados de S. cepivorum obtenidos del cultivo de ajo (Allium sativum) con 24 tratamientos de productos biológicos (16) y fungicidas (8).
Sensibilidad in vitro yevaluación de productos biológicos y fungicidas. Se pesaron y midieron las dosis recomendadas comercialmente de los productos biológicos y fungicidas a evaluar para ser agregados al agar y posteriormente se vacío en cajas Petri. Al solidificar el agar, se colocaron en el centro de la caja discos de un centímetro de diámetro de la periferia de las colonias obtenidas de cada aislado y se incubaron a 20±2 °C.
Evaluación del crecimiento del micelio. Se midió el diámetro de la colonia en dos direcciones, en la mayor y menor longitud, y el crecimiento micelial se obtuvo como el promedio de los valores en las dos direcciones a las 24, 48, 72, 96, 120, 144, 168, 192, 216, 240 y 268 horas, posteriores a la colocación del disco con el hongo en el centro de cada caja Petri en cada una de las tres repeticiones de cada tratamiento (Pérez et al., 1997; Pérez et al., 2009).
Análisis estadístico. En los tres experimentos se utilizó un diseño experimental de parcelas divididas con arreglo factorial, con tres repeticiones. En cada experimento se tuvo un arreglo factorial, el factor A correspondió a los aislados del hongo, los cuales tuvieron dos, cinco y dos niveles. Al factor B se le asignaron los agentes de control biológico y los fungicidas, el cual tuvo 25 niveles; lo anterior dio un total de 50, 125 y 50 tratamientos, respectivamente. En los tres experimentos, la comparación múltiple de medias se realizó con la prueba de Tukey (P≤0.05).
Sclerotinia minor. Los dos aislados de S. minor fueron sensibles a siete de los ocho fungicidas, Dicloran, Benomilo, Boscalid, Iprodione, Tebuconazole, Ciprodinilo-Fludioxonilo y Clorotalonil, considerando esto como los que no desarrollaron crecimiento promedio radial micelial (Cprm), a las 264 horas posteriores a la confrontación (Cuadro 1). Los agentes de control biológico que tuvieron los mayores efectos fungistáticos hacia los aislados de S. minor, es decir, los que propiciaron los menores crecimientos promedio radial micelial (Cprm), a las 264 horas posteriores a la confrontación, fueron: Microrganismos (BPG-Plus), Trichoderma sp. (Trichoderma), T. viride (Esporalis) y Bacillus subtillis (Serenade max), con 1.16a, 1.31a, 1.51a, y 1.85a, respectivamente; en comparación con Gliocadium virens (Soil gard), B. subtillis (Probac bs), Bacillus sp.-Glomus sp. (Soil cure) y B. subtillis (Natubacs), con 8.50h, 7.68gh, 6.71efg, y 7.61fgh, respectivamente, los cuales tuvieron los menores o nulos efectos fungistáticos hacia los aislados (Cuadro 1).
Sclerotinia sclerotiorum. Los cinco aislados fueron sensibles a cuatro de los ocho fungicidas, Dicloran, Benomilo, Tebuconazole y Ciprodinilo-Fludioxonilo, es decir, los que no presentaron crecimiento promedio radial micelial (Cprm), a las 264 horas posteriores a la confrontación (Cuadro 2). Los agentes de control biológico que tuvieron los mayores efectos fungistáticos hacia los aislados, entendiendo esto como los que propiciaron los menores crecimientos promedio radial micelial (Cprm), a las 264 horas posteriores a la confrontación, fueron: Trichoderma sp. (Trichoderma), Trichoderma harzianum (Natucontrol), Microorganismos (BPG-Plus) y T. harzianum (Biotricho-H), con 1.48abc, 1.56abc, 2.35bc, y 2.53cd, respectivamente; en comparación con T. harzianum (Triko root), B. subtillis (Probac bs), G. virens (Soil gard) y Streptomyces lydicus (Actinovate), con 7.12h, 6.79gh, 6.80gh, y 6.32fgh, respectivamente, los cuales tuvieron los menores o nulos efectos fungistáticos hacia los aislados de S. sclerotiorum (Cuadro 2).
Sclerotium cepivorum. Los dos aislados fueron sensibles a los ocho fungicidas, Dicloran, Benomilo, Boscalid, Iprodione, Clorotalonil-Cymoxanil, Ciprodinilo-Fludioxonilo, Tebuconazole y Clorotalonil, por lo que no presentaron crecimiento promedio radial micelial (Cprm), a las 264 horas posteriores a la confrontación (Cuadro 3). Los agentes de control biológico que ejercieron un mayor efecto fungistático hacia los aislados de S. cepivorum, lo que significa que propiciaron los menores crecimientos promedio radial micelial (Cprm), a las 264 horas posteriores a la confrontación, fueron: Trichoderma sp., (Trichoderma), T. viride (Esporalis), T. harzianum (Natucontrol) y Microorganismos (BPG-plus), con 1.03a, 1.73ab, 2.55b, y 2.70bc, respectivamente; en comparación con G. virens (Soil gard), Bacillus sp.-Glomus sp. (Soil cure), y B. subtillis (Natubacs), con 8.50i, 8.45i, y 8.50i, respectivamente, los cuales causaron un menor o un nulo efecto fungistático hacia los aislados (Cuadro 3).
En el caso de S. cepivorum se encontró un comportamiento uniforme hacia los fungicidas Tebuconazole (Tebucur), Iprodione (Rovral), Dicloran (Botran), Benomilo (Blindaje 50), Boscalid (Cabrio), Clorotalonil (Trevanil), Clorotalonil+Cymoxanil (Strike) y Ciprodinilo+Fludioxonilo (Swish). Resultados contrastantes se encontraron en el comportamiento de S. cepivorum hacia los fungicidas, los cuales fueron los reportados por Pérez et al. (1997) y Pérez et al. (2009), quienes mostraron la presencia de variabilidad del patógeno hacia los fungicidas usados. Con relación a la respuesta de S. cepivorum hacia los agentes de control biológico evaluados, se encontró una gran variabilidad, observando que los productos biológicos a los cuales hubo una mayor sensibilidad in vitro fueron los que se formularon con Trichoderma spp., la causa de este mayor efecto benéfico pudiera ser la acción biocontroladora de Trichoderma spp., en la que se han descrito diferentes modos de acción que regulan el desarrollo de los hongos fitopatógenos. Entre estos, los principales son la competencia por espacio y nutrientes, el micoparasitismo y la antibiosis, los que tienen una acción directa frente al hongo fitopatógeno (Infante et al., 2009); además, se conoce que Trichoderma spp. presenta otros mecanismos, cuya acción bioreguladora es de forma indirecta, tales como los mecanismos de defensa bioquímicos, que consisten en la desactivación de enzimas de los hongos fitopatógenos durante el proceso de infección (Infante et al., 2009); lo anterior puede explicar el alto porcentaje inhibitorio del crecimiento micelial de S. cepivorum. Esto sugiere una alternativa de control de la pudrición blanca, como ha sido señalado por Ulacio et al. (2011). El uso de T. harzianum como alternativa de control biológico en suelos que presentan elevadas densidades de inóculo de S. cepivorum, requiere de dosis altas del antagonista combinadas con otras alternativas de manejo para lograr el control eficiente de la enfermedad (Delgadillo et al., 2002; Ulacio et al., 2011).
Para S. minor y S. sclerotiorum, se encontró un comportamiento uniforme hacia la mayoría de los fungicidas y aislados evaluados. Los aislados de radicchio de Celaya y de lechuga de Irapuato crecieron en presencia de algunos fungicidas, en comparación con los demás aislados de ambos hongos que no lo hicieron, esto probablemente pudiera ser ocasionado por los tratamientos aplicados a los campos donde se obtuvieron los aislados, ya que son terrenos tratados con controladores biológicos y esto pudo ocasionar que los aislados tuvieran un crecimiento micelial más vigoroso con algunos de los fungicidas evaluados; algo que no se esperaba en este estudio, fue que los aislados de S. sclerotiorum provenientes de Celaya y de Irapuato crecieron en presencia de Boscalid (Cabrio) que es un fungicida que pertenece al grupo de las Carboxanilidas y de Iprodione (Rovral) perteneciente al grupo de las Dicarboximidas, en los cuales se tuvo crecimiento promedio radial micelial (Cprm) desde las 24 hasta las 264 horas posterior a la confrontación; esto posiblemente se encuentra relacionado entre otras causas, con la historia de los campos de donde se obtuvieron los aislados de S. sclerotiorum, con respecto al uso continuo de fungicidas para el control de enfermedades radicales en diferentes cultivos (Pérez et al., 2009). La insensibilidad a Boscalid e Iprodione obtenida en el presente estudio, contrasta con la sensibilidad reportada por Tarazona (2009), quien reportó que el Boscalid y el Iprodione inhibieron al 100 % el crecimiento de los hongos. La sensibilidad que presentaron los aislados S. minor y S. sclerotiorum a Tebuconazole, que propició un efecto inhibitorio del 100 %, coincide con lo reportado por Pérez et al. (1997) quienes encontraron resultados similares con S. cepivorum. Los agentes de control biológico con mayor poder inhibitorio del crecimiento micelial de S. minor y S. sclerotiorum fueron los que contenían al hongo Trichoderma spp. Los resultados obtenidos en el presente estudio concuerdan con los obtenidos por Villalta et al. (2012), quienes reportan una cepa de T. hamatum con alto porcentaje inhibitorio del crecimiento de S. minor. En el caso de B. subtillis (Serenade max), no se tuvo un efecto favorable sobre S. minor y S. sclerotiorum, en comparación con el efecto favorable obtenido con Trichoderma spp., ya que B. subtillis (Serenade max) fue de los controladores biológicos con menor efecto fungistático hacia los aislados de S. minor y S. sclerotiorum. Éstos resultados contrastan con lo reportado por Tarazona (2009), quien señala que B. subtillis tuvo un mayor efecto controlador hacia los hongos fitopatógenos evaluados.











 text in
text in 


