En México, la nochebuena (Euphorbia pulcherrima Willd. ex Klotzsch) se cultiva en traspatios y jardines, como especie mejorada y se encuentra en estado silvestre desde el noroeste de México hasta el sur de Guatemala (Trejo et al., 2012; Canul et al., 2014). Las plantas de nochebuena que se cultivan en jardines y traspatios reciben el nombre de "nochebuena de sol"; se utilizan como plantas medicinales, flor de corte y para adornar espacios públicos (Colinas, 2009; Canul et al., 2014). No se tienen datos oficiales sobre la superficie cultivada con "nochebuena de sol". En el 2010, en el estado de Morelos, se cultivaron alrededor de 20,000 m2 con mercado a nivel regional, estatal y nacional, y sin contrato para su comercialización (Galindo et al., 2012).
En contraste, la nochebuena, como especie mejorada (de aquí en adelante nombrada como nochebuena comercial), es una de las plantas ornamentales de mayor importancia a nivel mundial. De acuerdo con los registros de la producción de cultivos florícolas de Estados Unidos de América, su venta en el 2013 fue de 146 millones de dólares (USDA, 2014). En este mismo año, el valor de la producción en México fue superior a los 416 millones de pesos (SAGARPA, 2014).
La nochebuena silvestre ha estado bajo una constante presión de selección, por lo que ha desarrollado caracteres que le confieren valor como recurso fitogenético (SINAREFI, 2010) con potencial para investigación y comercialización, por lo que es necesario conservarla e incorporarla a programas de mejoramiento genético (Canul et al., 2010). En este sentido, el INIFAP del Campo Experimental Zacatepec está desarrollando un programa de mejoramiento genético de plantas de "nochebuena de sol" y silvestres con la finalidad de obtener variedades mexicanas con atributos comerciales y fitosanitarios que beneficien a los productores.
La nochebuena comercial es hospedante regular del Poinsettia mosaic virus (PnMV) y del Poinsettia latent virus (PnLV) (aus dem Siepen et al., 2005). A la fecha no se han reportado síntomas en plantas infectadas con el PnLV (aus dem Siepen et al., 2005), pero el PnMV induce distorsión de brácteas, mosaico y moteado foliar, causando pérdidas importantes en la comercialización (Lebas, 2007).
En México, el estudio de virus fitopatógenos en plantas de "nochebuena de sol" y silvestres es reciente. Se tienen dos reportes en donde se asocia la presencia de estos patógenos con síntomas de clorosis, mosaico, variegado y deformación foliar. En el 2012, en un diagnóstico preliminar con inmuno-tiras, se detectaron al Cucumber mosaic virus (CMV), Tobacco mosaic virus (TMV) y al Tomato spotted wilt virus (TSWV). La presencia del CMV y TMV se corroboró posteriormente con la prueba DAS-ELISA (Ocampo, 2012). En el 2013, se detectó mediante DAS-ELISA al TMV en plantas de "nochebuena de sol" que se recolectaron en Morelos, Guerrero, Distrito Federal, Michoacán, Estado de México, Puebla, Veracruz, Oaxaca y Nayarit. La presencia de este virus se corroboró con RT-PCR en las plantas del Estado de México y Nayarit. También se determinó la presencia del PnMV en plantas de "nochebuena de sol" de Michoacán, Estado de México, Veracruz y Oaxaca; ratificando el resultado con RT-PCR solamente en las plantas que se recolectaron en Michoacán y Oaxaca (Ocampo et al., 2013). En plantas silvestres de nochebuena recolectadas en los estados de Morelos, Guerrero y Nayarit, solo se determinó la presencia del TMV con la prueba DAS-ELISA (Ocampo, 2012).
Considerando que México importa las variedades comerciales de nochebuena para su producción y comercialización, que estas variedades se originaron a partir de plantas silvestres que se colectaron en México, y que el PnMV es una de las causas de pérdidas económicas en la producción de esta ornamental, el objetivo de esta investigación fue buscar una fuente de resistencia al PnMV en plantas silvestres de nochebuena.
En 2013 y 2014 se recolectaron plantas silvestres de nochebuena asintomáticas y con síntomas asociados a virus en los municipios de Jiutepec, Morelos (10 plantas); Tehuilotepec, Guerrero (9 plantas); Xilitla, San Luis Potosí (2 plantas) y en un invernadero de la Universidad Autónoma Chapingo (UACh), en el Estado de México (11 plantas). Además se consiguieron plantas de nochebuena (como especie mejorada) de las variedades "Freedom" y "Red Prestige" en la empresa "Vivero Internacional" ubicada en el estado de Morelos. A partir de dos de las nueve plantas recolectadas en Tehuilotepec y las dos obtenidas de Xilitla, se obtuvieron esquejes que se establecieron en un cubículo aislado del invernadero de virus fitopatógenos del Departamento de Parasitología Agrícola de la UACh.
La detección del PnMV se realizó serológicamente con la prueba DAS-ELISA en hojas tiernas y raíces de todas las plantas que se recolectaron en Jiutepec y Tehuilotepec, y solamente se analizó el tejido foliar de las plantas obtenidas del invernadero de la UACh y de las plantas de nochebuena comercial (5 de la variedad "Freedom" y 4 de "Red Prestige". El protocolo de detección se llevó a cabo según las indicaciones del fabricante (Reagent Set SRA 90700/0096 Agdia(r)). Los valores de absorbancia se midieron a los 60 minutos de incubación en un lector de micro-placas de ELISA (Multiskan EX, Labsystems) a 405 nm. Se consideraron positivas las muestras que tuvieron valores de absorbancia mayores al promedio de los controles negativos multiplicado por dos (García et al., 2014).
El ARN se aisló a partir de 100 mg de tejido foliar de todas las muestras con el Kit comercial ZR Plant RNA MiniPrep(tm) (R2024 Zymo Research) considerando el protocolo del fabricante. Para descartar la presencia de inhibidores, se amplificó un segmento del gen 18S con los iniciadores específicos 18SF (5´- ACG GAT CGC ACG GCC TTC GT -3) y 18SR (5´- ACC AGA CTT GCC CTC CAA TGG -3) (Zamboni et al., 2008). La amplificación parcial del PnMV se realizó con los iniciadores PnMV-F (5´-GTGCCAGCCGCCGTTCTTCT-3´) y PnMV-R (5´-TGAGCCGGCGACTCCATCCA-3´) (Ocampo et al., 2013). El control positivo se obtuvo de plantas comerciales de nochebuena variedad "Red Prestige" mantenidas en el invernadero de virus de la UACh. El control negativo consistió en la mezcla de reacción sin el ADN complementario. Los productos de PCR se resolvieron en un gel de agarosa al 1.5% p/v a 100 V durante 80 minutos. Los amplicones se observaron en un fotodocumentador (Vilber Lourmat, Quantum), se purificaron con el Kit comercial "Wizard (r) SV Gel and PCR Clean-Up System" de Promega(r), siguiendo el protocolo del fabricante, y se mandaron a secuenciar al Instituto de Biotecnología de la Universidad Nacional Autónoma de México.
Para los ensayos de transmisión, el PnMV se inoculó independientemente y de manera mecánica en cuatro plantas silvestres de nochebuena obtenidas a partir de las estacas recolectadas en Tehuilotepec y Xilitla, y en 10 especies de plantas indicadoras (Nicotiana benthamiana, N. clevelandii, N. tabacum cv. Xanthi, N. glutinosa, N. occidentalis, N. virginia, N. rustica, Datura stramonium, Chenopodium amaranticolor y Ch. quinoa). La fuente de inóculo se obtuvo de las plantas de nochebuena comercial "Red Prestige" y "Freedom" que presentaron la mayor concentración del virus según los resultados serológicos obtenidos. Brevemente, tres a cinco hojas jóvenes de las plantas se espolvorearon con carborundum de 600 mallas y se frotaron de manera independiente con un hisopo estéril previamente humedecido con el inóculo. Como control negativo se aplicó carborundum en la superficie de las hojas y se frotaron con un hisopo estéril humedecido con amortiguador de fosfatos + ácido dietilditiocarbámico (DIECA) pH. 7.4.
Adicionalmente, brotes tiernos de las variedades "Red Prestige" y "Freedom" que fueron positivos al PnMV con DAS-ELISA, se injertaron en tres plantas silvestres de nochebuena obtenidas a partir de las estacas recolectadas en Tehuilotepec y que fueron negativas al PnMV, según los resultados DAS-ELISA. A cada planta silvestre se le hicieron dos incisiones oblicuas; los injertos se cortaron en forma de cuña y se insertaron en las incisiones hechas en las plantas silvestres, de acuerdo con la metodología de Jayasinghe y Chuquillanqui (1992). Las plantas se mantuvieron en observación en un cubículo aislado del invernadero de virus de la UACh. Como control negativo se utilizaron dos plantas de nochebuena silvestre, una como injerto (brotes nuevos) y otra como portainjerto (plantas generadas a partir de las estacas recolectadas en Guerrero y San Luis Potosí).
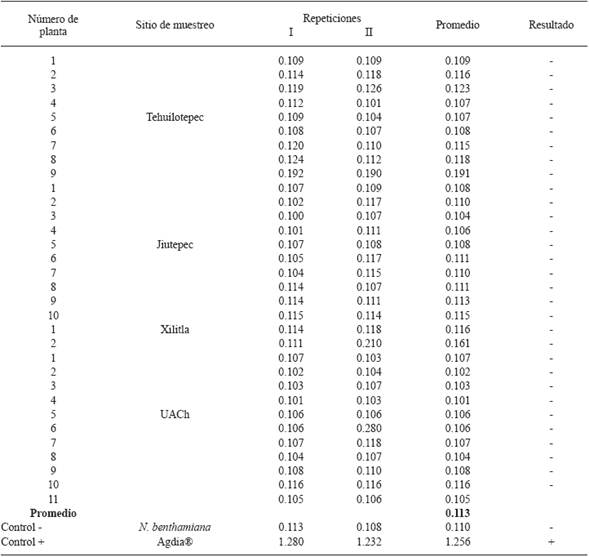
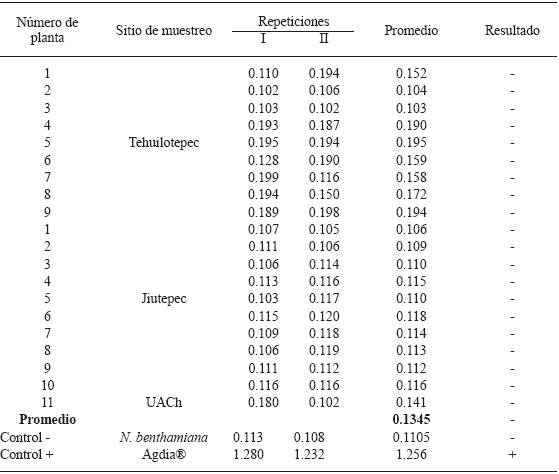
Solamente en algunas de las plantas silvestres de nochebuena que se recolectaron en Jiutepec y en el invernadero de la UACh se observaron síntomas de moteado, deformación foliar, mosaico y manchas anulares (Figura 1). El moteado y la deformación de hojas coincide con los síntomas inducidos por el PnMV en plantas de nochebuena comercial producidas en viveros comerciales de Venezuela (Carballo et al., 2001) y Nueva Zelanda (Lebas et al., 2007), pero los análisis serológico y molecular que se realizaron en la presente investigación no detectaron al virus. Las 32 plantas silvestres de nochebuena dieron reacción negativa al antisuero evaluado. En general, la absorbancia promedio de las muestras foliares fue de 0.113 (Cuadro 1); mientras que el tejido radical, que se evaluó de las mismas plantas recolectadas en Tehuilotepec y Jiutepec, y en una de las plantas silvestres de nochebuena del invernadero de la UACh, fue de 0.134 (Cuadro 2). Estos resultados tampoco concuerdan con lo reportado por Ocampo et al. (2013) en plantas de "nochebuena de sol" recolectadas en Michoacán y Oaxaca; en donde el análisis serológico por ELISA indicó que solamente 4 de 28 plantas con síntomas de clorosis, mosaico, variegado, deformación foliar y manchas blancas fueron positivas al PnMV. Estos síntomas, que se expresaron después de que las plantas se habían establecido en instalaciones del INIFAP (Campo Experimental Zacatepec) a partir de varetas recolectadas en las entidades señalas, no coinciden con los inducidos por el PnMV en plantas comerciales de nochebuena y pudieron haber sido causados por insectos. Sin embargo, el hecho de que en la savia se haya detectado al PnMV sugiere que pudo haber ocurrido contaminación con los controles positivos o que las infecciones causadas por este virus son latentes. En caso de que las infecciones sean latentes, es posible que las plantas silvestres de nochebuena asintomáticas que se recolectaron en Tehuilotepec, Jiutepec y aquellas que se desarrollaron a partir de varetas recolectadas en Xilitla puedan constituir una fuente de resistencia al PnMV, no obstante, como se indicó anteriormente, en todas estas plantas no se detectó al virus por DAS-ELISA y los iniciadores específicos solo amplificaron la banda esperada en los controles positivos ("Freedom"). Los iniciadores para el segmento del gen 18S ribosomal retrotranscribieron el fragmento esperado en el ARN que se aisló de las 32 plantas silvestres de nochebuena mostrando un 99 % de similaridad con la secuencia registrada en el Gen Bank (EU326598.1) (datos no mostrados), lo que indica que la calidad del ácido nucleico es buena y que no hubo inhibidores para la retrotranscripción.

Figura 1 Hojas de plantas silvestres de nochebuena (Euphorbia pulcherrima) con síntomas de posible origen viral. Hojas de plantas mantenidas en el invernadero de la Universidad Autónoma Chapingo. Mosaico (A y B), manchas anulares (C) y moteado (D). Hojas de plantas recolectadas en Jiutepec, Morelos. Deformación (E) y puntos cloróticos (F). Hojas asintomáticas de plantas recolectadas en Tehuilotepec, Guerrero (G) y en Xilitla, San Luis Potosí (H).
Límitede detección (L. D.) = Promedio testigo negativo x 2 = 0.1105 x 2 = 0.221.
Cuadro 1 Absorbancia a 405 nm en la prueba DAS-ELISA de tejido foliar de plantas silvestres de nochebuena (Euphorbia pulcherrima).
Límitede detección (L. D.) = Promedio testigo negativo x 2 = 0.1105 x 2 = 0.221.
Cuadro 2 Absorbancia a 405 nm en la prueba DAS-ELISA de tejido radical de plantas silvestres de nochebuena (Euphorbia pulcherrima).
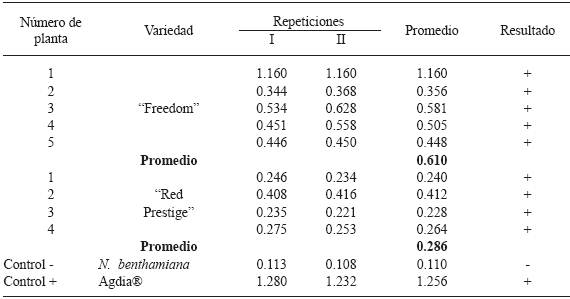
En plantas mejoradas de nochebuena, el PnMV puede no inducir síntomas o bien causar moteado foliar y distorsión de hojas y brácteas (Carballo et al., 2001; Lebas et al., 2007). Las plantas comerciales de nochebuena "Freedom" y "Red Prestige" que se utilizaron en la presente investigación presentaron mosaicos y fueron positivas al PnMV según los resultados de ELISA (Cuadro 3) y RT-PCR. Para determinar si las plantas silvestres de nochebuena son o no hospedantes del virus, la savia de las hojas de la var. "Freedom", en donde previamente se detectó al virus mediante DAS-ELISA, se inoculó mecánicamente en las hojas de plantas silvestres, pero no hubo expresión de síntomas y el virus no se detectó con las técnicas utilizadas. Tampoco se determinó si los injertos de las variedades "Freedom" y "Red Prestige" transmitieron al PnMV a las plantas de nochebuena silvestre debido a que los injertos abortaron.
Límite de detección (L. D.) = Promedio testigo negativo x 2 = 0.1105 x 2 = 0.221.
Cuadro 3 Absorbancia a 405 nm en la prueba DAS-ELISA de tejido foliar de dos variedades comerciales de nochebuena (Euphorbia pulcherrima).
Es posible que las condiciones de luminosidad y temperatura que se presentaron durante los ensayos de transmisión, que las características biológicas de la planta donante y receptora (etapa fenológica de desarrollo, nutrición) y/o que las características de los amortiguadores que se utilizaron para preparar el inóculo (relacionadas con la estabilidad e infectividad del virus) hayan inhibido o evitado la transmisión mecánica y por injerto del PnMV a plantas silvestres de nochebuena; sin embargo, también es probable que la nochebuena silvestre no sea hospedante de este virus, de tal manera que podría considerarse como fuente de resistencia para la generación de variedades mexicanas que puedan entrar a un sistema de mejoramiento genético que favorezca sus características comerciales.
No hubo transmisión del PnMV a las plantas indicadoras que se evaluaron. En N. benthamiana, que es una de las plantas en donde se ha logrado la transmisión del virus (Lebas et al., 2007), se presentaron pequeños puntos necróticos (Figura 2E), que más que un síntoma de origen viral pudiera tratarse de un daño mecánico generado durante la inoculación, aunque en las hojas del tratamiento testigo no se desarrollaron. En las hojas de N. rustica, N. occidentalis y en N. virginia hubo moteado clorótico (Figura 2A, C , G , I ), pero los análisis serológico y molecular no detectaron al virus.

Figura 2 Hojas de N. rustica (A y B), N. occidentales (C y D), N. benthamiana (E y F), N. tabacum cv. Xanthi (G y H) y N. virginia (I y J) a los 34 días después de haberse inoculado con el virus PnMV. En todas las plantas se desarrollaron moteados cloróticos, a excepción de N. benthamiana en donde se presentaron pequeños puntos necróticos. B, D, F, H y J corresponden a hojas de controles negativos.
En contraste con los resultados observados en las plantas de nochebuena silvestre, las plantas comerciales fueron positivas al PnMV según los resultados de RT-PCR y DAS-ELISA. La secuencia parcial del virus fue 92 % similar con la secuencia AB550791.1 reportada en el GenBank (datos no mostrados); y las plantas tuvieron una absorbancia promedio de 0.610 ("Freedom) y 0.286 ("Red Prestige"), superiores al límite de detección (0.221) (Cuadro 3). Como se indicó anteriormente, la nochebuena comercial infectada con este virus puede ser asintomática o desarrollar moteado y distorsión de hojas y brácteas (Carballo et al., 2001; Lebas et al., 2007). El PnMV es un patógeno cosmopolita; está reportado en Australia (Spetz et al., 2008), en Corea (Chung et al. 2004), Dinamarca (Bech, 1996), Nueva Zelanda (Lebas et al., 2007), Venezuela (Carballo et al., 2001), entre otros países. En México, éste es el primer reporte del virus en las plantas comerciales de nochebuena que se evaluaron.











 text in
text in 


