En México en 2010 se cultivaron alrededor de 19, 000 ha de jamaica (Hibiscus sabdariffa L.), Guerrero fue el principal productor con más del 70 % (SIAP, 2010); la principal zona productora se ubica en los municipios de Ayutla y Tecoanapa. En esta región, la enfermedad "pata prieta" que se caracteriza por presentar necrosis basal, marchitez generalizada, amarillamiento de hojas y muerte de la planta, constituye una de las principales limitantes fitosanitarias para la producción de esta especie. En estudios realizados en esta zona se concluyó que Phytophthora parasitica es el agente causal de esta enfermedad (Hernández y Romero, 1990). Sin embargo, en otros países se han reportado diversos organismos como causantes de pudrición de tallo y raíz en el cultivo de jamaica, entre los que destacan; Phytophthora parasitica, Rhizoctonia solani, Macrophomina phaseolina, Sclerotium rolfsii, Phymatotrichopsis omnivora, Fusarium oxysporum, F. semitectum, F. solani y F. equiseti (Ooi y Salleh, 1999; Amusa et al., 2005; Ploetz et al., 2007; Horst, 2008; Hassan et al., 2014). En estos municipios el cultivo se distribuye en rangos de altitudes que van desde los 100 msnm hasta alturas superiores a los 700 msnm, por lo que se consideró realizar el presente trabajo de investigación, mediante un muestro estratificado (Ceja-Torres et al., 2000). Con base en lo anterior el objetivo del presente estudio fue determinar la distribución y frecuencia de los organismos asociados a la enfermedad "pata prieta" de la jamaica en Ayutla y Tecoanapa, Guerrero.
Materiales y Métodos
Zona de estudio y muestreo. Se estableció el área de estudio en los municipios de Ayutla y Tecoanapa (Figura 1), en el ciclo de producción primavera-verano de 2011. En base a los registros de la estación más cercana (estación: 12012), los municipios registraron temperatura y precipitación promedio anual de 27.7 °C y 1,519.9 mm (SMN, 2012). Para la selección de sitios se utilizó un muestreo estratificado (Ceja-Torres et al., 2000), se consideró la variación que presenta esta zona con respecto a la altitud (msnm). Cuatro estratos quedaron definidos de la siguiente manera: estrato I) 100 a 300, estrato II) 301 a 500, estrato III) 501 a 700 y estrato IV) >701 (Cuadro 1). Se seleccionaron 12 localidades productoras y en cada una de ellas se seleccionó un sitio de muestreo. La altitud y posición geográfica (latitud y longitud) de cada sitio se determinó mediante un geoposicionador global (GPS, Garmin Etrex(r)) (Cuadro 1; Figura 1). En cada sitio seleccionado, se realizaron cuatro muestreos dirigidos a plantas con síntomas de "pata prieta" en los meses de septiembre, octubre, noviembre y diciembre. Se colectaron cinco plantas en cada muestreo, las plantas fueron etiquetadas para su identificación y trasladadas a laboratorio para ser procesadas. En cada sitio se determinaron las características físicas y químicas de suelo en el laboratorio de Física de Suelos del Colegio de Postgraduados. La textura se determinó por el método del hidrómetro de Bouyoucos, el pH (relación 1:2 en H2O) y la materia orgánica mediante el método de Walkley y Black (1934).

Figura 1 Sitios de muestreo en los municipios de Ayutla y Tecoanapa, Gro. México. Ciclo de producción primavera-verano de 2011.
Distribución y frecuencia de organismos. Fragmentos de tejido de plantas enfermas de aproximadamente 0.5 cm se desinfestaron y sumergieron en una solución de hipoclorito de sodio al 1.5 % durante 2 min, posteriormente se enjuagaron tres veces con agua destilada estéril, se secaron con papel absorbente estéril, se transfirieron a medio de cultivo PDA y se incubaron a 24±2 °C en condiciones controladas durante una semana, se cuantificó el desarrollo de cada organismo. A partir de los datos obtenidos para cada organismo aislado por sitio de muestreo, se generó un mapa de distribución. Se realizó una prueba de comparación de medias (Tukey, p=0.05) de las frecuencias obtenidas de cada especie de microorganismo (SAS Institute, 1988).
Caracterización cultural y morfológica. Los crecimientos miceliales se transfirieron y purificaron utilizando la técnica de cultivos monospóricos y punta de hifa en medio agua-agar al 2 %. En la identificación preliminar, las colonias con características culturales a Phytophthora se transfirieron en medio de cultivo V8-agar por catorce días, y para inducir esporulación se retransfirieron discos de un centímetro de diámetro en cajas Petri con 25 mL de agua destilada estéril. Los aislamientos restantes se transfirieron en medio de cultivo PDA. En todos los casos, los organismos se incubaron nuevamente a 24±2 °C. La identificación morfológica se efectuó con base en las claves taxonómicas de Holliday y Punithalingam (1970), Booth (1971), Mordue (1971), Sutton (1980), Hobbs et al. (1985), Hanlin (1990), Sutton (1992), Erwin y Ribeiro (1996), Leslie y Summerell (2006), Barnett y Hunter (2006), Gallegly y Hong (2008) y Damm et al. (2009).
Caracterización molecular. Del micelio de las colonias de los diferentes aislados de una semana de edad en medio PDA, se realizó la extracción de DNA con el método de CTAB (Murray y Thompson, 1980) con algunas modificaciones (uso de buffer STE1x y adición de PVP40 al 4 % al buffer de extracción). El micelio de cada especie se maceró con 1 mL de buffer STE1x (Tris-HCl 100 mM pH8, EDTA 50 mM pH8, NaCl 100mM, β-mercaptoetanol 0.3 %). Las muestras se centrifugaron a 14,000 rpm (revoluciones por minuto) durante 8 min. El sobrenadante se decantó y se adicionaron 800 μL de buffer de extracción (Tris-HCl 100 mM pH8, NaCl 1.5 M, EDTA 20 mM pH8, CTAB 3 %, PVP40 4 %, β-mercaptoetanol 0.3 %). Se incubó durante 40 min a 65°C, posteriormente, se adicionaron 700 μL de cloroformo/alcohol isoamílico (24:1), se mezcló y se centrifugó por 8 min a 14,000 rpm. El sobrenadante se transfirió a un tubo nuevo que contenía 800 μL de etanol absoluto. El DNA se precipitó por una hora a -20 °C. Posteriormente se centrifugó por 8 min a 13,000 rpm, el sobrenadante se decantó y el precipitado se secó a 37 °C por 20 min para resuspender el DNA obtenido en 100 μL de agua ultrapura estéril. Para amplificar las regiones espaciadoras internas transcritas (ITS1-ITS2) y la región intermedia 5,8S del rDNA de todos los organismos aislados, con excepción de Fusarium spp., se utilizaron los iniciadores ITS5 (5´GGAAGTAAAAGTCGTAACAAGG) e ITS4 (5´-TCCTCCGCTTATTGATATGC) (White et al., 1990). Mientras que para las especies de Fusarium se emplearon los iniciadores ITS5 y NL4 (5´-GGTCCGTGTTTCAAGACGG-3´), para amplificar además los dominios D1/D2 del gen 28S (O'Donnell, 1993). Las reacciones se realizaron en un volumen final de 25μL, que contenían 2.5 de buffer 10X, 1 μL de MgCl2 a 50mM, 0.5 μL de la mezcla de dNTPs 10 mM, 2 μL de cada iniciador 10 pmol/μL y 0.2 μL de Taq-DNA polymerase 5U/μL (Invitrogen(r), USA). Las reacciones se realizaron en un termociclador Biometra, con el siguiente programa: desnaturalización inicial a 95 °C por 3 min, 35 ciclos de desnaturalización a 95 °C por 30 seg (segundos), alineamiento a 55 °C por 45 seg, y extensión a 72 °C por 45 seg; una extensión final de 72 °C por 7 min. Los productos de PCR se visualizaron por electroforesis en gel de agarosa al 2 %. Una vez constatada la presencia de una sola banda, el DNA amplificado se envió con la compañía Macrogen (http://www.macrogen.com), para su secuenciación.
Una secuencia consenso de cada especie fue obtenida por alineamiento (forward y reverse) con el software DNA Baser(r) ver. 4.16, se compararon y alinearon con las disponibles en la base de datos del Banco de Genes del National Center for Biotechnology Information (NCBI), EE.UU. utilizando BLASTN 2.2.26 (Zhang et al., 2000) y se depositaron en el GenBank.
Pruebas de patogenicidad. En octubre de 2011, cada patógeno aislado se inoculó en plantas de jamaica de tres meses de edad, el material vegetal utilizado, se multiplicó por semilla botánica "criolla" de Guerrero, sembradas en macetas con suelo estéril y cultivadas en cámara de ambiente controlado con temperatura de 28 °C durante el día y 18 °C en la noche, con periodos de luz/oscuridad de 12 h. El inóculo de Phytophthora parasitica se incrementó en medio V8-agar durante 14 días, posteriormente, para inducir la liberación de zoosporas, discos de 1cm de diámetro fueron transferidos a cajas Petri con 25 mL de agua destilada estéril sometidos a 5 °C por 5 min, y después a temperatura ambiente (24-27 °C) por 10-15 min; mientras que para el incremento de inóculo de los otros organismos aislados, solo se utilizaron cajas Petri con PDA. Así, para Fusarium oxyporum, Fusarium incarnatum, Fusarium solani, Macrophomina phaseolina y Colletotrichum truncatum el desarrollo fue por 14 días, y 30 días para Phomopsis longicolla y Glomerella cingulata. La concentración de inóculo se estimó con una cámara de Neubauer. Para P. parasitica fue de 2x103 zoosporas mL-1. Suspensiones conidiales de F. oxyporum, F. solani, F. incarnatum, P. longicolla, y C. truncatum se inocularon a concentraciones de 1x106 conidios mL-1. La inoculación de Macrophomina phaseolina se realizó con suspensiones de microesclerocios. En todos los casos se inocularon 10 mL de la suspensión por planta. Para G. cingulata se utilizaron diez discos de PDA (1 cm diámetro), colocados en la base del tallo de cada planta. Cinco plantas por cada especie de organismo (tratamiento) fueron inoculadas y se adicionó un tratamiento testigo sin inocular.
Una segunda prueba se realizó en condiciones a cielo abierto, en el INIFAP-Campo Experimental Iguala, Guerrero en febrero de 2012, con temperaturas y precipitación promedio anual de 26.7 °C y 965.4 mm respectivamente (SMN, 2012). Para el incremento de inóculo nuevamente se utilizó medio PDA y V8-agar. Se inocularon cinco plantas de tres meses de edad por cada especie de hongo u oomiceto (tratamiento) mediante la inserción en el tallo de un palillo esterilizado impregnado con micelio del microorganismo, más un testigo sin la aplicación de inóculo. Las plantas en estudio quedaron a cielo abierto después de ser inoculadas. Cuando se manifestaron síntomas inducidos por los patógenos inoculados, éstos fueron reaislados con la técnica descrita.
Resultados y Discusión
Distribución y frecuencia de organismos. De las plantas colectadas y procesadas, se identificaron cinco géneros de hongos y un oomiceto. Phytophthora parasitica (oomiceto) se detectó en 10 sitios con frecuencias que variaron de 85 a 92.2 % (promedio de 72.4 %); Macrophomina phaseolina fue aislado en cuatro sitios y en dos de ellos, que fueron Tlachimala y Pozolapa, con altas frecuencias de 66.7 y 56.3 % respectivamente y con promedio de 10.6 %; Fusarium oxysporum se distribuyó en 11 sitios con frecuencias de aislamientos bajas (3.6 a 18.8 %) y el promedio fue de 10.6 %. Los hongos Fusarium incarnatum, Phomopsis longicolla, Fusarium solani, Colletotricum truncatum y Glomerella cingulata de baja frecuencia (promedio de 0.4 a 2.4 %) y distribución (Figura 2, Cuadro 2).
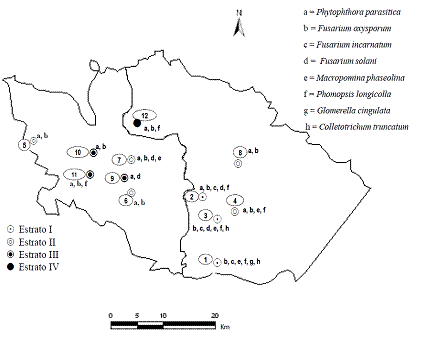
Figura 2 Distribución de organismos asociados a la "pata prieta" de la jamaica durante el ciclo primavera-verano 2011, en Ayutla y Tecoanapa, Guerrero.

Cuadro 2 Frecuencia de organismos aislados de plantas de jamaica con síntomas de "pata prieta" en 12 localidades de los municipios de Ayutla y Tecoanapa, Guerrero, México. En el ciclo de cultivo primavera-verano de 2011.
En el Cuadro 2 se observa que la frecuencia de Phytophthora parasitica fue significativamente mayor (p=0.05), los otros organismos no mostraron diferencias significativas entre grupos, sin embargo numéricamente le siguen Macrophomina phaseolina y Fusarium oxysporum.
Las plantas enfermas en donde se aisló con mayor frecuencia a Phytophthora parasitica exhibieron marchitez generalizada, amarillamiento, flacidez de hojas, necrosis en la parte basal del tallo, la cual en ocasiones se extendió hacia la parte aérea, abarcando parte de las ramas (Figura 3a y b ). También en menor grado fueron observados síntomas de necrosis más agrietamiento en la base del tallo con producción de exudados, lo cual en ocasiones provocó el acame y muerte de la planta, éstos síntomas corresponden a los ya reportados por Hernández y Romero (1990) y Erwin y Ribeiro (1996). Sin embargo, en plantas enfermas provenientes de Tlachimala y Pozolapa en donde P. parasitica no fue aislado, se detectaron síntomas similares, en estos lugares la necrosis se limitó a la base del tallo de la planta, frecuentemente se encontraron plantas con desprendimiento de epidermis y constricción en la zona de avance de la enfermedad (Figura 3d), las plantas presentaron marchitez generalizada, amarillamiento y flacidez de hojas (Figura 3c) y muerte de la planta, en estos sitios Macrophomina phaseolina fue aislado con alta frecuencia (Cuadro 2). Localmente ambas sintomatologías son conocidas como "pata prieta" de la jamaica.

Figura 3 Síntomas de "pata prieta" causada por diferentes organismos. a) marchitez generalizada, amarillamiento y flacidez de hojas. b) necrosis de tallo, extendiéndose hacia las ramas. c) marchitez generalizada, amarillamiento y flacidez de hojas. d) pudrición en raíces y base del tallo con desprendimiento de epidermis y constricción en la zona de avance.
Este es el primer reporte de M. phaseolina, F. incarnatum, F. solani, P. longicolla, C. truncatum y G. cingulata, como organismos asociados a la enfermedad "pata prieta" en esta zona del estado de Guerrero, en donde se comprobó con base en pruebas de patogenicidad, que no todos fueron patogénicos.
Por otra parte, los rangos de pH variaron de 4.7 a 6.9, el contenido de materia orgánica de 1.2 a 2.9 % y los tipos de suelo fueron franco, franco arenoso y franco arcillo arenoso. El organismo Phytophthora parasitica fue aislado de plantas enfermas en 10 sitios caracterizadas por presentar suelos con pH de 4.7 a 5.5, mientras que en dos sitios no fue aislado, estos fueron Pozolapa y Tlachimala (Cuadro 2) y presentaron un pH de 6.6 y 6.8 respectivamente (Cuadro 3), sitios ubicados en el estrato I. Lo anterior indica que las condiciones del suelo con pH cercanos a la neutralidad no favoreció la presencia de P. parasitica.
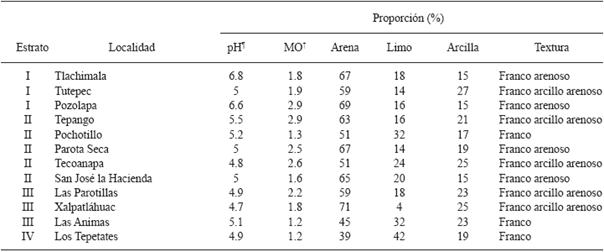
pH= Potencial de Hidrógeno.
†MO=Materia orgánica (%).
Cuadro 3 Características edáficas en parcelas de jamaica (Hibiscus sabdariffa L.) de Ayutla y Tecoanapa, Guerrero, México.
Existen evidencias de que el pH del suelo es un factor crítico para la formación de esporangios en algunas especies de Phytophthora. En general un pH alto resulta tóxico para los esporangios; en este sentido, Dasgupta et al. (2012), evaluaron el comportamiento de P. parasitica en suelos con pH de 5.4, 7.0 y 8.5, determinaron que el patógeno presentó el mejor crecimiento en pH de 5.4. De igual forma Besoain (2013), reportó que las colonias de Phytophthora parasitica se desarrollan a pH entre 5.5 y 6, y su crecimiento fue afectado cuando éste era superior a 6.5. En el presente estudio P. parasitica fue aislado en suelos con pH de 4.7 a 5.5, mientras que en suelos con pH entre 6.6 y 6.8 no se aisló este organismo, resultados similares a los reportados por Dasgupta et al. (2012) y Besoaín (2013). Por otra parte en otros cultivos Jha y Dubey (2000); Surinder et al. (2013), determinaron que Macrophomina phaseolina prefiere rangos de pH entre 6 y 7, similares a los presentes en las localidades de Tlachimala y Pozolapa donde este patógeno fue aislado en alta frecuencia. No se detectó relación con el contenido de materia orgánica y textura (Cuadro 3).
Caracterización cultural y morfológica. De las plantas procesadas se identificaron ocho especies de microorganismos. 1) Phytophthora pasitica Dastur, desarrolló colonias densas, de crecimiento algodonoso, en forma de roseta, micelio cenocítico, en su mayoría de crecimiento aracnoide, esporangios predominantemente de forma oval y con una papila prominente, en promedio midieron de 44.4 x 35.3 μm (largo por ancho), clamidosporas intercalares y terminales (28 μm en promedio), características que coinciden con lo descrito para esta especie por Erwin y Ribeiro (1996) y Gallegly y Hong (2008). 2) Macrophomina phaseolina (Tassi.) Goid., las colonias presentaron coloración gris en su fase de crecimiento y desarrollo, oscureciéndose con la edad, desarrollaron microesclerocios muy variables en tamaño (33-54 μm), de redondos a irregular con coloración negra, articulados y duros, micelio septado, características que coinciden para esta especie con base en lo descrito por Holliday y Punithalingam (1970), Abawi y Pastor-Corrales (1990), Kaur et al. (2012). 3) Fusarium incarnatum (Robergge) Sacc. (=F. semitectum), colonias inicialmente blancas, con pigmento anaranjado en el centro, posteriormente se volvieron color marrón. En medio de cultivo CLA (Carnation Leaf Agar) produjo macroconidios con septos que variaron en número de 3 a 5 (28.3-35.4 μm) y con célula basal en forma de pie, microconidios de 0 a 3 septos, estas características coinciden a lo descrito por Nelson et al. (1983) y Leslie y Summerell (2006) para esta especie. 4) Fusarium oxysporum Snyder y Hansen, colonias de color blanco-rosada, con el tiempo se tornaron violeta, presentaron macroconidios fusiformes, generalmente con 3 septos, de 23.3-49.9 x 3.1-5.2 μm, microconidios abundantes, sin septos y cilíndricos, clamidosporas intercalares y terminales, características que coinciden con las reportadas por Nelson et al. (1983), Leslie y Summerell (2006). 5) Fusarium solani Snyder y Hansen, presentó colonias de color crema, micelio escaso, esporodoquios presentes en abundancia, frecuentemente con pigmentación verdosa en el centro, macroconidios de 5 a 7 septos de 28.3-41.5 x 4.3-6.4 μm, microconidios de 0 a 2 septos, células conidiogénicas en monofialides largas, características que coinciden para esta especie de acuerdo a Nelson et al. (1983), Leslie y Summerell (2006). 6) Glomerella cingulata (Stoneman) Spauld. y H. Schrenk, colonias de color blanco grisáceo a oscuras, las ascas se formaron después de 3 a 4 semanas, de forma clavada a cilíndrica (45.8-62.6 x 9.2-11.6 μm) ligeramente curvadas, con ocho ascosporas por asca de forma cilíndricas (11.7-18.5 x 3.8-5.3 μm), unicelulares y hialinas, esto concuerda con las características culturales y morfológicas señaladas para esta especie por Mordue (1971). (7) Colletotrichum truncatum (Schwein.) Andrus y W.D. Moore, colonias planas, blanco grisáceas, desarrollaron acérvulos. Las setas midieron en promedio 80-150 μm, conidióforos más de 90 μm y conidios ligeramente curvados, con promedio de 17.5-21.5 x 2.55-3.32 μm, estas características fueron consistentes para la descripción de Colletotrichum truncatum (Damm et al., 2009). 8) Phomopsis longicolla Hobbs (=Diaporthe longicolla) (Santos et al., 2011), las colonias presentaron crecimiento algodonoso de color blanco, se observaron picnidios alargados y produjeron alfa-conidios y beta-conidios. Los alfa-conidios fueron hialinos, elipsoides a fusiformes de 4.05-7.57 x 1.48-3.25 μm. Beta-conidios, escasos, hialinos, filiformes y con punta en forma de gancho, con dimensiones de 18.2-34.5 x 1.3-2.9 μm. Las características de cultivo y morfológicas se ajustan a la descripción de Phomopsis longicolla reportadas por Hobbs et al. (1985).
Caracterización molecular. Las amplificaciones realizadas con los iniciadores ITS5/ITS4 amplificaron un fragmento aproximado de 900 pb para Phytophthora parasitica, y de aproximadamente 600 pb para Macrophomina phaseolina, Glomerella cingulata, Colletotricum truncatum y Phomopsis longicolla. Con los iniciadores ITS5/NL4 se amplificó un fragmento aproximado de 1100 pb en los aislamientos de Fusarium spp. Las secuencias consenso de nucleótidos obtenidas al ser comparadas con las disponibles en el GenBank del National Center for Biotechnology Information (NCBI), indicaron un 99% de porcentaje de similitud (Cuadro 4). Lo que confirmó la identidad de los organismos aislados a nivel de especie. La secuencia consenso de cada microorganismo fue depositada en el GenBank (Cuadro 4).

¥NCBI (National Center of Biotechnology Information)
ZAnamorfo.
Cuadro 4 Caracterización molecular por alineamiento de las secuencias reportadas en el banco de genes con las secuencias intergénicas (ITS) de los genes rDNA de los organismos aislados de plantas de jamaica con síntomas de "pata prieta".
Pruebas de patogenicidad. En los ensayos realizados en cámara de ambiente controlado y a cielo abierto Phytophthora parasitica resultó ser el organismo de mayor patogenicidad, al causar la muerte del 100 % de las plantas inoculadas. Plantas inoculadas con este organismo en cámara de ambiente controlado, mostraron síntomas de la enfermedad 10 días después de inocularse (ddi) (Cuadro 5). A cielo abierto los síntomas de la enfermedad fueron observados a los 7 ddi. Resultados similares a los obtenidos por Hernández y Romero (1990) para P. parasitica. El hongo Macrophomina phaseolina, en cámara de ambiente controlado indujo síntomas en una planta a los 28 ddi (Cuadro 5), posteriormente en la etapa avanzada de la enfermedad (34 ddi) formó microesclerocios en la base del tallo; mientras que a cielo abierto, indujo síntomas en dos plantas a los 13 ddi (Cuadro 5). En los sitios donde se aisló M. phaseolina en alta frecuencia con 66.7 % y 56.3 % (Tlachimala y Pozolapa respectivamente), fueron los únicos donde no se detectó la presencia de Phytophthora parasitica, por lo que se consideró que M. phaseolina es el que causó los síntomas observados. Sin embargo, en los sitios de Tepango y Tecoanapa en donde también se detectó a M. phaseolina con baja frecuencia (4.2 % y 3.8 %) respectivamente, P. parasitica se aisló con mayor frecuencia (Cuadro 2), por lo que se considera a este último como el causante de la enfermedad. En México hasta el momento en que se desarrolló esta investigación, no se encontraron reportes de la patogenicidad de M. phaseolina en jamaica.

ø1=Ensayo 1, realizado en cámara de ambiente controlado. 2= Ensayo 2, realizado a cielo abierto.
Proporción de plantas que mostraron síntomas en cada ensayo.
Cuadro 5 Pruebas de patogenicidad con organismos asociados a la "pata prieta" de la jamaica (Hibiscus sabdariffa L.).
Fusarium incarnatum ocasionó síntomas de la enfermedad únicamente en ensayo a cielo abierto, en dos de cinco plantas inoculadas. Los síntomas se observaron a los 15 ddi (Cuadro 5), y se caracterizaron por marchitez y necrosis basal. Al aislarse a este organismo con una baja frecuencia (2.4 %) (Cuadro 2), se considera en este estudio, como patógeno secundario de la enfermedad "pata prieta" en los sitios donde se detectó.
Los resultados de las inoculaciones con Phytophthora parasítica indicaron que este organismo fue el de mayor patogenicidad, seguido por Macrophomina phaseolina y el de menor patogenicidad fue Fusarium incarnatum (Cuadro 5). En Egipto M. phaseolina y F. incarnatum fueron aislados de plantas con síntomas de pudrición radical y marchitez de plantas de jamaica. En inoculaciones artificiales en invernadero y a cielo abierto determinaron que M. phaseolina fue más patogénico que F. incarnatum (Hassan et al., 2014), lo que coincide con lo determinado en el presente estudio.
A partir de plantas inoculadas en forma independiente con P. parasitica, M. phaseolina y F. incarnatum, y que indujeron síntomas se obtuvo la misma especie que fue inoculada, al realizar los reaislamientos.
En los ensayos realizados en cámara de ambiente controlado y a cielo abierto, como se observa en el Cuadro 5, los otros organismos inoculados y las plantas testigos no manifestaron síntomas de la enfermedad.
En un estudio similar realizado en Nigeria, en jamaica con pudrición de tallo y raíz, se aisló a Phytophthora parasitica, Rhizoctonia solani y Fusarium solani. En pruebas de patogenenicidad P. parasitica resultó ser el principal agente causal de la enfermedad; R. solani solo causó muerte de plántulas y F. solani no fue patogénico (Adeniji, 1970).
Phytophthora parasitica ha sido reportado en Guerrero por Hernández y Romero (1990) como agente causal de la "pata prieta", en la India causa la pudrición radical y de tallo en jamaica (Kumar y Mandal, 2010), también se ha informado de su presencia en África, Indonesia, Puerto Rico, Malasia, Filipina, Costa de Marfil, Brasil, entre otros países, como causante de pudrición radical y de tallo en esta especie (Erwin y Ribeiro, 1996; Drenth y Guest, 2004; Silva et al., 2014).
Por otra parte, en Cuba y el Salvador, Wellman (1977) reportó que Macrophomina phaseolina es causante de pudrición del tallo en plantas de jamaica, recientemente en Egipto se menciona como inductor de pudrición radical y marchitez de plantas en esta misma especie (Hassan et al., 2014). En Bangladés, se ha aislado de semilla de jamaica, como patógeno que afecta la germinación (Islam et al., 2013). También se menciona en otras especies del género Hibiscus. Así, en la India causa la "pudrición del cuello" en hibisco de coral (Hibiscus schizopetalus) (Santhakumari, 2002).
El hongo Fusarium incarnatum (=F. semitectum) en Egipto se reporta como causante de pudrición radical y marchitez de jamaica (Hassan et al., 2014). Además en otros países se tienen registros como patógeno de otras especies del género Hibiscus, por ejemplo; Farr y Rossman (2015) reportan a F. incarnatum en kenaf (Hibiscus cannabinus L.) en Irán y Kenia, y sobre tulipán (Hibiscus rosa-sinensis L.) en la Isla de Barbados. Leslie et al. (1990) indica que F. incarnatum es un agente patogénico común en el suelo, distribuido principalmente en regiones tropicales y subtropicales.
El hongo Fusarium oxysporum no fue patogénico, sin embargo existen reportes como patógeno de jamaica en Malasia, Nigeria, EUA, entre otros países (Ooi y Salleh, 1999; Amusa et al., 2005; Ploetz et al., 2007; Hassan et al., 2014).
Por otra parte en la India reportan a Hibiscus sabdariffa como nuevo hospedante de Fusarium solani (Padaganur et al., 1988). En Egipto Hassan et al. (2014) mencionan que F. solani es agente patogénico para la jamaica, además Chehri et al. (2014) en Malasia lo aisló de plantas de jamaica con síntomas de podredumbre de raíz, sin embargo en el presente estudio no fue patogénico.
El género Colletotrichum incluye a numerosas especies patógenas de plantas de importancia económica. Distribuido principalmente en regiones tropicales y subtropicales (Cannon et al., 2012). El hongo Colletotrichum truncatum es patógeno de jamaica en la India (Farr y Rossman, 2015) y además se ha reportado en otras especies del género Hibiscus, por ejemplo: H. esculentum en la India y Pakistán; mientras que en Malasia sobre H. rosa-sinensis (Farr y Rossman, 2015). Glomerella cingulata también se ha reportado en especies del género Hibiscus tales como H. tiliaceus como causante de antracnosis en los EUA (Farr y Rossman, 2015) y en H. rosa-sinensis en Argentina (Rivera et al., 2000). Tanto C. truncatum y G. cingulata también han sido reportadas como especies endófitas de plantas de la familia Malvaceae, además de otras especies de plantas (Costa et al., 2012; Kumar y Kaushik, 2013). Lo que coincide con lo obtenido en este estudio, al no ser patogénicos en plantas de jamaica.
El género Phomopsis se relaciona con enfermedades de plantas herbáceas, aunque puede atacar arbustos y algunos árboles frutales (Agrios, 2005). P. longicolla en cacahuate (Arachis hypogaea L.) causa tizón del tallo (Sanogo y Etarock, 2009), en soya induce cancros en tallo, y es capaz de infectar vainas y semillas (Lu et al., 2010; Li, 2010), también ha sido reportado como endófito en soya y otras especies (Larran et al., 2002; Wagenaar y Clardy, 2001; Rhoden et al., 2012), no se encontraron reportes de este organismo como patógeno de jamaica (Farr y Rossman, 2015), además en el presente estudio, este organismo no fue patogénico. Por lo anterior los hongos F. oxysporum, F. solani, G. cingulata, C. truncatum y P. longicolla se consideran organismos asociados a la jamaica y de bajo riesgo para esta zona en estudio, debido a que no fueron patogénicos (Cuadro 5), la frecuencia de aislamiento fue baja y en general presentaron distribución limitada.
Conclusiones
Se concluye que Phytophthora parasitica es el organismo de mayor frecuencia y distribución en la región estudiada, por lo que se considera el principal agente causal de la enfermedad "pata prieta". El hongo Macrophomina phaseolina presentó baja distribución, sin embargo fue aislado en alta frecuencia en dos sitios, por lo que es el causante de la enfermedad en tales lugares. Fusarium incarnatum fue patogénico, sin embargo se requiere de más estudios, debido a su baja frecuencia y distribución. Se reporta por primera vez a Macrophomina phaseolina y Fusarium incarnatum como patógeno de la jamaica en México. Fusarium oxysporum se encontró ampliamente distribuido, no obstante presentó baja frecuencia y no fue patogénico. Los hongos Fusarium solani, Glomerella cingulata, Colletotrichum truncatum y Phomopsis longicolla se consideran de bajo riesgo para el cultivo, debido a que no fueron patogénicos y su frecuencia de aislamiento fue baja.











 texto en
texto en 



