La marchitez causada por Phytophthora capsici Leonian, es una enfermedad devastadora de cultivos de chile (Capsicum annuum L.) y se encuentra presente en todas las áreas productoras del mundo (Morán et al., 2010). Este patógeno puede causar pérdidas de rendimiento de hasta 100 % (Rico-Guerrero et al., 2004). Una vez que se le detecta en el campo puede hacerse necesaria una combinación de estrategias de rotación de cultivos, fumigación, subsoleo, elevación de camas de siembra, irrigación con agua de pozo, resistencia genética, aplicación de fungicidas, la destrucción de plantas infectadas y cosecha temprana para poder manejar la enfermedad (Granke et. al., 2012).
Actualmente existe una fuerte demanda de alternativas ambientalmente aceptables para la protección de cultivos. Entre estas alternativas se encuentra la inducción de resistencia sistémica; en cuyo proceso está involucrada la activación de los mecanismos naturales de defensa de las plantas mediante elicitores generados por los propios patógenos, por otros organismos o por factores ambientales (Carvajal, 2013). La aplicación de productos químicos sintéticos también puede activar procesos fisiológicos y bioquímicos propios de la planta y evitar o reducir el progreso de enfermedades (Guevara y Rodríguez-Gálvez, 2006). Entre estos compuestos destaca el acibenzolar S-metil (ASM), un inductor de resistencia sistémica adquirida (SAR) que ha sido estudiado para el control de enfermedades de las plantas en los últimos años (Buzi et al., 2004). EL ASM actúa como un análogo funcional del ácido salicílico en la vía de señalización de la SAR, influencia la expresión de genes y la actividad de varias enzimas relacionadas con la resistencia, así como la producción de lignina y compuestos fenólicos (Malolepsza, 2006). Se ha reportado reducción de la marchitez con la aplicación de ASM contra P. capsici en chile pimiento (Matheron y Porchas, 2002 ), contra P.cactorum y P. fragariae var fragariae en fresa (Eikemo et al., 2003) y contra P. capsici en calabaza (Koné et al., 2009). Similarmente, el pre-tratamiento de plántulas de Curcuma longa induce SAR contra Pythium aphanidermatum (Radhakrishnan et al., 2011). Sin embargo, el efecto del ASM contra P. capsici en chile de otras variedades no ha sido bien documentado.
Las plantas pueden cambiar su nivel de resistencia a enfermedades conforme avanza la edad de la planta o la madurez de los tejidos (Develey-Riviere y Galiana, 2007). Estos cambios en resistencia son cada vez más reconocidos como un componente importante de defensa de la planta frente a la infección (Whallen, 2005) y pueden tener implicaciones importantes en la definición de estrategias adecuadas de control. La severidad del daño por P. capsici puede variar con la edad de las plántulas (Kim et al., 1989). En cucurbitáceas, frutos de edades avanzadas mostraron una reducción gradual de la susceptibilidad a P. capsici con respecto a frutos jóvenes (Ando et al., 2009). Similarmente, frutos de chile (C. annuum L.) tuvieron menos infección conforme avanzaron en su proceso de maduración (Biles et al., 1993).
El manejo conjunto de inductores de resistencia y la variación en la edad de las plántulas al trasplante son dos elementos más en el manejo de la marchitez del chile por P. capsici que podrían contribuir a reducir la cantidad de fungicidas empleados en la producción de este cultivo. En el presente trabajo se evaluó si la aplicación regular de ASM a plantas de diferentes edades al trasplante puede ser utilizada como una estrategia de reducción de la severidad de la marchitez en dos cultivares de chile serrano.
Materiales y Métodos
Establecimiento de los experimentos. Se sembraron cada 15 días semillas de chile (C. annuum) del cv. híbrido Camino Real (Harris Moran) y de un cultivar criollo de Tetela de Ocampo, Estado de Puebla, México, en vasos de poliuretano de 125 ml con peat moss (PREMIER) más perlita (AGROLITA), esterilizados y en proporción 3:1. Plántulas de 45, 30 y 15 d fueron trasplantadas a macetas de poliuretano con 1 L de suelo de la región productora de chile de la Vega de Metztitlán, Hidalgo, México (VMH), donde la marchitez es un problema grave. Como tratamientos se definió un arreglo factorial de los factores: 1) cultivar (Camino Real y criollo de Tetela de Ocampo), 2) edad de las plántulas (trasplantadas a 45, 30 y 15 d después de la siembra), 3) inductor de resistencia (con o sin aplicación de ASM) y 4) inoculación con P. capsici (Cepa 1, Cepa 2 y un testigo no inoculado). De esta forma se tuvo un total de 36 combinaciones (2 x 3 x 2 x 3) a evaluar. El experimento fue establecido en condiciones de invernadero, bajo un diseño completamente al azar con diez repeticiones y se realizó dos veces.
En los tratamientos correspondientes se aplicó semanalmente al follaje 1 mg de ASM/planta a plántulas de las tres edades, iniciando una semana antes del trasplante y hasta el término del experimento (51 d después del trasplante). Como fuente de ASM se utilizó el producto Actigard (r) 50 (Syngenta). La inoculación de P. capsici se realizó a los 45 d después del trasplante. Las cepas utilizadas fueron aisladas de plantas de chile serrano de la VMH y probadas previamente como patogénicas en los cultivares arriba mencionados. Antes de la inoculación se aplicó un riego con agua destilada a todas las plantas. Cada plántula fue inoculada con 1 mL de una suspensión de 105 zoosporas/mL. La suspensión fue inyectada al pie del tallo a una profundidad de 2 cm. Después de la inoculación, se regó hasta saturar el suelo de cada maceta. Los testigos no inoculados fueron tratados con agua destilada estéril. Las condiciones diarias de temperatura en el invernadero variaron de 12 a 35 °C.
Variables evaluadas. A partir del trasplante, se evaluó cada tercer día la severidad de la marchitez, la altura de planta y el número de hojas. Al final del experimento se evaluó el peso seco de la parte aérea. La severidad fue evaluada con base en la escala de Morán et al. (2010). Con estos resultados se calculó el área bajo la curva del progreso de la severidad (ABCPS) mediante el método de integración trapezoidal (Shaner y Finney, 1977). Para la estimación del peso seco de planta, el material vegetal fue colocado en bolsas de papel con perforaciones y secado en una estufa de aire forzado a 70 °C, durante 72 h. Al final del experimento se colectaron segmentos de raíces y se incubaron a temperatura ambiente (24 °C) en medio PARPH (Kannwischer y Mitchell, 1978) y en cajas de Petri con agua destilada estéril para verificar la aparición de micelio cenocítico con esporangios típicos de P. capsici.
Análisis de datos. Los datos obtenidos se analizaron estadísticamente mediante técnicas de análisis de varianza y la prueba de rango múltiple de Tukey (Steel y Torrie, 1980). La información fue procesada mediante el paquete para análisis estadístico SAS (Statistical Análisis System, v. 9.3 Cary, North Carolina).
Resultados
En el Cuadro 1 se presenta un resumen de los resultados del análisis de varianza de las principales variables evaluadas en el presente trabajo. En las Figuras 1 a 7 se reportan resultados para las interacciones significativas de mayor orden.
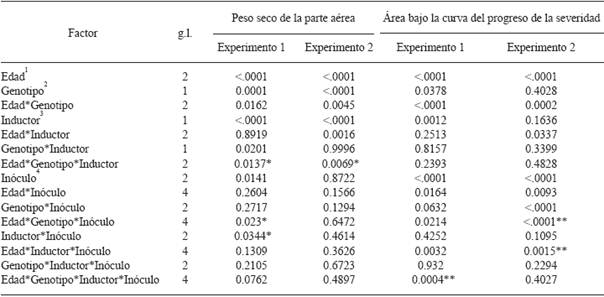
1Trasplante a 45, 30 y 15 días después de la siembra. 2cv Camino Real (Harris Moran), cv criollo de Tetela de Ocampo, Puebla. 3Con acibenzolar S-metil, sin Inductor de resistencia. 4Testigo no Inoculado, Cepa1 y Cepa 2 de Phytophthora capsici. ** Interacción utilizada para la comparación de medias y preparación de gráficas.
Cuadro 1 Resumen del análisis de varianza (P > F) de variables evaluadas en plantas de chile serrano (Capsicum annuum L.).
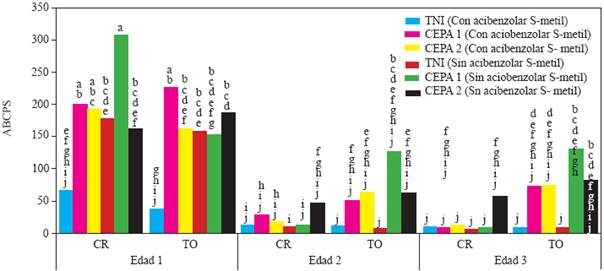
Figura 1 Experimento 1. Efecto de interacción Edad de la planta X Genotipo X Inductor de Resistencia X Inoculación con Phytophthora capsici sobre el área bajo la curva del progreso de la severidad de la marchitez del chile (Capsicum annuum L.) cultivado en suelo no esterilizado de la Vega de Metztitlán Hidalgo (VMH). Las cepas del oomiceto fueron aisladas de plantas de chile serrano de la VMH. La inoculación de realizó con 105 zoosporas por planta a los 45 días después del trasplante. Promedios de diez repeticiones. Las medias con la misma letra son estadísticamente iguales (Tukey α=0.5). Edad 1, 2 y 3=trasplante a 45, 30 y 15 días después de la siembra. CR = cv Camino Real (Harris Moran). TO=cv criollo de Tetela de Ocampo, Puebla. TNI=testigo no inoculado con P. capsici, suelo no esterilizado.
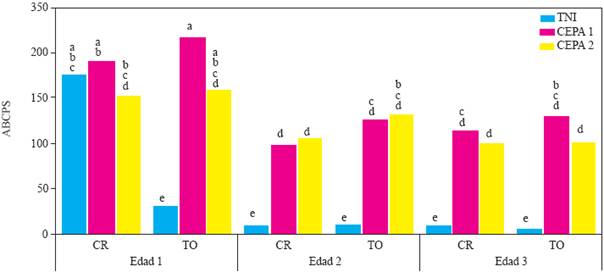
Figura 2 Experimento 2. Efecto de interacción Edad de la planta X Genotipo X Inoculación con Phytophthora capsici sobre el área bajo la curva del progreso de la severidad de la marchitez del chile serrano (Capsicum annuum L.) cultivado en suelo no esterilizado de la Vega de Metztitlán Hidalgo (VMH). Las cepas del oomiceto fueron aisladas de plantas de chile serrano de la VMH. La inoculación de realizó con 105 zoosporas por planta a los 45 días después del trasplante. Medias de veinte repeticiones. Las medias con la misma letra son estadísticamente iguales (Tukey α=0.5). Edad 1,2 y 3 = trasplante a 45, 30 y 15 días después de la siembra. CR = cv Camino Real (Harris Moran). TO = cv criollo de Tetela de Ocampo, Puebla. TNI = Testigo no inoculado con P. capsici, suelo no esterilizado.
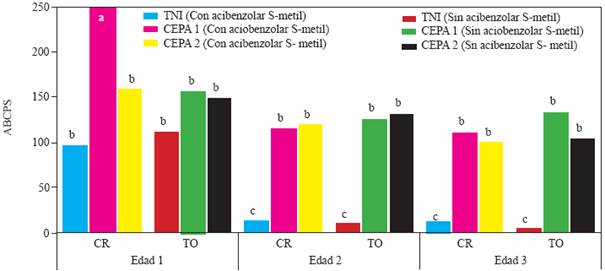
Figura 3 Experimento 2. Efecto de interacción Edad de la planta X Inductor de Resistencia X Inoculación con Phytophthora capsici sobre el área bajo la curva del progreso de la severidad de la marchitez del chile serrano (Capsicum annuum L.) cultivados en suelo no esterilizado de la Vega de Metztitlán Hidalgo (VMH). Las cepas del oomiceto fueron aisladas de plantas de chile serrano de la VMH. La inoculación de realizó con 105 zoosporas por planta a los 45 días después del trasplante. Medias de veinte repeticiones. Las medias con la misma letra son estadísticamente iguales (Tukey α = 0.5). Edad 1,2 y 3 = trasplante a 45, 30 y 15 días después de la siembra. CI = con acibenzolar S-metil. SI = sin inductor de resistencia. TNI = testigo no inoculado con P. capsici, suelo no esterilizado.
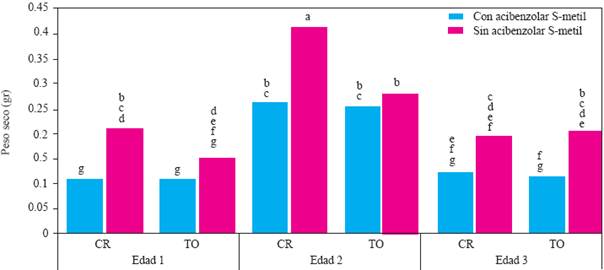
Figura 4 Experimento 1. Efecto de interacción Edad de la planta X Genotipo X Inductor de Resistencia sobre el peso seco de la parte aérea de plantas de chile (Capsicum annuum L.) cultivadas en suelo no esterilizado de la Vega de Metztitlán Hidalgo (VMH). Promedios de 30 repeticiones. Las medias con la misma letra son estadísticamente iguales (Tukey α = 0.5). Edad 1, 2 y 3 = trasplante a 45, 30 y 15 días después de la siembra. CR = cv Camino Real (Harris Moran). TO = cv criollo de Tetela de Ocampo, Puebla. CI = con acibenzolar S-metil. SI = sin inductor de resistencia.

Figura 5 Experimento 1. Efecto de interacción Edad de la planta X Genotipo X Inoculación con Phytophthora capsici sobre el peso seco de la parte aérea de plantas de chile (Capsicum annuum L.) cultivadas en suelo no esterilizado de la Vega de Metztitlán Hidalgo (VMH). Las cepas del oomiceto fueron aisladas de plantas de chile serrano de la VMH. La inoculación de realizó con 105 zoosporas por planta a los 45 días después del trasplante. Promedios de 20 repeticiones. Las medias con la misma letra son estadísticamente iguales (Tukey α = 0.5). Edad 1, 2 y 3 = trasplante a 45, 30 y 15 días después de la siembra. CR = cv Camino Real (Harris Moran). TO = cv criollo de Tétela de Ocampo, Puebla. TNI = testigo no inoculado con P. capsici, suelo no esterilizado.
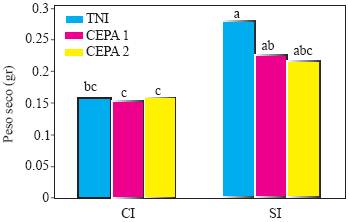
Figura 6 Experimento 1. Efecto de interacción de Inductor de Resistencia X Inoculación con Phytophthora capsici sobre el peso seco de la parte aérea de plantas de chile (Capsicum annuum L.) cultivadas en suelo no esterilizado de la Vega de Metztitlán Hidalgo (VMH). Las cepas del oomiceto fueron aisladas de plantas de chile serrano de la VMH. La inoculación de realizó con 105 zoosporas por planta a los 45 días después del trasplante. Promedios de 60 repeticiones. Las medias con la misma letra son estadísticamente iguales (Tukey α = 0.5.TNI = testigo no inoculado con P. capsici, suelo no esterilizado. CI = con acibenzolar S-metil. SI = sin inductor de resistencia.
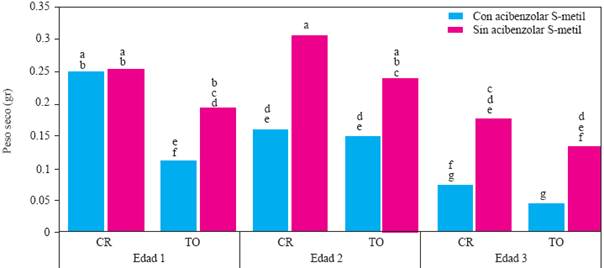
Figura 7 Experimento 2. Efecto de interacción Edad de la planta X Genotipo X Inductor de Resistencia sobre el peso seco de la parte aérea de plantas de chile (Capsicum annuum L.) cultivadas en suelo no esterilizado de la Vega de Metztitlán Hidalgo (VMH). Promedios de 30 repeticiones. Las medias con la misma letra son estadísticamente iguales (Tukey α=0.5). Edad 1, 2 y 3 = trasplante a 45, 30 y 15 días después de la siembra. CR = cv Camino Real (Harris Moran). TO=cv criollo de Tetela de Ocampo, Puebla. CI = con acibenzolar S-metil. SI = sin inductor de resistencia.
Área bajo la curva del progreso de la severidad (ABCPS). En el experimento 1, el análisis de varianza indicó efectos altamente significativos de la interacción edad X cultivar X inductor X inoculación (P<0.0004). Este resultado indica que, en general, las plantas de la edad 1 (trasplantadas a 45 d después de la siembra) tuvieron un ABCPS más alto que en las edades 2 y 3 (trasplantadas a 30 y 15 d) (Figura 1). En la edad 1, la inoculación con P. capsici produjo una mayor ABCPS que en los testigos no inoculados, con ASM, particularmente cuando las plantas fueron infectadas con la cepa 1 (Figura 1). Cuando no se aplicó ASM las diferencias entre tratamientos con y sin inoculación sólo fueron significativas cuando se aplicó la cepa 1 en el cultivar Camino Real. Con excepción de este tratamiento, el patrón de respuesta entre cultivares en esa edad resultó similar. En las edades 2 y 3, el ABCPS, aunque fue más alto en los tratamientos inoculados, las diferencias con respecto al testigo sólo resultaron significativas en plantas del cultivar criollo Tetela de Ocampo inoculadas con la cepa 1, sin ASM.
La aplicación de ASM redujo el ABCPS pero no en todos los casos. En la edad 1, las plantas del cv Camino Real, inoculadas con la cepa 1 de P. capsici y las plantas testigo no inoculadas, tratadas con ASM, tuvieron menor ABCPS que las no tratadas con este inductor. Sin embargo las plantas inoculadas con la cepa 2 no tuvieron reducción en el ABCPS por efecto del ASM y el valor de esta variable resultó significativamente más alto que el testigo no inoculado, con ASM. Las plantas de la edad 2 y 3, con y sin ASM, tuvieron un ABCPS y estadísticamente igual.
En el experimento 2, el análisis de varianza indicó efectos altamente significativos de la interacciones edad X genotipo X inoculación (P<0.0001) y edad X inductor X inoculación (P<0.0015). En la primera interacción no se detectaron diferencias en el ABCPS debidas a las diferentes edades, excepto cuando las plantas de la edad 1 fueron inoculadas con la cepa 1 (Figura 2), donde se observó la ABCPS más alta. El resto de diferencias se debió principalmente a la inoculación con P. capsici, independientemente de la cepa, quien causó mayor ABCPS que en los testigos (Figuras 2 y 3 ), con excepción de las plantas no inoculadas de la edad 1, cv Camino Real, que resultaron estadísticamente iguales.
Al analizar la interacción edad X inductor X inoculación (Figura 3) se observa que no hubo reducción significativa del ABCPS con la aplicación de ASM, independientemente de la edad. Además, contra lo que se esperaba, las plantas de la edad 1 inoculadas con la Cepa 1 y tratadas con ASM tuvieron mayor ABCPS que el testigo no inoculado y tratado con ASM.
Formación de micelio y esporangios de P. capsici a partir raíces de chile. Al final de los experimentos se obtuvo crecimiento micelial en medio PARPH en plantas de todas las edades inoculadas con ambas cepas de P. capsici, pero la mayor cantidad de segmentos donde creció micelio ocurrió en plantas inoculadas a 45 d después de la siembra (edad 1). La frecuencia de casos en las edades 2 y 3 fue considerablemente menor. El ASM tendió a reducir el número de casos con formación de micelio en la edad 1 pero no inhibió la infección (datos no mostrados). La formación de esporangios en agua, a partir de segmentos de raíz de chile inoculadas con P. capsici, sólo ocurrió en plantas de la edad 1 en ambos experimentos, pero en plantas de las edades 2 y 3 no se detectaron estas estructuras reproductivas en ningún tratamiento.
Peso seco de la parte aérea, número de hojas y altura de planta. En el experimento 1, el análisis de varianza indicó efectos significativos sobre el peso seco de la parte aérea (PSPA) de las interacciones edad X genotipo X inductor (P=0.0137), edad X genotipo X inóculo (P = 0.023) e inductor X inóculo (P = 0.0344). La primera interacción indica que el ASM redujo el PSPA en todas las edades y cultivares, pero sólo en las plantas del cv Camino Real, edades 1 y 2 y en el cv Tetela de Ocampo, edad 3, las diferencias entre plantas tratadas y no tratadas con ASM, resultaron significativas (Figura 4).
En el caso de la interacción edad X genotipo X inoculación, los resultados indican que el PSPA del cv Camino Real, edad 2, con o sin inoculación con P. capsici, fue mayor que el de todos los tratamientos de las edades 1 y 3 (Figura 5). En el cv Tetela de Ocampo, edad 2, los resultados fueron estadísticamente iguales a los del cv Camino Real, pero, particularmente en las plantas inoculadas con la cepa 1, que mostró una reducción en el PSPA, las diferencias con el resto de tratamientos no resultaron significativas de acuerdo a la prueba de Tukey, no obstante el alto número de repeticiones involucradas y el hecho de que hubo reducciones de peso relativamente drásticas. Cabe también señalar que en la mayoría de los casos el PSPA de los testigos en cada edad y cultivar fue numéricamente más alto que en las plantas inoculadas con el patógeno. Los resultados de la interacción inductor de resistencia X inoculación indican que las plantas con ASM tuvieron valores más bajos que las no tratadas y que el valor más alto correspondió al testigo no inoculado y sin ASM (Figura 6). Las diferencias dentro del grupo de plantas sin ASM no resultaron significativas. El testigo no inoculado, sin ASM, tuvo un PSPA significativamente más alto que el de las plantas con ASM, con o sin inoculación con P. capsici. A su vez, el PSPA de las plantas sin ASM, inoculadas con la cepa 1 de P. capsici, resultó mayor que el de las plantas inoculadas, tratadas con ASM.
En el experimento 2, el análisis de varianza sólo indicó efecto significativo de la interacción edad X genotipo X inductor (P = 0.0069) sobre el peso seco de la parte aérea (PSPA). Este resultado indica que la aplicación de ASM causó una reducción significativa en el PSPA de las plantas de todos los genotipos y edades, con excepción del cv. Camino Real, edad 1 (Figura 7). El PSPA del cv. Camino Real, edad 2, sin ASM, tuvo el valor más alto, pero fue estadísticamente igual al de las plantas del mismo cultivar, edad 1, con o sin ASM, y que las del cultivar Tetela de Ocampo, edad 2, sin ASM. El PSPA en plantas de la edad 3, con ASM, fue significativamente más bajo en las plantas tratadas con este inductor de resistencia, independientemente del cultivar.
Los resultados del análisis de varianza del número de hojas y del área bajo la curva del progreso de la altura de planta mostraron tendencias similares a las descritas para el PSPA, con una reducción significativa en el valor de estas variables por efecto de la aplicación de ASM y una tendencia a mayor desarrollo en plantas de la edad 2, con efectos negativos de la inoculación con P. capsici con respecto a los testigos no inoculados (datos no mostrados).
Discusión
En el presente trabajo el ASM causó una reducción en el ABCPS de la marchitez del chile pero el efecto no fue consistente contra las dos cepas evaluadas. El factor edad de la planta por su parte determinó cambios importantes en la expresión de enfermedad.
El ASM tendió a ser más eficaz en la reducción de la severidad de la marchitez del chile en plantas de las edades 2 y 3, pero no inhibió completamente la expresión de síntomas. Esto concuerda con otros investigadores que han reportado reducción de la enfermedad con la aplicación de ASM contra P. capsici en chile pimiento (Matheron y Porchas, 2002) y en calabaza (Koné et al., 2009). En este trabajo, el ASM se aplicó semanalmente a partir de una semana antes de inoculación, pero causó una reducción en el peso seco, número de hojas y altura de las plantas de todas las edades. Ramos (2013) también observó una disminución en el desarrollo y crecimiento de plantas de (Physalis peruviana) a concentraciones de ASM mayores de 10 mg/L. Mejía et al. (2009) a dosis de 25 mg/L observaron también resultados similares en el cultivo del tomate de árbol (Solanum betaceum). Por su parte, Nair et al. (2007) reportaron que dosis de 25 mg/L retardaron el crecimiento de plantas de Amaranto (Amaranthus spp.). La activación de la resistencia sistémica adquirida mediante el uso del ASM puede conducir a un costo energético adicional, produciendo plantas y productos de menor tamaño y peso (Van Wees et al., 2000; Romero et al., 2001). Sin embargo, el efecto de la aplicación de inductores puede depender del tiempo de activación de las señales, de la cepa del hongo, del inductor empleado y de la persistencia de las mismas sobre las plantas (Perazzolli et al., 2008). Resulta entonces necesario realizar ensayos adicionales para optimizar el tiempo y dosis de aplicación de ASM. Por otra parte, se ha reportado que la combinación de inductores de resistencia sistémica inducida (RSI) con microorganismos que propician la resistencia sistémica adquirida (RSA) da como resultado una mayor coordinación entre las rutas metabólicas implicadas (Abo-Elyousr et al., 2009), aunque se ha reportado que la activación de una ruta inhibe la otra. Este tipo de combinaciones no ha sido evaluado en chile, por lo que sería recomendable probar la acción conjunta de inductores de RSI y RSA, así como la aplicación subsecuente de fungicidas.
Factores asociados a los cambios bioquímicos y fisiológicos en diferentes edades de las plántulas evaluadas pudieron determinar variaciones en la susceptibilidad a la enfermedad (Kim et al., 1989; Gevens et al., 2006; Juvany et al., 2013). Para efectos prácticos, el uso de plántulas de 30 días de edad, con una dosis optimizada de ASM podría coadyuvar a una menor daño por P. capsici, particularmente si se toma en cuenta que los niveles naturales de infección en el suelo usado este trabajo fueron considerablemente menores que los obtenidos con la inoculación de un alto número de zoosporas por planta. Es necesario, sin embargo, evaluar este comportamiento bajo condiciones de campo, ya que factores ambientales y de manejo bajo esas condiciones, no son fácilmente reproducibles en invernadero.
Conclusiones
La aplicación de ASM redujo el ABCPS de la marchitez del chile serrano pero también causó, en la mayoría de los casos, una reducción en la acumulación de materia seca en la parte aérea de plantas de los cultivares Camino Real (Harris Moran) y criollo de Tetela de Ocampo, Puebla.
Plantas de chile de 30 d de edad después de la siembra tuvieron mayor tolerancia a la marchitez y mayor desarrollo que plantas de 45 d o de 15 d, independientemente de si fueron inoculadas con P. capsici a los 45 d después del trasplante a suelo.











 texto em
texto em 


