La piña (Ananas comosus L. Merril) es nativa de las regiones tropicales y subtropicales de América del Sur,pertenece a la familia de las bromeliáceas, del orden Bromeliales y a la especie Ananas comosus.
Según estimaciones de la Organización para la Alimentación y la Agricultura (FAO), se calcula que para 2014 la producción mundial de frutas tropicales llegará a 82 millones de toneladas; el 78 % corresponde a las "frutas principales" (mango, piña, aguacate y papaya) y el 22 % a las "frutas secundarias" (litchi, rambután, guayaba y maracuyá). Los países en desarrollo representan alrededor del 98 % de la producción total, mientras que los países desarrollados representan el 80 % del comercio mundial de importaciones (FAOSTAT, 2013).
La producción de piña es de importancia económica para las zonas tropicales y subtropicales del mundo, es el segundo fruto tropical producido después del mango. Los principales productores de piña se encuentran en Asia-Pacifico (Tailandia, India, Filipinas, China, Vietnam y Malasia) con el 47 % de la producción mundial. En América Latina los principales productores son Brasil y Costa Rica, ocupando el segundo y tercer lugar a nivel mundial respectivamente; México ocupa el décimo lugar. En el año2012 la superficie total cultivada con piña fue de aproximadamente 17 mil ha, con una producción total aproximada de 760 mil t, siendo los principales productores los estados de Veracruz, Oaxaca, Nayarit y Tabasco (FAOSTAT, 2013; SIAP, 2013).
El cultivar más sembrado en México es'Cayena Lisa' con 80% de la superficie total sembrada (Rebolledo et al. 2006); en las últimas dos décadas "Del Monte" y "Dole", las dos principales empresas productoras de piña en el mundo liberaron un nuevo cultivar, el híbrido MD2 ('Piña miel'), originado en Hawai. El cultivar MD2 genera frutos con pulpa más amarilla, más dulce y con menor acidez que otros cultivares, posee de 15 a 17° de sólidos solubles totales, mientras que 'Cayena Lisa' tiene de 12 a 15° ; también cuenta con un mayor contenido de vitamina A y C, además de que el fruto adquiere una forma más cilíndrica y no con forma de botella, lo que facilita su manejo en su industrialización (FAOSTAT, 2013; Williams and Fleisch, 1992; Rebolledo et al.,1998; Rebolledo et al., 2011; Fold and Gough, 2008; Chan et al., 2002; Morgan and Thompson, 2000).
El principal problema que enfrenta el cultivar MD2 en las zonas productoras de Veracruz es la pudrición del cogollo. Coppens et al. (1997) han reportado que esta enfermedad ha causado graves pérdidas económicas en Australia, Hawái, Filipinas, Sudáfrica y Tailandia. Rebolledo et al. (2011) mencionan que es causado por Erwinia chrysanthemi y Espinosa and Adam (1972), aluden esta enfermedad a Phytophthora nicotianae. El objetivo del presente estudio fue identificar al agente causal de la pudrición del cogollo de la piña para la localidad de Isla, Veracruz, México.
Materiales y métodos
Sitio de estudio y muestreo. El área de estudio se localizó en localidad en la Isla, Veracruz, México a 18° 8' N y 95° 35' O, 60 msnm de altitud, con clima cálido-húmedo, temperatura promedio de 24.9 ºC y precipitación pluvial media anual de 2316 mm. De Septiembre de 2011 a Marzo de 2012 se recolectaron 40 plantas con síntomas característicos de pudrición del cogollo y se procesaron en el Laboratorio de enfermedades de frutos en postcosecha del Colegio de Postgraduados, Campus Montecillo, Texcoco, Estado de México.
Aislamiento. Las plantas de piña enfermas se lavaron bajo el chorro de agua potable para eliminar exceso de tierra. En hojas basales, se cortaron trozos de 5 mm2 entre tejido sano y enfermo, se desinfestó por inmersión en una solución de hipoclorito de sodio 3 % durante 4 min, con 4 enjuagues con agua destilada estéril y se secaron con toallas de papel absorbente estéril. Un total de 600 fragmentos se sembraron en tres medios de cultivo: papa- dextrosa- agar (PDA), agar- nutritivo, V8- agar (pimaricina 10 µg/L, ampicilina 292 µg/L, rifampicina 10 µg/L, pentacloronitrobenceno 0.10 g/L e himexazol 0.25 µg/L), con un total de 150 cajas sembradas. Todas las cajas de Petri se incubaron a 28 °C en luz blanca como lo recomiendan Jeffers and Martin,1986 y Erwin and Ribeiro, 1996. Se realizó la purificación de aislamientos por punta de hifa, una vez purificadas se transfirieron a cajas de Petri con medio de cultivo V8- agar (acidificado con ácido láctico al 25 %) para su caracterización.
Por otra parte, se cortaron 20 hojas basales de las plantas enfermas con pudrición, se desinfestaron como lo descrito para hojas basales, se colocaron en agua destilada estéril a 28 °C en luz blanca. Después del segundo día se observó crecimiento de micelio color blanquecino y de cada hoja se transfirió segmento de micelio en medio de cultivo jugo de verduras V8- acidificado.
Preparación del inóculo. A partir de aislamientos de Phytophthora en medio de cultivo PDA, se tomaron fragmentos que se colocaron en agua destilada estéril para formación de esporangios y liberación de zooporas. Con la cámara de Neubahuer se preparó una suspensión de zoosporas a una concentración de de 108 zoosporas ml-1 (Rodríguez et al., 2002).
Pruebas de patogenicidad. Se realizaron pruebas de patogenicidad in vitro en 60 coronas y 80 vástagos in vivo, ambos materiales se secaron a la luz solar durante 5 días y se desinfestaron con hipoclorito de sodio 3 % por 4 min y se enjuagaron 4 veces con agua destilada estéril. En las 60 coronas se realizaron 4 lesiones con aguja en el tallo medio de la corona, 30 de las coronas se colocaron en recipiente con 300 ml de la suspensión de esporas, 30 coronas se utilizaron como testigos y solamente se le adicionó agua destilada estéril sin zoosporas. El tratamiento se colocó en luz blanca a 28 °C hasta la aparición de síntomas. Para las pruebas in vivo se utilizaron vástagos de 5 meses de edad sembrados en bolsas de polietileno en una mezcla de tierra y tezontle (3:2 v/v). En 40 vástagos se removió la tierra 8 cm alrededor del cogollo, se les hicieron cuatro lesiones con una aguja esterilizada en el tallo medio y se agregaron 300 ml del inóculo junto con fragmentos de micelio con esporangios y se cubrió de nuevo con la tierra removida, a los 40 testigos se realizó la misma técnica, pero solo se utilizó agua destilada estéril. A las plantas se les colocó otra bolsa de polietileno hasta la aparición de síntomas. En ambos tratamientos el tejido dañado se sembró en medio de cultivo V8- agar acidificado.
Caracterización morfológica. Se caracterizó en base a crecimiento micelial, pigmentación y formación de estructuras de reproducción de la colonia creciendo en PDA y bajo luz blanca continua a 28 °C. La identificación del género se hizo con las claves de Erwin and Ribeiro (1996), y para especie con las descritas por Gallegly and Hong (2008).
Identificación molecular. La extracción del ADN se hizo a partir de un cultivo de 6 dias de crecimiento en medio líquido V8 a 28 °C, utilizando el protocolo de CTAB (Doyle and Doyle, 1990). El espacio transcrito interno del ADN ribosomal se amplificó utilizando los iniciadores ITS6 e ITS4 (White et al., 1990). Las secuencias obtenidas se compararon con la base de datos del Banco de Genes del centro NCBI (2012), USA (http://www.ncbi.nlm.nih.gov).
Resultados
Aislamiento de microorganismos. En los diferentes medios se observó que en el medio de cultivo V8 - agar con antibiótico, se aisló con mayor frecuencia a Phytophthora sp. y en menor frecuencia en agar-nutritivo y PDA. En medio de cultivo agar nutritivo y PDA se aisló con mayor frecuencia a Pythium, los porcentajes se muestran en el Cuadro 1.
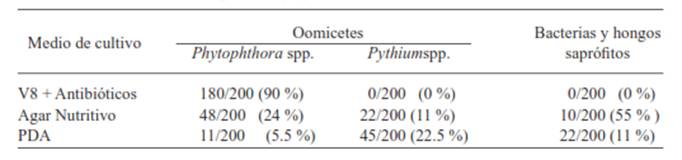
Cuadro 1 Porcentaje de microorganismos aislados de plantas de piña (Ananascomosus L. Merril) cultivar MD-2 con signos y síntomas de pudrición del cogollo. Isla, Veracruz, México, Verano del 2011.
De las 20 hojas colocadas en frascos con agua destilada estéril, a los 2 días se observó el crecimiento de micelio (Figura 1) y en los fragmentos sembrados en PDA y V8-agar acidificado se desarrollaron colonias características de Phytophthora sp.

Figura 1 A) y B) Micelio de Phytophthora sp. desarrollado a dos días en agua destilada estéril, en hojas basales de piña colectadas en campo
Pruebas de patogenicidad. En las pruebas in vitro, los síntomas mostraron un color verde pálido, puntas de hojas necrosadas a los 7-9 dias. Además se observó hojas centrales podridas y en el centro de la roseta había una coloración café tenue y micelio de Phytophthora (Figura 2), el 100 % de las coronas inoculadas se enfermaron. Los testigos no presentaron síntomas ni signos y desarrollaron un sistema radical abundante. A partir del tejido necrosado, se realizaron nuevamente aislamientos en medio V8-Agar acidificado de donde se aisló a Phytophthora nicotianae. Para las pruebas in vivo los síntomas y signos tardaron 16 días en manifestarse, iniciando con un cambio en la coloración de las hojas a verde más claro, las puntas de estas se necrosaron alrededor del cogollo. A los 20 días la pudrición del cogollo era evidente, el centro de la roseta mostró una coloración café y micelio, la base de las hojas centrales con olor putrefacto; 38 (95 %) de las 40 plantas inoculadas mostraron síntomas de la enfermedad. Los testigos no presentaron síntomas ni signos de la enfermedad. De las hojas necrosadas se hicieron aislamientos en medio V8-agar acidificado, donde se corroboró la presencia de Phytophthora nicotianae.

Figura 2 Síntomas y signos de la pudrición del cogollo de la piña. A) Pruebas in vitro de la pudrición del cogollo de la piña. B) Signos y síntomas en coronas inoculadas. C) Pudrición del cogollo. D) Hoja de corona con pudrición. E) Corona de piña 9 ddi. F) Signos del oomiceto en plantas inoculadas. G) Signos y síntomas en plantas inoculadas en invernadero. H) Cogollo podrido de la planta de piña. I) Cogollo y raíz de planta testigo de prueba in vivo. J) Cogollo y raíz de planta inoculada. K) Planta de piña 16 ddi.
Caracterización morfológica. En medio de cultivo V8-agar se desarrollo crecimiento micelial hialino, esporangios no caducos, esféricos a limoniformes con una papila prominente, el tamaño promedio de 100 esporangios fue de 44.6×36.8 µm; se presentaron clamidosporas esféricas, no papiladas, hialinas terminales e intercalares de 30.2 µm (promedio de 100 clamidosporas) (Figura 3). La formación de esporangios en agua destilada estéril se presentó a las 48 hs. en exposición continua bajo luz blanca. Las características coinciden con las reportadas por Erwin and Ribeiro(1996) y Gallegly and Hong (2008) para Phytophthora nicotianae.
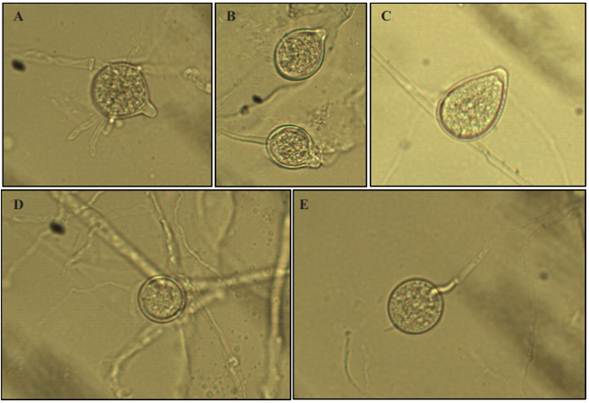
Figura 3 Estructuras asexuales de Phytophthoranicotianae. A) Esporangio esférico. B) Esporangio limoniforme. C) Esporangio ovoide. D) Clamidospora intercalar. E) Clamidospora terminal.
Identificación molecular. El producto de amplificación que se obtuvo con los iniciadores ITS4 e ITS6 fue de 850 bp (Fig 3). La comparación de la secuencia de nucleótidos del aislamiento mostró 100% de similitud con la secuencia de Phytophthora nicotianae.
Discusión
Los resultados de pudrición del cogollo in vivo e in vitro similares a los observados en los campos de cultivo de Isla, Veracruz, que inician con lesiones acuosas en la base de las hojas (tejido sin clorofila) y el cogollo, las hojas se tornan a un verde más claro, las puntas de estas se necrosan y desarrollan un olor fétido característico es causado por Phytophthora nicotianae y coincide con lo descrito por Espinosa y Adam (1972) en México y por Joy y Sindhu (2012) en la India respectivamente. Estos síntomas probablemente se deban a la obstrucción física del sistema vascular causado por el crecimiento de hifas y a la penetración de otros organismos secundarios (hongos y bacterias), aumentando la formación de gomas que se originan por la oxidación y acumulación de los residuos de la degradación celular, como sucede en plantas ornamentales (Arévalo-Galarza, 2012; Agrios, 2005). Posterior a la inoculación y a la formación de zoosporas, éstas son atraídas a la zona de elongación y diferenciación de la raíz, en donde forman quistes, e inclusive invaden a las raíces secundarias y no a las puntas(Galiana et al., 2005; Attard et al., 2010).La mayor incidencia de pudrición del cogollo de la piña en el área de muestreo se observó en la temporada de lluvia, con temperaturas que oscilan entre 24 - 26 °C y una humedad relativa del 90 -100 %; la alta humedad relativa induce el desarrollo de las enfermedades causadas por Phytophthora sp. en el cultivo de piña (Duniway, 1983).
Adicionalmente al sembrar en áreas con pendiente, labores culturales (fertilización, control de malezas, remoción del suelo, etc.) y lesiones causadas por otros organismos (nematodos y roedores) al sistema radical, facilitan la dispersión y el riesgo de infección por Phytophthora sp. como lo mencionan Erwin y Ribeiro, 1996, Elliott, 1989 Jung y Blaschke, 2004y ; Galiana et al., 2005.











 texto en
texto en 


