La capacidad de las bacterias para desarrollar resistencia antibacteriana, ha motivado la investigación de nuevos y más potentes antibióticos (Dax, 1997; Demain y Sánchez, 2009). Los metabolitos secundarios fúngicos son una fuente importante de compuestos bioactivos útiles en la agricultura y la medicina, ya que comprenden una amplia gama estructural (Nigam y Singh et al., 2000). Entre los hongos, aquellos que viven en estrecha asociación con otros organismos, suelen ser los que producen metabolitos con mayor bioactividad, ya que los altos niveles de estrés ambiental y las interacciones intensas y frecuentes con otros organismos promueven mayor diversidad metabólica (Dreyfuss y Chapela, 1994). Ejemplo de ello, son los hongos fitopatógenos, causantes de enfermedades antes, durante, después de la cosecha y almacenamiento de los vegetales (García, 2004; Trigos et al., 2008) los cuales constituyen el grupo de microorganismos más importante desde el punto de vista económico en cuanto a su frecuencia de aparición y daño que puedan causar en diferentes cultivos agrícolas (Agrios, 2005).
En México, es prácticamente nula la investigación relacionada con el potencial biomédico de los hongos fitopatógenos; por ello, investigaciones anteriores de nuestro grupo de trabajo han demostrado la capacidad de algunas especies de hongos fitopatógenos para inhibir el crecimiento de cepas bacterianas de interés médico y fitopatógenas (Trigos et al., 2005 y 2006). De igual forma, Espinoza et al., (2008) demostraron que compuestos y extractos crudos de Idriella sp. presentaron actividad antibacteriana en contra de bacterias fitopatógenas. Cabe mencionar que los géneros Gliocadium, Geotrichum y Rhizopus considerados como saprófitos y que fueron utilizados en este estudio, de igual forma están asociados como agentes causales del decaimiento y muerte de la palma real (Sepúlveda, 1998), pudrición ácida del limón (Hernández-Montiel et al., 2011) y pudrición poscosecha del jitomate (Zhao et al., 2008) respectivamente. Adicionalmente, el género Idriella ha sido reportado como causante de la pudrición de raíz en cultivos de fresa siendo la especie I. lunata el agente causal de dicha enfermedad (Nelson y Stephen, 1956). Por lo anterior, el objetivo de este trabajo fue evaluar la actividad antibacteriana de extractos metanol:cloroformo del cultivo de 15 hongos fitopatógenos en contra de cepas bacterianas de interés clínico.
Materiales y métodos
Hongos fitopatógenos. Las cepas fúngicas utilizadas en este estudio (Cuadro 1) fueron obtenidas del cepario del Laboratorio de Alta Tecnología de Xalapa (LATEX) y provenían de diferentes cultivos de interés económico del estado de Veracruz, México. Su identificación ha sido soportada mediante claves taxonómicas (Romero-Cova, 1988; Mendoza-Zamora, 1996; Barnett y Hunter, 1998) y para el género Colletotrichum se realizaron pruebas de patogenicidad (Márquez-Fernández et al., 2013). De igual forma, se utilizó una cepa de I. lunata ATCC 12574, ya que dicha especie mostró actividades antibacterianas según lo reportado por Espinoza et al., (2008). La resiembra de cada uno de los hongos se realizó en cajas Petri con medio de cultivo papa dextrosa agar (PDA, Difco), el periodo de incubación varió para cada especie y osciló entre los 7 y 12 días a 25 ± 2 °C hasta que el micelio cubrió el 75 % de la superficie del medio de cultivo.
Cuadro 1 Cepas de hongos fitopatógenos.
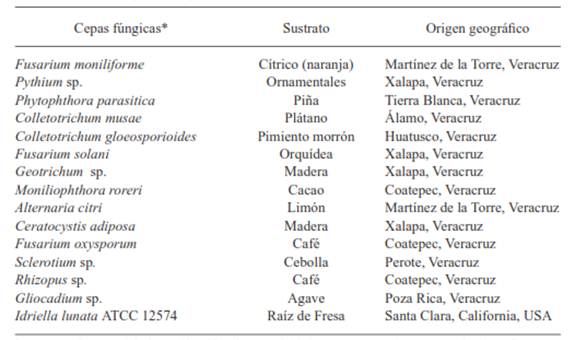
Las cepas fueron aisladas e identificadas morfológicamente por claves taxonómicas (Romero-Cova, 1988; Mendoza-Zamora, 1996; Barnett y Hunter, 1998) y por pruebas de patogenicidad para el género Colletotrichum (Márquez-Fernández et al., 2013).
Cepas bacterianas. Las cepas bacterianas utilizadas fueron: Staphylococcus aureus β-hemolítico (ATCC 25923), Streptococcus pneumoniae (ATCC 6303), Staphylococcus epidermis coagulasa (+) (ATCC 14990), Escherichia coli (ATCC 25922) y Pseudomonas aeruginosa (ATCC 17933) ( American Type Culture Collection, 2010).
Cultivo fúngico y extracción. Para el cultivo líquido de los hongos fitopatógenos, se tomaron círculos de 1 cm de diámetro de cada una de las cepas fúngicas de un cultivo de 7 días de incubación, y se transfirieron asépticamente a matraces Erlenmeyer de 250 mL con 50 mL de caldo de papa y dextrosa, donde se incubaron a 25 ± 2 °C por 15 días manteniéndose en agitación constante a 150 rpm. Una vez concluido el periodo de incubación, se filtró al vacío la biomasa producida para cada cepa fúngica, posteriormente se deshidrató mediante liofilización y se extrajo con una mezcla metanol: cloroformo (1:1) durante 3 días, el exceso de disolvente se eliminó por destilación a presión reducida (Trigos et al., 2011).
Evaluación de actividad antibacteriana de extractos de hongos fitopatógenos en contra de cepas bacterianas de interés clínico. La actividad antibacteriana se evaluó siguiendo el método de difusión en agar en disco de Kirby-Bauer (Koneman et al., 2004). Los tratamientos se llevaron a cabo en cajas Petri con agar Luria-Bertani las cuales fueron inoculadas con cada una de las cepas bacterianas en estudio, con una suspensión celular cuya turbidez se igualó con la del tubo 0.5 de la escala de McFarland, equivalente a 1.5x108 UFC/mL (Clinical and Laboratory Standards Institute, 2007). Por otro lado, los extractos fúngicos secos, se disolvieron en dimetilsulfóxido (DMSO, Sigma Chemical Co.) a una concentración de 1 mg/mL, a partir de esta solución se realizaron diluciones seriadas para obtener las diferentes concentraciones de extracto que se utilizaron en el ensayo (20, 50 y 70 µg/mL). Posteriormente, sobre las cajas Petri se colocaron discos de papel filtro (6 mm de diámetro) impregnados con 20 μL de cada uno de las diferentes concentraciones de los extractos de hongos fitopatógenos. Discos impregnados con DMSO sirvieron como control negativo y discos comerciales con 25 μg de ampicilina como control positivo. Finalmente, las cajas Petri se incubaron a 35 ± 2 ºC durante 24 h. El diámetro de los halos de inhibición se midió en mm. Los tratamientos se realizaron con tres repeticiones para cada concentración del extracto de cada uno de los hongos fitopatógenos frente a cada una de las cepas bacterianas probadas.
Análisis estadístico. Los datos obtenidos se analizaron con una ANOVA de Dunnett, (P<0.0001) para detectar diferencias entre los halos de inhibición obtenidos por los extractos en comparación al control negativo.
Resultados y Discusión
El análisis estadístico de los halos de inhibición obtenidos mostró que los extractos de Colletotrichum musae y C. gloeosporioides resultaron activos inhibiendo el crecimiento de Escherichia coli de manera significativa a las concentraciones de 20, 50 y 70 µg/mL (P<0.0001), en relación al control negativo. Por otro lado, también se registraron diferencias significativas en los halos de inhibición provocados por el extracto de Idriella lunata sobre el crecimiento de Staphylococcus aureus β-hemolítico, E. coli y Pseudomonas aeruginosa en concentraciones de 50 y 70 µg/mL (P<0.0001) en relación al control negativo utilizado (Cuadro 2). Los resultados obtenidos muestran que los extractos de C. gloeosporioides y C. musae son selectivos para E. coli, lo que podría ser útil en el tratamiento de aguas residuales domesticas utilizadas principalmente en la agricultura, especialmente en lugares donde este recurso hídrico escasea (Pedrero et al., 2010). Adicionalmente, el extracto de Idriella lunata mostró actividad contra bacterias tanto Gram (-) como Gram (+).
Cuadro 2 Diámetros de halos de inhibición bacteriana a partir de extractos fúngicos.
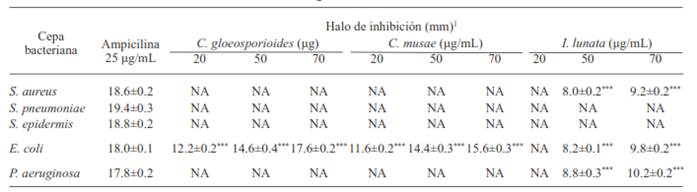
1Promedio de tres repeticiones ± el error estándar de la media (ESM). *** indican diferencias estadísticas significativas con respecto al control negativo (Dunnett, p<0.0001). NA. No activo
Al tratarse de extractos crudos y no de un compuesto químico puro, las concentraciones activas son alentadoras ya que demuestran una actividad altamente efectiva, que además son similares a resultados anteriores que han demostrado la actividad antimicrobiana de otras especies de hongos fitopatógenos como Menisporopsis theobromae e Idriella sp, en contra de E. coli, S. aureus, P. aeruginosa, Erwinia carotovora, E. carotovora pv. atroseptica y Agrobacterium tumefaciens (Trigos et al., 2005). Adicionalmente, Curvularia lunata, Phytophthora drechsleri, Phytophthora capsici, Gliocadium spp, Neocosmospora vasinfecta resultaron activas contra bacterias como E. coli y P. aeruginosa (Trigos et al., 2006). De igual forma, Espinoza et al. (2008), demostraron que el 5-hidroximetil-2-furaldehido y el 1-n-Butil-β-D-fructopiránosido obtenidos del cultivo de Idriella sp mostraron actividades antibacterianas en contra de bacterias fitopatógenas Xanthomonas axonopodis, Pectobacterium carotovorum, P. chrysanthemi y Erwinia amylovora con una Concentración Mínima Inhibitoria (CMI) de 0.625 mg/mL.
Conclusiones
Si bien los hongos fitopatógenos siguen siendo la causa de la disminución parcial y total del rendimiento de los cultivos y como consecuencia elevadas pérdidas económicas; los resultados obtenidos colocan a las cepas de Colletotrichum musae, C. gloeosporioides e Idriella lunata, por su actividad antibacteriana, como fuentes potenciales de compuestos bioactivos contra cepas bacterianas de interés médico causantes de infecciones comunes en nuestro país. Por lo anterior, este trabajo abre la posibilidad de continuar explorando el aprovecha miento de los hongos fitopatógenos en aplicaciones médicas, previos estudios químicos, farmacológicos, toxicológicos y clínicos.











 texto en
texto en 


