México cuenta con diferentes especies de cactáceas que tienen importancia alimenticia, ecológica y cultural. De las cactáceas comestibles destacan los nopales (Opuntia spp.) los cuales se producen como cladodios jovenes para consumo humano, siendo O. ficus-indica (L.) Miller la especie más importante. Actualmente, México es el primer productor y consumidor de nopal verdura en el mundo. En el 2009, el país contaba con 13,123.91 ha (SIAP-SAGARPA, 2013), siendo la zona centro la principal región productora y consumidora. En Cuautepec de Hinojosa, Hidalgo, en donde se cultiva la variedad Atlixco-Puebla, se detectaron plantas con manchas anulares de color amarillo a blanquecino localizadas alrededor de las areolas. Cladodios con síntomas más severos presentaron coloración amarillenta generalizada, adelgazamiento y eventual marchitez. Los cladodios que se cortan para la venta se oscurecen progresivamente y en 24 h pueden mostrar una coloración cobriza que demerita su comercialización. En México, Venezuela y Estados Unidos de Norteamérica se reportan en algunas cactáceas al Cactus virus X (Lastra et al., 1976), Saguaro cactus virus (Nelson y Tremaine, 1975), Sammons'Opuntia virus (Milbrath y Nelson, 1972), Cactus virus 2 (Brandes and Wetter, 1959), Zygocactus virus (Fauquet et al., 2005) y al Tobacco mosaic virus (Giri y Chessin, 1975). En Cuautepec de Hinojosa, los síntomas que se manifiestan en los cladodios de nopal verdura ocasionan pérdidas económicas al productor, lo que justifica la importancia de generar conocimiento acerca de la etiología de esta enfermedad. Con base en lo anterior, los objetivos del presente trabajo fueron determinar el agente causal de las manchas cloróticas del nopal verdura en Cuautepec de Hinojosa, Hidalgo, y estimar la incidencia y severidad en plantaciones comerciales de esta localidad.
Se examinaron tres unidades de producción de nopal verdura de 102 x 46 m cada una, ubicadas en Puerta de Yolo en Cuautepec de Hinojosa, Hidalgo. Las plantas estaban sembradas en surcos a 35 cm entre plantas y a 60 cm entre hileras, y se fertilizaron con estiércol vacuno. El productor incluyó podas intensas en el manejo de plantación y cosecha. En otoño 2009, se recolectaron 50 cladodios jóvenes de 50 plantas de nopal localizadas en estas unidades; 25 tenían halos cloróticos alrededor de las areolas (Figura 1A) y el resto fueron asintomáticos. Las muestras se trasladaron al invernadero y laboratorio de Virus Fitopatógenos del Colegio de Postgraduados. Para descartar la presencia de hongos y bacterias fitopatógenas, los cladodios sintomáticos se observaron directamente en un microscopio estereoscópico y se disectaron en fragmentos de 1 cm2 que se sembraron en PDA y B de King. Para cada medio se sembraron 40 fragmentos de cladodio distribuidos en cuatro cajas Petri. Este análisis se repitió dos veces, y al obtener resultados negativos para estos microorganismos se hizo la extracción de ARN bicatenario (ARNbc) para determinar la presencia de un posible virus. La extracción se hizo independientemente a partir del tejido epidérmico de cuatro cladodios sintomáticos y de cuatro asintomáticos (testigo), siguiendo el protocolo de Dodds et al., (1987).

Figura 1 Cladodios de nopal verdura en campo con manchas anulares cloróticas alrededor de las aereolas o entre ellas (A). Síntomas en plantas indicadoras inoculadas con la savia de cladodios de nopal verdura con manchas anulares cloróticas (B). Lesiones locales necróticas en Nicotiana tabacum var. Xanthi (B1). Lesiones locales cloróticas en Chenopodium quinoa (B2). Lesiones locales cloróticas en N. benthamiana (B3).
La purificación parcial del posible virus se hizo de acuerdo con el protocolo propuesto por Lastra et al., (1976). Además, el purificado parcial y el macerado de la epidermis que cubría los halos cloróticos de cladodios enfermos se colocaron independientemente en rejillas de cobre de malla 400 con formvar, se contrastaron con acetato de uranilo al 2 % y se observaron en un microscopio electrónico de transmisión JEOL modelos JEM-1200 EXII y JEM-100 CX II de la Central de Instrumentación de Microscopía de la Escuela Nacional de Ciencias Biológicas del IPN y de la Facultad de Estudios Superiores Unidad Iztacala de la UNAM, respectivamente.
La transmisión del posible virus se hizo mediante inoculación mecánica en tres grupos de 11 plantas indicadoras cada uno (Nicotiana tabacum cv. Xanthi, N. rustica, N. glutinosa, N. occidentalis, N. benthamiana, N. clevelandii, Capsicum annuum, Chenopodium quinoa, Ch. amaranticolor, Datura stramonium y Solanum lycopersicum). Como fuente de inóculo se utilizó la epidermis de cladodios sintomáticos recolectados en Cuautepec de Hinojosa. Las plantas se mantuvieron en invernadero a 25-30 °C con humedad relativa del 70±5 % y 12 horas-luz, y se revisaron durante 15 días para registrar la aparición de síntomas. La transmisión mecánica a plantas de nopal se hizo también mecánicamente en siete cladodios asintomáticos de plantas diferentes. Como fuente de inóculo se utilizó la epidermis de cladodios sintomáticos, la cual se maceró en amortiguador de fosfatos + DIECA 0.01M pH 7.2. Se espolvoreó carborundum de 600 mallas sobre una superficie aproximada de 5 cm2 en la porción superior del cladodio, y con un hisopo se tomó el inóculo y se frotó sobre dicha superficie. Como testigo negativo se inocularon siete plantas asintomáticas con un hisopo humedecido en el amortiguador antes indicado. Todas las plantas se mantuvieron en invernadero durante 45 días y se observaron cada 72 h para registrar la aparición de síntomas. Las plantas utilizadas en esta fase se obtuvieron en Tlalnepantla, Morelos, región en donde no se han observado síntomas virales, a fin de tener condiciones naturales de crecimiento.
La extracción de ARN se hizo de la epidermis de cladodios sintomáticos y asintomáticos con el producto comercial Trizol(c) siguiendo las instrucciones del fabricante, y con el método de sílica. La RT-PCR se hizo con iniciadores para el Tobacco mosaic virus (TMV), Carnation mottle virus (CarMV) y para los géneros Potexvirus y Tobamovirus. Para el TMV la RT-PCR se realizó en un solo paso con los iniciadores específicos TMVCPF y TMVCPR (Ortega et al., 2007) que amplifican un fragmento de 240 pb. El fragmento de la cubierta proteica del CarMV (1.05 kb) se amplificó con los iniciadores CarMV y CarMV/F (Singh et al., 2005). Para el género Potexvirus (Van der Vlugt et al., 2000) se utilizaron los iniciadores POTEX1RC, POTEX2RC y POTEX5RC. Las combinaciones POTEX1RC / POTEX5RC y POTEX2RC / POTEX5RC amplifican un fragmento de 735 y 584 pb, respectivamente, correspondientes a la replicasa viral. Para algún miembro del género Tobamovirus se utilizaron los iniciadores TMV5vAccl / TMV3vc y TMVcp5 / TMVcp3, que amplifican un fragmento de 360-419, y 300 pb, respectivamente. Para cada par de iniciadores se realizó la RT-PCR en un solo paso.
Para evaluar la distribución de la incidencia de síntomas en las unidades de producción, se determinó el número de plantas con manchas cloróticas irregulares o circulares, y la presencia de anillos cloróticos alrededor de las areolas. La primera unidad se dividió en tres secciones de cinco surcos cada una (localizadas a la entrada, parte media y final del invernadero, respectivamente) para evaluar 50 plantas/surco/sección (250 plantas en total). En cada una de las otras dos unidades se evaluaron 20 plantas continuas en cinco surcos (100 plantas en total). La severidad de la enfermedad se estimó cuantificando el número de cladodios sintomáticos con respecto al número de cladodios totales por planta, considerando que los daños inducidos son de tipo sistémico, y bajo el supuesto de que mayor número de cladodios enfermos implicó mayor periodo de infección. Los datos obtenidos se analizaron con Surfer(r) ver. 8.0 para generar mapas de dispersión de severidad por interpolación geoestadística.
Los cladodios de nopal verdura con síntomas asociados a virus presentaron manchas anulares alrededor y entre las areolas (Figura 1A), y a 48 horas después de haberlos recolectado se tornaron acuosos y de color marrón. El análisis fitosanitario general de los cladodios sintomáticos no mostró signos de bacterias ni hongos fitopatógenos, pero se aisló ARN bicatenario, lo que indicó la presencia de un virus con ARN genómico. En algunos miembros de la familia Cactaceae están reportados el Cactus virus X, Zygocactus virus, Cactus virus 2, Saguaro cactus virus, Sammon´s Opuntia virus y el Tobacco mosaic virus, cuyo genoma es también de ARN. Sin embargo, todos estos virus se descartan como posibles inductores de los síntomas observados debido a que los síntomas que se expresaron en el rango de plantas hospedantes (Cuadro 1), y la forma y tamaño de las partículas virales (Figura 2, Cuadro 2) no concuerdan con lo que hasta ahora está reportado en la literatura (De la Torre et al., 2007; Hausbeck y Gildow, 1991; Lastra et al., 1976; Nelson y Tremaine 1975).
Cuadro 1 Síntomas en plantas indicadoras inoculadas con el virus aislado de cladodios de nopal verdura con manchas anulares cloróticas. Cuautepec de Hinojosa, Hidalgo.
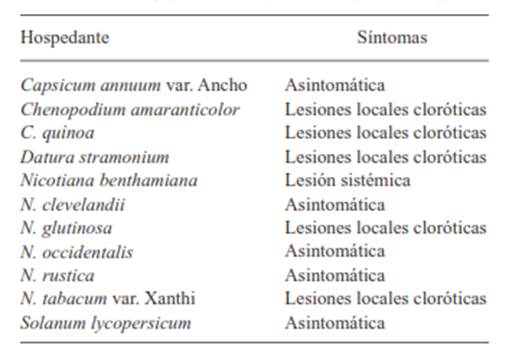
Figura 2 Partículas virales presentes en el purificado parcial obtenido de cladodios de nopal verdura con síntomas putativos a virus (A). Bandas de RNA bicatenario obtenidas a partir de plantas de nopal verdura (B). Carril 1: marcador molecular de 1Kb; carril 2: cladodios asintomáticos; carril 3: cladodios con manchas anulares cloróticas alrededor de las areolas. Productos de amplificación de RT-PCR para el género Potexvirus (C). Carril 1: marcador molecular de 1 Kb (Plus Invitrogen); carriles 2-6 y 8-12: cladodios de nopal verdura con manchas anulares cloróticas; carril 13: tejido foliar de orquídea infectada con un Potexvirus; carril 14: testigo negativo; carril 7: sin muestra. Manchas anulares cloróticas en brotes de cladodios inoculados con savia infectiva a los 7 (D1), 14 (D2) y 25 (D3) días después de la inoculación.

Cuadro 2 Tipo y tamaño de partícula viral en el purificado parcial obtenido de cladodios de nopal verdura con manchas anulares cloróticas. Cuautepec de Hinojosa, Hidalgo.
En la epidermis de cladodios sintomáticos se observaron partículas virales en forma de varilla flexible, y en el purificado parcial varillas fragmentadas de tipo rígido (Figura 2A). Estas partículas tuvieron un tamaño promedio de 112 x 24 nm, el cual difiere de lo reportado por Fauquet et al. (2005) y De la Torre et al. (2007) (Cuadro 2), por lo que se descartó que las fracciones rígidas en nopal verdura correspondieran a alguna especie de Tobamovirus, género que se encontró en nopal tunero (De la Torre et al., 2007). Las varillas flexibles en los cladodios de nopal no correspondieron a las del Cactus virus X, Zygocactus virus (familia Alphaflexiviridae) ni al Cactus virus 2 (Familia Betaflexiviridae), ya que su tamaño es mayor al de las partículas observadas.
La transmisión mecánica del agente causal ocurrió en tres de los siete cladodios inoculados. Ningún cladodio testigo mostró síntomas. A los siete días después de la inoculación (ddi), se presentaron los primeros síntomas en todos los brotes emitidos de los cladodios inoculados. Los síntomas fueron anillos y halos cloróticos localizados principalmente en la parte media de los brotes (Figura 2D). A los 14 ddi, la clorosis fue más evidente e incrementaron el número y tamaño de halos cloróticos (1-1.5cm), principalmente rodeando las areolas (Figura 2D). A los 25 ddi, los halos se convirtieron en manchas cloróticas circulares (1.5-2cm) e irregulares debido a su coalescencia (Figura 2D). Estos síntomas contrastan con los reportados por De la Torre et al. (2007), quienes observaron manchas cloróticas de 0.5-1cm distribuidas uniformemente fuera de la zona areolar en los cladodios de nopal tunero (O. amyclaea). De los virus reportados en cactáceas, únicamente en la asociación Cactus virus X - Nopalea cochenillifera (Lastra et al., 1976), se presentan síntomas similares a los observados en el presente trabajo. En cactáceas silvestres este virus induce manchas anulares amarillas simples o concéntricas de 2-4 cm entorno a las areolas. Con base en la identificación por RT-PCR, los cladodios sintomáticos estuvieron infectados con alguna especie del género Potexvirus (Figura 2D). Este resultado es congruente con el análisis en microscopía electrónica de transmisión, en donde se observaron partículas virales flexibles, por lo que los síntomas asociados a cladodios de nopal verdura podrían corresponder a alguna especie del género Potexvirus, a excepción del Cactus virus X y Zygocactus virus, cuyas partículas son más grandes que las del virus aislado de los cladodios de nopal verdura; además, los síntomas inducidos por Zygocactus virus en C. quinoa son distintos a los encontrados en el presente trabajo.
La incidencia de plantas enfermas y la severidad promedio fue de 47-60 y 51-79 %, respectivamente, lo que sugiere una infección crónica y la transmisibilidad vegetativa del agente causal. En Taiwán, el Cactus virus X causó en pithaya (Hylocereus undatus) una incidencia de 90, 50 y 60-70 % en Pingtung, Kinman y en otras áreas, respectivamente (Liao et al., 2003). El patrón de distribución espacial de plantas enfermas fue agregado con direccionalidad de los surcos (Figura 3). Los agregados fueron de 2-5 plantas implicando posible diseminación por medio de poda y cosecha, las cuales se realizan con cuchillo sin desinfestar. Esta posibilidad se reafirma con resultados de la transmisión mecánica (43 %), por lo que el manejo de este virus debe ser preventivo mediante uso de material propagativo sano y con desinfestación de herramientas. Debido a que el altiplano mexicano es la principal región productora de nopal verdura, es necesario determinar la especie encontrada del género Potexvirus y conducir estudios epidemiológicos y de manejo.
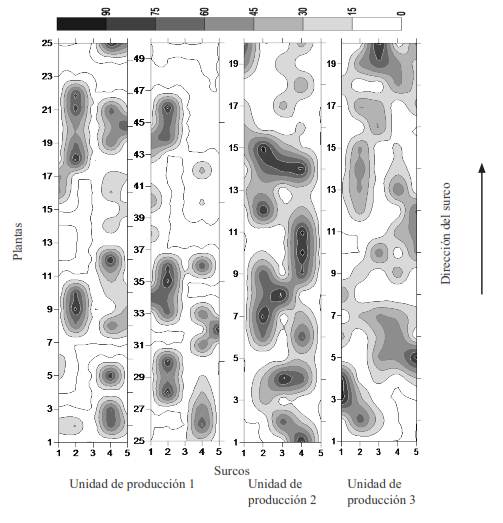
Figura 3 Mapa de distribución espacial de la severidad de la enfermedad asociada a manchas cloróticas en nopal verdura en Cuautepec de Hinojosa, Hidalgo.
Conclusiones
En este trabajo se reporta un nuevo virus afectando a la familia Cactaceae en México. Los síntomas de halos y manchas cloróticas irregulares y circulares presentes en O. ficus-indica se relacionaron con un virus de ARN de cadena sencilla con partícula de tipo varilla flexible. Con base en la RT-PCR, se confirmó que el virus pertenece al género Potexvirus. La incidencia de la enfermedad fue del 47-60 %, con distribución agregada y fuerte tendencia en dirección de surcos posiblemente por efecto del manejo y cosecha.
Agradecimientos
A la M.C. Ma. Esther Sánchez Espíndola, de la Central de Instrumentación de Microscopía de la ENCB-IPN, por su apoyo en la observación y fotografías al microscopio electrónico de transmisión (MET). Al técnico Jesús Espinoza de la FES-Iztacala UNAM, por las fotografías en el MET. Al Sr. Fermín Cerón Téllez, por permitir hacer este estudio en las unidades productivas de nopal verdura. Al CONACyT, por proporcionar la beca de postgrado.











 texto en
texto en 


