Lasiodiplodia theobromae (Pat.) Griffon and Maubl. es la especie tipo del género Lasiodiplodia es un hongo que fue descrito por primera vez alrededor de 1890 por Saccardo, afectando frutos de cacao (Theobromae cacao) en Ecuador (Crous y Palm, 1999). Este hongo es cosmopolita y tiene un amplio rango de hospederos, incluidos monocotiledóneas, dicotiledóneas y gimnospermas, especialmente de los trópicos y subtrópicos. Es un hongo pleomórfico y ubicuo, por lo cual ha tenido más de un sinónimo (Abdollahzadeh et al., 2010; Wang et al., 2011).
Las enfermedades ocasionadas por este patógeno incluyen muerte descendente, cáncer, gomosis, tizón de la hoja, pudrición de raíz en plantas maderables y cultivos (Pitt y Hocking, 2009; Shahbaz et al., 2009). L. theobromae es saprófito pero se le considera un patógeno latente, encontrándose como endófito en tejidos sanos de la planta, convirtiéndose en patógeno cuando el hospedero está debilitado o estresado (Rubini et al., 2005; Mohali et al., 2005); también se ha reportado como un patógeno oportunista de humanos causando infecciones subcutáneas, oculares y de órganos internos (Rebell y Forster, 1976; Maslen et al., 1996; Summerbell et al., 2004; Woo et al., 2008). A nivel mundial existen registros de L. theobromae afectando cultivos frutales de mango (Jonhson, 1992), aguacate (Pegg et al., 2003), papaya (Queiroz et al., 1997), plátano (Alves et al., 2008), rambután (Sivakumar et al., 1997), litchi (Liu et al., 2005), uva (van Niekerk et al., 2004), guanábana (Lutchmeah, 1988), anacardo (Cardoso et al., 2002), cítricos, duraznos (Damn et al., 2007) y longan (Serrato-Díaz et al., 2014) entre otros, causando pérdidas económicas en las distintas etapas de la producción.
En años recientes se ha establecido su relación filogenética con especies crípticas a través del análisis de ADN en fragmentos de las regiones espaciadoras intergénicas (ITS) y el factor de elongación 1 alfa (EF-1α), lo que ha permitido resultados más claros de su ubicación en relación a especies similares o cercanamente relacionadas (Pavlic et al., 2004; Alves et al., 2008; Abdollahzadeh et al., 2010).
La etiología de la enfermedad es crucial para estudios epidemiológicos y para una mejor comprensión de la distribución e importancia de este hongo, así como para establecer estrategias y tratamientos de control efectivo. El objetivo de este escrito es describir el estatus de L. theobromae afectando distintos cultivos frutales y maderables en México así como la compilación de los resultados publicados de los cultivos afectados enfocándose en aspectos de biología, patogenicidad, epidemiología y estrategias de control de este hongo en nuestro país.
Taxonomía
El hongo Lasiodiplodia theobromae se clasifica dentro de los Ascomicetos en el orden Botryosphaeriales y en la familia Botryosphaeriaceae (Schoch et al., 2006; Slippers et al., 2013); presenta un estado sexual (teleomorfo), poco común Botryosphaeria rhodina. Sin embargo no existen descripciones recientes de su estado sexual, por lo cual se ha reportado que éste se encuentra perdido (Phillips et al., 2008). El estado sexual de este hongo necesita clarificarse, los resultados que se tienen hasta ahora han sido inconclusos dado que no se han encontrado subsecuentes reportes que confirmen esta conexión (Alves et al., 2008).
L. theobromae tuvo como sinónimo a Diplodia theobromae (Alvarez, 1976; Denman et al. 2000). En años recientes estudios filogenéticos, basados en las regiones ITS, realizados por Zhou y Stanosz (2001), Slippers et al. (2004) y Phillips et al. (2008) muestran que los clados de estos dos géneros están separados entre sí. Además, morfológicamente los dos géneros son claramente distintos. Por ejemplo, las estrías de los conidios están presentes solo en Lasiodiplodia de igual manera la forma sexual, se ha reportado solamente en L. theobromae. Por lo anterior, no hay razón para considerar a estos dos géneros como sinónimos (Phillips et al., 2013).
Por mucho tiempo se consideró a Botryodiplodia theobromae Pat. (1892) como el basinomio de L. theobromae, el cual fue descrito en la planta Theobroma cacao en Ecuador; sin embargo, Crous y Palm (1999) examinaron el tipo original conservado en Pennsylvania y encontraron un ascomiceto valsoide por lo que el nombre de Botryodiplodia (Sacc.) Sacc. se considera nomen dubium (nombre incierto). Por otro lado, no se ha encontrado el holotipo de L. theobromae en herbario alguno (Pavlic et al., 2004) con lo que se presume que se perdió con el tiempo. Hecho por el cual, Phillips et al. (2013) designaron un neotipo aislado de un fruto indefinido del arrecife de coral de la costa este en Papua Nueva Guinea, lejos de la localidad del holotipo y del substrato original (planta de cacao), considerando este neotipo como una cepa de referencia para L. theobromae.
En relación a su teleomorfo, a través del tiempo la taxonomía superior del género Botryosphaeria (estado sexual de Lasiodiplodia theobromae) ha tenido diferentes modificaciones. Slippers et al. (2013) indica que en un inicio el género fue asignado a la familia Melogrammataceae, dentro del orden Sphaeriales; posteriormente, fue situado en la familia Pseudosphaeriaceae que agrupaba taxones con un solo lóculo y ascostramata multiascal, dentro del orden Dothideales, posteriormente se creó la subfamilia Botryosphaerieae y fue colocado en ésta, pero no se le ubicó dentro de un orden. Un año después, se le designó en el orden Myriangiales, posteriormente se creó la subclase Dothideineae dentro del nuevo orden Pseudosphaeriales y la nueva familia Botryosphaeriaceae. Una de las razones principales de esta reorganización en la clasificación de Botryosphaeria fue la confusión respecto a la ontogenia y morfología de verdaderos peritecios, ascostromata y tejido intersticial (Denman et al., 2000; Slippers et al., 2013).
En los últimos años, debido principalmente a la disponibilidad de herramientas moleculares basadas en el ADN recombinante, ha surgido una taxonomía más sólida para este grupo de hongos. Hasta hace una década la posición del género en la clasificación más alta de los ascomicetes no había sido resuelta (Denman et al., 2000). Estudios filogenéticos señalan la posición de la familia Botryosphaeriaceae en la clase Dothiodeomycetes, situándola dentro de Botryosphaeriales, un nuevo orden e independiente de los órdenes Pleosporales y Dothideales (Crous et al., 2006). Actualmente se reconocen 6 familias dentro de este orden: Botryosphaeriaceae (con 17 géneros), Phyllostictaceae (Phyllosticta), Planistromellaceae (Kellermania), Aplosporellaceae (Aplosporella, Bagnisiella), Melanopsaceae (Melanops) y Saccharataceae (Saccharata) (Slippers et al., 2013).
Los análisis basados en la secuenciación de ADN han originado cambios significantes en la nomenclatura, identificación y circunscripción de especies en Botryosphaeriaceae. Estos cambios son resultados de la implementación de una sola nomenclatura para todas las formas (sexual y asexual) de una especie (Hawksworth et al., 2011), incluyendo la descripción de especies crípticas basadas en la secuencias de ADN donde los caracteres morfológicos no son suficientes para este propósito (Pavlic et al., 2009; Sakalidis et al., 2011). Estudios contemporáneos de la familia Botryosphaeriaceae apoyan esta moción, basándose en que las características morfológicas usadas típicamente para la clasificación de especies (forma del conidio o ascosporas y sus dimensiones, septación y pigmentación) son frecuentemente poco fiables. También los datos ecológicos y geográficos son difíciles de interpretar cuando algunas especies tienen varios huéspedes, y un huésped tiene distintas especies (Slippers et al., 2009). Por esta razón la mayoría, si no es que todos, los taxa incluyen la secuencia de ADN y su inferencia filogenética para redefinir estas clasificaciones (Slippers et al., 2013). Por ejemplo, Liu et al. (2012) se basaron en la amplificación y secuenciación de distintas regiones del genoma usando los oligonucleótidos NS1 y NS4, LROR y LR5, ITS4 e ITS5 , EF2-728 F/ EF2-968F y Bt2a y Bt2b (Que amplifican la región de la subunidad pequeña del gen ribosomal nuclear, un segmento de la subunidad grande del gen RNA ribosomal, las regiones espaciadoras intergénicas del rDNA, un segmento del factor de elongación 1-alfa y un segmento del gen de β-tubulina, respectivamente) con el objetivo de reordenar a la familia Botryosphaeriaceae aceptando 29 géneros y 1485 especies, aclarando que faltan especies no descritas aún y algunos complejos de especies. También se reordenó el género Macrovalsaria en esta familia, el cual es monotípico, es decir con una sola especie M. megalospora, la cual se encuentra solamente en estado sexual y esta genéticamente cercana a Lasiodiplodia spp. Algunos consideran este género como el estado sexual de Lasiodiplodia spp. pero aún faltan estudios más profundos para confirmar esta proposición (Liu et al., 2012).
Cambios recientes en la taxonomía de hongos, según la nomenclatura de algas, hongos y plantas (Código Melbourne), establecen solo un nombre para cada especie de hongo, ya que durante más de 100 años el código permitió los nombres de la fase asexual y la sexual de una sola especie (Rico, 2011). El género Lasiodiplodia se considera válido y se encuentra en la lista pendiente de aprobación por el comité de nomenclatura de hongos, lo cual podría ocurrir en el próximo congreso internacional de botánica en China en el año 2017 (Kirk et al., 2013; Wijayawardene et al., 2014).
Biología
Fisiología y Morfología. La principal característica que distingue al género Lasiodiplodia de otros géneros cercanamente relacionados es la presencia de picnidios, paráfisis y estriaciones longitudinales en conidios maduros. Cerca de 20 especies han sido descritas en base a la morfología de conidios y paráfisis. Las descripciones más recientes de estas especies, aparte de la morfología, se basan en la secuenciación de las regiones espaciadoras intergénicas del rDNA (ITS) y factor de elongación 1 alfa (EF-1) (Damm et al., 2007; Netto et al., 2014).
La morfología de su ascocarpo es de color café oscuro a negro, agregado, con pared gruesa de color café oscuro y hialino en capas internas, de 250-400 µm de diámetro. El asca es bitunicada, estipitada, con 8 esporas, de 90-120 µm de longitud. Las ascosporas son biseriadas, hialinas, aseptadas de 30-35 x 11-14 µm. El conidiomata es estromático, simple o agregado, inmerso en el hospedero y una vez maduro emerge de éste, de color café oscuro, unilocular, de pared gruesa o delgada de color marrón, con frecuencia setoso, de hasta 5 mm de ancho, ostiolo central, único, papillado. Paráfisis hialinas, cilíndricas, tabicadas, ocasionalmente ramificadas con los extremos redondeado hasta 55 µm de largo y 3-4 µm de ancho (Phillips et al., 2013).
Los conidióforos son hialinos, simples, algunas veces septados, rara vez ramificados, cilíndricos. Las células conidiogénicas son hialinas, de pared gruesa, lisas, cilíndricas a sub-obpiriformes, holoblásticos, con una o dos anillaciones. Los conidios son subovoides a elipsoidales, con ápices ampliamente redondeados, que se estrechan para truncar la base, más ancha a mediados del tercio superior, de paredes gruesas, con contenido granular, en un principio hialino y aseptados, convirtiéndose a café oscuro una vez maduros, con 1 septo, presentan depósitos de melanina en la superficie interior de la pared dispuestos longitudinalmente dando una apariencia estriada con medidas de 21.5-31-5 x 13-17 µm y una proporción de 1.9 Largo/Ancho (Figura 1) (Pitt y Hocking, 2009; Phillips et al., 2013).

Figura 1 Estructuras de Lasiodiplodia theobromae en aislado proveniente de papaya. A) Micelio y picnidios en PDA a 14 días de crecimiento. B) Conidios maduros e inmaduros a 14 días de crecimiento.
Las colonias en medio de cultivo son moderadamente densas, con micelio aéreo, inicialmente blancas tornándose gris-olivo a los 7 días y con el tiempo adquieren un color negro. Las temperaturas de crecimiento para L. theobromae son 15 °C mínima, 28 °C como óptima y 40 °C como máxima (Slippers et al., 2004; Alves et al., 2008). La esporulación del hongo es favorecida por fotoperiodos de más de 16 horas de exposición de luz lo que permite la formación de picnidios; por el contrario, una exposición menor a 4 horas de luz diaria en un periodo de 23 días inhibe la esporulación del hongo (Perera y Lago, 1986). La presencia de nitrógeno en el medio de cultivo favorece la esporulación; Saha et al. (2008) evaluaron la concentración de nitrógeno en distintos medios de cultivo, encontrando que el agar de papa dextrosa (PDA) adicionado con extracto de raíz de té induce a un crecimiento rápido y mayor del micelio, además de una concentración de esporas superior al resto de los medio evaluados. Por muchos años, la fisiología de los aislamientos en la separación de especies del género Lasiodiplodia ha sido tema de controversia. Por ejemplo, Alves et al. (2008) distinguieron a L. parva y L. pseudotheobromae de L. theobromae basados en la habilidad de las dos primeras de producir un pigmento rosa en medio PDA a 35 °C; también reportaron que L. pseudotheobromae era la única que crecía a 10 °C. En contraste, Abdollahzadeh et al. (2010) encontraron que L. theobromae a 35 °C producía una fuerte pigmentación rosa en PDA, además de que las tres especies crecían a 10 °C. Entonces, las características fisiológicas tienen un valor limitado para determinar la separación de especies ya que existe una gran variabilidad en las características fisiológicas entre los aislamientos de una misma especie.
Estudios filogenéticos. Al considerar la similitud en diversas secuencias de ADN, distintos géneros se agruparían con Lasiodiplodia al grado de considerarlos sinónimos de éste. Phillips et al. (2013) consideran a Macrovalsaria en el grupo de este género. Esto también fue señalado por Liu et al. (2012), aunque no encontraron suficiente evidencia en las regiones LSU y SSU para realizar este cambio y establecerlo como un sinónimo.
Por otro lado, aunado a la presencia cosmopolita, el amplio número de huéspedes y la variabilidad morfológica de L. theobromae, existen varias especies crípticas. Por ejemplo, Pavlic et al. (2004) describieron a L. gonubiensis Pavlic, Slippers & Wingf en base a la morfología y dimensiones de sus conidios y en la secuenciación de las regiones ITS. Posteriormente, Burgess et al. (2006) describieron a L. crassispora, L. venezuelensis y L. rubropurpurea en base a las regiones ITS y EF1-α y a las características morfológicas. Otras especies que se consideran crípticas son L. parva y L. pseudotheobromae (Alves et al., 2008), las cuales están separadas por el tamaño y forma del conidio. En L. pseudotheobromae el conidio es más grande y elipsoidal que en L. theobromae. También, L. parva es fácilmente distinguible de las otras dos especies ya que sus conidios son más pequeños. Otra especie que se considera críptica es L. mahajangana, la cual es filogenéticamente cercana a L. theobromae pero morfológicamente distinta pues la primera tiene conidios relativamente más pequeños de 17.5-11.5 µm (Abdollahzadeh et al., 2010).
Los marcadores SSR se han usado recientemente para examinar genes y genotipos, modos reproductivos y especiación de un número de hongos, incluyendo Botryosphaeria spp. y sus anamorfos (Burgess et al., 2006; Mohali et al., 2005). Una investigación sugiere que existen barreras geográficas para el intercambio de genes entre L. theobromae, basándose en los marcadores SSR, con aislados de Venezuela, México y Sud África (Mohali et al. 2005). Shah et al. (2010) analizaron 30 aislados de L. theobromae del cultivo de pera en India, encontrando una alta diversidad genética entre los aislados provenientes de distintas zonas geográficas y poca diversidad genética entre los aislados de la misma zona geográfica.
Otros estudios de diversidad genética proponen que dos especies crípticas de Lasiodiplodia (L. theobromae y L. pseudotheobromae), no han sido encontradas y estudiadas en el mismo huésped por lo que no se ha podido establecer si en algún momento ocurrió alguna hibridación entre ambas (Begoude et al., 2010). Al-Sadi et al. (2013) encontraron un moderado nivel de diversidad genética en poblaciones de tres especies de Lasiodiplodia provenientes de distintos huéspedes y orígenes geográficos, y un alto número de genotipos (no especificados) de L. theobromae, L. hormozganensis y L. iraniensis en Omán UAE (Emiratos Árabes Unidos), también encontraron que L. hormozganensis difería mayormente con L. theobromae en cuanto a diversidad genética, sugiriendo que L. hormozganensis por mucho tiempo fue erróneamente identificada como L. theobromae, debido a que solo se disponía de identificación por caracteres morfológicos de especies y a que la primera es especie críptica de la segunda.
Patogenicidad y virulencia. La especie L. theobromae es más virulenta en comparación con otros géneros y especies de la familia Botryosphaericeae. Por ejemplo, Úrbez-Torres et al. (2008) encontraron que L. theobromae es más virulenta que Diplodia seriata en el cultivo de vid ya que ocasiono lesiones de mayor tamaño en los tallos inoculados. En frutos de mango L. theobromae mostró una virulencia media-alta en comparación con L. egyptiacae y L. pseudotheobromae (Ismail et al., 2012); en contraste, Marques et al. (2013) describió a L. theobromae con una virulencia media comparada con L. hormozganensis siendo ésta la más virulenta, ocasionando lesiones de 33.6 mm de diámetro en el fruto.
Umezurike (1979) menciona la actividad celulítica del hongo, el cual ataca a la planta de manera similar a un hongo de pudrición suave, usando el almidón y otros sacáridos presentes en el sustrato inicial de la madera antes de la degradación de celulosa y hemicelulosa, aunque no degrada la lignina.
Sintomatología y epidemiología. En la pudrición del fruto y del pedúnculo, la enfermedad está condicionada a alta temperatura y humedad relativa (Ploetz 2003). Las lesiones ocasionadas por L. theobromae en frutos de mango son inicialmente difusas, acuosas-hundidas dispersándose desde el pedúnculo en forma de proyecciones de huellas dactilares, las cuales oscurecen y coalescen rápidamente alrededor de la base del pedúnculo formando márgenes ondulados. La necrosis ocurre debajo de la cutícula, invadiendo la pulpa del fruto y llegando a momificarlo. Se llegan a observar picnidios primero sobre el pedúnculo y después sobre el fruto; además, de las lesiones puede fluir un exudado café (Ploetz, 2003; Ventura et al., 2004).
La principal vía de entrada de L. theobromae a los hospederos es a través de heridas producidas por herramientas de trabajo, insectos o causas naturales (Ploetz, 2003).Se ha reportado que durante los periodos lluviosos hay mayor producción de esporas las cuales pueden ser diseminadas por las gotas de lluvia y el viento (Vázquez et al., 2009). El hongo coloniza el sistema vascular y avanza por delante de los síntomas visibles (Burgess et al., 2006; Shahbaz et al., 2009).El hongo sobrevive sobre tejidos muertos en el árbol o suelo (Pegg et al., 2003) y especialmente en frutos momificados (Ploetz, 2003). La incidencia de L. theobromae está influenciada por la temperatura (mayor a 30° C), al estrés hídrico y bajos niveles de nutrición de la planta (Khanzada et al., 2005). Cuando los frutos son infectados en el árbol, el patógeno puede permanecer quiescente hasta que los frutos maduran. En postcosecha, los frutos pueden ser infectados al colocarlos sobre el suelo después de cosechados o a través del contacto físico de un fruto sano con uno enfermo (Ventura et al., 2004).
Reportes en México
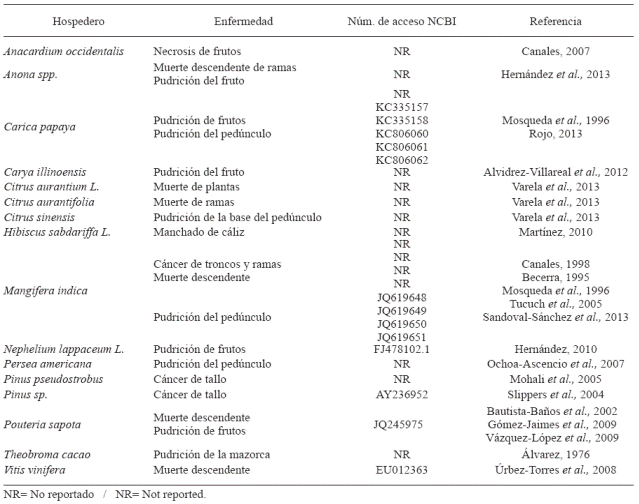
Lasiodiplodia theobromae ha sido reportado en México causando distintas enfermedades en varios cultivos principalmente frutícolas (Cuadro 1). El reporte más antiguo encontrado de este patógeno es el realizado por Álvarez (1976) afectando el cultivo de cacao (Theobroma cacao). Otros cultivos que también reporta son: aguacate (Persea americana), papaya (Carica papaya) y árbol del caucho (Hevea brasiliensis Muell.) bajo el nombre de Diplodia theobromae, en caña de azúcar (Saccharum officinarum L.) como Diplodia cacaoicola, en chirimoya (Annona cherimola Mill) y durazno (Prunus persica) como Diplodia natalensis causando la pudrición del fruto y gomosis, respectivamente.
La mayoría de las descripciones de este patóge no han sido en base a características morfológicas y es a partir de la década pasada que se ha complementado la identificación con técnicas de biología molecular. Entre los reportes basados solamente en morfología se encuentran los realizados en el cultivo de mango (Mangifera indica) en el estado de Veracruz, donde las condiciones ambientales agravan la situación pues las lluvias no permiten que el árbol recupere su follaje (Mosqueda et al., 1996). También, Romero (1993) realizó una descripción de hongos fitopatógenos en cultivos agrícolas de México y reportó a B. theobromae afectando los frutos de los cultivos de mango, chirimoya, algodón, yuca, camote y barbasco. Otros reportes con el nombre de Botryodiplodia theobromae son los de Becerra (1995) afectando el cultivo de mango en Michoacán, Nayarit y Veracruz, donde la humedad favorece la aparición del fitopatógeno. Tucuch et al. (2005) reportan a B. theobromae como el agente causal de la muerte descendente en mango en Campeche, en donde la enfermedad se presenta en mayor intensidad cuando la humedad relativa es mayor al 80% y temperatura entre 26 a 32 °C, manifestándose un secamiento en forma progresiva y descendente con puntos negros en la corteza, en las hojas inicia con lesiones de color gris pardo ocasionando una fuerte defoliación causando la muerte del árbol. Además de los reportes anteriores, también existen otros donde solo se designó como agente causal a Lasiodiplodia sp. en marañón (Anacardium occidentalis) causando necrosis en frutos en Campeche, Quintana Roo y Yucatán (Canales, 2007). También Canales (1998) describe el cáncer de tronco y ramas en mango bajo el nombre de Botryodiplodia sp., además de inducir la floración al ocasionar un estrés hídrico en las ramas y provocar un efecto de anillado.
En otros cultivos, basados únicamente en características morfológicas, se incluyen los realizados por Bautista-Baños et al. (2002) en donde reportan a B. theobromae como el agente causal de la pudrición de frutos maduros de mamey; Martínez (2010) reporta a L. theobromae afectando flores de jamaica (Hibiscus sabdariffa); Hernández (2010) lo reporta como agente causal de la mancha negra de rambután (Nephelium lappaceum) en poscosecha; Hernández et al. (2013) lo reportan asociado a la muerte descendente de ramas en guanábana (Annona spp), aunque aún son necesarias pruebas de patogenicidad que comprueben que es el agente causal de la enfermedad y Varela et al. (2013) lo describen como el agente causal de la muerte de plantas de naranjo agrio injertadas con diferentes especies de cítricos en viveros, de la muerte de ramas en árboles de limón mexicano y de la pudrición del pedúnculo en frutos de naranja.
Entre los reportes que consideran además de las características morfológicas, alguna caracterización molecular se encuentran los de Úrbez-Torres et al. (2008), quienes identificaron a L. theobromae ocasionando cáncer de la vid en el norte de México y el sur de Estados Unidos de Norteamérica, para su identificación y caracterización se basaron en las regiones ITS1-5.8S e ITS 2, una región parcial del gen de beta tubulina (β- tubulina), y parte del gen del factor de elongación 1 alfa (EF1-α); Vázquez et al. (2009) reportaron a L. theobromae afectando varetas de zapote e identificaron al patógeno mediante características morfológicas y la secuenciación de las regiones ITS. En el árbol de la nuez (Carya illinoensis), se encontró a L. theobromae en asociación a un coleóptero como el agente causal de la pudrición del fruto; el hongo fue identificado en base a las características morfológicas y a la secuenciación de las regiones ITS (Alvidrez-Villarreal et al., 2012). En el cultivo de mango (Mangifera indica) se reportó además de L. theobromae a L. pseudotheobromae (especie críptica de la primera) ocasionando pudrición del pedúnculo y muerte descendente, respectivamente. La identificación de las especies se basó en características morfológicas y en la amplificación y secuenciación de las regiones ITS (Sandoval-Sánchez et al., 2013). En papaya (Carica papaya), Rojo (2013) identificó, mediante características morfológicas y la secuencia de regiones ITS, a L. theobromae como responsable de pudrición del pedúnculo en poscosecha.
Control. Numerosos son los estudios realizados para controlar a L. theobromae una vez detectado en el cultivo. Li et al. (1995) evaluaron fungicidas contra L. theobromae y Botryosphaeria dothidea causantes de gomosis en duraznos y albaricoque, encontrando que el fungicidas metil-tiofanato inhibió el crecimiento micelial, la germinación de conidios y controló el desarrollo de la enfermedad en árboles de albaricoque; también reportaron que los fungicidas asperjados, metil-tiofanato 70WP y carbendazima 50WP se pueden usar como tratamiento auxiliar para prevenir la infección del patógeno.
Por otro lado, Tamayo (2007) recomienda la utilización de hipoclorito de calcio y carboxin/captan, a fin de prevenir posibles pudriciones o la manifestación del hongo en el semillero, y antes del almacenamiento se deben sumergir los frutos en una solución fungicida a base de procloraz. También recomienda aspersiones precosecha con fungicidas a base cobre, benomil, metil tiofanato, carbendazim o tiabendazol en forma rotativa a fin de evitar la aparición de poblaciones del patógeno resistentes a los fungicidas.
En un estudio de evaluación de la sensibilidad de L. theobromae hacia dos grupos de fungicidas se concluyó que un 91.6 % de 120 aislados provenientes de huertos de papaya fueron sensibles a los ingredientes activos del grupo de carbamatos del tipo metil benzimidazol (benomyl y tiabendazol). En cuanto al grupo de fungicidas del tipo inhibición por demetilación (Imazalil, procloraz, tebuconazol) se encontró gran variabilidad en cuanto al grado de sensibilidad de los aislados analizados concluyendo que L. theobromae es menos sensible a este grupo de fungicidas (da Silva et al., 2012).
En poscosecha, Barbosa-Martínez et al. (2002) evaluaron el efecto del ozono, yodo y cloro en la germinación de esporas de L. theobromae aislado de frutos de mango y encontraron que en la aplicación de yodo (500 mg. L-1) la germinación de esporas de L. theobromae fue de 10%; mientras que con ozono (2.2 mg. L-1) y cloro (360 mg. L-1) la germinación de esporas fue de 30 y 40%, respectivamente.
Tovar et al. (2013) reportaron que la combinación de lavado y posterior aplicación de tiabendazol redujo la incidencia de la enfermedad ocasionada por L. theobromae hasta un 81 % en injertos de zapote. Los fungicidas ciprodinil+fludioxinil, piraclostrobin+boscalid, procloraz, tebuconazol, iprodione fueron eficaces para inhibir el crecimiento miceliar de L. theobromae in vitro.
En cítricos, Varela et al. (2013) reportan la aplicación de benomyl y compuestos a base de oxicloruro de cobre contra L. theobromae en las distintas etapas del cultivo. Canales (1998) sugiere, para el control del cáncer de tronco y ramas de mango, realizar una cirugía en los cánceres hasta eliminar el tejido dañado y aplicar Benlate(r), Tecto 60(r) o Derosal 50(r) en las heridas. Tambien en mango, en la muerte descendente se recomienda podar las heridas y realizar aspersiones de fungicidas a base de cobre cada 15-20 días, también se puede aplicar los productos Captán, Maneb, Zineb y Benomyl, desde el inicio de la floración hasta un mes antes de la cosecha (Tucuch et al., 2005). En marañón se recomiendan podas sanitarias y tratamiento preventivo con fungicidas a base de oxicloruro de cobre o azufre como ingrediente activo antes de iniciar la floración; durante la floración y formación del fruto se puede utilizar un fungicida sistémico a base de Fosetyl-al, Metalaxil-m o Triforine para reducir la incidencia de la necrosis en frutos (Canales, 2007).
Conclusiones
Lasiodiplodia theobromae es un patógeno con escasos estudios de patogenicidad y rango de hospederos en México. La mayoría de los reportes de L. theobromae se han basado en características morfológicas. El complejo de especies crípticas asociadas a L. theobromae requiere de estudios que asocien características morfológicas y moleculares o genéticas. Las prioridades de los programas de investigación deberían enfocarse en cuantificar el impacto que ocasiona este hongo en diversos cultivos, así como determinar el modo de infección y la evaluación de susceptibilidad a productos químicos para establecer lineamientos de una estrategia efectiva de control.











 texto en
texto en