La jamaica (Hibiscus sabdariffa L.) pertenece a la familia Malvaceae y su origen se ubica en India y Malasia. De acuerdo al Servicio de Información Agroalimentaria y Pesquera (SIAP), Guerrero es el principal productor se este cultivo; en 2012 se produjeron 3943 ton en una superficie de 13 679 ha; los municipios con mayor producción fueron Ayutla de los Libres, Tecoanapa, Acapulco, San Luis Acatlán y San Marcos, que en conjunto aportaron el 85.4 % del volumen de producción estatal, con un valor de 43.9 millones de pesos.
Aproximadamente el 95 % de la producción nacional, se vende a granel para su consumo en seco. El principal problema de la cadena productiva se deriva de un deficiente manejo postcosecha, ya que el productor, regularmente, descuida la sanidad durante el proceso de deshidratado lo que trae como resultado una baja calidad del producto debido a la presencia de hongos postcosecha, lo que repercute directamente en el precio (Galicia et al., 2008).
El deshidratado de los cálices debe reducir su contenido de humedad al 10-12 % para asegurar un adecuado almacenamiento (Augustburger et al., 2000; FAO, 2004; McClintock y El Tahir, 2004). Lo anterior coincide con lo que indica la Norma Mexicana NMX-FF-115-SCFI-2010, donde se establece que los cálices de jamaica deben ser comercializados con una humedad máxima del 10-12 %, y un máximo de 10 UFC/g de mohos y levaduras.
Existe escasez de información sobre la micoflora asociada a los cálices jamaica, su importancia en el daño directo y la posible formación de micotoxinas. Algunos autores que han abordado el tema son Owusu y Odamtten (1999), Ojokoh et al. (2002), Omemu et al. (2006), Doughari et al. (2007) y Adebayo-tayo y Samuel (2009). Dado que en la República Mexicana no se ha encontrado información documentada sobre los microorganismos asociados a los cálices de jamaica, durante su almacenamiento, y los factores podrían contribuir a su deterioro; el objetivo de la presente investigación consistió en identificar los hongos asociados a los cálices de jamaica deshidratados y almacenados, así como su incidencia y condiciones de almacenamiento que afectan su calidad fitosanitaria.
Materiales y métodos
En los meses de diciembre de 2012, febrero de 2013 y mayo de 2013 y con base en un muestreo al azar (Steel et al., 1997), se colectaron en total 49 muestras de 30 g cada una de cálices deshidratados de la variedad criolla en los almacenes ubicados en Ayutla municipio de Ayutla y Las Mesas municipio de San Marcos, en el estado de Guerrero.
Identificación de hongos asociados a cálices almacenados de Jamaica. Para el aislamiento, purificación y caracterización de colonias se tomaron cinco cálices al azar por cada muestra y se cortaron en trozos de 1 cm2 aproximadamente, se desinfestaron con hipoclorito de sodio al 1 % por 1.5 a 2 minutos y se enjuagaron tres veces con agua destilada estéril, se secaron con papel absorbente estéril y se procedió a sembrar cuatro trozos por caja Petri en medio de cultivo PDA (Crous et al., 2009) marca Bioxon(r). Las cajas se incubaron a 25-26 °C por 10 días o hasta el desarrollo de estructuras. De igual manera, se colocaron cinco trozos en cámara húmeda y se dejaron en condiciones de luz-oscuridad natural hasta el desarrollo de estructuras (Crous et al., 2009). Después de este tiempo se verificó la aparición de microorganismos fungosos y se realizaron los sub-cultivos necesarios en medio de cultivo PDA, con el fin de iniciar el proceso de purificación con la técnica de punta de hifa y siembra monoconidial (Leslie y Summerell, 2006; Crous et al., 2009). Con cada uno de los aislamientos puros, se realizó la identificación a nivel de género con base en características morfológicas macroscópicas observadas en un microscopio estereoscópico Zeiss y características microscópicas (de acuerdo al Sistema de Saccardo) con base en la medida de 100 estructuras vegetativas y reproductivas de los cultivos (Crous et al., 2009), observadas al microscopio compuesto Nikon Eclipse Ci con una cámara de la serie microscopio AmScope MU 1000; la identificación se hizo con base en las claves taxonómicas de Ellis (1971), Sutton (1980), Hanlin (1997), Barnett y Hunter (1998) y Leslie y Summerell (2009).
Para la identificación molecular se realizó la extracción de DNA del micelio de las colonias crecidas en PDA y se siguió el método AP (Sambrook y Russell, 2001). En un Termociclador Techne(r), modelo TC-512, se realizó el análisis de PCR para amplificar las regiones internas en los genes ribosomales (rDNA) localizados entre las subunidades 18S-5.8S-28S. Se emplearon los iniciadores universales ITS 4 (TCCTCCGCTTATTGATATG) e ITS 5 (GGAAGTAAAAGTCGTAACAAGG) sintetizados en el Instituto de Biotecnología de la UNAM. Cada mezcla de reacción contuvo 2.5 µL de amortiguador de reacción 10X, 1.25 µL de MgCl2, 0.5 µL de dNTP´s (Promega (r)), 1.0 µL de ITS 4, 1.0 µL de ITS 5, 0.5 de Taq DNApolimerasa (Promega 5 µ/µL), 2.0 µL de DNA y 16.25 µL de agua inyectable para tener un volumen final de 25 µL (Innis et al., 1990; Crous et al., 2009). El programa de amplificación fue: temperatura de desnaturalización inicial de 95 °C por 5 minutos, seguido por 30 ciclos a 95 °C por 45 segundos para la desnaturalización, 57 °C por 45 segundos para la hibridación y 72 °C por 1 minuto para la extensión y un último ciclo de 72 °C por 5 minutos para la extensión final y una temperatura final de refrigeración de 10 °C (Innis et al., 1990; Crous et al., 2009). La calidad de los productos de extracción de DNA y amplificación de PCR se verificó con una electroforesis en gel de agarosa (Agarose LE Axygen (r)) al 1 %; para los productos de PCR se utilizó un marcador de peso molecular de 100 pb (DNA Ladder Promega (r)). La electroforesis se realizó en un First Light Illuminator UV a 90 V por 30 min. (Innis et al., 1990; Crous et al., 2009).
El producto obtenido de la amplificación se envió a secuenciar a Macrogen Inc. (Seúl, Corea). Las secuencias se editaron con el programa Gene Runner 5.0.33 Beta y se determinó la homología de la secuenciación en estudio con las bases de datos de NCBI (National Center for Biotechnology Information).
Determinación de la incidencia de cálices enfermos. La incidencia de cálices enfermos se evalúo usando el método propuesto por Campbell y Madden (1990) y se determinó de manera nominal (enfermo o sano), sin considerar la severidad de la enfermedad. Los síntomas de cálices considerados enfermos, podían presentar manchas sobre el cáliz o tizón en las puntas.
Evaluación de condiciones de almacenamiento de los cálices. La humedad de los cálices almacenados se determinó de acuerdo al método 14.004 del AOAC (1984). Asimismo, se obtuvieron promedios mensuales de las variables temperatura, luminosidad y humedad relativa de cada uno de los almacenes muestreados. El periodo evaluado fue de diciembre de 2012 a mayo de 2013, registrando valores de cada variable, cada cuatro horas con la ayuda de un Hobo Data Loggers U12.
Análisis de datos. Con los datos obtenidos de todas las variables bajo estudio se realizaron análisis de varianza con el software The SAS System versión 9, y se realizó una comparación de medias mediante el método de Diferencia Mínima Significativa (DMS) con un nivel de significancia del 5% (Steel et al., 1997). Además de realizó un análisis de correlación (Steel et al., 1997) entre las variables temperatura, humedad relativa, luminosidad, humedad de cálices, incidencia de cálices enfermos, número de géneros aislados y su frecuencia con los datos observados de ambos almacenes.
Resultados y discusión
Aun cuando la norma NMX-FF-115-SCFI-2010 clasifica un solo grado de calidad designado como Flor (cáliz) deshidratada de jamaica, se identificaron tres grados de calidad de mayor a menor: Extra, Suprema y Comercial. Dicha clasificación fue establecida por los acopiadores y está en función de la apariencia visual del producto y por tanto varía su valor económico en el mercado (Figura 1).
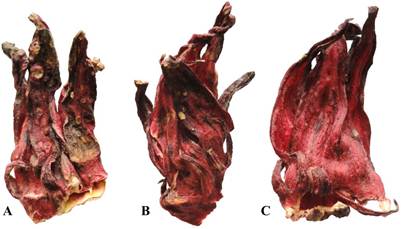
Figura 1: Calidad comercial de cálices de jamaica nacional A) Comercial B) Suprema C) Extra, colectados en Ayutla y Las Mesas, diciembre de 2012-mayo de 2013.
El 40.8 % de las muestras colectadas correspondió a la calidad Comercial, la cual presentó cálices rotos, color rojo oscuro, con presencia de manchas y/o tizón en las puntas, el 24.5 % fueron cálices de calidad Extra los cuales se observaron enteros, de color rojo intenso y limpios visualmente; la calidad Suprema es un grado intermedio que correspondió al 34.7 %.
Identificación de hongos asociados a los cálices almacenados de jamaica. De acuerdo a la caracterización cultural y morfológica se aislaron e identificaron 16 géneros de hongos asociados con cálices deshidratados y almacenados de jamaica, su identidad y frecuencia acumulada se muestra en la Figura 2. No se encontró diferencia significativa de la frecuencia entre Aspergillus al compararlo con Alternaria y Nodulisporium, pero si entre Aspergillus y el resto de los aislamientos.
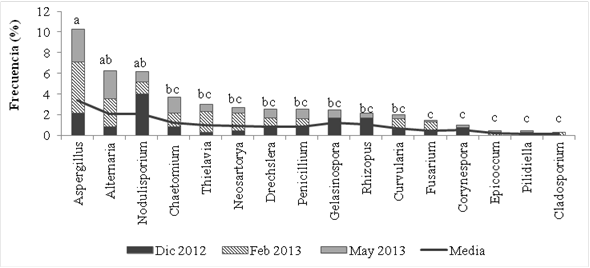
Figura 2: Frecuencia acumulada y media de los 16 géneros de hongos aislados en los diferentes periodos de muestreo.
Crous et al. (2009), mencionan que los géneros más comunes que se pueden encontrar dispersos en el aire son Alternaria, Aureobasidium, Aspergillus, Cladosporium, Eurotium, Fusarium, Mucor, Penicillium, Phoma, Rhizopus, Scopulariopsis, Stachybotrys, Ulocladium y Wallemia, por otro lado, en un estudio realizado por Essien et al. (2013), se aislaron frecuentemente de la atmosfera esporas de Curvularia, Drechslera, Nigrospora, Pithomyces y Stemphylium. Lo anterior hace suponer que algunos de los géneros aislados en esta investigación pueden encontrarse de manera regular en el área de estudio. No obstante, algunos géneros han sido aislados también de cálices frescos aun sin cosechar, lo que apoya la teoría de que algunos hongos son acarreados desde el campo de cultivo.
La secuenciación de los amplicones confirmó la identificación de los organismos aislados, mediante un BLAST que arrojó ≥97 % de similitud con estudios realizados por otros autores y reportados en el GenBank, a excepción de Neosartorya que fue del 88 %. Por las características de fácil reconocimiento, Rhizopus y Penicillium solo se identificaron a nivel género con base en sus características culturales y morfológicas. El Cuadro 1, muestra el porcentaje de identidad con el BLAST de 14 géneros aislados de cálices de jamaica deshidratados y almacenados.
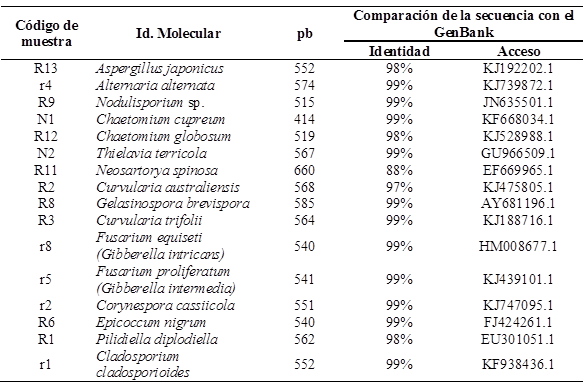
Cuadro 1 Ubicación en el GenBank de 14 géneros de hongos obtenidos en cálices deshidratados y almacenados en centros de acopio de Ayutla y Las Mesas.
Se identificaron dos especies de Chaetomium y dos especies de Fusarium. Es importante mencionar que estudios filogenéticos demuestran que Drechslera ha sido aceptado dentro de las especies de Curvularia y Bipolaris, siendo sinónimo por tanto de C. australiensis y B. australiensis, respectivamente (Manamgoda et al., 2012; Deng et al., 2014).
El género más frecuentemente aislado fue Aspergillus y de acuerdo con Hedayati et al. (2007) y Adebayo-tayo y Samuel (2009), las esporas de Aspergillus pueden contaminar fácilmente el producto durante el deshidratado de los cálices, siendo la humedad relativa la variable más importante, a esto se atribuye su alta frecuencia y nuevamente el manejo postcosecha juega un papel importante en la contaminación del producto. Varios autores han reportado la presencia de A. flavus, A. niger, A. terreus, A. glaucus, A. candidus, A. fumigatus, A. ochraceus, A. rubrum A. wentii y levaduras en bebidas a base de extracto de jamaica (Owusu y Odamtten 1999; Adebayo-tayo y Samuel, 2009); por lo que no se descarta que su presencia provenga desde el almacenamiento.
Algunos organismos aislados, también son reportados por Owusu y Odamtten (1999), al evaluar la microflora de té de hierbas ghanés, compuesto de hojas secas de Cinnamon, Hibiscus y Citronella, donde aislaron 16 especies de hongos en Hibiscus pertenecientes a los géneros Aspergillus, Cladosporium, Eurotium, Manoascus, Paecilomyces, Penicillium, Septodochium, Rhizopus y Syncephalastrum. También determinaron muestras infectadas en campo con A. candidus, A. fumigatus, A. ochraceus, C. cladosporioides, C. herbario, Penicillium digitatum, Syncephalastrum spp. con capacidad para infectar muestras de hojas secas en el almacén. Además, Omemu et al. (2006), encontraron una cuenta total de 3.2x104 UFC/ml de hongos en cálices deshidratados de jamaica, aislando Saccharomyces cerevisiae, Candida krusei, Rhizopus oligosporum, Mucor spp., A. flavus y Penicillium citrinum. Otros autores han aislado A. niger, fumigatus, A. flavus, Trichoderma sp., Rhizopus stolonifer, Penicillium citrinum, Saccharomyces cerevisiae y Geotrichum en bebidas a base de cálices de jamaica (Ojokoh et al., 2002; Doughari y Elmahmood, 2008; Nwafor y Ikenebomeh, 2009). La consecuencia más notable de Aspergillus es la posible producción y acumulación de micotoxinas; es muy frecuente encontrar en productos agrícolas la presencia de aflatoxinas producidas por A. flavus y A. parsiticus y ocratoxinas producidas por A. niger, A. ochraceus y A. carbonarius (Perrone et al., 2007). Battilani et al. (2003) reportaron A. japonicus como productor de ocratoxina A (OA) en cultivo de uvas, sin embargo, lo anterior no fue corroborado en estudios realizados por Parenicová et al. (2001), Samson et al. (2004) y Perrone et al. (2007). En el presente trabajo solo se determinó la identidad de los hongos asociados a cálices de jamaica deshidratados y almacenados, por lo que no se puede aseverar la presencia de alguna toxina en el producto como consecuencia de la presencia de los hongos aislados.
Determinación de la incidencia en cálices enfermos. Al comparar la incidencia media de cálices enfermos entre almacenes, no se encontró diferencia significativa entre Ayutla (60.5 %) y Las Mesas (48.6 %) (DMS=14.99); sin embargo, al compararla por fecha de colecta, en el mes de mayo de 2013 se obtuvo un valor medio mayor (71.11 %) comparado con los meses de diciembre de 2012 (42.04 %) y febrero de 2013 (53.79 %) (DMS=16.5).
Mientras que en Ayutla, no se encontró diferencia significativa al comparar las tres fechas de colecta en el mismo almacén, en Las Mesas se observó una incidencia mayor en mayo de 2013 comparado con diciembre de 2012. Al comparar los dos almacenes, en diciembre de 2012 se observó mayor incidencia en Ayutla. Lo anterior se atribuye a que durante los primeros meses de cosecha, en el almacén de Ayutla se almacenó jamaica en sus diferentes grados de calidad, mientras que en Las Mesas solo se recibió producto calidad Extra y Suprema en donde no se permite que haya cálices con necrosamiento. Sin embargo, ya para los meses de abril en adelante, que hay escases del producto, en Las Mesas también se recibió la calidad Comercial, consecuentemente, hubo la presencia de cálices con manchas, igualando la incidencia entre los dos almacenes.
La incidencia de cálices enfermos se determinó de manera nominal (enfermo o sano), por tanto un cáliz calidad Extra podría considerarse enfermo al igual que un cáliz calidad Comercial, aun cuando el primero presente apenas una pequeña mancha; lo anterior es poco confiable al momento de determinar la calidad del producto final, ya que el acopiador solo se basa en la apariencia visual y el criterio de selección varía entre acopiadores. El grado Comercial mostró una incidencia mayor de cálices enfermos (67.66 %) comparada con la calidad de mayor precio económico, la Extra (44.02 %) (DMS=17.276); lo anterior se atribuye al número de muestras colectadas por grado de calidad; es decir, fue más frecuente encontrar cálices manchados y/o con tizón en las puntas (40.8 %) que cálices sanos (24.5 %). La media del número de géneros de hongos aislados en cálices con diferente grado de calidad no mostró una diferencia significativa, lo anterior se relacionó con el criterio visual de los acopiadores al momento de clasificar las calidades comerciales de jamaica y con la consideración hecha anteriormente.
El análisis estadístico, con un nivel de significancia del 5 %, no indicó diferencia entre almacenes, en el número de géneros aislados (11.6 para ambos almacenes, DMS=4.719) y su frecuencia (9.9 % y 5.8 %, para Ayutla y Las Mesas, respectivamente, DMS=4.7405); sin embargo, al aumentar el nivel de significancia a 10 % se encontró una diferencia significativa en la frecuencia de los géneros aislados entre Ayutla y Las Mesas (DMS=3.6399); esta diferencia se atribuye a los grados de calidad recibidos en cada almacén y al manejo postcosecha dentro de los mismos, ya que en Ayutla, fue común observar la recepción de cálices calidad Comercial, el almacenamiento se realiza por mayor tiempo en cúmulos a granel, compartiendo el mismo espacio para los diferentes grados de calidad, aunado a esto, la humidificación y traspaleo constante del producto favorece que las esporas liberadas se distribuyan fácilmente en el aire, y de acuerdo con Omemu et al. (2005) y Adebayo-tayo y Samuel (2009), pueden caer sobre el producto para dañarlo posteriormente.
Evaluación de condiciones de almacenamiento. En cuanto al porcentaje de contenido de humedad promedio de cálices, no se determinó diferencia significativa entre las muestras colectadas en Las Mesas (15.0 %) y Ayutla (14.5 %) (DMS=2.0656). La Figura 3 muestra la humedad determinada para las 49 muestras procesadas y su ubicación respecto a los límites que establece la NMX-FF-115-SCFI-2010. El 81.63% de las muestras reportaron un contenido de humedad mayor al 12 %; condición que favorece el desarrollo de hongos durante el almacenamiento (Augustburger, 2000); además Gradinaru et al. (2003) y Galicia et al. (2008), mencionan que este factor repercute también en la estabilidad del color de los cálices, ya que incrementa las velocidades de reacción de degradación de antocianinas, componente responsable de la coloración de los cálices.
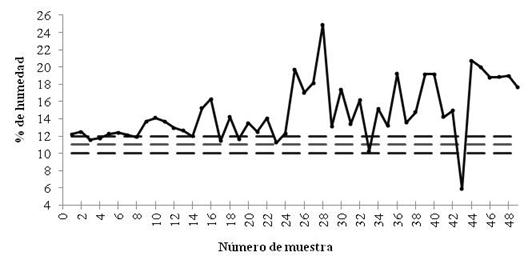
Figura 3 Humedad de cálices de jamaica almacenados; la secuencia de las muestras corresponde al orden de colecta. Las líneas punteadas corresponden a los valores, mínimo, medio y superior establecidos por la NMX-FF-115-SCFI-2010.
Al comparar el contenido de humedad de los cálices por fecha de colecta, en ambos almacenes se determinó significativamente que los cálices más húmedos se colectaron en los meses de febrero y mayo de 2013 (Figura 4).
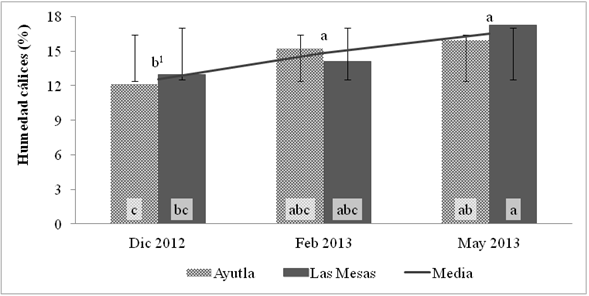
Figura 4 Humedad promedio de cálices en diferentes periodos de muestreo. 1Medias con la misma letra dentro de línea y dentrode barras son estadísticamente iguales (DMS entre almacenes, P<0.05=3.3361; DMS media, P<0.05=2.2185).
Las variaciones en el porcentaje de humedad del producto entre las diferentes fechas de muestreo se debe a las practicas postcosecha que se realizan en cada almacén; generalmente el acopio de los cálices se realiza en los meses de noviembre y diciembre, poco después de que el productor los ha deshidratado y envasado; mientras que en los meses más calurosos el producto ya se encuentra en el almacén y se asperja con agua para evitar que se quiebre y pierda peso, lo anterior ocasiona que los cálices reabsorban humedad (Juliani et al., 2009). Vallecillo y Gómez (2004) mencionan que de las condiciones de almacenamiento y manejo del producto depende que la jamaica no reabsorba humedad del ambiente y favorezca el crecimiento de hongos, por lo que resulta necesario diseñar y evaluar prácticas que inhiban esta condición.
Durante la colecta de material, la temperatura media que se registró en Las Mesas fue mayor (27.6 °C) que la de Ayutla (27.1 °C) (DMS=0.162); mientras que la humedad relativa en Ayutla fue mayor (58.4 %) comparada con Las Mesas (52.4 %) (DMS=0.8993). La luminosidad de Las Mesas fue mayor (38.3 lux) que la luminosidad de Ayutla (16.8 lux) (DMS=4.5752). El centro de acopio de Ayutla se ubica a una altitud de 391 msnm y el almacén de Las Mesas a 432 msnm.
Augustburger et al. (2000) recomiendan almacenar el producto empacado en bolsas de polietileno, polipropileno o cajas de cartón en espacios protegidos del sol a temperaturas máximas de 15-20 °C y una humedad ambiental máxima de 60% y bajo estas condiciones el producto puede conservarse por 12 a 18 meses.
Las condiciones de almacenamiento que se practican en la zona de estudio difieren de las recomendaciones de Augustburger et al. (2000); ya que el producto se almacena en su mayoría en cúmulos a granel a temperatura ambiente, la cual registró un valor medio de hasta 28.6 °C, mientras que la humedad relativa registró valores hasta de 66.4 % en Ayutla; de acuerdo a Arauz (1998), la mayoría de los hongos patógenos esporulan mejor a humedades relativas altas que a niveles bajos. La variación en la luminosidad se relacionó con las condiciones propias de las instalaciones, el volumen de acopio y las practicas postcosecha que se practican en cada almacén; sin embargo, la influencia de la luz sobre el desarrollo de enfermedades, en particular en condiciones naturales, tiene una importancia mucho menor que la que tiene la temperatura o la humedad.
Se realizó un análisis de correlación entre las variables: temperatura, humedad relativa, luminosidad, humedad de cálices, incidencia de cálices enfermos, número de géneros aislados y frecuencia de géneros aislados. Los coeficientes de correlación de las variables de almacenamiento de ambos almacenes, se presentan en el Cuadro 2.
Cuadro 2 Coeficientes de correlación entre las variables de almacenamiento evaluadas en Ayutla y Las Mesas.
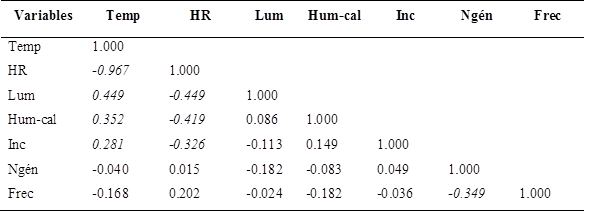
Las correlaciones en cursivas indican una diferencia significativa de P<0.05. Temp= Temperatura, HR=Humedad relativa, Lum=Luminosidad, Hum-cal=Humedad de cálices, Inc=Incidencia de cálices enfermos, Ngén=Número de géneros aislados, Frec=Frecuencia de géneros aislados / The correlations in italic show a significant difference of P< 0.05. Temp= Temperature, HR=Relative humidity, Lum=Luminosity, Hum-cal=Humidity of the calyxes, Inc=Incidence of diseased calyxes, Ngén=Number of isolated genera, Frec=Frequency of the isolated genera.
Se determinó una correlación negativa muy alta entre la temperatura y la humedad relativa. Así, Arauz (1998) menciona que una influencia indirecta de la temperatura en el desarrollo de patógenos es su efecto en la humedad; conforme aumenta la temperatura, la humedad relativa disminuye y más rápidamente se secan las superficies foliares.
Por otro lado, la temperatura de almacenamiento y la humedad de los cálices mostraron una correlación positiva baja, al aumentar la temperatura también aumenta la humedad de los cálices almacenados, esto se debe a que disminuye la humedad relativa, se siguen deshidratando los cálices y los acopiadores asperjan con agua el producto durante su permanencia en los centros de acopio para facilitar su manejo y evitar pérdidas de peso, por lo que, como ya se mencionó, los cálices pueden reabsorber humedad (Juliani et al., 2009).
La correlación positiva baja entre la temperatura y la incidencia de cálices enfermos se atribuye a las prácticas postcosecha, donde se debe evitar que el producto no vuelva a absorber humedad del ambiente, lo que favorecería el crecimiento de hongos (Vallecillo y Gómez, 2004) y por tanto aumentaría la incidencia de cálices enfermos.
Al aumentar la temperatura aumenta la luminosidad de almacenamiento, esta correlación positiva moderada, depende del diseño y/o prácticas postcosecha propias de cada almacén, sin embargo, la luminosidad es un factor de menor importancia para el desarrollo de enfermedades.
El número de géneros aislados mostró una correlación negativa baja con su frecuencia acumulada, esto se atribuye a la clasificación visual de las calidades que realizan los acopiadores al momento de recibir la jamaica, mismas que no están basadas en criterios científicos; ya que podría recibirse un cáliz aparentemente sano, calidad extra y éste estar contaminado superficialmente con esporas presentes en el aire.
La jamaica es un producto no perecedero, que requiere de cuidados para conservar su estado natural después de la cosecha. El proceso de deshidratación de los cálices debe ser rápido para evitar enmohecimiento, y de esta manera el producto se almacene con una humedad menor al 12 %, con una adecuada ventilación.
Conclusiones
La media de contenido de humedad de las muestras analizadas de jamaica fue de 14.5 %, superior a lo técnicamente recomendado por varios autores, incluyendo lo establecido en la NMX-FF-115-SCFI-2010; esto favoreció el desarrollo de hongos. El 81.63 % de las muestras superó el límite superior establecido para el contenido de humedad aceptado para su comercialización.
La incidencia de cálices enfermos fue mayor en el mes de mayo de 2013 (71.11 %) comparada con los meses de diciembre de 2012 (42.04 %) y febrero de 2013 (53.79 %). No se encontró diferencia significativa en la incidencia de cálices enfermos colectados en los almacenes de Ayutla (60.5 %) y Las Mesas (48.6 %). Asimismo, los cálices calidad Comercial mostraron una incidencia mayor que los cálices de calidad Extra.
Se aislaron 16 géneros de hongos asociados a los cálices deshidratados y almacenados de jamaica; los 5 géneros aislados más frecuentemente fueron Aspergillus, Alternaria, Nodulisporium, Chaetomium y Thielavia.
Con un α=0.1 se determinó diferencia significativa en la frecuencia acumulada de éstos hongos aislados entre almacenes, la principal causa de la diferencia se debe a las prácticas de manejo que se realizan en cada almacén.
Los resultados obtenidos en el presente estudio, permitieron conocer las condiciones bajo las que se almacena la jamaica cosechada y deshidratada en Guerrero, mismas que deben corregirse para evitar el favorecimiento de la presencias de los organismos identificados.











 texto em
texto em 


