Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.32 no.1 Texcoco 2014
Artículos científicos
Colonización de Trichoderma y Bacillus en Plántulas de Agave tequilana Weber, var. Azul y el Efecto Sobre la Fisiología de la Planta y Densidad de Fusarium
Colonization of Trichoderma and Bacillus in Seedlings of Agave tequilana Weber, var. Azul and the Effect on the Plant Physiology and Fusarium Density
Bertha Tlapal Bolaños1, Héctor González Hernández1, Emma Zavaleta Mejía1, Prometeo Sánchez García1, Gustavo Mora Aguilera1, Cristian Nava Díaz1, José Ignacio Del Real Laborde2, Ramón Rubio Cortes2
1 Postgrado Fitopatología, Entomología y Nutrición Vegetal. Colegio de Potgraduados Km. 36.5 Carretera México-Texcoco, Montecillo, Edo. De México, CP 56230, México. Correspondencia: cnava@colpos.mx, navadiaz57@prodigy.net.mx
2 Área de Investigación de Tequila Sauza S.A. de C.V., "Rancho El Indio", Tequila, Jalisco, México.
Recibido: Agosto 16, 2013
Aceptado: Diciembre 11, 2014
Resumen
Un problema fitosanitario en agave (Agave tequilana var. Azul). es la marchitez, provocado por varios organismos en plantaciones de dos años de edad después de trasplante. Entre los patógenos se reportan varias especies de Fusarium spp. y Thielaviopsis paradoxa. Se planteó el presente trabajo con el objetivo de introducir organismos benéficos en plantas de micropropagación como manejo preventivo en vivero. Los tratamientos fueron T1 Trichoderma harzianum (Th), T2 T. virens (Tv), T3 T. aureoviride (Ta), T4 Bacillus subtilis (Bs), T5 Tv + Bs, T6 Ta + Bs, T7 testigo absoluto (Tabs) y T8 testigo regional (Treg). Se estableció un diseño en bloques al azar con dos repeticiones, la unidad experimental (UE) consistió de 122 plántulas; el tamaño mínimo de muestra comprendió 26. Las variables evaluadas fueron altura de planta, unidades formadoras de colonias (UFC) de Trichoderma, Fusarium y Bacillus en sustrato y raíz, determinación de clorofila, y área bajo la curva (ABC); los muestreos fueron seis con intervalo de 30 días de octubre 2008 a mayo 2009. Los resultados indican que los tratamientos T1, T3, T4 y T6, son los que presentaron mayor capacidad de establecimiento, generando un ambiente de equilibrio con densidades de Fusarium spp. en sustrato y raíz que oscilaron de 2 y 2.5 log (UFC mL-1); el ANAVA para ABC de Fusarium spp. no reportó diferencias estadísticas, sin embargo fue menor que la de los antagonistas en suelo T8 Treg con nivel de 120 y T7Tabs 75.75, el resto oscilo por debajo de 50; en raíces el nivel alto fue T6 Ta+Bs 375, T7 Treg 262.5 y los valores menores se encontraron en T3 Ta 105, T5 Tv+Bs 187.5, T4 Bs 187.5 y T1 Th 210. No se observaron diferencias estadísticas en clorofilas y alturas.
Palabras clave: equilibrio, densidad, Trichoderma, Fusarium, Bacillus.
Abstract
One of the most important phytosanitary problems in two-year plantations of Agave tequilana var. Azul. is agave wilt, that is caused by several organisms, among those pathogens are reported several species of Fusarium and Thielaviopsis pradoxa. The main goal of this research was to introduce beneficial organisms in micropropagation plants as control measure. Inoculated treatments were T1 Trichoderma harzianum (Th), T2 T. virens (Tv), T3 T. aureoviride (Ta), T4 Bacillus subtilis (Bs) , T5 Tv + B, Ta + B T6, T7 absolute control (Tabs) and T8 regional control (Treg). Treatments were established in a randomized block design with two replications, the experimental unit (EU) consisted of 122 plants; the minimum sample size was 26 plants. Evaluated variables were colony forming units (CFU) of Trichoderma, Fusarium spp. and Bacillus from roots and substrate and plant height, chlorophyll from plants. Variables were evaluated every 30 days from October 2008 to May 2009. Area under curve (AUC) was calculated for each variable. Our results show that microorganism in the treatments T1, T3, T4 and T6 colonized agave roots and maintain high levels, creating a balance to Fusarium spp. in soil and roots. Under this conditions Fusarium density ranged from 2 to 2.5 log (CFU/mL-1). Analysis of variance did not detect any significant difference among treatments. However, Fusarium spp. density on soil (AUC) was higher in treatments T8 Treg (120) and T7 Tabs (75.75) compared with the rest of treatments (50 or less). Fusarium density on roots was higher on treatments T6 Ta + B (375) and T7 Treg (262.5) compared to T3 Ta (105), T5 Tv + B (187.5), and T1 T4 Th B (210). No significant differences were found on chlorophylls and plant heights.
Keywords: balance, density, Trichoderma, Fusarium, Bacillus.
El tequila ha adquirido importancia por la demanda creciente nacional e internacional, siendo la actividad de campo un componente importante y decisivo para el abastecimiento de la materia prima, el agave tequilero Agave tequilana Weber var. Azul para la producción de tan importante bebida (Pérez y Del Real, 2007). Las plantaciones de agave tequilero dentro de la zona de Denominación de Origen del Tequila (DOT) integran un inventario de 253,033,239 plantas sembradas (CRT, 2010). La industria del tequila ha crecido en forma sostenida durante los últimos años y su potencial de crecimiento es aún grande, por lo que se requiere de un abasto sostenido y predecible de materia prima para asegurar su producción (Byerly, 2007).
La Norma Oficial Mexicana para la producción de tequila NOM-006-SCFI- 2005, especifica la variedad azul de Agave tequilana como la única autorizada para elaborar tequila, lo que implica que los métodos de propagación deben cumplir el requisito, por lo que se desecha la reproducción sexual que traería variación genética o segregación entre las plantas hijas. La reproducción asexual se da a través de la propagación vegetativa; los individuos obtenidos mediante este tipo de reproducción constituyen un clon y estos clones, a excepción de mutaciones naturales, son genéticamente idénticos a la planta madre. Para la propagación de A. tequilana Weber, var. Azul, existen los siguientes métodos de multiplicación asexual: bulbillos, rizomas (hijuelos) y micropropagación. Este último método tiene la ventaja de producir grandes cantidades de plantas en espacios relativamente reducidos durante todo el año. La propagación in vitro permite controlar la condición sanitaria de las plantas a lo largo de su producción y constituir grupos de plantas de la misma edad para su manejo agrícola (Vicente y Del Real, 2007).
El mejoramiento de la condición sanitaria y proliferación de raíces en muchas plantas de vivero se ve fortalecida con el uso de organismos como Trichoderma spp. y Bacillus spp. (Kloepper et al., 1992; Van Veen et al., 1997) en diversos cultivos hortícolas, ornamentales y forestales; en los cuales se ha observado el desarrollado de múltiples mecanismos que reportan incremento en resistencia a enfermedades, crecimiento y productividad de las plantas, así como tolerancia al estrés provocado por diversas situaciones en los cultivos (Hartman et al., 2004; Harman, 2006; Lorito et al., 2010). En el cultivo del agave Agave tequilana weber var. Azul. se reportan varios problemas fitosanitarios, uno de los cuales es la marchitez, síntoma que puede ser provocado por varios organismos y el Consejo Regulador del Tequila (CRT) le atribuye incidencias elevadas en plantaciones que superan los dos años de edad después del trasplante (CRT, 2010). ). La marchitez que se presenta en cualquier cultivo se debe a una deshidratación de los tejidos y esto se da a su vez porque hay una reducción, muerte o destrucción del sistema radical, o bien porque hay destrucción o taponamiento de haces vasculares (CRT, 2005). Múltiples investigadores como Luna-Hernández (1996), Virgen-Calleros (2000) y Fucikovsky-Zak (2001), entre otros reportaron como agentes causantes de este síntoma a Fusarium oxysporum y Thielaviopsis paradoxa. En 2007 Cuevas y Domínguez, reportaron que el complejo de especies F. culmorum, F. equiseti, F. oxysporum, F. solani y F. verticillioides, podría ser el causante de la marchitez del cultivo. También, el mismo síntoma puede ser ocasionado por insectos que se alimentan del agave y su acción puede provocar heridas aprovechadas por los patógenos para acceder a la planta (CRT, 2005); entre estos esta la gallina ciega, que al alimentarse de la raíz, hace que la planta tenga menos área para absorber agua y nutrientes, a la vez que provoca heridas que son una fuente de entrada potencial para patógenos de la raíz, como Fusarium spp. Otro insecto que puede ocasionar marchitez es el gusano blanco del maguey, ya que al barrenar la piña, afecta diversas zonas del tallo, incluyendo haces vasculares, y aunque tal vez no haya invasión de microorganismos, si puede observarse encarrujamiento de hojas, así como una detención del crecimiento. Cuando una planta esta estresada por algún otro factor (manejo, nutrición, herbicidas o enfermedad), es fácilmente atacada por el picudo, el cual además de alimentarse dentro de la planta, también puede provocar marchitez, pudrición y muerte de la misma (CRT, 2005).
Como parte de un manejo integrado del cultivo, se planteó el presente trabajo con el objetivo de adicionar organismos benéficos que se establezcan en el sustrato y raíces de plantas de micropropagación durante la etapa previa al establecimiento en campo. Lo anterior bajo la hipótesis de que los organismos antagonistas presentan beneficios fisiológicos en plántulas que reducen el estrés causado por factores abióticos y patógenos como Fusarium spp.
MATERIALES Y MÉTODOS
Localización. El experimento de vivero fue establecido en el "Rancho El Indio" de la empresa Sauza S.A. de C.V. en la localidad de Tequila, Jalisco.
Plántulas. Las plántulas de micropropagación usadas en el experimento fueron de cuatro hojas y una altura de 10cm, con una edad de doce meses.
Tratamientos. Los tratamientos considerados fueron tres cepas nativas de la región productora de agave de Jalisco, las cualés fueron obtenidas de investigaciones previas realizadas por Cuevas y Domínguez (2007), y Carballo y Díaz (2008). Las especies corresponden a Trichoderma harzianum, T. virens y T. aureoviride, que fueron identificadas morfológica y molecularmente en los trabajos citados; una cepa comercial de Bacillus subtilis (Serenade®), las mezclas de T. virens + B. subtilis, T. aureoviride + B. subtilis; y los testigos absoluto y comercial (Cuadro 1).

Los tratamientos correspondientes a las tres especies de Trichoderma fueron adicionadas en medio liquido papa dextrosa (papa 200g; dextrosa 11g; agua destilada 1000mL) a una concentración de 1 x 104 UFC mL-1, y 10mL por plántula al cuello de la misma. Bacillus subtilis cepa QST 713 se agregó en la dosis comercial de 1g L-1 de agua del producto comercial Serenade® que reportó en la etiqueta una concentración de 8 x 109 UFC g-1, la aplicación fue similar a Trichoderma spp. así como el volumen por plántula. El experimento se estableció en octubre de 2008 y se hicieron cuatro aplicaciones de los tratamientos cada 30 d. Se realizaron seis muestreos de diciembre de 2008 a mayo de 2009 a intervalos de 30 d. En los testigos regional y absoluto no se adicionó ningún organismo.
El sustrato empleado fue una mezcla de composta de bagazo de piña de agave (5%), fibra de coco (80%) y corteza de pino (15%) (Crespo et al., 2013). Las macetas usadas fueron de fibra de coco con capacidad de 1kg.
Diseño experimental. El diseño establecido fue un bloques completamente al azar con dos repeticiones, constituido por dos naves comerciales, las cuales correspondían a dos áreas de condiciones similares en sombreado y riego, pero de tamaño diferente.
Yij=μ + Ti+ßj+Εij
Yij es el valor de la variable respuesta; μ es la media general; T efecto que produce el tratamiento i, T1, T2, ...., Ti; ßj es bloque; Eij error experimental.
La unidad experimental (UE) se conformó por 122 plántulas por repetición con un total de 244 por tratamiento y 1952 en el experimento; se muestrearon 26 plántulas en cada UE. Las variables evaluadas fueron altura de planta, unidades formadoras de colonias (UFC) de Trichoderma, Fusarium y Bacillus en sustrato y raíz, determinación de clorofila y carotenos; en ellas se determinó el área bajo la curva (ABC), de acuerdo a lo reportado por Madden et al. (2007).

Donde, n es el número de mediciones, yi es la variable evaluada, y ti es el número de días desde el inicio del experimento a la fecha de medición i.
Los datos se sometieron a un análisis de varianza y comparación de medias de diferencia mínima significativa (α=0.05), con el paquete estadístico SAS.
Cuantificación de UFC en sustrato. Para Trichoderma spp. y Fusarium spp., la cuantificación de UFC provenientes de suelo se hizo a través del procedimiento siguiente: se pesaron 10g de una muestra de sustrato y se agregaron en 90mL de agua destilada estéril en un matraz de 125mL, se hicieron diluciones hasta 10-3. Se empleó el medio de cultivo Papa Dextrosa Agar Penetrex Estreptomicina (PDA-PS) con 0.5mL del surfactante comercial Penetrex®, 0.01g de estreptomicina y 0.0075g de clorhidrato de tetraciclina, se agitó el medio suavemente para no formar burbujas. De la dilución 10-3 se tomaron 10 muestras de 0.1mL, que se agregaron al medio PDA-PS. El material se incubó por siete días a temperatura ambiente de 22 a 24oC. La determinación de UFC de Bacillus subtilis se realizó con la misma técnica anterior solo que empleando la dilución 10-8 en medio de cultivo agar nutritivo (AN Bioxon® 38g L-1) y cuantificando la densidad de población en base a la morfología de la colonia y la prueba de Gram (Schaad et al., 2001).
En el sustrato empleado se cuantificaron las UFC g-1 de sustrato de Trichoderma spp., Fusarium spp. y Bacillus spp., presentes ya que fue una composta natural que se emplea por la empresa para su material de micropropagación y no pasa por esterilización.
Cuantificación sobre raíces. Se pesó un gramo de raíces a partir de 26 plántulas de agave de cada UE y se lavaron con agua común. Las muestras destinadas a determinar Trichoderma sp. y Fusarium sp., se desinfestaron en hipoclorito de sodio al 3% por tres minutos y al final se enjuagaron con agua destilada esterilizada y secaron para sembrarse en medio de cultivo PDA e incubarse en cámara de crecimiento a temperatura de 22 a 24oC. El número de colonias de Trichoderma y Fusarium se evaluaron a los siete y 10 días. Para cuantificar B. subtillis se siguió el procedimiento anterior solo sin la desinfestación con hipoclorito de sodio. Las raíces se sembraron en medio AN incubándose a la misma temperatura indicada arriba y se evaluaron a las 24 y 48h tomando en cuenta la morfología de la colonia y la prueba de Gram (Schaad et al., 2001).
Determinación de clorofila. Se tomaron 10g de hojas de agave por tratamiento y se introdujeron en 80mL de acetona al 70%, se dejaron reposar por 24h en oscuridad y posteriormente se llevaron al espectrofotómetro para su cuantificación (Porra et al., 1989).
RESULTADOS
Cuantificación de flora microbiana fungosa en sustrato. El resultado de la cuantificación de flora microbiana fungosa en el sustrato empleado en las plántulas reportó la presencia de Trichoderma sp. en 1.2 ufc(x1000) g-1, Penicillium sp. 21.4 ufc(x1000) g-1, Aspergillus sp. 7.7 ufc(x1000) g-1, Mucor sp.12.1 ufc(x1000) g-1 y Chalaropsis sp. 0.4 ufc(x1000) g-1(Figura 1), las cuales se identificaron a género con ayuda de las claves para hongos imperfectos de Barnett y Hunter (1998). Estos resultados no sorprenden ya que se trató de un sustrato natural y sentó referencia de los organismos con los cuales convivirían los organismos de los diferentes tratamientos introducidos para enriquecer el mismo.
Dinámica de UFC en sustrato y raíz. El establecimiento de las especies de Trichoderma spp. ocurrió desde la primera evaluación a los 30 d después de la inoculación (ddi) en todos los tratamientos como se puede apreciar en la Figura 2, y se mantuvo constante durante el tiempo (60, 90, 120, 150 y 180ddi) en valores de 3.5 a 4 log (UFC mL-1) en todos los tratamientos.
Los propágulos de Fusarium spp. tuvieron un comportamiento diferente en sustrato y raíz. En raíz los tratamientos T1 Th, T2 Tv y T4 Bs no reportaron UFC en los primeros 30 d, sin embargo a los 60 ddi ya oscilaban entre 2 y 2.5 log (UFC mL-1), el tratamiento T3 Ta alcanzó los mismos niveles entre los 100 y 120 ddi; para T5 Tv + Bs se lograron a los 90 ddi; T6 Ta + Bs, T7 Tabs y T8 Treg iniciaron con los niveles desde los 30 ddi. En sustrato la colonización ocurrió desde los 30 ddi alcanzando niveles de 2 y 2.5 log (UFC mL-1) en todos los tratamientos, sin embargo en los tratamientos T3 Ta y T7 Tabs, ocurrió un descenso de UFC a los 150 ddi y coincidió con la evaluación de marzo de 2009. El tratamiento T5 Tv + Bs reporto un descenso de UFC de Fusarium spp. a los 60 ddi (enero 2009), no obstante alcanzó los niveles de 2 y 2.5 log (UFC mL-1) posteriormente.
La colonización de B. subtilis en los tratamientos T4 Bs, T5 Bs + Tv y T6 Bs + Ta, reportaron niveles elevados de UFC de la bacteria en raíces y su población se mantuvo entre 6.5 a 7.0 log (UFC/mL). En los tratamientos T1 Th, T2 Tv, T3 Ta, T4 Bs, T7 Tabs y T8 Treg, la bacteria descendió en sus niveles de densidad a los 180 ddi en la raíz; sin embargo, en los tratamientos T5 Tv+Bs y T6 Ta+Bs se mantuvo constante en los niveles de 6.5 a 7.0 log (UFC/mL) (Figura 2). El establecimiento de la bacteria en sustrato no ocurrió en los tratamientos T2 Tv y T8 Treg; mientras que en T1 Th, T3 Ta y T7 Tabs, su densidad se empezó a incrementar a los 150 ddi; los tratamientos que incluyeron a la bacteria desde el inicio T4 Bs, T5 Tv+Bs y T6 Ta+Bs, se establecieron en suelo desde los 30 ddi y se mantuvieron en densidades similares que los de raíz.
Análisis de varianza de área bajo la curva (ABC) y comparación de medias Trichoderma sp. sustrato. Los resultados del ANAVA mostraron diferencias entre tratamientos con una P = 0.0003 respecto a la colonización de UFC de Trichoderma sp. en sustrato, donde la prueba de comparación de medias de LSD (diferencia mínima significativa α=0.05) reportó al T3 Ta con la mayor ABC 1338.75; el T1 Th alcanzó niveles de 1160.25, le siguieron T4 Bs con 1012.50 y T8 Treg 1048.50. El resto de los tratamientos estuvieron por debajo de mil, T7 Tabs 951.00, T5 Tv + Bs 921.00, T6 Ta + Bs 836.25 y T2 Tv 703.50 (Cuadro 2).

Trichoderma sp. raíz. El ANAVA de las UFC en raíz de Trichoderma sp. reportó diferencias en los tratamientos con una P = 0.0325. La prueba de comparación de medias de LSD (α=0.05) señaló que el ABC mayor fue obtenida por T1 Th 772.5, seguido de un grupo de cinco tratamientos donde se agruparon T3 Ta 645.0, T2 Tv 532.5, T8 Treg 518 y T4 Bs 412.5, que pese a reportarse como iguales estadísticamente presentan diferencias de más de 100 puntos entre algunos de ellos. Las áreas menores las obtuvieron los tratamientos T5 Tv + Bs y T6 Ta + Bs, con 315.0 y 277.5, respectivamente (Cuadro 2).
Bacillus subtilis sustrato. El ANAVA del ABC indico diferencias entre tratamientos con una P de 0.016. La prueba de comparación de medias LSD (α=0.05) resaltó a los tratamientos donde se encontró la bacteria como los de mayores niveles de ABC. El T4 Bs fue el de niveles altos con una ABC de 2055.0, seguido de aquellos tratamientos que tuvieron interacción con Trichoderma como el T5 Tv + Bs 1387.50 y T6 Ta + Bs 1290.0. Niveles menores se encontraron en T1 Th 30.0, T3 Ta 52.5 y T7 Tabs 15.0. Los tratamientos T2 Tv y T8 Treg no reportaron colonización en suelo de B. subtilis (Cuadro 3).
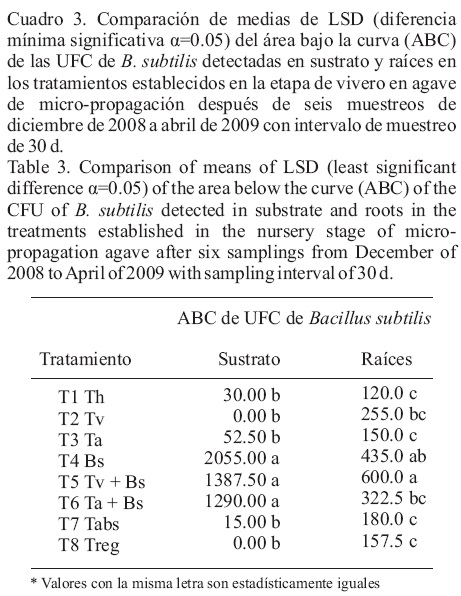
Bacillus subtilis raíz. Un comportamiento similar al de B. subtilis en sustrato se observó en raíces, donde también se mostró la existencia de diferencias estadísticas entre tratamientos del ANAVA del ABC con una P de 0.0135. Los resultados arrojados por la prueba de comparación de medias de LSD (α=0.05) señalaron que B. subtillis reportó presencia en todos los tratamientos en sus raíces. El ABC mayor la alcanzó el T5 Tv + Bs 600.0, seguido del T4 Bs 435.0 y T6 Ta + Bs 322.5; T2 Tv reportó 255.0. T1 Th, T3 Ta, T7 Tabs y T8 Treg, obtuvieron las ABC más bajas con valores de 120.0, 150.0, 180.0 y 157.5 (Cuadro 3).
Fusarium sp. sustrato. Las UFC de Fusarium sp. en sustrato no reportaron diferencias estadísticas entre tratamientos en el ANAVA, sin embargo se apreciaron niveles por debajo de 50 para la mayoría de los tratamientos, excepto para el T7 Tabs y T8 Treg, donde se reportaron ABC de 75.75 y 120 (Cuadro 4).

Fusarium sp. raíz. No hubo diferencias estadísticas de tratamientos en el ANAVA del ABC de UFC de Fusarium sp. en raíces. Sin embargo se tuvieron valores de más de 200 entre varios de los tratamientos (Cuadro 4). T6 Ta + Bs obtuvo niveles de ABC de 375.0, mientras que los valores de T1 Th, T2 Tv, T7 Tabs y T8 Treg, fueron de 210, 235.5, 225.0 y 262.5, respectivamente. Los valores bajos se encontraron en los tratamientos T3 Ta 105.0, T4 Bs 187.5 y T5 Tv + Bs 165.0.
Clorofila y Altura. No se reportaron diferencias estadísticas entre tratamientos en el ANAVA de estas dos variables (Cuadro 5).

DISCUSIÓN
Los resultados de este trabajo demuestran que los microorganismos como Trichoderma spp. y Bacillus subtilis son capaces de establecerse en suelo y algunos de estos tienen la capacidad de hacer a las raíces su nicho; con esto tienen la cualidad de equilibrar las densidades de población de organismos patógenos como varias de las especies de Fusarium comunes en la mayoría de los suelos del mundo las poblaciones de microorganismos en los suelos o sustratos que se empleen; Smith et al. (2001) indican que los niveles de UFC por debajo de 100 UFC g-1 pueden considerarse bajos y de riesgo reducido para causar enfermedad por este hongo, sin embargo, por arriba de ese nivel se deben tomar precauciones ya que se consideran niveles elevados (Valiuskaite et al., 2008). El control biológico de patógenos de plantas comúnmente involucra el mejorar o aumentar el antagonismo alrededor de las plantas o en el suelo pero en poblaciones bajas que permitan un adecuado equilibrio. Este tipo de herramientas prácticas permiten la protección contra infecciones que pudieran establecerse; la protección del material que se plantará puede protegerse vía raíces, suelo o en semilla. Gnanamanickan et al. (2002) reportaron el éxito de tratamiento de la semilla en millones de hectáreas de algodón en china con Streptomyces 5406 como un ideal de forma en la protección de cultivos desde el punto de vista preventivo. La capacidad que se observó en este trabajo de T1 Th para establecerse en suelo y raíz, también lo reportó Harman (2000) para la especie T. harzianum T-22 donde señalo además que la cualidad de colonizar el área de la rizósfera en las plantas trae el beneficio de poder actuar como un inductor de mecanismo de resistencia sistémica adquirida, lo que conlleva a prolongar la protección de las plantas hacia patógenos. El tratamiento T3 Ta tuvo un comportamiento similar a T1 Th; Howell (2002) y Harman et al. (2004) reportaron que son varias las especies de Trichoderma que tienen la capacidad de poder colonizar el área del sistema de raíces de plantas donde se aplica con la finalidad de conferir protección y que los organismos pueden actuar contra los patógenos a través de la producción o liberación de varios compuestos que pueden inducir respuestas de resistencia sistémica adquirida o localizada y así perdida de patogenicidad en las plantas; señalando que dicha asociación microorganismo-raíz causa sustanciales cambios en el metabolismo y proteoma de la planta. El poder establecerse en suelo también trae como beneficio que las especies puedan actuar a través de competencia por espacio o por micoparasitismo que son algunos de los mecanismos reportados desde los 70's para algunas de las especies del genero Trichoderma (Harman, 2006; Harman et al., 2004 y Howell, 2002). La aplicación preventiva también fue reportada por Horst et al. (2005) quienes mencionan que varios de los aislamientos y especies de Trichoderma spp. pueden reducir la severidad de enfermedades en plantas cuando se aplicaron en tratamiento a la semilla o trasplante entre ellas reportan a T. asperellum T-203, T. hamatum GT3-2, T. hamatum T382, T. harzianum T39, T. harzianum T22 y T. virens G6.
Respecto al comportamiento de B. subtilis los resultados de este trabajo demuestran la capacidad que tiene de establecimiento donde se adiciona sea en suelo o sustrato, así como en las raíces. El género Bacillus está considerado como promotor del crecimiento con potencial para incrementar el rendimiento en las plantas. Varias especies han sido objeto de investigación para su implementación como agentes de control biológico debido a sus características de alta capacidad de colonización de la raíz y de supervivencia que le confieren las esporas (Kloepper et al., 1992; Van Veen et al., 1997); es un grupo de bacterias que se encuentran en diversos nichos ecológicos incluyendo suelo, agua y aire (Pankaj et al., 2012). Jacobsen et al. (2004) señalaron que Bacillus spp. son agentes de control biológico que tienen un gran potencial como herramienta en un sistema de manejo integrado de plagas con tendencias hacia un manejo sustentable. Una de las investigaciones que demostró lo señalado por Jacobsen et al. (2004) son los resultados obtenidos por Zhang et al. (2009) quienes aplicaron B. subtillis en tratamiento a semilla y directo al suelo, en cultivo de soya contra Fusarium oxysporum y F. graminearum, y reportaron que reduce la severidad de pudrición de raíces por 68 a 74% e incrementa la emergencia en 13 a 17%, la altura en 9 a 18%, y el peso seco de raíz de 8.4 a 19%. Veerubommu et al. (2011) encontraron que una mezcla de rizobacterias (Bacillus atrophaeus + Burkholderia cepacia) reducen la incidencia de F. oxysporum f. sp. gladioli bajo condiciones de producción en invernaderos y en experimentos de campo fue de 48.6 y 46.1%, comparado con el tratamiento con fungicida (carbendazim) que reportó una reducción de 51.5 a 47.1%. Turner y Backman (1991) mostraron que B. subtilis podía colonizar consistentemente el sistema radical de cacahuate. El tratamiento a las semillas de cacahuate reportó una emergencia mayor que los no tratados y los resultados de vivero se repitieron en ensayos de campo. Dukare et al. (2011) señalaron resultados similares a los autores anteriores en el tratamiento de semilla y en composta con B. subtilis contra el ahogamiento ocasionado en plántula por Pythium aphanidermatum, P. debaryanum, Rhizoctonia solani y Fusarium oxysporum, donde sus resultados mostraron reducción de la incidencia y severidad de la enfermedad. Chae et al. (2006) evaluaron una composta conteniendo diversas bacterias con capacidad de producir chitinasas, entre ellas B. subtillis, como enmienda de suelo contra la marchitez del chile ocasionada por Phytophthora capsici y concluyeron que se abate el efecto del patógeno creando condiciones supresivas en el área de la rizósfera.
CONCLUSIONES
Los resultados de este trabajo indican que el uso de Trichoderma spp., B. subtilis o la mezcla de ambos, en algunos casos, debe ser un tratamiento preventivo en el material de propagación en el cultivo de Agave tequilana Weber var. Azul, ya que se establecen las poblaciones de antagonistas creando un ambiente de equilibrio en el área de la rizósfera que no permite que las poblaciones de Fusarium spp. se disparen y se mantegan densidades de UFC que no superen las 100 UFC g-1; también esta colonización será de apoyo cuando las plantas sean llevadas a campo y sean sometidas al estrés del transplante y enfrentadas a la población nativa de organismos habitantes de los diferentes suelos.
LITERATURA CITADA
Barnett, H. L. and Hunter, B. B. 1998. Illustrated genera of imperfect fungi. Fourth edition. APS-Press The American Phytopahtological Society. St. Paul Minnesota. 218p. [ Links ]
Byerly, M. K. F. 2007. Prólogo. P 7-8 in Pérez y Del Real (ed). Conocimiento y prácticas agronómicas para la producción de Agave tequilana Weber en la zona de denominación de origen del tequila. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Centro de Investigación Regional del Pacífico Centro. Libro técnico No. 4, Tepatitlán, Jalisco. [ Links ]
Carballo, S.M. y Díaz, C. A. 2008. Evaluación de agentes de biocontrol contra la marchitez del agave causada por Fusarium spp. bajo condiciones de invernadero en agave tequilero (Agave tequilana Weber var. Azul) en Tequila, Jalisco. Tesis de licenciatura. Universidad Autónoma Chapingo. [ Links ]
Chae, D.H., Jin, R.D., Hwangbo, H., Kim, Y.W., Kim, Y.C., Park, R.D., Krishnan, H.B. and Kim, K.Y. 2006. Control of late blight (Phytophthora capsici) in pepper plant with compost containing multitude of chitinase producing bacteria. Biocontrol 51: 339-351. [ Links ]
Crespo, G. M. R., González, E.D.R., Rodríguez, M. R., Rendón, S.L.A., Del Real L. J. I. y Torres, M.J.P. 2013. Evaluación de la composta de bagazo de agave como componente de sustratos para producir plántulas de agave azul tequilero. Revista Mexicana de Ciencias Agrícolas, vol. 4 :1161-1173. [ Links ]
CRT, Consejo Regulador del Tequila. 2005. Plagas y enfermedades del Agave tequilana Weber var Azul. Ed. Pandora. Impreso en México. 123p. [ Links ]
CRT, Consejo Regulador del Tequila. 2010. Actualización de la base de datos y diagnóstico fitosanitario: Agave tequilana Weber Var. Azul. Comité técnico agronómico-Subcomite de fitosanidad. 10p. [ Links ]
Cuevas, A.F. y Domínguez, V. X. 2007. Evaluación in vitro de aislados de Trichoderma spp. Encontrados en la region de Tequila, Jalisco contra Fusarium spp. Tesis de licenciatura. Universidad Autónoma Chapingo. [ Links ]
Dukare, A.S., Prasanna, R., Dubey, S. Ch., Nain, L., Chaudhary, V., Singh, R. and Saxena, A. K. 2011. Evaluating novel microbe amended composts as biocontrol agents in tomato. Crop Protection 30: 436-442. [ Links ]
Fucikovsky-Zak, L. 2001. Tristeza and death of Agave tequila Weber, var .azul. Ed. De Boer, S.H., In: Plant Pathogenic Bacteria. Kluwer Academic Publishers. Dordrecht, Boston, London. 454p. [ Links ]
Gnanamanickan, S. S. 2002 . Biological control of crop diseases. Mercel Dekker, Inc. USA. 468p. [ Links ]
Harman, G.E. 2000. Myths and dogmas of biocontrol. Changes in perceptions derive from research on Ttrichoderma harzianum T-22. Plant Disease 84: 393. [ Links ]
Harman, G.E., Lorito, M., and Lynch, J. M.2004. Uses of Trichoderma spp. To remediate soil and water pollution. Advances in Applied. Microbiology 56:313-330. [ Links ]
Harman, G.E. 2006. Overview of mechanisms and uses of Trichoderma spp. Phytopathology 96:190-194. [ Links ]
Harman, G.E., Howell, C.R., Viterbo, A., Chet, I., Lorito, M., 2004. Trichoderma Species-opportunistic, avirulent plant symbionts. Nature Rivews Microbiology 2:43-56. [ Links ]
Horst, L. E., Locke, J., Krause, C. R., McMahon, R. W., Madden, L. V., and Hoitink, H. A. J. 2005. Suppression of Botrytis blight of begonia by Trichoderma hamatum 382 in peat and compost-amended potting mixes. Plant Disease 89:1195-1200. [ Links ]
Howell, C. R. 2002. Cotton seedling pre-emergence damping-off incited by Rhizopus oryzae and Pythium spp. and its biological control with Trichoderma spp. Phytopathology 92:177-180. [ Links ]
Jacobsen, B. J., Zidack, N. K., and Larson, B. J. 2004. The role of Bacillus-based biological control agents in integrated pest management systems: Plant diseases. Phytopathology 94:1272-1275. [ Links ]
Kloepper J.W, Tuzun S, Kuc J. 1992. Proposed definitions related to induced disease resistance. Biocontrol Science Technology 2:349-351. [ Links ]
Lorito, M., Woo, S. L., Harman, G. E. and Monte, E. 2010. Translational research on Trichoderma: from Omics to the field. Annual Review of Phytopathology. 48: 395-417. [ Links ]
Luna-Hernández G.1996. Pudrición de tallo de Agave tequila Weber, var.azul en el estado de Jalisco, México. Tesis de Licenciatura. Universidad Autónoma de Chapingo. [ Links ]
Madden, L. V., Hughes, G., and van den Bosch, F. 2007. The study of plant disease epidemics. APS Press, The American Phytopathological Society St. Paul, Minnesota U.S.A. 421 p. [ Links ]
Pankaj, K., Dubey, R.C. and Maheshwari, D.K. 2012. Bacillus strains isolated from rhizosphere showed plant growth promoting and antagonistic activity against phytopathogens. Microbiological Research 167: 493-499. [ Links ]
Pérez, D.J.F y Del Real, J.I. 2007. Conocimiento y prácticas agrónomicas para la producción de Agave tequila Weber en la zona de denominación de origen de tequila. Prometeo editores e INIFAP, Guadalajara, Jalisco México. 195 p. [ Links ]
Porra, R.J., Thompson, W.A. and Kriedemann, P.E. 1989. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta, 975: 384-394. [ Links ]
Schaad, N. W., Jones, J. B. and Chun, W. 2001. Laboratory guide for the identification of plant pathogenic bacteria. 3th ed. St. Paul, Minnesota. APS Press. 370 pp. [ Links ]
Smith, N. S, J. E. DeVay and W. Hsieh. 2002. Soilborne populations of Fusarium oxysporum f. sp. vasinfectum, a cotton wilt fungus in California fields. Mycologia 93: 737-743. [ Links ]
Turner, J. T., and Backman, P. A. 1991. Factors relating to peanut yield increases after seed treatment with Bacillus subtilis. Plant Disease 75:347-353. [ Links ]
Valiuskaite, A., Surviliene, E. and Raudonis, L. 2008. Effect of Mycostop on Fusarium root-rot agents of raspberry. Sodininkyste ir Darzininkyste 27 : 47-51. [ Links ]
Van Veen , J. A., Van Oberbeek, L. S . and Van Elsas, J.D. 1997. Fate and activity of microorganisms introduced into soil. Microbiology Molecular Review 61:121-135. [ Links ]
Veerubommu, S., Nandina, K., Markandey S., Sukhjinder, S. and Ramdeen, P. 2011. Biocontrol of vascular wilt and corm rot of gladiolus caused by Fusarium oxysporum f. sp. gladioli using plant growth promoting rhizobacterial mixture. Crop Protection 30:807-813. [ Links ]
Vicente, R. I., y Del Real, J.I. 2007. Métodos de propagación del Agave tequilana Weber var. Azul. P 57-67 in Rulfo V., F.O., Pérez, D. J.F., Del Real, L. J. I. y Byerly, M. K. F. 2007. (ed). Conocimiento y prácticas agronómicas para la producción de Agave tequilana Weber en la zona de denominación de origen del tequila. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Centro de Investigación Regional del Pacífico Centro. [ Links ]
Virgen-Calleros, G. 2000. Epidemiología y manejo integrado de problemas fitosanitarios en Agave tequilana Weber, var. azul. Departamento de producción agrícola. CUCBA. U de G. Informe técnico para el programa general de apoyo y desarrollo tecnológico a la cadena productiva agave-tequila. [ Links ]
Zhang, J.X., Xue, A.G., and Tambong, J.T. 2009. Evaluation of seed and soil treatments with novel Bacillus subtilis strains for control of soybean root rots caused by Fusarium oxysporum and F. graminearum. Plant Disease 93:1317-1323. [ Links ]














