Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.28 n.2 Texcoco Jan. 2010
Notas fitopatológicas
Peroxidación Lipídica como Marcador de Muerte Celular en Cultivos Celulares de Cempasúchil (Tagetes erecta L.)
Lipid Peroxidation as a Marker of Cell Death in Cell Cultures of Mexican Marigold (Tagetes erecta L.)
Joaquín Alejandro Qui–Zapata1, Luis Manuel Peña–Rodríguez2, Lizbeth Arianelly Castro–Concha3 y María de Lourdes Miranda–Ham3
1 Unidad de Biotecnología Vegetal, Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco, Av. Normalistas No. 800, Colinas de la Normal, Guadalajara, Jalisco, México. CP 44270.
2 Unidad de Biotecnología.
3 Unidad de Bioquímica y Biología Molecular de Plantas, Centro de Investigación Científica de Yucatán, Calle 43 No. 130, Chuburná de Hidalgo, Merida, Yucatán, México. CP 97200. Correspondencia: mirham@cicy.mx.
Recibido: Diciembre 18, 2009
Aceptado: Octubre 25, 2010
Resumen
La peroxidación de lípidos en las plantas es una característica importante de la muerte celular hipersensible durante las interacciones incompatibles o no hospedero especificas, de las plantas con patógenos. El ensayo colorimétrico 1–metil–2–fenilindol ha sido considerado como específico en sistemas animales, pero su aplicabilidad a los tejidos de las plantas sigue siendo desconocida. En el presente estudio se reporta la utilización en cultivos celulares de Tagetes erecta L. (cempasúchil) tratados con peróxido de hidrógeno. Los resultados sugieren una estrecha relación entre el grado de daño de la membrana, resultante de la peroxidación lipídica y la viabilidad celular.
Palabras clave: Método colorimétrico, per–oxidación lipídica, malondialdehído, estrés oxidativo.
Abstract
Lipid peroxidation in plants is an important feature of hypersensitive cell death during incompatible or non–host interactions of plants with pathogens. Malondialdehyde is a marker of oxidative lipid injury. The 1 –methyl–2–phenylindole colorimetric assay has been considered specific for the quantitation of malondialdehyde in animal systems, but its applicability to plant tissues remains unknown. In here, we report its utilization in cell cultures of Tagetes erecta L. (cempasúchil) treated with hydrogen peroxide. Our results suggest a close relationship between the extent of membrane damage that resulted from lipid peroxidation and cell viability.
Keywords: Colorimetric assay, lipid peroxidation, malondialdehyde, oxidative stress.
La per–oxidación lipídica (PL) en las plantas es una característica importante de la muerte celular hipersensible durante las interacciones, incompatibles o no de hospedero especificas de las plantas con patógenos (Göbel et al., 2003). Con frecuencia, se utiliza al malondialdehído (MDA) como un marcador de daño oxidativo de lípidos y su concentración varía dependiendo el tipo de estrés al que se sometan las células. Ha sido cuantificado por diversos metodos, siendo el más utilizado el ensayo de sustancias reactivas del ácido tiobarbitúrico (SRATB). Los reactivos usados en esta técnica son de venta restringida en los paises que siguen los criterios dictados por la Organización Mundial de la Salud, incluyendo México. Un metodo colorimétrico mejorado, basado en la reacción de 1–metil–2–fenilindol con el MDA, para producir un cromóforo azul/púrpura con un máximo de absorbancia a 586 nm, fue desarrollada para las células de mamíferos (Gerard–Monnier et al., 1998), y ahora está siendo aplicado a los sistemas vegetales (Johnston et al., 2007). El presente trabajo se enfoca en reportar su uso para medir el MDA producido en cultivos celulares de Tagetes erecta tratados con peróxido de hidrógeno.
MATERIALES Y MÉTODOS
Los procedimientos utilizados para la inducción de cultivos celulares, así como el análisis de viabilidad celular están descritos en Qui et al., (2010). Las muestras para la cuantificación de MDA se prepararon de la siguiente manera: Las células tratadas con peróxido fueron filtradas y se tomó una muestra de 0.5 g. Ésta fue congelada y pulverizada en nitrógeno líquido. Se añadieron diez mililitros de 20 mM Tris–HCl (pH 7.4) y la mezcla fue transferida a tubos Corex. Después se agregaron 100 μ de 0.5 M hidroxitolueno butilado y centrifugados a 10,000 x g por 20 min a 4°C, hasta que el sobrenadante se aclaró. Las alícuotas (200 μl) del sobrenadante se transfirieron a micro–tubos. Una solución de N–metil–2–fenilindol en acetonitrilo: metanol (3:1; v/v) se preparó en fresco para el ensayo. Para el testigo (A0), 200 μl de 20 mM Tris–HCl (pH 7.4) se agregaron a 650 μl de N–metil–2–fenilindol, y fue procesado de la misma manera que las muestras (adición de 150 μl HCl, seguido de incubación). A cada tubo de 200 μl de la muestra tratada, se le agregaron 650 μl de N–metil–2–fenilindol y se mezclaron en un vortex. Después de esto, se agregaron 150 μl de HCl y se mezcló de nuevo. Los tubos se incubaron a 45°C por 60 minutos y fueron centrifugados hasta obtener un sobrenadante claro. Su absorbancia se determinó a 586 nm. Se preparó una curva estándar por medio de la dilución de 20 μl de 10 mM 1,1,3,3 ,–tetrametoxipropano (TMOP) en 10 ml de agua milliQ. Se prepararon una serie de diluciones correspondientes a 0, 0.5,1, 2,3 y 4 μM de TMOP y los tubos se trataron como ya se mencionó anteriormente. Los datos de absorbancia fueron utilizados para obtener una ecuación de la curva estándar (y = 0.113x – 0.002). La observancia neta (A586) se calculó restando la absorbancia del control (A0) de cada uno de los valores de absorbancia de las muestras. La concentración de MDA de las muestras se determinó utilizando la ecuación siguiente:
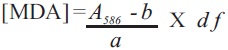
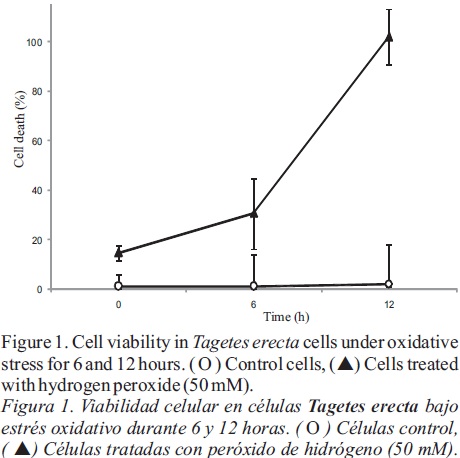
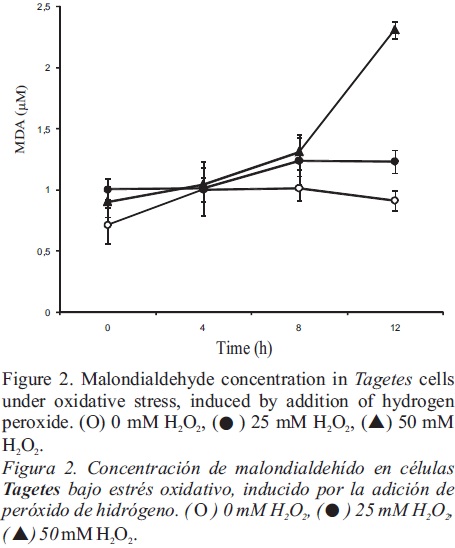
[MDA], concentración en la muestra (μM); A586 , absorvancia neta de la muestra; a, pendiente de la curva estándar (0.113); b, intercepto de la curva estándar (0.002); d f, factor de dilución. Con el fin de determinar los parámetros de inducción, se determinó la variabilidad celular en diferentes períodos de tiempo (0, 6 y 12 h; Figura 1) despues de un tratamiento de 50 mM H2O2. Después de 6 horas, la muerte celular en los cultivos tratadas fue de 30% en comparación con el testigo; mientras que a las 12 horas, todas las células que habían recibido el tratamiento estaban muertas. A partir de estos resultados, se eligieron tiempos de muestreo de 0,4, 8 y 12 h, y concentraciones de H2O2 de 25 y 50 mM para inducir estrés oxidativo en las suspensiones, con el fin de medir la concentración de MDA, resultante de la PL. Como se muestra en la Figura 2, el tratamiento con 25 mM de H2O2 resultó en bajos niveles de MDA, lo cual no difirió mucho de los del testigo después de 8 horas de tratamiento. Empeoró, cuando se utilizó la concentración más alta, la acumulación de MDA fue significativa después de 8 horas, alcanzanzando su nivel máximo a las 12 horas de tratamiento. La disminución en las tasas de supervivencia de las células tratadas con H2O2 (Figura 1) se correlacionó positivamente con un incremento en la concentración de MDA (Figura 2) como un marcador de PL. Este resultado sugiere una relación estrecha entre el daño a las membranas, resultante de la PL y la viabilidad celular. Es importante señalar que este ensayo representa un sustituto viable de las SRATB en cultivos celulares de Tagetes erecta para evaluar los niveles de MDA, y representa una herramienta adecuada en la búsqueda de marcadores de muerte celular.
J.A.Q. fue apoyada por una beca del Consejo Nacional De Ciencia y Tecnología (CONACYT, México) (183263).
LITERATURA CITADA
Gerard–Monnier, D., Erdelmeier, I., Regnard, K., Moze–Henry, N., Yadan, J.C., and Chaudiere, J. 1998. Reactions of 1 –methyl–2–phenylindole with malondialdehyde and 4–hydroxyalkenals. Analytical applications to a colorimetric assay of lipid peroxidation. Chemical Research in Toxicology 11:1176–1183. [ Links ]
Göbel, C., Feussner, I., and Rosahl, S. 2003. Lipid peroxidation during the hypersensitive response in potato in the absence of 9–lypoxygenases. The Journal of Biological Chemistry 278:52834–52840. [ Links ]
Johnston, J.W., Horne, S., Hardong, K., and Benson, E. 2007. Evaluation of the 1–methyl–2–phenylindole colorimetric assay for aldehydic lipid peroxidation products in plants: Malondialdehyde and 4–hydroxynonenal. Plant Physiology and Biochemistry 45:108–112. [ Links ]
Qui, J.A., Castro–Concha, L.A., García–Sosa, K., Miranda–Ham, M.L., and Peña–Rodríguez, L.M. 2010. Is zinniol a true phytotoxin? Evaluation of its activity at the cellular level against Tagetes erecta. Journal of General Plant Pathology 76:94–101. [ Links ]














