Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.28 n.2 Texcoco Jan. 2010
Artículos científicos
Uso de Portainjertos Resistentes para el Control de la Fusariosis (Fusarium oxysporum f. sp. lycopersici Snyder & Hansen raza 3) del Tomate (Lycopersicon esculentum Mill) en Condiciones de MallaSombra
Resistant Rootstocks Utilization for Fusarium Control (Fusarium oxysporum f. sp. lycopersici Snyder & Hansen race 3) in Tomato (Lycopersicon esculentum Mill) under Shade Conditions
Emma Paulina Báez–Valdez1, José Armando Carrillo–Fasio1, Manuel Alonzo Báez–Sañudo1, Raymundo Saúl García–Estrada1, José Benigno Valdez–Torres1 y Rosalba Contreras–Martínez1
1 Centro de Investigación en Alimentación y Desarrollo, A.C., Coordinación Culiacán, km 5.5 Carr. Culiacán–El Dorado, Culiacán, Sinaloa. CP 80129. Correspondencia: acarrillo@ciad.edu.mx.
Recibido: Mayo 25, 2010
Aceptado: Agosto 18, 2010
Resumen
El objetivo del presente estudio fue evaluar el comportamiento de cuatro portainjertos de tomate: Multifort (DeRuiter), Aloha (Takii), RT–160961 (Takii) y Vigostar 10 (Hazera) injertados con cinco híbridos de tomate bola: TL–41500 (Zeraim Gedera), Imperial (Enza Zaden), Pilavy (Rogers), Liberty (Hazera) y Aegean (Enza Zaden), inoculados con el hongo Fusarium oxysporum f. sp. licopersici raza 3 (Fol 3), causante de la Fusariosis, en base a resistencia de la enfermedad y productividad. El estudio se realizó durante seis meses, llevándose a cabo evaluaciones mensuales del desarrollo de la enfermedad. Se observó que el material Multifort presentó resistencia, ya que no se observaron plantas con presencia de síntomas de la enfermedad en ninguna de sus combinaciones con los cinco híbridos. Por otra parte, Vigostar 10, Aloha y RT–41500 resultaron tolerantes, ya que se observaron algunas plantas con síntomas de la enfermedad. En cuanto al rendimiento, las mejores combinaciones se dieron con los portainjertos Multifort y Vigostar 10, inj ertados con el híbrido Imperial, en las cuales se obtuvo un incremento en la producción de alrededor de un 170% respecto al híbrido sin injertar. Fotomicrografías de las raíces de los patrones Multifort y Vigostar 10 mostraron diferencias en la organización celular respecto al híbrido Imperial, el cual es altamente susceptible a Fol 3. Así mismo, se observó la presencia de barreras estructurales como tílides en los patrones Multifort y Vigostar 10, actuando como un mecanismo de resistencia ante la presencia de Fol 3. Referente a los estudios histoquímicos, los patrones (Multifort y Vigostar 10) mostraron mayor presencia de polifenoles comparado con el híbrido Imperial (susceptible), considerando a estos compuestos como un factor que interviene en la resistencia que presentan los patrones; contrario a esto, los polisacáridos solubles e insolubles no mostraron suficiente evidencia que los relacione con la resistencia que presentan dichos patrones.
Palabras clave adicionales: Genética, manejo.
Abstract
The present study is aimed to evaluate the performance of four tomato rootstocks: Multifort (DeRuiter), Aloha (Takii), RT–160961 (Takii) and Vigostar 10 (Hazera) grafted with five tomato bola hybrids: TL–41500 (Zeraim Gedera), Imperial (Enza Zaden), Pilavy (Rogers), Liberty (Hazera) and Aegean (Enza Zaden), inoculated with the fungus Fusarium oxysporum f. sp. licopersici race 3 (Fol 3), which causes Fusarium based on disease resistance and productivity. The study was conducted for six months, performing monthly reviews of the disease development. It was revealed that the Multifort material was resistant, as no plants were observed in the presence of symptoms of the disease in any of their combination with the five hybrids. Moreover, Vigostar 10, Aloha and RT–41500 were tolerant, due to the fact that there were some plants with symptoms of the disease. Regarding performance, the best combinations were obtained with the rootstocks Multifort and Vigostar 10 grafted with the Imperial hybrid, in which there was an increase in production of about 170% compared to the hybrid without grafting. Differences in cell organization on the hybrid Imperial photomicrographs were revealed by roots of Multifort and Vigostar 10 standards, which is highly susceptible to Fol 3. Similarly, the presence of structural barriers such as tyloses Multifort and Vigostar 10 standards was observed, acting as a resistance mechanism in the presence of Fol 3. An increased presence of polyphenols compared with the hybrid Imperial (susceptible), was revealed by histochemical studies concerning the standards (Multifort and Vigostar 10), considering these compounds as a factor in the resistance by employers; opposite to this, soluble and insoluble polysaccharides did not reveal enough evidence relating the resistance of those standards.
Additional keywords: Genetic, management.
INTRODUCCIÓN
Entre las enfermedades del tomate que afectan a la raíz, destaca la marchitez o fusariosis, ocasionada por el hongo Fusarium oxysporum Schlecht f. sp. lycopersici Snyder & Hansen (Fol). En regiones calidas como las del estado de Sinaloa, México, la Fusariosis es muy severa en los cultivos de tomate, desarrollados bajo condiciones de campo abierto o protegido, ocasionando fuertes daños en los híbridos que muestran susceptibilidad al ataque de este fitopatógeno. Los daños se presentan con mayor severidad cuando las plantas son sometidas a un período de estrés en las etapas de floración y fructificación. La magnitud del daño ocasionada por esta enfermedad en Sinaloa es muy variada, donde se reporta que el rendimiento del tomate cultivado el lotes infestados, ha disminuido hasta en un 50% debido al ataque de la enfermedad, tanto en campo abierto como en invernadero (Carrillo–Fasio et al., 2003; García y Valenzuela, 2009). Los síntomas inicialmente se presentan con una clorosis foliar en un sector de la planta y a medida que la enfermedad progresa, el amarillamiento se observa de forma gradual en la mayor parte del follaje (Figura 1–A), ocasionando la marchitez y posteriormente la muerte de la planta, sin producir fruta o en ocasiones es escasa. El tejido vascular en la base del tallo presenta coloración castaño oscuro, extendiéndose hasta el extremo apical del tallo (Figura 1–B). El color pardo en la parte interna del tallo es característico de la enfermedad, por lo que es utilizado para su identificación, mientras que la médula permanece libre de la infección. La infección del fruto (Figura 1–C) aparece de forma ocasional mediante coloración café oscuro en el tejido vascular (Jones y Jiménez, 2001). En Sinaloa, el control de las enfermedades radiculares en el cultivo de tomate mediante la utilización de plaguicidas (fungicidas y fumigantes del suelo) ha ayudado a mantener altos rendimientos y satisfacer la calidad de los alimentos; sin embargo, en años recientes estas contribuciones han sido desafiadas en varios reportes que sugieren que los efectos negativos sobre el medio ambiente pesan más que su beneficio a la sociedad. Si bien es cierto que el uso de estos agroquímicos ha permitido obtener incrementos substanciales en la producción; sus efectos adversos están impactando de manera significativa la sustentabilidad de la agricultura (Watson et al., 1992). La práctica del monocultivo y la contaminación por el uso indiscriminado de agroquímicos, han impactado en la agricultura, reduciendo la biodiversidad (microorganismos) de los agro ecosistemas, ocasionando la inestabilidad de los mismos, la cual se refleja, entre otros efectos nocivos, en una mayor incidencia y severidad de esta enfermedad en las plantas de tomate. Esto y los problemas de seguridad y salud pública inherentes a la fabricación y uso de agroquímicos han conducido a la búsqueda y establecimiento de alternativas ecológicas de manejo de las enfermedades. Por lo anterior, surge el interés por el uso de tecnologías de agricultura protegida y subsecuentemente el uso de la resistencia genética para el manejo integrado de enfermedades, en especial con el uso de portainjertos resistentes a las enfermedades de la raíz. Este método consiste en cultivar una planta susceptible, pero altamente productiva, con el sistema radicular de otra planta resistente a la enfermedad que se pretende controlar. El uso de portainjertos constituye actualmente una alternativa que podría sustituir el control químico para el combate de las enfermedades radiculares en el cultivo de tomate; ya que además de su elevado costo, el control químico trae como consecuencia el desarrollo de resistencia en los patógenos, así como problemas de contaminación y toxicidad. Así mismo, otros propósitos con el uso de injertos, son la tolerancia a estrés por temperaturas, tolerancia a la salinidad, tolerancia a condiciones de sequía del suelo y adicionalmente el incremento del vigor de la planta y aumentar el rendimiento (Godoy y Castellanos, 2009). En los últimos diez años la actividad hortícola en Sinaloa, principalmente en el cultivo de tomate ha venido sustituyendo su sistema de producción de campo abierto a cultivo protegido, con un incremento de superficie protegida de 65 hectáreas para el ciclo hortícola 1998–1999 a 2,485 hectáreas para el ciclo hortícola 2007–2008, de las cuales el 40.3 % (923 hectáreas) corresponden al cultivo de tomate, dividido en 679 hectáreas para tomate bola y 244 hectáreas a tomate Roma o Saladette (AMHPAC, 2008). La técnica del injerto se basa en el uso de la combinación de patrones resistentes a los patógenos del suelo con variedades y/o híbridos comerciales altamente productivos, con la finalidad de sustituir el uso de fumigantes/fungicidas de suelo en muchos cultivos (Miguel, 1997). Mazollier, 1999 reporta que los portainjertos de tomate más promisorios son híbridos interespecíficos de Lycopersicon esculentum x Lycopersicon hirsutum, los cuales reúnen resistencia al nematodo agallador de raíces Meloidogyne incognita y a patógenos del suelo como Fusarium oxysporum, Verticillium dahlia y Pyrenochaeta lycopersici. Una de las características que sobresale de los portainjertos comerciales es que la resistencia que presentan se enfoca principalmente a patógenos de sistema radicular como: Fusarium oxysporum f. sp. lycopersici razas 1, 2, 3; Fusarium oxysporum f. sp. radicis–lycopersici, Fusarium oxysporum f. sp. melongena, Meloidogyne incognita, M. arenaria, M. javanica, Verticillum dahliae (raza 1 y 2), Verticillum albo–atrum, Pyrenochaeta lycopersici, Ralstonia solanacearum, Phytophthora capsici, Clavibacter michiganensis subsp michiganensis y Sclerotinia sclerotiorum (Mitidieri et al.,2005; Besri, 2003). En estudios previos se ha demostrado la eficacia del uso de portainjertos resistentes a ciertos patógenos en diferentes cultivos hortícolas. Kuniyasu y Yamakawa (1983) reportaron un estudio utilizando dos variedades de tomate KNVF y KVF, híbridos interespecíficos de Lycopersicon esculentum x Lycopersicon hirsutum, los cuales mostraron resistencia a Fusarium oxysporum f. sp . lycopersici raza 3 y Pyrenochaeta lycopersici, por lo que se utilizaron como patrones para injertar dos variedades japonesas (Fukuju 2 y Walter) susceptibles a la marchitez por Fusarium, demostrando que el injerto de variedades susceptibles sobre cultivares resistentes, disminuían considerablemente la incidencia de la enfermedad. Mitidieri et al. (2005), utilizaron como portainjerto el híbrido He–Man (Syngenta) sobre el cual injertaron los híbridos Fortaleza (Syngenta) y Superman (Petoseed). Las plantas injertadas mostraron mayor rendimiento, porcentajes significativamente menores de plantas muertas hasta 30 días después del transplante y plantas con síntomas aéreos de ataque de nematodos. Khaled et al. (2006), reportaron el control de la pudrición de corona y raíz de tomate causada por Fusarium oxysporum f.sp. radicis–lycopersici, mediante el injerto de patrones resistentes Heman y Beaufort en las variedades susceptibles Durintha F1 y Bochra F1 demostrando así el efecto benéfico del uso de portainjertos resistentes sobre desarrollo de la planta, rendimiento y calidad del fruto. Rivard y Louws, (2006) reportan índices de resistencia de diversos portainjertos de tres compañías internacionales: DeRuiter Seeds (Maxifort y Beaufort con moderada resistencia a Fol R1 y alta reistencia a Fol R2); Takii Seeds (Anchor–T, Survivor y Aegis con alta resistencia a razas de Fol 1 y 2) y Bruinsma Seeds (Body y Robusta con alta resistencia a ambas razas de Fol). En México se realizó la técnica de injerto utilizando los híbridos de tomate Caimán, Imperial y Gironda (Enza Zaden) y el patrón Multifort (De Ruiter), para evaluar la producción (ton/ha) en plantas guiadas a uno y dos tallos demostrando que las plantas injertadas presentaron mayor producción respecto a las no injertadas, con una diferencia de 36 ton/ha a un tallo y 66 ton/ha a dos tallos (Garduño y González, 2007). En este mismo lugar se llevó a cabo un estudio similar con las variedades Caimán y Gironda (Enza Zaden) injertadas sobre Beaufort y Maxifort (De Ruiter) con el fin de evaluar la producción en relación al tamaño del fruto, menor a 200 g o mayor a 300 g, demostrando que la variedad Caimán injertada con Maxifort presentó mayor producción de frutos con peso mayor a 300 g (Garduño y González, 2007). Por otro lado, Ricárdez et al. (2008), realizaron un estudio empleando la técnica de injerto en el cultivo de tomate roma como una alternativa al uso del bromuro de metilo en el control de plagas y enfermedades del suelo, realizando dos combinaciones con los portainjertos: Multifort (DeRuiter) y Spirit (Nunhems), con el híbrido comercial 7705 (Nunhems), bajo condiciones de malla sombra y usando suelo con y sin bromuro de metilo. También utilizaron diferentes densidades de plantas en la malla sombra (50%, 60% y 80%), considerando la distancia entre plantas de 0.60, 0.50 y 0.40 m respectivamente. Ellos encontraron que las combinaciones de los portainjertos Multifort y Spirit con el híbrido 7705, presentaron mayor producción a una densidad del 80% (distancia de 0.40 cm entre plantas con un rendimiento de 187.4 ton/ha en Multifort + híbrido 7705 y de 165.4 ton/ha en Spirit con el híbrido 7705. Considerando los trabajos anteriores y dado el uso extensivo de la técnica de injerto en la producción de tomate en el estado de Sinaloa, se planteó la presente investigación con las combinaciones de cuatro portainjertos: Multifort (DeRuiter), Aloha (Takii), RT–160961 (Takii) y Vigostar 10 (Hazera) y cinco híbridos de tomate tipo bola indeterminado: TL–41500 (Zeraim Gedera), Imperial (Enza Zaden), Pilavy (Rogers), Liberty (Hazera) y Aegean (Enza Zaden); con el objetivo de determinar las mejores combinaciones portainjerto – híbrido comercial de tomate a la resistencia de la Fusariosis (Fusarium oxysporum f sp lycopersici raza 3), con referencia a la severidad de la enfermedad y su productividad, cultivados bajo condiciones de malla sombra. De igual manera, se propuso determinar los mecanismos de resistencia en la supresión a Fol 3 de los portainjertos mencionados.

MATERIALES Y MÉTODOS
El experimento se estableció en una estructura protegida con malla sombra 855 m2, con un 50% de sombreo respecto a la irradiación total del sol, ubicada en el Centro de Investigación en Alimentación y Desarrollo, A.C. (CIAD, A.C.) Coordinación Culiacán, el cual se encuentra ubicado en carretera Culiacán–Eldorado, Km. 5.5. Las semillas de los materiales de los portainjertos: (Multifort (DeRuiter), Aloha (Takii), RT–160961 (Takii) y Vigostar 10 (Hazera); así como, de los híbridos de tomate bola indeterminados: TL–41500 (Zeraim Gedera), Imperial (Enza Zaden), Pilavy (Rogers), Liberty (Hazera) y Aegean (Enza Zaden), se sembraron en charolas de germinación de 120 cavidades con sustrato de musgo, las cuales se saturaron de agua cubriéndose con polietileno negro hasta el inicio de la germinación. Es importante mencionar que la siembra de los híbridos comerciales se efectuó una semana antes que los portainjertos. Una vez germinadas las semillas, tanto de los híbridos comerciales como portainjertos, se sometieron a condiciones de invernadero hasta que los tallos de ambos materiales presentaran un grosor de 0.4 a 0.6 cm de diámetro y/o que presentaran el desarrollo de 3 a 4 hojas verdaderas. Posteriormente, todos los materiales fueron llevados a una cámara de fusión con una temperatura de 25° C y 95% de humedad relativa. El proceso de injerto se realizó mediante la técnica de aproximación, la cual consiste en poner en contacto los tejidos del portainjerto y de la variedad, de manera que las regiones del cambium coincidan y se mantengan estrechamente unidas presionándose con un clip de injerto de silicona (Godoy y Castellanos, 2009). Una vez realizado el injerto, las plantas se mantuvieron en la cámara de fusión por tres días a las condiciones antes mencionadas, disminuyendo la humedad relativa en forma gradual, hasta llegar a 80 – 85 %. Una vez fusionadas las plántulas, las charolas fueron trasladadas al invernadero dejándose 24 horas en sombreo para aclimatarlas y finalmente se trasplantaron en bolsas de 16 L con sustrato de fibra de coco y riego por goteo. El trasplante de cada uno de los materiales (combinación patrón/híbrido comercial) se efectuó el 17 de noviembre del 2007. Para la distribución de las plantas en el invernadero se prepararon camas con dos líneas de plantas, con una separación de 1.80 m entre camas y con una separación entre bolsas de 0.4 m. Es decir, había una densidad de 27,750 plantas por hectárea.
Inoculación de macetas (plantas injertadas). Una vez establecido el trasplante de los injertos a las macetas en la malla sombra, se realizó la inoculación de hongo Fusarium oxysporum f sp. lycopersiciraza3, previamente identificado a nivel de raza fisiológica, mediante el uso de líneas diferenciales de tomate: EP7, Packmor, Walter, IR3–301–301 y el híbrido SUN–0289 (Carrillo–Fasio et al., 2003) y corroborada con la identificación por medio de técnicas moleculares (PCR) por parte del Dr. Tsutomo Arie de la Universidad de Agricultura y Tecnología de Tokio Japón (Báez, 2009). Aplicando 50 mL de una suspensión de esporas de 1 X 106 esporas/mL (previamente determinado con evaluaciones de conteo de esporas con la ayuda de un hematocitometro) en la base del tallo de cada planta por maceta (50,000 esporas por gramo de sustrato). Entre cada combinación patrón / híbrido comercial, se dejaron como plantas testigo o convencionales; macetas con cada material híbrido sin injertar, con el propósito de determinar el comportamiento de cada híbrido comercial en la resistencia/susceptibilidad a Fusarium oxysporum f. sp lycopersiciraza 3 (Carrillo–Fasio et al., 2003).
Severidad de Fusariosis. Posterior a la inoculación de las plantas, se evaluó cada mes la severidad de la enfermedad. En las plantas inoculadas de cada uno de los injertos se determinó la presencia de los síntomas de la enfermedad, para lo cual se consideró la severidad ocasionada por Fol, tomando en consideración la escala arbitraria propuesta por Vakalounaks y Fragkiadakis, (1999), donde: 0 Planta sana, 1 Planta clorótica, 2 planta marchita y 3 Planta muerta. Dado que la escala de medición utilizada fue nominal, se transformaron los datos a porcentajes de severidad empleando la fórmula propuesta por Vakalounaks y Fragkiadakis (1999).
Evaluación de productividad. Utilizando una balanza electrónica con capacidad de 40 kg, se evaluó la productividad en relación al número de frutos y al peso total de los mismos por planta, así como el tamaño de los frutos, tomando como referencia la escala propuesta por la USDA (1997), que considera los tamaños MXL, XL, L, M, S y rezaga.
Estudio histológico e Histoquímico. Las raíces inoculadas y no inoculadas con Fol 3 de las plántulas de los portainjertos Multifort, Vigostar 10 y del híbrido Imperial, fueron utilizadas para el estudio histológico. Parte vello se inocularon diez plantas por separado de cada uno de los patrones e híbridos de interés con la cepa de Fol 3, a concentración de 1x1 06 esporas/ml (determinando la concentración con la ayuda del hematocitometro), sumergiendo la raíz de las plántulas durante 30 minutos en la suspensión de esporas (100 mL), las cuales posteriormente fueron sembradas en macetas de 1.0 L, con sustrato suelo–arena (50–50) esterilizada. Las plantas inoculadas y sus respectivos testigos (sin inoculación) fueron conservadas en el invernadero, hasta que las plantas del híbrido imperial (testigo positivo) manifestara los síntomas de la enfermedad (clorosis foliar). Posteriormente se realizaron cortes transversales en la base del tallo para corroborar la presencia de necrosis en los vasos conductores de xilema y floema (Santos y López, 1993). Igualmente, se realizaron pruebas histológicas en las raíces de los patrones resistentes a Fol raza 3 y en el híbrido susceptible para determinar cambios estructurales o morfológicos. Las muestras de raíz se cortaron en trozos de 2 cm de largo y se fijaron con FAA (formaldehido–ácido acético–alcohol–agua). Posteriormente se realizó la deshidratación la cual consistió en tratar los tejidos con una serie de soluciones de alcohol (50, 70, 96 y 100%), con el fin de preparar el tejido para la infiltración e inclusión en parafina. Secciones finas (10 μm) se cortaron del material inmerso en la parafina con un micrótomo y se montaron en los portaobjetos. Para la determinación de polifenoles las raíces se tiñeron con permanganato de potasio al 1% y posteriormente se observaron los tejidos vegetales bajo el microscopio compuesto. La literatura reporta que los polifenoles presentes en los tejidos vegetales, adquieren una coloración café (Curtis, 1986). Para la determinación de polisacáridos solubles, los tejidos de las raíces se tiñeron con ácido peryódico al 0.05%, adquiriendo estos un color magenta (Jensen, 1962). Para la detección de polisacáridos insolubles, igualmente las raíces se tiñeron con ácido peryódico al 0.05%, pasándose posteriormente al reactivo de Schif, donde los polisacáridos insolubles se tiñen de color violeta (Jensen, 1962).
Análisis estadístico. En la evaluación de la severidad se utilizó un diseño de un factor cruzado (Tiempo) y un factor nido (Patrón), tomando las plantas injertadas como unidades experimentales anidadas en el factor Patrón y con medidas repetidas en el factor Tiempo. Los niveles de cada factor fueron: Patrón (Multifort, Vigostar 10, Aloha, RT–169061 y sin patrón) y Tiempo (1 mes, 2 meses, 3 meses, 4 meses y 5 meses), obteniendo un total de 25 tratamientos con 5 injertos (réplicas) cada uno, para un total de 125 observaciones. Para la evaluación de la productividad se realizó un diseño de 2 factores totalmente al azar (Patrón e Híbrido), con los siguientes niveles por factor: Patrón (Multifort, Vigostar 10, Aloha, RT–169061 y sin patrón) e Híbrido (Imperial, Pilavy, TL–41500, Liberty y Aegean) resultando un total de 25 tratamientos, con 3 replicas cada uno, para un total de 75 observaciones. Para los estudios histológicos e histoquímicos se realizó un análisis descriptivo, observando la presencia de estructuras de resistencia y sustancias químicas en raíces de los patrones resistentes a Fol 3 (Multifort y Vigostar 10), teniendo como testigo el híbrido Imperial sin injertar (susceptible).
RESULTADOS Y DISCUSIÓN
Severidad de Fusariosis. Los primeros síntomas de la enfermedad (clorosis) se presentaron en el primer mes (22 días después del trasplante y 15 días después de la inoculación de Fol 3), principalmente en los híbridos sin injertar. Posteriormente se observó un incremento en la severidad de Fol 3 a través del tiempo, principalmente en los híbridos sin injerto (Convencionales), usados como testigos para cada combinación. Los síntomas de la enfermedad en las plantas afectadas se incrementaron a través del tiempo hasta llegar al marchitamiento y muerte de la planta al quinto mes. Los híbridos injertados sobre los patrones Vigostar 10, Aloha y RT–160961 mostraron una misma tendencia, presentando síntomas de clorosis hasta el quinto mes; es decir, presentaron síntomas iniciales de la enfermedad hasta el final del ciclo del cultivo, por lo que se consideran tolerantes a Fol 3 (Cuadro 1). En cambio, los híbridos injertados sobre Multifort no manifestaron daños externos (clorosis, marchitamiento y muerte); así como tampoco daños en la raíz (necrosis radicular y/o vascular) hasta el término del cultivo, por ello se considera a este material completamente resistente a Fol 3. Estos resultados indican que estos patrones o portainjertos pueden ser usados como una alternativa viable de control de patógenos radiculares y en este caso especial sobre la marchitez causada por Fusarium oxysporum f. sp. lycopersici raza 3 en tomate. Resultados obtenidos por Pavlou et al., (2002), demostraron que el uso de patrones resistentes protegen a los cultivos de pepino de patógenos de suelo como Fusarium oxysporum f. sp. radicis–cucumerinum, contrario a lo observado en los híbridos susceptibles sin injertar. Así mismo, Kuniyasu y Yamakawa (1983) probaron que el injerto de los cultivares resistentes KNVF y KVF, con las variedades susceptibles Fukuju 2 y Walter, disminuyeron la incidencia de la marchitez ocasionada por Fusarium oxysporum f. sp. lycopersici raza 3 y Pyrenochaeta lycopersici en plantas de tomate. Si bien esto ya había sido demostrado en ensayos en otros estados de la República Mexicana (Ricárdez et al., 2008), valores similares son reportados por otros autores (Mitidieri et al., 2005), donde mencionan que las plantas injertadas de tomate mostraron porcentajes significativamente menores de plantas enfermas hasta los 30 días después del trasplante y de plantas con síntomas aéreos ocasionados por el ataque de nemátodos y Fusarium oxysporum. Con estos resultados queda demostrado que los cultivares o híbridos que normalmente son utilizados por productores hortícolas en el estado de Sinaloa, México y otras zonas del país, pueden ser injertados sobre este tipo de patrones para conferir resistencia al ataque de este fitopatógeno, sin que disminuya el rendimiento y la calidad la fruta.

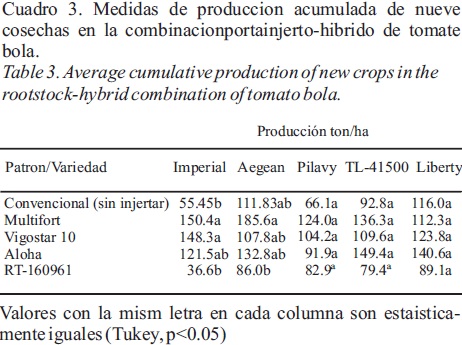
Evaluación de Productividad de Injertos de Tomate Bola. El análisis de varianza (Cuadro 2) para el rendimiento muestra diferencias significativas (P < 0.05) entre las combinaciones portainjerto–híbrido de tomate utilizados. El híbrido Imperial se comportó mejor con los patrones Multifort y Vigostar 10 ya que promediaron mayores rendimientos, siendo estadísticamente iguales con 150.4 y 148.3 ton/ha respectivamente; proporcionando además 28.2 y 32.5 % de producto con calidad de exportación (frutos calibres MXL, XL, L y M); mientras que las combinaciones del híbrido Imperial con el patrón RT–160961 y el híbrido Imperial sin injerto, tuvieron rendimientos de 36.6 y 55.4 ton/ha respectivamente (Cuadro 3). La combinación de los portainjertos con el híbrido Pilavy mostró una tendencia similar. La mayor producción se registró con el portainjerto Multifort con un rendimiento de 124.0 ton/ha, y un promedio del 28.8% con calidad de exportación. Para el híbrido Aegean, la mejor combinación ocurrió con el portainjerto Multifort con una producción de 185.6 ton/ha; aunque en este caso se obtuvo el valor más bajo (25%) en cuanto al porcentaje de frutos de exportación, es decir, hubo una gran cantidad de frutos con defecto como lo es el mal cierre apical (cara de gato). Para las combinaciones de los portainjertos con el híbrido TL–41500, las mejores combinaciones en producción se obtuvieron con los portainjertos Aloha y Multifort, con 149.4 y 136.3 ton/ha, con porcentajes de 31.0 y 30.0 %, respectivamente, de producto con calibres de exportación; sin embargo, en ambas combinaciones se observó un alto porcentaje de daño por pudrición apical del fruto (Blossom end rot). Entre las combinaciones de los portainjertos con el híbrido Liberty, la mayor producción se registró con el portainjerto Aloha (140.6 t/ha); presentando 27.8% de frutos con calidad de exportación. En general, el efecto de las combinaciones portainjerto–híbrido muestra un incremento en el rendimiento de los híbridos, el cual puede atribuirse a los injertos con patrones que presentan características de resistencia o tolerancia a Fol 3, ya que los híbridos sin injertar, Imperial y Pilavy, tuvieron la menor producción, pero al ser injertados aumentaron la producción en la mayoría de los patrones, excepto con RT–160961, combinación que disminuyó la producción de todos los híbridos. De acuerdo a los resultados obtenidos por Ermel et al., (1999). La disminución en la producción de algunos híbridos injertados puede deberse a la incompatibilidad que hay entre el patrón RT–160961 y los híbridos. Esta incompatibilidad puede estar dada conexión vascular discontinua y necrosis vascular por alteraciones fisiológicas, anatómicas y bioquímicas debido a la presencia de fenoles en el área de unión del injerto. Los resultados de esta investigación coinciden con los reportados por Khaled et al., (2006), quienes comprobaron el efecto benéfico del uso de portainjertos resistentes sobre el desarrollo de planta, rendimiento y calidad del fruto de tomate.

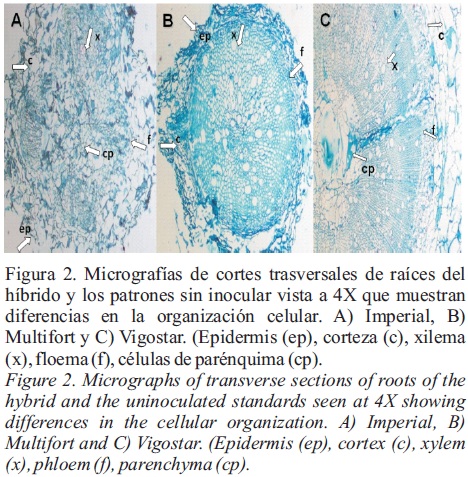
Observaciones histológicas e histoquímicas. En los cortes transversales de lasa raíces se comparó la integridad de los tejidos en el híbrido Imperial sin inocular respecto al inoculado (Figura 2). En este último se aprecia abundante colonización inter e intracelular de micelio de Fusarium oxysporum f. sp. lycopersici raza 3 en la mayor parte del tejido radicular, incluyendo epidermis, corteza, células de parénquima y vasos conductores (Figura 3); sobresaliendo la colonización en células de la corteza; así como la penetración de las hifas de manera intercelular en algunas células de xilema colonizadas intracelularmente, lo que generó severos daños en el tejido inoculado, probablemente debido a toxinas producidas por el patógeno como ácido Fusárico y licomarasmina que actúan matando al protoplasma de las células (Cárdenas, 2005). El estudio histológico de los patrones Vigostar 10 y Multifort revela que la organización celular de las raíces es muy diferente a la organización que presenta el híbrido Imperial, ya que las raíces de Vigostar 10 y Multifort están conformadas por abundante sistema vascular, principalmente de xilema, el cual está distribuido a través de la raíz y una corteza aparentemente de menor grosor principalmente en el caso de Multifort. En la raíz del portainjerto Vigostar 10, se aprecia una corteza de tamaño similar al hibrido Imperial, pero con una mejor delimitación de la corteza. Probablemente este acomodo celular influye en la resistencia preexistente que presentan los patrones, contrario al híbrido Imperial que muestra el sistema vascular discontinuo, encontrándose distribuido en ciertos sectores de la raíz, conformada esta última en su mayoría por tejido parenquimatoso, lo que puede intervenir en la susceptibilidad que presenta este cultivar a Fol 3, ya que la organización del sistema vascular puede tener un efecto en la susceptibilidad relativa de la planta (Beckman y Talboys, 1981). Además, el parénquima está constituido de células vivas con pared celular muy delgada y puede ser desintegrada fácilmente por varias especies de Fusarium, Pythium, Phytophthora y Rhizoctonia (Cárdenas, 2005). El grado de la colonización fungosa fue reducido en tejido de las raíces de las plantas de los portainjertos Multifort y Vigostar 10. Las pocas hifas del patógeno que lograron penetrar al sistema de la raíz, fueron restringidas principalmente a la epidermis y a la corteza externa, mientras que los tejidos internos raramente fueron colonizados. La penetración del patógeno en los tejidos externos de la raíz, se correlacionó con los cambios citológicos caracterizados principalmente por la formación de las aposiciones o barreras físicas formadas por tílides (Figura 4) en vasos de xilema, las cuales son una respuesta de defensa ante la presencia del patógeno (Agrios, 2005). Rojas (1992), menciona que las barreras físicas son los principales mecanismos involucrados en la resistencia de plantas de Lycopersicon esculentum a Fusarium oxysporum f. sp. radisis lycopersici. Resultados similares fueron reportados por García (1994), quien observó la formación de tílides en raíces de plantas de Lycopersicon esculentum cvs. Bonny Best, Contesa y Larma, inoculadas con Fusarium oxysporum f. sp. radicis lycopersici, siendo el material Larma, resistente a este fitopatógeno, donde se presentaron mayor cantidad de tilides, factor que se ha indicado que le confiere la resistencia al fitopatógeno señalado, como se ha indicado.


Determinación de polifenoles como mecanismos de defensa bioquímica. Los resultados de la tinción de los tejidos de los patrones Multifort y Vigostar 10; así como, del híbrido Imperial con permanganato de potasio al 1%; resultaron ser positivos para la presencia de polifenoles, los cuales se tiñeron de café por la oxidación de los compuestos fenólicos, indicando que la técnica de tinción empleada fue correcta. Se observó evidencia suficiente que muestra diferencias en la presencia de estos compuestos dentro de los cultivares, ya que en el tejido sin inocular, los patrones Vigostar 10 y Multifort, mostraron una coloración café menos intensa comparados con el híbrido Imperial, lo cual puede atribuirse al grado de resistencia que presentan los patrones y a la abundante colonización que se observó en el híbrido Imperial. Sin embargo, los tejidos infectados de Vigostar 10 y Multifort mostraron evidencia de una mayor acumulación de polifenoles en las paredes y espacios intercelulares, siendo probablemente una respuesta de defensa benéfica, ya que de acuerdo a lo citado por Cárdenas (2005), los polifenoles proporcionan una barrera melanizada entre la zona de colonización y la zona de defensa, y se manifestó con un aumento en la intensidad de color dentro de estas zonas, contrario a lo observado en Imperial, cuya coloración en los sitios infectados fue menor a la de los patrones, principalmente Multifort.
CONCLUSIONES
El uso del portainjerto Multifort en combinación con los cinco híbridos comerciales presentó el mejor control de la severidad de la fusariosis en comparación con los portainjertos Aloha, RT–160961 y Vigostar 10, así como, con los materiales convencionales (sin injertar), logrando una severidad de la fusariosis del 0%, en comparación con el resto de los portainjertos, que presentaron valores de 6.66 a 9.99% de severidad. Una ventaja adicional del uso de los portainjertos es que permite incrementar la productividad en tamaños de exportación. Respecto a los mecanismos de acción de la resistencia del portainjerto Multifort y la tolerancia de Vigostar 10, se pueden atribuir al tipo de organización celular del xilema que presentan los patrones de manera natural, además de la formación de tílides y mayor presencia de polifenoles. Los polisacáridos solubles e insolubles no se relacionaron en estos patrones como un factor importante en la resistencia de Fusarium oxysporum f. sp. lycopersici raza 3.
Agradecimientos
A Yoshio Smith Félix Gutiérrez (responsable de invernaderos) y al personal de los laboratorios: Brissa Darinka Plata Vargas y Laura Aracely Contreras Angulo, por su apoyo técnico en la producción y
manejo del cultivo de tomate.
LITERATURA CITADA
Agrios, G. N. 2005. Como se defienden las plantas de los patógenos en: Fitopatología. Guzman, M.(ed). 2da ed. Limusa. México, D.F. 952 p. [ Links ]
AMHPAC, 2008. Asociación Mexicana de Horticultura Protegida. www.amhpac.org. [ Links ]
Báez, Valdez, E. P. 2009. Efecto Patrón/Híbrido Sobre Resistencia a la Fusariosis, Productividad y Cambios Histológicos e Histoquímicos en Raíces de Tomate Bola. Tesis de Maestría. Centro de Investigación en Alimentación y Desarrollo. A.C. Culiacán, Sinaloa, México. 101 p. [ Links ]
Beckman, C. H., and Talboys, P. W. 1981. Anatomy of resistance. pp. 431–486. In: Mace, M. E., A. A. Bell, and C. H. Beckman. (eds.). Fungal wilt disease of plants. Academic Press, New York. USA. 726 p. [ Links ]
Besri, M. 2003. Tomato grafting as an alternative to methyl bromide in Morocco. In Annual International Research Conference on Methyl Bromide Alternatives and Emissions Reductions. november 2003. San Diego, CA USA. [ Links ]
Cárdenas, S. E. 2005. Histopatología vegetal. Colegio de postgraduados Montecillo, Edo. de México. 80 p. [ Links ]
Carrillo–Fasio, J. A., Montoya–Rodríguez, T., García–Estrada, R., Cruz Ortega, J., Márquez Zequera, I. y Adriana Josefa Sañudo–Barajas. 2003. Razas de Fusarium oxysporum f. sp. lycopersici Snyder & Hansen, en tomate en el Valle de Culiacán, Sinaloa, México. Revista Mexicana de Fitopatología. 21: 123–127. [ Links ]
Curtis P. J. 1986. Microtecnia Vegetal. Ed. Trillas. México D.F., México. 106 p. [ Links ]
Ermel, F. F., Kervella, J., Catesson, A. M., and Poessel, J. L. 1999. Localizated graft incompatibility in pear/quince (Pyrus communnis/Cydonia oblonga) combinations: multivariate analysis of histological data from 5–month–oldgrafts. Tree Physiology 19:645–654. [ Links ]
García, E. R. 1994. Alteraciones fisiológicas e histológicas inducidas por Fusarium oxysporum f. sp. radicislycopersici en tres cultivares de tomate. Tesis de doctorado. Colegio de Postgraduados. Montecillo estado de México . 124p. [ Links ]
García, E. R. y Valenzuela, U. G. 2009. Marchitez del Tomate y Pudrición de la Corona y raíz. In: Manual de Producción de Tomate en Invernadero. Celaya, Guanajuato, Mexico. Ed. Intagri. 458p. [ Links ]
Garduño, S.I., y González, G.A. 2007. Efecto del injerto y el número de tallos por planta sobre el rendimiento en el cultivo del tomate (Lycopersicon esculentum Mill). Tesis de Licenciatura. Instituto Tecnológico de Roque. Roque Celaya, Guanajuato, México. 102p. [ Links ]
Godoy, H. H, y Castellanos, J. 2009. El injerto en tomate. In: Manual de Producción de Tomate en Invernadero. Celaya, Guanajuato, Mexico. Ed. Intagri. 458p. [ Links ]
Jensen, W.A. 1962. Botanical histochemistry: principles and practice. 3a. ed. Freeman, Ames, Iowa.USA. 389p. [ Links ]
Jones, J. B. y Jiménez G. M. 2001. Plagas y enfermedades del tomate. Mundi–Prensa Libros. Madrid, España. 74p. [ Links ]
Khaled, H., Mejda, D. R., Hayfa, J. K., and Mohamed, E. M. 2006. Control of fusarium crown and root rot of tomato, Caused by Fusarium oxysporum f. sp. radicis–lycopersici by Grafting onto Resistant Rootstocks. Plant Pathology Journal 5:161–165. [ Links ]
Kuniyasu, K. and Yamakawa, K. 1983. Control of Fusarium wilt of tomato caused by Fusarium oxysporum f. sp. lycopersici race 3 by grafting to KNVF and KVF, rootstocks of the interespecific hybrids between Lycopersicon esculentum x L. hisutum. Annual Phytopathology Society Japan 49: 581–586. [ Links ]
Mazollier, C. 1999. Greffage de la tomate en culture sous abri. PHM. Reve Horticole. Editions du Point Veterrinarse 404: 44–48. [ Links ]
Miguel, A. 1997. Grafting for the control of soilborne pathogens. pp. 75–80. In: Bello, A., Gonzalez, J.A., Arias, M. and Rodrigues–Kabana, R. (eds) Alternatives to methyl bromide for the southern European countries. S.C.V. Valencia Spain. 404p. [ Links ]
Mitidieri, M. S., Brambilla, M. V., Piris, M., Piris, E., y Maldonado, L. 2005. El uso de portainjertos resistentes en cultivo de tomate bajo cubierta: resultados sobre la sanidad y el rendimiento del cultivo. INTA Centro Regional Buenos Aires Norte, Buenos Aires, Argentina. 8p. [ Links ]
Pavlou, G. C., Vakalounakis, D. J., and Ligoxigakis, E. K. 2002. Control of root and stem rot of cucumber, caused by Fusarium oxysporum f. sp. radicis–cucumerinum by grafting onto resistant rootstocks. Plant Disease. 86:379–382. [ Links ]
Ricárdez, M., Rodríguez N., Díaz, M. y Camacho F. 2008. Influence of rootstock, cultivar and environment on tomato yield under greenhouse. Departamento de producción vegetal. Universidad de Almería, España. Acta Horticultural 797. ISHS. [ Links ]
Rivard, C., Louws, F. 2006. Grafting for disease resistance in heirloom tomatoes. Department of Agriculture and local governments cooperating. North Carolina State University, North Carolina A & T State University, U.S. 8 p. [ Links ]
Rojas, M. R. I. 1992. Posibles factores bioquímicos involucrados en la resistencia a Fusarium oxysporum f. sp. radicis–lycopercisi en plantas de jitomate. Tesis de Maestría en Ciencias. Colegio de Postgraduados. Montecillo, México. 80 p. [ Links ]
Santos, J. R. M. and López, C. A. 1993. Tomato cultivar differentials for Fusarium oxysporum f. sp. lycopersici races. Horticultura Brasilieira 11: 27–29. [ Links ]
USDA, 1997. United Stated Standards for grades of fresh tomatoes: Agric. Handbook No. 437. U.S. Gov. Printing Office.Washington D.C., USA. 560 p. [ Links ]
Vakalounakis, D. J. and Fragkiadakis, G. A. 1999. Genetic diversity of Fusarium oxysporum isolate from cucumber. Differentiation by pathogenicity, vegetative compatibility and RAPD fingerprinting. Phytopathology 89:161–168. [ Links ]
Watson, R. T., Albritton, D. T., Anderson, S. O., and Lee–Bapty, S. 1992. Methyl bromide: its atmospheric science, technology and economics. Montreal Protocol Assessment Suppl., United Nations Environment Programme, Nairobi, Kenya: 234 p. [ Links ]














