Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.26 no.2 Texcoco Jan. 2008
Artículos científicos
Reacción de Germoplasma Mejorado de Soya [Glycine max (L.) Merr.] a Macrophomina phaseolina (Tassi) Goidanich y Déficit Hídrico
Reaction of improved soybean [Glycine max (L.) Merr.] germplasm to Macrophomina phaseolina (Tassi) Goidanich and drought stress
Homar René Gill–Langarica1, Nicolás Maldonado–Moreno2, Víctor Pecina–Quintero2, y Netzahualcóyotl Mayek–Pérez1
1 Instituto Politécnico Nacional (IPN), Centro de Biotecnología Genómica (CBG), Apdo Postal 152, Reynosa, Tamaulipas, México CP 88730. Correspondencia: nmayek@ipn.mx
2 INIFAP, Campo Experimental Río Bravo, Apdo. Postal 172, Río Bravo, Tamaulipas, México CP 88900.
Recibido: Marzo 16, 2007
Aceptado: Mayo 17, 2007
Resumen
La reacción a una cepa altamente virulenta de Macrophomina phaseolina se evaluó en 73 líneas experimentales y diez variedades de soya (cuatro Mexicanas y seis del extranjero) en condiciones in vitro (semilla) y de invernadero (plántula) bajo riego–secano para identificar germoplasma resistente al hongo. Treinta semillas de cada genotipo se cultivaron por cinco días en cajas Petri con crecimiento fungoso de M. phaseolina. El germoplasma se estableció en invernadero en un arreglo factorial en parcelas subdivididas donde las parcelas grandes correspondieron a dos niveles de humedad (riego –con riego cada tercer día– y secano –aplicación de un riego en la siembra solamente–), las medianas a los niveles de inoculación con M. phaseolina (inoculado y testigo) y las chicas a los 83 genotipos de soya. Tanto in vitro como en invernadero, las líneas experimentales Mexicanas H86–5030 y H98–1552 y la variedad Mexicana Suaqui–86 fueron moderadamente resistentes a M. phaseolina, mientras que el 96.5 y 85% del germoplasma evaluado fue susceptible in vitro y en invernadero, respectivamente. En invernadero, la sequía incrementó la infección de M. phaseolina y redujo el peso seco de plántula. M. phaseolina redujo también el crecimiento de la soya y agravó los efectos de la sequía en la acumulación de biomasa.
Palabras claves: Pudrición carbonosa, resistencia genética.
Abstract
The reaction of 73 experimental lines and ten soybean cultivars (four from Mexico and six from abroad) to a highly virulent isolate of Macrophomina phaseolina was evaluated in vitro (seed) and in the greenhouse (seedling), under irrigated drought–stress conditions in order to identify resistant germplasm to the fungus. Thirty seeds of each genotype were cultivated for five days in Petri dishes with cultures of M. phaseolina. The germplasm was established in the greenhouse using a split–split factorial arrangement, where the large plots were two humidity levels (irrigated: irrigation each third day; and drought stress: only one irrigation at sowing); intermediate plots corresponded to M. phaseolina levels (inoculated and control), and small plots were assigned to the 83 soybean genotypes. Mexican experimental lines H86–5030 and H98–1552, as well as Mexican cultivar Suaqui–86 were moderately resistant to M. phaseolina in vitro and under greenhouse conditions, while 96.5% of the soybean germplasm evaluated was susceptible in vitro and 85% under greenhouse conditions. In greenhouse, drought stress increased M. phaseolina infections and reduced seedling dry weight. The inoculation with M. phaseolina also reduced soybean growth and aggravated drought stress effects based on biomass accumulation.
Keywords: Charcoal rot, genetic resistance.
La pudrición carbonosa del tallo es causada por el hongo Macrophomina phaseolina (Tassi) Goidanich y es un problema común en soya [Glycine max (L.) Merr.] (Wrather et al., 1998). En Brasil, el hongo se considera un patógeno secundario que infecta a la soya al final de su ciclo biológico (Machado, 1987). La enfermedad se asocia principalmente con la ocurrencia de períodos de sequía y ocasiona pérdidas de 50% en el rendimiento de soya en Paraná, Brasil (Ferreira et al., 1979), mientras que en EUA se han reportado pérdidas del 20% (Sinclair y Gray, 1972). En México, M. phaseolina causa daños significativos, tanto en soya como en frijol (Phaseolus vulgaris L.), ajonjolí (Sesamum indicum L.) y sorgo [Sorghum bicolor (L.) Moench.], aunque se carece de estadísticas precisas al respecto (Díaz, 1992). El hongo infecta varios cultivos importantes debido a que es un patógeno no específico (Singh y Nene, 1990). El daño en soya por M. phaseolina se desarrolla inicialmente en la raíz, el hongo invade el tejido cortical inter e intracelularmente para finalmente infectar el sistema vascular (Ammon et al., 1972). Las plántulas infectadas pueden continuar su desarrollo con síntomas no visibles hasta la fase reproductiva (Sinclair y Backman, 1989), donde sus síntomas y daño son evidentes (Bruton et al., 1987; Pearson et al., 1984; Sinclair y Backman, 1989). Las plantas infectadas reducen la cantidad y tamaño de las hojas para entrar en un período de senescencia (Sinclair y Backman, 1989). Las infecciones severas producen clorosis y muerte de las hojas así como la aparición de una coloración gris en vaina, pecíolo, tallo y raíz debido a la formación de microesclerocios (Wyllie, 1988). En campo, los síntomas de la pudrición carbonosa aparecen bajo condiciones que reducen el vigor de la planta, como baja fertilidad del suelo (Sinclair y Backman, 1989); altas densidades de siembra (Pearson et al., 1984; Sinclair y Backman, 1989); sequía y temperaturas mayores a 35°C (Odvody y Dunkle, 1979); y lesiones en la raíz debidas a maquinaria (Canaday et al., 1986). El método más práctico y rentable para controlar la pudrición carbonosa en soya es la producción y cultivo de genotipos resistentes a la enfermedad (Smith y Carvil, 1997). En EUA se han identificado genotipos de soya resistentes al hongo (Canaday et al., 1986; Kadlicskó, 1994; Smith y Carvil, 1997), pero pocos genotipos tienen niveles aceptables de resistencia y su eficacia en campo es inconsistente (Kendig et al., 2000). Una alternativa para el manejo de la enfermedad es la rotación de cultivos resistentes al patógeno; sin embargo, al ser este hongo no específico que ataca un amplio rango de plantas hospederas puede sobrevivir y multiplicarse en residuos de cosecha o vivir saprofíticamente en materia orgánica en descomposición (Almeida et al., 2002; Pearson et al., 1984). Otra práctica se basa en el manejo del suelo alterando el ambiente y favorecer el desarrollo de microorganismos antagonistas al hongo (Almeida et al., 2002). De acuerdo con Kendig y Rupe (1989) y Kendig et al. (2000), la irrigación del suelo reduce significativamente la pudrición carbonosa en soya lo que convierte al control cultural como el más efectivo para el manejo integrado del hongo. Un factor significativo que afecta la presencia del hongo en el suelo es la permanencia o incorporación de los residuos de la cosecha anterior; además, la producción continua de soya en campos con labranza cero origina la acumulación de residuos que a su vez incrementan la incidencia de la enfermedad (Almeida et al., 2002). Los microesclerocios permanecen en el suelo conforme los residuos se descomponen (Short et al., 1980) pudiendo permanecer viables por más de cuatro años (Watanabe, 1973). Dichos propágulos son la fuente de inóculo primario más importante de M. phaseolina en soya (Young y Alcorn, 1984). Los objetivos de este trabajo fueron determinar la variación en la reacción de germoplasma de soya a M. phaseolina en condiciones in vitro; determinar la reacción de dicho germoplasma en condiciones de invernadero bajo déficit hídrico; así como identificar genotipos de soya resistentes al patógeno en las condiciones de evaluación probadas.
MATERIALES Y MÉTODOS
En este trabajo se incluyeron 83 accesiones de soya: seis variedades comerciales introducidas de Taiwán (AGS–154) y Brasil (Curio, DM301, Doko, EMBRAPA–48, Tukano); cuatro variedades Mexicanas (Huasteca 100, Huasteca 200, Suaqui–86, Surubi), desarrolladas por el Programa de Mejoramiento Genético de Soya para el Trópico Húmedo de México del Campo Experimental Sur de Tamaulipas, México (CESTAM) del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), ubicado en Estación Cuauhtemoc, Tamaulipas, México; y 73 líneas experimentales avanzadas pertenecientes al mismo programa con distintos orígenes. Salvo EMBRAPA–48 (grupo IV); Suaqui–86 y Surubi (grupo V); Doko (grupo VII); y AGS 154 y Curio (grupo desconocido), el germoplasma pertenece al grupo de maduración IX, el cual se cultiva de los 14 a 22° LN y son de hábito de crecimiento determinado y con ciclo precoz a intermedio (Cuadro 1) (Castillo–Torres y Montoya–Coronado, 1993). La cepa de M. phaseolina utilizada en el estudio se obtuvo de plantas de soya infectadas por el hongo y colectadas en 2004 en el CESTAM. El aislamiento se purificó transfiriendo porciones de medio de cultivo con crecimiento fungoso en medio de cultivo papa–dextrosa–agar (PDA) fresco, acidificado con 1 mL de ácido láctico L–1 y se incubó a 30°C durante cinco a siete días para la obtención del aislamiento puro.
Reacción de germoplasma de soya a M.phaseolina in vitro. La cepa de M. phaseolina se sembró en cajas Petri con PDA y se incubó en oscuridad a 30°C por siete días. Una vez que las cajas fueron invadidas completamente por el hongo, se depositaron 15 semillas de cada uno de los 83 genotipos de soya por caja Petri. Previamente, las semillas se desinfestaron con hipoclorito de sodio 2% por 2 min, se enjuagaron con agua destilada estéril y se colocaron en las cajas colonizadas por el hongo, mismas que se sellaron e incubaron a 30°C en condiciones de oscuridad durante cinco días. Cada genotipo se sembró en dos repeticiones (30 semillas). La severidad de daño causada por el hongo en la semilla se midió con la escala descrita por Manici et al. (1995) que consta de seis valores donde 0 = semilla sana, 1 = la semilla tiene cierto grado de decoloración, 2 = el tegumento de la semilla se encuentra invadido por micelio y microesclerocios, 3 = el tegumento se encuentra libre pero la semilla está infectada, 4 = tegumento y semilla infectados, y 5 = la semilla no germina ya que está completamente invadida por el hongo. Los valores de 0 a 2 se consideraron como reacción de resistencia y los valores mayores a 2, como reacción de susceptibilidad. El experimento se repitió dos veces.
Reacción de germoplasma de soya a M.phaseolina y déficit hídrico en invernadero. Las 83 variedades de soya se establecieron en condiciones de invernadero en charolas de poliestireno de 96 pozos bajo un arreglo factorial en parcelas subdivididas con doce repeticiones, donde la unidad experimental consistió de una semilla/plántula. Las parcelas grandes correspondieron a dos condiciones de humedad (riego y sequía); las medianas al factor de inoculación con M. phaseolina (inoculado y testigo) y las chicas, a los 83 genotipos de soya. Al momento de la siembra el sustrato utilizado (tipo peat–mos Premier®, Québec, Canadá) fue inoculado en una proporción del 5% peso/peso con semilla de arroz (Oryza sativa L.) colonizada por el hongo. El inóculo se preparó de acuerdo con Abawi y Pastor–Corrales (1990). En las parcelas bajo riego se aplicó un riego a capacidad de campo cada tercer día durante el desarrollo del experimento, mientras que en las parcelas bajo sequía sólo se aplicó un riego a capacidad de campo al momento de la siembra. La severidad de la enfermedad causada por el hongo se determinó a los 14 días después de la siembra considerando la escala de Abawi y Pastor–Corrales (1990). Dicha escala consta de nueve clases (de 1 a 9) donde 1 = sin síntomas visibles; 3 = hasta 10% de los tejidos de hipocótilo y raíces con lesiones; 5 = hasta 25% de los tejidos con lesiones; 7 = hasta 50% de los tejidos con lesiones y 9 = 75% o más de los tejidos con lesiones. Los valores de 1 a 3 se consideraron como reacción de resistencia y los valores mayores a 3, como reacción de susceptibilidad. Finalmente, se registró el peso seco de plántula (g) de cada unidad experimental.
Análisis estadístico. A partir de los datos de reacción a M. phaseolina in vitro se determinó la distribución de frecuencias del daño causado por el hongo, mientras que los datos obtenidos en el invernadero se sometieron al análisis de varianza (ANVA). Las variables medidas se sometieron al análisis de correlación de Pearson. El análisis estadístico se llevó a cabo con el paquete estadístico SAS versión 6.12 (SAS Institute, 1998).
RESULTADOS Y DISCUSIÓN
Reacción de germoplasma de soya a M.phaseolina in vitro.
El 96.5% del germoplasma de soya fue susceptible a M. phaseolina, donde las líneas H86–5030, H98–1552 y la variedad mexicana Suaqui–86 presentaron los menores daños (Fig. 1). La agresividad del aislamiento de M. phaseolina utilizado en este trabajo fue alta, pues no se observaron valores de reacción menores a 1 ó de cero. No obstante que el germoplasma de soya estuvo expuesto a una alta presión de inóculo del hongo, los resultados concuerdan con los observados en otras especies tales como maíz (Zea mays L.), frijol, soya, cacahuate (Arachis hypogea L.), garbanzo (Cicer arietinum L.) o ajonjolí en pruebas in vitro (Muñoz–Cabañas et al., 2005), indicando que las evaluaciones conducidas en condiciones de laboratorio ofrecen resultados confiables y rápidos y, particularmente, asociados con los observados en condiciones de invernadero o de campo.

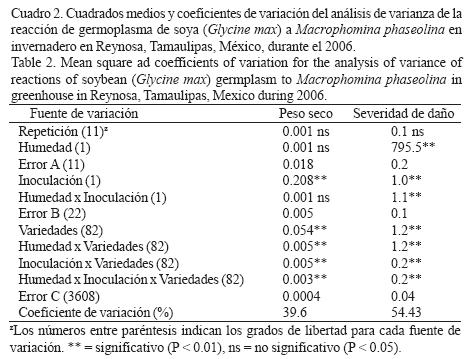
Reacción de germoplasma de soya a M. phaseolina y déficit hídrico en invernadero. El ANVA para el peso seco de plántula detectó diferencias significativas (p < 0.01) entre niveles de inoculación y entre genotipos, así como en las interacciones dobles y triples, mientras que en el caso de la severidad de la pudrición carbonosa indicó diferencias significativas (p < 0.01) entre niveles de humedad y de inoculación y en las interacciones dobles y triples (Cuadro 2). La inoculación con M. phaseolina agravó el efecto de la deficiencia hídrica pues redujo significativamente la producción de biomasa seca (Cuadro 3). Los genotipos mostraron valores mayores de biomasa y menores de daños por M. phaseolina en condiciones de riego comparados con la condición de sequía, aunque la correlación entre ambas variables mostró valores de intermedios (r = –0.52*) a bajos (r = –35*) en condiciones de deficiencia hídrica y riego, respectivamente (Fig. 2). Los resultados indicaron que las variedades Suaqui–86 y DM–301 así como las líneas experimentales H86–5030, H98–1552, H98–0695 fueron resistentes al hongo, presentando además los mayores promedios de biomasa en condiciones de riego y déficit hídrico. La línea H86–5030 mostró resistencia a M. phaseolina tanto en riego como en sequía en invernadero y en condiciones in vitro. Los resultados de este trabajo confirmaron que la inoculación artificial y la sequía favorecen la colonización de raíces y tallos de la plántula de soya por M. phaseolina.


El contenido de agua en el ambiente es un factor importante para la supervivencia y reproducción de M. phaseolina, pues Banerjee et al. (1982) y Viana y Souza (2002) indicaron que aún con contenidos de humedad de –80 KPa ocurre la germinación de microesclerocios. Olaya et al. (1996), Olaya y Abawi (1996) y Cervantes–García et al. (2003) indicaron también que el hongo tolera bajos contenidos hídricos y aún en dichas condiciones mantiene su agresividad en semillas y plántulas de frijol. Por su parte, Kending et al. (2000) determinaron que el contenido alto de agua en el suelo afecta negativamente la colonización de la raíz de soya por M. phaseolina. Un aspecto negativo del proceso de búsqueda de resistencia a M. phaseolina en el germoplasma mexicano de soya evaluado en este estudio, es la presencia de genotipos pertenecientes al grupo de maduración IX, ya que Pearson et al. (1984) indicaron que el germoplasma tardío de los grupos de maduración III, IV y V en general es resistente al hongo. Los resultados de este trabajo coinciden en ese sentido, debido básicamente a la baja frecuencia de genotipos resistentes a pudrición carbonosa observados en condiciones in vitro y de invernadero, ya que pertenecen a los grupos de maduración precoz. Un comportamiento similar en cuanto a la asociación entre precocidad y susceptibilidad a M. phaseolina y déficit hídrico en campo, se ha observado en germoplasma de frijol (Mayek–Pérez et al., 2001, 2004). Los genotipos identificados como resistentes son promisorios para derivar materiales genéticos de soya con características de resistencia combinada a déficit hídrico y M. phaseolina, o bien, funcionar como progenitores en esquemas de mejoramiento genético para el sur de Tamaulipas, México. Futuros trabajos en campo serán indispensables para corroborar la clasificación aquí realizada. El hongo M. phaseolina no puede eliminarse totalmente del suelo y por ello constituye una amenaza actual y potencial para la producción de soya en los trópicos, dependiendo de la ocurrencia y la intensidad de períodos de deficiencia hídrica. Por tanto, la manipulación del ambiente del suelo durante tiempos cortos se considera una medida apropiada dentro del manejo integrado del patógeno, pues ayudaría a reducir los daños por M. phaseolina. Sin embargo, la búsqueda y aprovechamiento de genotipos de soya resistentes al hongo debe ser práctica constante que, implementada sistemáticamente, ofrezca mejores resultados a mediano y largo plazo en la reducción de la incidencia y daños por M. phaseolina, y el incremento de la rentabilidad de la soya en el trópico de México.
CONCLUSIONES
Las líneas experimentales H86–5030, H98–1552 y la variedad mexicana Suaqui–86 fueron moderadamente resistentes a M. phaseolina bajo condiciones in vitro y de invernadero. La resistencia a M. phaseolina se observó en genotipos mexicanos adaptados a las condiciones agroclimáticas del sur de Tamaulipas, y que pertenecen a los grupos de maduración tardía (V y IX), aunque no estuvo asociada con la tolerancia al déficit hídrico ni con la mayor acumulación de biomasa seca.
AGRADECIMIENTOS
El trabajo fue financiado por el Instituto Politécnico Nacional (IPN) (CGPI–20040311) y por el programa de mejoramiento genético de soya del INIFAP del Estado de Tamaulipas, México. La publicación es financiada por el Fondo Mixto–Gobierno del Estado de Tamaulipas. H.R. Gill–Langarica agradece al IPN becas PIFI e IPN (B030906) y al Consejo Nacional de Ciencia y Tecnología (Registro 195236), las becas otorgadas para realizar sus estudios de Maestría en Ciencias en el CBG–IPN. V. Pecina–Quintero y N. Mayek–Pérez son becarios del SNI. N. Mayek–Pérez es becario EDI y COFAA del IPN.
LITERATURA CITADA
Abawi, G.S., and Pastor–Corrales, M.A. 1990. Root Rots of Beans in Latin America and Africa: Diagnosis, Research Methodologies, and Management Strategies. CIAT. Cali, Colombia. 114 p. [ Links ]
Almeida, A.M.R., Amorim, L., Bergamin, F., Torres, A.E., Farias, J.R.B., Benato, L.C., Pinto, M.C., and Valentim, N. 2002. Progress of soybean charcoal rot under tillage and no–tillage systems in Brazil. Fitopatología Brasileira 28:131–135. [ Links ]
Ammon, V, Wyllie, T.D., and Brown, M.F. Jr. 1972. An ultrastructural investigation of pathological alterations induced by Macrophomina phaseolina (Tassi) Goid. in seedlings of soybean, Glycine max (L.) Merrill. Physiological Plant Pathology 4:1–4. [ Links ]
Banerjee, S., Mukherjee, B., and Sen, C. 1982. Fungistasis and germination patterns of sclerotia of Macrophomina phaseolina (Tassi) Goid. in different soils. Indian Journal of Microbiology 22:190–193. [ Links ]
Bruton, B.D., Jeger, M.J., and Reuveni, R. 1987. Macrophomina phaseolina infection and vine decline in cantaloupe in relation to planting date, soil environment, and plant maturation. Plant Disease 71:259–263. [ Links ]
Canaday, C.H., Helsel, D.G, and Wyllie, T.D. 1986. Effects of herbicide–induced stress on root colonization of soybeans by Macrophomina phaseolina. Plant Disease 70:863–866. [ Links ]
Castillo–Torres, N. y Montoya–Coronado, L. 1993. Soya. pp. 139–159. En: F. Márquez–Sánchez (ed.). Producción y Genotecnia de Plantas Autógamas. AGT Editor. México. 272 p. [ Links ]
Cervantes–García, D., Padilla–Ramírez, J.S., Simpson, J., and Mayek–Pérez, N. 2003. Osmotic potencial effects on in vitro growth, morphology and pathogenicity of Macrophomina phaseolina. Journal of Phytopathology 151:456–462. [ Links ]
Díaz, F.A. 1992. Evaluación de genotipos de frijol e influencia de la temperatura con relación a la pudrición carbonosa. Agricultura Técnica en México 18:3–10. [ Links ]
Ferreira, L.P., Lehman, P.S., and Almeida, A.M.R. 1979. Doenças da soja no Brasil. Empresa Brasileira de Pesquisa Agropecuaria. Circular Técnica 1. Brasilia, Brasil. 41 p. [ Links ]
Kadlicskó, S. 1994. Resistance of seedlings of maize and sunflower hybrids as well as soybean cultivars to Macrophomina phaseolina. Cereal Research Communications 22:235–245. [ Links ]
Kendig, S.R., and Rupe, J.C. 1989. Relationship of irrigation regime to populations of Macrophomina phaseolina microsclerotia in root tissue and yield in soybean Phytopathology 79:1179–1180. (Abstract). [ Links ]
Kendig, S.R., Rupe, J.C., and Scott, H.D. 2000. Effect of irrigation and soil water stress on densities of Macrophomina phaseolina in soil and roots of two soybean cultivars. Plant Disease 84:895–900. [ Links ]
Machado, C.C. 1987. Macrophomina phaseolina: Biological Behavior of Isolates, Spatial Pattern of Microesclerotia in the Soil, and incidence on soybeans. Ph.D. Thesis. University of Illinois. Urbana Champaign, USA. 170 p. [ Links ]
Manici, L., Caputo, F., and Cerato, C. 1995. Temperature responses of isolates of Macrophomina phaseolina from diferente climate regions of sunflower production in Italy. Plant Disease 79:834–838. [ Links ]
Mayek–Pérez, N., López–Castañeda, C., López–Salinas, E., Cumpián–Gutiérrez, J. y Acosta–Gallegos, J.A. 2001. Resistencia a Macrophomina phaseolina en frijol común bajo condiciones de campo en México. Agrociencia 35:649–661. [ Links ]
Mayek–Pérez, N., López–Salinas, E., Cumpián–Gutiérrez, J. y Acosta–Gallegos, J.A. 2004. Reacción de germoplasma de frijol común a Macrophomina phaseolina en condiciones de riego–secano en Veracruz, México. Agronomía Mesoamericana 15:45–52. [ Links ]
Muñoz–Cabañas, R.M., Hernández–Delgado, S. y Mayek–Pérez, N. 2005. Análisis patogénico y genético de Macrophomina phaseolina (Tassi) Goid. en diferentes hospedantes. Revista Mexicana de Fitopatología 23:11–18. [ Links ]
Odvody, G N. and L. D. Dunkle. 1979. Charcoal rot of sorghum: Effect of environment on host–parasite relations. Phytopathology 69:250–254. [ Links ]
Olaya, G., and Abawi, G.S. 1996. Effect of water potential on mycelial growth and on production and gemination of sclerotia of Macrophomina phaseolina. Plant Disease 80:1347–1350. [ Links ]
Olaya, G., Abawi, GIS., and Barnard, J. 1996. Influence ofwater potential on survival of sclerotia in soil and in colonization of bean stem segments by Macrophomina phaseolina. Plant Disease 80:1351–1354. [ Links ]
Pearson, C.A.S., Schwenk, F.W., Crowe, F.J., and Kelley, K. 1984. Colonization of soybean roots by Macrophomina phaseolina. Plant Disease 68:1086–1088. [ Links ]
Short, G.E., Wyllie, T.D., and Bristow, P.R. 1980. Survival of Macrophomina phaseolina in soil and in residue of soybean. Phytopathology 70:13–17. [ Links ]
SAS Institute. 1998. SAS/STATR User Guide. Release 6.03 edition. SAS Institute Inc. Cary, NC, USA. 364 p. [ Links ]
Sinclair, J.B., and Gray, L.E. 1972. Three fungi that can reduce soybean yields. Illinois Research 14:5. [ Links ]
Sinclair, J.B., and Backman, P.A. (eds.). 1989. Compendium of Soybean Diseases. 3rd. ed. American Phytopathological Society. Saint Paul, MN, USA. 106 p. [ Links ]
Singh, S.K., and Nene, Y.L. 1990. Cross inoculation studies on Rhizoctonia bataticola isolates from different crops. Indian Phytopathology 43:446–448. [ Links ]
Smith, G.S., and Carvil, O.N. 1997. Field screening of commercial and experimental soybean cultivars for their reaction to Macrophomina phaseolina. Plant Disease 81:363–368. [ Links ]
Viana, F.M.P., and De Souza, N.L. 2002. Efeito da interacao temperatura–tensao de agua sobre a germinacao de microesclerodios de Macrophomina phaseolina. Fitopatología Brasileira 27:268–272. [ Links ]
Watanabe, T. 1973. Survivability offMacrophomina phaseoli (Maubl.) Ashby in naturally infested soils and longevity of the sclerotia formed in vitro. Annals of the Phytopathological Society of Japan 39:333–337. [ Links ]
Wrather, J.A., Kendig, S.R., and Tyler, D.D. 1998. Tillage effects on Macrophomina phaseolina populations density and soybean yield. Plant Disease 82:247–250. [ Links ]
Wyllie, T.D. 1988. Charcoal rot of soybeans current status. pp. 106–113. In: T.D. Wyllie, and D.H. Scott (eds.). Soybean diseases of North Central Region. American Phytopathological Society Press. St. Paul, MN, USA. 149 p. [ Links ]
Young D.J., and Alcorn, S.M. 1984. Latent infection of Euphorbia lathyris and weeds by Macrophomina phaseolina and propagule populations in Arizona field soil. Plant Disease 68:587–589. [ Links ]














