Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.26 n.1 Texcoco Jan. 2008
Artículos científicos
Efecto del pH en la Sobrevivencia de Esclerocios de Phymatotrichopsis omnívora (Dugg.) Hennebert Expuestos a Tilt y Trichoderma sp.
Effect of pH on survival of sclerocia of Phymatotrichopsis omnivora (Dugg.) Hennebert exposed to Tilt and Trichoderma sp.
José Alfredo Samaniego–Gaxiola
INIFAP, Campo Experimental La Laguna, Blvd. José Santos Valdéz No. 1200 Pte., Col. Centro, Matamoros, Coahuila, México CP 27440. Correspondencia: samaniego.jose@inifap.gob.mx
Recibido: Septiembre 11, 2007
Aceptado: Diciembre 4, 2007
Resumen
Previa determinación del efecto del pH en soluciones amortiguadoras solas o adicionadas con NaOCl sobre los esclerocios de Phymatotrichopsis omnivora, en este trabajo se evaluó la sobrevivencia de los esclerocios expuestos por 14 días a un aislamiento de Trichoderma sp. en soluciones amortiguadoras a pH 4, 5, 6, 8.2 y 10.4 y en soluciones de ácido acético a 0, 25, 50 y 100 ppm. La sobrevivencia también se evaluó desde un minuto hasta tres días en soluciones acuosas y amortiguadoras adicionadas hasta con 1000 ppm de Tilt (Propiconazole). A pH 6 y 8.2, la sobrevivencia de los esclerocios después de 14 días en presencia de Trichoderma sp. fue 90 y 10%, respectivamente, pero a pH 4, 5 y 10.4 los esclerocios no sobrevivieron ni un día. En presencia de Trichoderma sp. incubados 14 días a 0, 25, 50 y 100 ppm de ácido acético, los esclerocios sobrevivieron 100, 80, 40 y 0%, respectivamente. El tiempo necesario para matar 100% de esclerocios disminuyó 864 y 216 veces usando 1000 ppm de Tilt a pH 4 y 5, respectivamente, en comparación al tiempo necesario para lograr el mismo efecto a pH 7 (3 días). El pH tiene un efecto determinante en la sobrevivencia de los esclerocios de P. omnivora.
Palabras clave: Hongos del suelo que atacan a plantas, hongos del suelo.
Abstract
Previous to determination of the pH effect in just buffer solutions or ammended with NaOCl on sclerotia of Phymatotrichopsis omnivora, in this work, sclerotia survival exposed during 14 days to an isolate of Trichoderma sp. in buffers solutions at pH 4, 5, 6, 8.2, and 10.4, and acetic acid solutions at 0, 25, 50, and 100 ppm was evaluated. Sclerotia survival was also evaluated in aqueous and buffer solutions ammended with 1000 ppm of Tilt (Propiconazole) during one minute up to three day exposure. Sclerotia survival in presence of Trichoderma sp. after 14 days was 90 and 10% at pH 6 and 8.2, respectively, but at pH 4, 5, and 10.4 sclerotia did not survive a single day. In the presence of Trichoderma sp. incubated 14 days at 0, 25, 50, and 100 ppm of acetic acid, sclerotia showed 100, 80, 40, and 0% survival, respectively. The time needed to kill 100% sclerotia diminished 864 and 216 times using 1000 ppm of Tilt at pH 4 and 5, respectively, with respect to the time needed to obtain the same effect at pH 7 (3 days). The pH had a determinant effect on survival of sclerotia of P. omnivora.
Key words: Soilborne plant pathogens, soil fungi.
El micelio de Phymatotrichopsis omnivora (Dugg.) Hennebert puede crecer en medio de cultivo aceptablemente ente pH 4 a 8 con un óptimo de 5 (Gunasekaran, 1973; Lyda, 1978), aunque, no se conoce el efecto que tiene el pH in vitro sobre la sobrevivencia de los esclerocios que son expuestos a fungicidas y microorganismos que le son potencialmente dañinos. El pH in vitro tiene un efecto dramático sobre la sobrevivencia de los esclerocios de Sclerotium rolfsii Sacc., particularmente el pH alcalino (> 8) en presencia de compuestos con nitrógeno inducen la muerte de los esclerocios al generarse en el medio de cultivo amoniaco (Punja y Grogan, 1982). Suelos con pH ácido se asocian con la presencia de especies de Trichoderma y a la producción in vitro de muchas de sus enzimas involucradas en el proceso de degradación de hongos que ataca (Chet y Baker, 1981a, b; Jackson et al., 1991; Kredics et al., 2003; Liu y Baker, 1980). El fungicida Tilt ® (Propiconazole) se ha utilizado para el control de P. omnivora en algunos cultivos (Adaskaveg et al., 1999; Herrera–Pérez y Samaniego–Gaxiola, 2002; Whitson y Hine, 1986), pero el micelio y los esclerocios de P. omnivora tienen diferente susceptibilidad a los fungicidas, siendo éstos últimos más tolerantes (Hine et al., 1969; Lyda y Burnett, 1970; Rush y Lyda, 1982). La movilidad, materia orgánica, absorción y el pH en el suelo son factores determinantes en la efectividad de los fungicidas incluyendo al Tilt (Thorstensen et al., 2001); de igual manera, el tiempo de estabilidad de Tilt dentro de una planta es afectado por el pH (Armstrong, 1999). En este trabajo se evaluó la sobrevivencia de los esclerocios de P. omnivora expuestos a Tilt y Trichoderma sp. en diferentes pH inducidos con soluciones amortiguadoras o ácido acético.
MATERIALES Y MÉTODOS
Reproducción y manejo de los esclerocios. En frascos de vidrio de un litro se mezclaron 600 g de arena cernida en tamiz de malla 16 con 1.8 g de carbono activado, luego se colocaron encima 80 g de semilla de sorgo limpia la cual fue previamente humedecida dos días en agua; posteriormente, se vertió agua destilada hasta saturar el suelo. Enseguida, los frascos fueron esterilizados una hora durante dos días consecutivos e inmediatamente se les añadió micelio de P. omnivora de 15 días de crecido en placas Petri con papa–dextrosa–agar (PDA) a 28 ± 1°C (el contenido de 1/2 placa por frasco). Los frascos inoculados se incubaron nueve semanas antes de recuperar los esclerocios. Del contenido de los frascos se les quitó el sorgo y el micelio, y el resto se colocó en un tamiz de malla 16 lavándolos a chorro de agua corriente. Los esclerocios retenidos en el tamiz fueron nuevamente lavados exhaustivamente eliminando los residuos de sorgo y cordones visibles. Los esclerocios limpios se colocaron inmersos en agua destilada en un frasco de un litro a temperatura de 10°C. Durante los siguientes 15 días, los esclerocios fueron seleccionados, colocando 25 en 10 mL de agua destilada en viales que se almacenaron a 10°C. Cada vial constituyó una repetición para cada tratamiento en los experimentos establecidos, los cuales iniciaron tres días después de haber obtenido los primeros viales con esclerocios. Desde el establecimiento del primero hasta el último experimento transcurrieron seis semanas. Todos los experimentos se repitieron dos veces.
Soluciones amortiguadoras con Trichoderma. Un aislamiento de Trichoderma sp. obtenido de esclerocios invadidos de manera natural en el laboratorio de fitopatología del Campo Experimental La Laguna, se hizo crecerjunto con 50 esclerocios de P. omnivora en placas de PDA durante 15 días a 28 ± 1°C. A continuación, un esclerocio invadido por Trichoderma se extrajo de las placas de PDA y se colocó en cada vial que contenía 25 esclerocios inmersos en 10 mL de una solución amortiguadora. El pH de las soluciones amortiguadoras usadas fue de 4, 5, 6, 8.2 y 10.4. Las soluciones de pH 4 y 5 fueron preparadas combinando 0.2 M de ácido acético–acetato de sodio, mientras que para dar un pH 6 y 8.2, se combinó KOH–fosfato de sodio dibásico 0.2 N; y para pH 10.4 se mezcló 0.1 M de carbonato de sodio–bicarbonato de sodio (Plummer, 1981). Los viales inoculados con Trichoderma y esclerocios se incubaron durante 1, 3, 5, 7 y 14 días a 28 ± 1°C. Justo antes de extraer los esclerocios se determinó el pH en cada tratamiento (soluciones amortiguadoras y tiempos); las determinaciones de estos pH y posteriores se realizaron con un potenciómetro Orion Modelo 710 A. Los esclerocios que se extrajeron al término de cada período de incubación se colocaron en arena no estéril donde se evaluó su sobrevivencia y se registró su invasión por Trichoderma sp.
Ácido acético con Trichoderma. Se realizó un experimento similar al anterior, excepto por la sustitución de las soluciones amortiguadoras por soluciones de ácido acético (grado reactivo); las concentraciones de ácido utilizadas fueron de 0, 25, 50 y 100 ppm. En este experimento no se determinó el pH hacia el día de incubación 14, debido a que los viales estaban profusamente colonizados por Trichoderma sp. pH y Tilt. Se prepararon soluciones acuosas que contenían 1, 10, 50, 100, 200, 400, 500, 800 y 1000 ppm de Tilt (i.a.), luego de cada solución por separado se vertieron 10 mL en viales donde previamente se habían colocado 25 esclerocios de P. omnivora; estos viales se incubaron durante 1, 5, 10, 20 min, y 1, 6, 24 ó 72 h a 28 ± 1°C, después se extrajeron los esclerocios y se determinó su sobrevivencia. La sobrevivencia de los esclerocios también se evaluó en dos soluciones amortiguadoras de pH 3.6 y 7 que contenían Tilt a las concentraciones referidas y tiempos de incubación de 1, 6, 24 ó 72 h a 28 ± 1°C. Finalmente, los esclerocios se colocaron durante 1, 5, 20 ó 60 min a 28 ± 1°C en soluciones amortiguadoras de pH 4, 5, 6 y 7 que contenían Tilt en las concentraciones señaladas, y enseguida se evaluó su sobrevivencia.
Análisis de los datos. La sobrevivencia de los esclerocios se expresó como porcentaje y a sus valores se aplicó una transformación arco–seno antes de su análisis estadístico usando el programa SAS (SAS, Institute 1988). Cada experimento fue analizado con un diseño completamente al azar y un arreglo factorial. Las medias de los tratamientos fueron separadas con DMS.
RESULTADOS
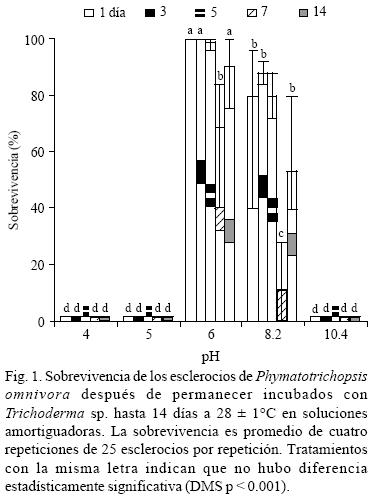
Soluciones amortiguadoras con Trichoderma. Excepto para el pH en función del tiempo, el resto de las variables: sobrevivencia de los esclerocios, invasión de Trichoderma sp. hacia los esclerocios y su interacción fueron altamente significativas (p < .001). No se detectó diferencia estadística en los cambios de pH a través del tiempo en las soluciones amortiguadoras, excepto en la solución de pH inicial de 10.4 donde el pH alcanzó valores cercanos a 9.2 al quinto día de incubación. La sobrevivencia de los esclerocios fue nula a pH 4, 5 y 10.4 en todos los tiempos de incubación. A pH 6 y tiempos de incubación no hubo diferencia estadística en la sobrevivencia de esclerocios (90–100%), excepto para el séptimo día de incubación con una sobrevivencia del 69% (Fig. 1). El descenso de la sobrevivencia de los esclerocios fue estadísticamente significativo en todos los tiempos de incubación a pH 8.2, aunque los menores porcentajes de sobrevivencia se registraron al día 7 y 14 con 11 y 53% de sobrevivencia, respectivamente. La invasión de los esclerocios por Trichoderma sp. se caracterizó por una variación acentuada entre repeticiones dentro de un mismo tratamiento (excepto para los tratamientos donde la sobrevivencia fue de por lo menos 98 ó 0%) y por una fuerte variación entre el factor tiempo (días de incubación) dentro de niveles similares del pH de las soluciones amortiguadoras (Fig. 2). Los mayores porcentajes de invasión de Trichoderma sp. hacia los esclerocios se presentaron a pH 10.4, sin embargo, no en todos los tiempos de incubación ocurrió ésto; así los esclerocios fueron invadidos entre el 98–100% a los 1, 5 y 7 días, pero 0 y 35% a los días 3 y 14, respectivamente. A pH 6 Trichoderma sp. no pudo invadir ningún esclerocio en los días de incubación 1, 3 y 5, y lo hizo escasamente a los 7 y 14 días. En pH 4, 5 y 10.4 no se presentó una relación entre la sobrevivencia de los esclerocios y su invasión por Trichoderma sp., pero sí a pH 6 y 8.2 (Fig. 3).


Ácido acético con Trichoderma. La proliferación de Trichoderma sp. se hizo evidente en las soluciones con ácido acético y no así en la solución acuosa (testigo). Los esclerocios que perdieron su sobrevivencia no formaron cordones, y en algunos casos permitieron la proliferación de Trichoderma sp. alrededor o encima de ellos. Algunos esclerocios que fueron invadidos por Trichoderma sp. fueron capaces de formar cordones, por tanto se consideraron viables. En la figura 4F, se aprecia un esclerocio que no formó cordones y que permitió la proliferación de Trichoderma sp. sobre y alrededor de éste. Las variables pH de las soluciones de ácido acético, sobrevivencia de los esclerocios de P. omnivora e invasión de los esclerocios por Trichoderma sp. fueron altamente significativa p < .001 en función de las concentraciones de ácido, tiempo y la interacción de ambas. Conforme se aumentó la concentración de ácido acético y el tiempo de incubación de Trichoderma sp. con los esclerocios, la sobrevivencia de este último disminuyó, de tal forma que para el día 14 de incubación la sobrevivencia de los esclerocios que permanecieron en soluciones de ácido acético a 25, 50 y 100 ppm fue de 76, 39 y 0%, respectivamente (Fig. 5). La invasión de Trichoderma sp. sobre los esclerocios se incrementó conforme se aumentó la concentración de ácido y el tiempo de incubación. Los tratamientos de ácido acético a 100 ppm (días 1, 5, 7 y 14) causaron una invasión entre 88 a 100% de los esclerocios, excepto en el tratamiento del día tres en donde Trichoderma sp. no logró invadir a éstos (Fig. 6). El cambio de pH fue altamente significativo p < .001 con relación a la cantidad de ácido acético añadido y el tiempo de incubación de Trichoderma sp. con los esclerocios. El pH en los tratamientos con ácido acético cambió desde su niveles iniciales de 3.6–3.8 hasta 5–5.5 al séptimo día de incubación de Trichoderma sp. con los esclerocios; estos cambios fueron paulatinos, pero estadísticamente significativos (Fig. 7). pH + Tilt. Los esclerocios empezaron a disminuir su sobrevivencia después de permanecer 72 h en soluciones de agua destilada con no menos 400 ppm de Tilt, registrándose una sobrevivencia del 8% en el tratamiento de 1000 ppm de Tilt (Fig. 8). Tiempos menores de incubación de los esclerocios en 400 ppm o menos de Tilt no afectaron su sobrevivencia (datos no mostrados). En contraste, cuando se utilizó 1000 ppm de Tilt disuelto en solución amortiguadora de pH 3.6 sólo se requirió de una hora de permanencia de los esclerocios para que perdieran por completo su sobrevivencia (Fig. 9). La variable sobrevivencia de los esclerocios fue altamente significativa p < .001 en función del pH de las soluciones amortiguadoras (pH 4–7 donde se disolvió 1000 ppm de Tilt) y el tiempo de permanencia de los esclerocios en estas soluciones, así como la interacción soluciones/tiempo de incubación. La sobrevivencia de los esclerocios que permanecieron de 1 a 60 min en soluciones amortiguadoras de pH 6 y 7 con 1000 ppm de Tilt no fue afectada, por el contrario, esclerocios inmersos en soluciones de pH 4 durante un min o a pH 5 durante cinco min su sobrevivencia fue alrededor del 40%, y la sobrevivencia fue nula al incrementarse los tiempos a cinco y veinte min en las soluciones de pH 4 y 5, respectivamente (Fig. 10).





DISCUSIÓN
Trichoderma sp. logró matar a los esclerocios alrededor de un 50% después de permanecer dos semanas en soluciones amortiguadora a pH 8.2, esto contrasta con la sobrevivencia del 8% exhibida cuando los esclerocios permanecieron dos semanas en solución amortiguadora a pH 7.8 sin presencia de Trichoderma sp. (datos no publicados). La diferencia mencionada sugiere que la presencia de Trichoderma en la solución pH 8.2 podría amortiguar los posibles efectos tóxicos de la solución amortiguadora. Las soluciones amortiguadoras no parecen ser un buen sistema para probar la relación pH/ invasión de Trichoderma sp. hacia los esclerocios, pues los resultados obtenidos aquí confirman un posible efecto tóxico de las soluciones a pH 4, 5 y 10.4, si bien, Trichoderma sp. no pierde su capacidad para invadir a los esclerocios aún en esos pH. La invasión de Trichoderma sp. sobre los esclerocios en soluciones amortiguadoras es un fenómeno complejo, pues existe una variación fuerte en el porcentaje de esclerocios invadidos entre repeticiones a un mismo tratamiento (pH/ tiempo); aún más, en momentos determinados, los esclerocios no siempre pudieron ser invadidos por Trichoderma sp. a un mismo nivel de pH, por ejemplo, a pH 10.4 todos los esclerocios fueron invadidos casi 100% después de 1, 5 o 7 días, pero ninguno lo pudo ser al tercer día (Fig. 2). No todos los esclerocios que fueron invadidos por Trichoderma sp. murieron, es decir, los esclerocios muchas veces fueron capaces de germinar y formar cordones aún después o al mismo tiempo que eran invadidos por Trichoderma sp. (Figs. 4D y E). Otros hongos o bacterias pueden también invadir a los esclerocios que están germinando, aún en tratamientos donde Trichoderma sp. se incubó con los esclerocios (datos no mostrados), lo que sugiere que los esclerocios pueden llegar a escapar del ataque de los microorganismos. Por tanto, la invasión Trichoderma sp./sobrevivencia de esclerocios no fue del todo estrecha, aunque si se presentó a pH 6 y 8.2 (Fig. 3). En todas las soluciones de ácido acético se favoreció que Trichoderma sp. invadiera y matara a los esclerocios, observándose un incremento invasión/sobrevivencia conforme se aumentó la dosis de ácido acético y el tiempo de permanencia de los esclerocios. El pH en este sistema se incrementó hasta alcanzar valores alrededor de 5.5 semejantes al tratamiento testigo (agua destilada). El ácido acético más Trichoderma sp. y esclerocios no es un sistema donde se reguló el pH como en las soluciones amortiguadores, no obstante, los resultados indican que la acidez inicial inducida por el ácido favorece la invasión y muerte de esclerocios por Trichoderma sp. Típicamente Trichoderma es un género que le favorece el pH ácido a neutro en el suelo y/o está asociado a ciertos cultivos o residuos de cosecha (Baird et al., 2003; Chet y Baker, 1981 a y b; Liu y Baker, 1980). Los pequeños cambios permanentes de pH en el suelo, cambios temporales de pH en el suelo o el pH de la rizósfera podrían estar involucrados en la capacidad que tiene Trichoderma spp. para atacar a hongos incluyendo P. omnivora; por ejemplo, la fertilización ácida durante 10 años se asoció con la disminución de síntomas de plantas de vid (Vitis vinifera L.) afectadas por P. omnivora y un incremento de especies de Trichoderma spp. en el suelo (Olsen et al., 1988). En futuros experimentos podrían usarse ácidos añadidos al suelo periódicamente para regular el pH y estudiar el efecto pH invasión y muerte de esclerocios de P. omnivora por Trichoderma spp. u otras especies de hongos. En este trabajo, el tiempo necesario para matar 100% de esclerocios disminuyó 864 y 216 veces usando Tilt a pH 4 y 5, respectivamente, en comparación al tiempo necesario para lograr el mismo efecto a pH 7 (Figs. 8–10). El efecto de las soluciones amortiguadoras a pH 4 y 5 adicionadas con Tilt sobre la sobrevivencia de los esclerocios tal vez sea sinérgico, debido a que las soluciones afectan la sobrevivencia del esclerocios y ello se acentúa dramáticamente en presencia del Tilt, así se podría explicar la muerte de los esclerocios en tiempos tan cortos como 5 min (pH 4). Los productos químicos o microorganismos potencialmente útiles para el control de P. omnivora y otros microorganismos, continúan estando limitados en muchos casos por la eficiencia que ellos tienen en los suelos establecidos con cultivos agrícolas. Si revisamos la eficiencia de algunos fungicidas podemos ver que 1 ppm de Tilt en caja Petri es efectivo para inhibir el micelio de Armillaria mellea (Vahl:Fr.) P. Kumm. y P. omnivora (Adaskaveg et al., 1999; Whitson y Hine, 1986); pero en campo A. mellea necesitó 440 ppm en la solución acuosa en suelo. Los esclerocios de P. omnivora muestran una marcada tolerancia a varios fungicidas a concentraciones tan altas como 10,000 ppm (Hine et al., 1969), e incluso, se requirió de 276 ppm de amoniaco para disminuir significativamente la sobrevivencia de los esclerocios (Rush y Lyda, 1982). En este trabajo se registra una disminución en los tiempos y dosis necesarios para matar a los esclerocios de P. omnivora expuestos a Tilt y Trichoderma sp., todo ello en función del pH. La sobrevivencia de los microesclerocios de Verticillium dahliae Kleb. fue disminuida en función de la fertilización a pH ácido (Tenuta y Lazarovits, 2002), pero también a la descomposición microbiana de ácidos orgánicos volátiles (incluyendo el ácido acético) en pH ácido o alcalino (Conn et al., 2005). Anteriormente, se determinó que los esclerocios de P. omnivora pueden ser destruidos al añadir 1000 a 2000 ppm de glucosa en el suelo (Samaniego–Gaxiola, 1994), tal vez esas cantidades puedan ser disminuidas en suelos ácidos o acidificando temporalmente el suelo. Aunque los esclerocios podrían morir también con la adición de productos químicos entre ellos algunos fungicidas, fertilizantes o tan sólo desco mponiendo materia orgánica en pH neutro o ácido.
LITERATURA CITADA
Adaskaveg, J.E., Fõrster, H., Wade, L., Thompson, D.F., and Connell, J.H. 1999. Efficacy of sodium tetrathiocarbonate and propiconazole in managing Armillaria root rot of almond on peach rootstock. Plant Disease 83:240–246. [ Links ]
Armstrong, S.D. 1999. Microwave–Assisted Extraction for the Isolation of Trace Systemic Fungicides from Woody Plant Material. Ph.D. Thesis. Faculty of the Virginia Polytechnic Institute and State University. Blacksburg, Virginia. 129 p. [ Links ]
Baird, R.E., Watson, C.E., and Scruggs, M. 2003. Relative longevity of Macrophomina phaseolina and associated mycobiota on residual soybean roots in soil. Plant Disease 87:563–566. [ Links ]
Chet, I., and Baker, R. 1981a. Isolation and biocontrol potential of Trichoderma hamatum from soil naturally suppressive of Rhizoctonia solani. Phytopathology 71:286–290. [ Links ]
Chet, I., and Baker, R. 1981b. Inductions of suppressiveness to Rhizoctonia solani in soil. Phytopathology 71:994–998. [ Links ]
Conn, L.K., Tenuta, M., and Lazarovits, G 2005. Liquid swine manure can kill Verticillium dahliae microsclerotia in soil by volatile fatty acid, nitrous acid, and ammonia toxicity. Phytopathology 95:28–35. [ Links ]
Gunasekaran, M. 1973. Physiological studies on Phymatotrichum omnivorum IV. Effect of pH and the interaction of temperature, minerals and carbon source on growth in vitro. Mycopathologia 50:313–321. [ Links ]
Herrera–Pérez, T. y Samaniego–Gaxiola, J. 2002. Enfermedades del nogal. pp. 177–206. En: J. Arreola–Ávila e I. Reyes–Juárez (eds.). Tecnología de Producción del Nogal Pecanero. Campo Experimental La Laguna. INIFAP. Matamoros, Coahuila, México. 220 p. [ Links ]
Hine, R.B., Jhonson, D.L., and Wenger, C.J. 1969. The persistency of two benzimidazole fungicides in soil an their fungistatic activity against Phymatotrichum omnivorum. Phytopathology 59:798–801. [ Links ]
Jackson, A.M., Whipps, J.M., and Lynch, J.M. 1991. Effects of temperature, pH and water potential on growth of four fungi with disease biocontrol potential. Journal of Microbiology and Biotechnology 7:494–501. [ Links ]
Kredics, L., Antal, Z., Manczinger, L., Szekeres, A., Kevei, F., and Nagy, E. 2003. Influence of environmental parameters on Trichoderma strains with biocontrol potential. Food Technology Biotechnology 41:37–42. [ Links ]
Liu, S., and Baker, R. 1980. Mechanism ofbiological control in soil suppressive to Rhizoctonia solani. Phytopathology 70:404–412. [ Links ]
Lyda, S.D. 1978. Ecology of Phymatotrichum omnivorurm. Annual Review of Phytopathology 16:193–209. [ Links ]
Lyda, S.D., and Burnett, E. 1970. Influence of benzimidazole fungicides on Phymatotrichum omnivorum and Phymatotrichum root rot of cotton. Phytopathology 60:726–728 [ Links ]
Olsen, M.W., Hine, R.B., and Dutt, G.R. 1988. Control of Phymatotrichum root rot of wine grapes in calcareous soils with amonium–thiosulfate applied in drip irrigation systems. Phytopathology 78:1521. [ Links ]
Plummer, T.D. 1981. An Introduction to Practical Biochemistry. McGraw–Hill Book Co. London, UK. 345 p. [ Links ]
Punja, Z.K., and Grogan, R.G. 1982. Effects of inorganic salts, carbonate–bicarbonate anions, ammonia, and the modifying influence of pH on sclerotia germination of Sclerotium rolfsii. Phytopathology 72:635–639. [ Links ]
Rush, C.M., and Lyda, S.D. 1982. Effects of anhydrous ammonia on mycelium and sclerotia Phymatotrichum omnivorum. Phytopathology 72:1085–1089. [ Links ]
Samaniego–Gaxiola, J. 1994. Viabilidad de los esclerocios de Phymatotrichum omnivorum (Shear) Duggar en suelos inundados y complementados con glucosa. Revista Mexicana de Fitopatología 12:125–133. [ Links ]
SAS Institute, Inc. 1988. SAS/STAT user's guide. Relase 6.03 edition. SAS Insitute. Cary, North Carolina, USA. 1028 p. [ Links ]
Tenuta, M., and Lazarovits, G. 2002. Ammonia and nitrous acid from nitrogenous amendments kill the microsclerotia of Verticillium dahliae. Phytopathology 92:255–264. [ Links ]
Thorstensen, C.W., Lode, O., Eklo, O.M., and Christiansen, A. 2001. Sorption of bentazone, dichlorprop, mcpa, and propiconazole in reference soils from norway. Journal of Environmental Quality 30:2046–2052. [ Links ]
Whitson, R.S., and Hine, R.B. 1986. Activity of propiconazole and other sterol–inhibiting fungicides against Phymatotrichum omnivorum. Plant Disease 70:130–133. [ Links ]














