Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.26 no.1 Texcoco Jan. 2008
Artículos científicos
Diversidad Genética de Sclerotium rolfsii Sacc. en México
Genetic diversity of Sclerotium rolfsii Sacc. in Mexico
Hilda Elizabet Flores–Moctezuma1, Roberto Montes–Belmont1 y Marco Antonio Rogel–Hernández2 y María Esperanza Martínez–Romero2
1 Instituto Politécnico Nacional, Centro de Desarrollo de Productos Bióticos, Apdo. Postal 24, km 8.5 Carr. Yautepec–Jojutla, Col. San Isidro, Yautepec, Morelos, México CP 62731.Correspondencia: rbelmont@ipn.mx
2 Universidad Nacional Autónoma de México, Centro de Investigación en Ciencias Genómicas, Av. Universidad s/ n, Col. Chamilpa, Cuernavaca, Morelos, México CP 62210.
Recibido: Septiembre 4, 2007
Aceptado: Noviembre 29, 2007
Resumen
Para evaluar la diversidad genética de Sclerotium rolfsii en México, se determinaron los grupos de compatibilidad micelial (GCM) de 20 aislamientos de diferentes regiones de la República Mexicana mediante su confrontación entre ellos en medio papa–dextrosa–agar y se compararon con once aislamientos de una colección mundial. Cada uno de los aislamientos utilizados dio un patrón diferente de GCM, al confrontarse éstos con los de la colección mundial predominó el GCM 33 en 8 aislamientos de México. Todo parece indicar que los GCM no tienen relación con el hospedero de origen ni con el área geográfica. En los mismos aislamientos se determinó la variación en las secuencias espaciadoras transcritas internas (ITS) de los genes ribosomales mediante la prueba de RFLP con digestión de cuatro enzimas de restricción: Rsal, HpalI, Sau3AI y MspI. La combinación de los patrones de bandas para las cuatro enzimas se usaron para determinar la variación entre aislamientos y se comparó con los grupos obtenidos en la colección mundial. Se encontraron doce aislamientos de México que pertenecen a algunos de los grupos de RFLP de la colección mundial de Harlton et al, los ocho aislamientos restantes pertenecen a un grupo nuevo característico de México.
Palabras clave: Variación genética, tizón sureño, RFLP–ITS, grupos de compatibilidad micelial.
Abstract
Twenty isolates of Sclerotium rolfsii from different regions of Mexico were confronted amongst themselves to evaluate their genetic diversity. This trial was made using potato–dextrose–agar media to establish mycelial compatibility groups (MCG) and then they were compared with eleven isolates of a worldwide collection of this fungus. Each isolates showed a different MCG pattern, and when they were confronted with isolates from the world colection MCG 33 prevailed over 8 isolates from Mexico. It seems that there is no relationship between either MCG and the host or geographical area. The variation in the internal transcribed spacer (ITS) regions of the ribosomal genes in the same isolates, was determined by RFLP using the restriction enzymes Rsal, HpalI, Sau3AI, and MspI. Combined banding patterns for the four enzymes were used to characterize isolate variation and to compare these results with the combing banding patterns of the eleven isolates from the worldwide collection. It was found that twelve isolates from Mexico belong to some of the RFLP–ITS groups of the worldwide collection of Harlton et al.; the other eight isolates belong to a new group characteristic of Mexico.
Key words: Genetic variability, southern blight, RFLP–ITS, mycelial compatibility groups.
Sclerotium rolfsii Sacc. es uno de los hongos fitopatógenos habitantes de suelo de más amplio rango de hospederos; tan sólo en Estados Unidos se conocen alrededor de 500 especies de plantas susceptibles a su ataque, las cuales se ubican en alrededor de 100 familias de plantas, la mayoría dicotiledóneas y algunas monocotiledóneas (Farr et al, 1989); esta especie se encuentra distribuida en el mundo en varios tipos de climas sin que se conozca con exactitud el total de sus hospederos (Punja, 1985). Su diversidad genética se ha puesto en evidencia mediante la detección de grupos de compatibilidad micelial (GCM) y/o estudios genéticos con marcadores moleculares utilizando diversas técnicas. La presencia de GCM en sus poblaciones implica limitaciones para introducir nuevos genotipos del hongo en un área. Considerando que este hongo carece de esporas asexuales y a que sus basidiosporas sólo se han encontrado en condiciones de laboratorio, haría suponer que su potencialidad de variación genética parecería limitada; sin embargo, los estudios realizados al respecto demuestran lo contrario (Punja, 1988). Los GCM pueden ser tan diversos en un área geográfica amplia como en una localizada; Harlton et al. (1995) encontraron 49 GCM en una colección de aislamientos de S. rolfsii, en tanto que Nalim et al. (1995) encontraron 25 GCM en aislamientos de Texas. Los GCM no parecen seguir patrones de distribución geográfica homogéneos ni tienen hospederos restringidos; los aislamientos de una misma área geográfica u hospedero con frecuencia pertenecen a un solo GCM, pero también ocurre que aislamientos de muy diversas áreas geográficas u hospederos, pueden quedar incluidos dentro en un mismo GCM o bien pueden pertenecer a muy diversos GCM. Utilizando la técnica molecular de RFLP–ITS [polimorfismo en la longitud de fragmentos de restricción (RFLP) en las secuencias espaciadoras transcritas internas (ITS)] de los genes ribosomales (rDNA), Harlton et al. (1995) encontraron 12 grupos subespecíficos de patrones de distribución de bandas de electroforesis, algunos de los cuales se correlacionaron con sus respectivos GCM, pero también aislamientos de un GCM tuvieron diferentes patrones de distribución de bandas y otros subgrupos pudieron quedar entre varios GCM. También se han tenido buenos resultados para diferenciar variantes genéticas del hongo en los GCM con la técnica de RAPDs (DNA polimórfico amplificado al azar) y la de AFLP (polimorfismo en la longitud de fragmentos amplificados) en una colección mundial de aislamientos (Punja y Sun, 2001), en Sudáfrica (Cilliers et al., 2000), Japón (Okabe et al., 2000) y en Brasil (Almeida et al., 2001). No obstante, ninguno de estos estudios han sido comparados entre si para poder determinar la distribución geográfica de las variantes genéticas. Por otra parte poco se sabe sobre la relación de las variantes genéticas con los niveles de patogenicidad y rango de hospederos, lo cual podría influir en los niveles de confianza de medidas de control como la rotación de cultivos (Flores–Moctezuma et al., 2006). Ante esta perspectiva el presente trabajo se orientó a estudiar la variación genética en aislamientos de S. rolfsii de México mediante la determinación de los GCM y los perfiles electroforéticos de los RFLP–ITS.
MATERIALES Y MÉTODOS
Aislamientos usados. Se utilizaron aislamientos de S. rolfsii de diferentes áreas geográficas representativas de México, desde el nivel del mar (Veracruz) hasta 1800 msnm (Guanajuato, (Cuadro 1). También se incluyeron 11 aislamientos de S. rolfsii proporcionados por el Dr. Zamir K. Punja de la Universidad Simon Fraser de Burnaby, British Columbia, Canada, que son parte de una colección mundial y que representan 11 grupos de RFLP–ITS (Cuadro 2). Todos los aislamientos se mantuvieron en medio de cultivo papa–dextrosa–agar (PDA) (Difco Laboratories, Detroit) en cajas de petri de 100 x 15 mm e incubados de 25 a 27°C.
Determinación de grupos de compatibilidad micelial. Todos los aislamientos fueron confrontados en pares entre si para determinar si había compatibilidad o no entre ellos. Para esto se tomaron discos de micelio de colonias de 7 días de edad y se colocaron cada uno a distancias entre si de 25 a 35 mm en cajas de Petri de 100 x 15 mm; después se incubaron a 26 a 28°C durante 7 días. Si los aislamientos confrontados fueron capaces de mezclar sus micelios se consideraron compatibles, mientras que la formación de una barrera entre ellos se consideró como de incompatibilidad. El registro de datos se realizó con base en 3 repeticiones. Los resultados permitieron establecer los GCM de acuerdo a la relación entre todos los aislamientos de México y a sus equivalencias con los GCM de Harlton et al. (1995).
Detección de variantes por RFLP–ITS. Cada uno de los aislamientos se sembró por duplicado en cajas con PDA, y a los 7 días de crecimiento se cosechó el micelio raspando con un bisturí estéril la superficie del micelio de cada aislamiento para que se pudiera extraer el DNA. El micelio de cada aislamiento se colocó de forma rápida en morteros de porcelana esterilizados y enfriados a –70°C. Después se agregó 1000 μL de nitrógeno líquido para romper las paredes celulares. Se maceró el micelio con el pistilo, el polvo obtenido de esta maceración se colocó en tubos de microcentrífuga estériles y etiquetados, los cuales se fueron guardando a –70°C para que no se descongelara el micelio macerado mientras se realizaba la molienda de las demás muestras. Posteriormente se siguió el protocolo para extracción de DNA de hongos con el kit Qiangen® (2001), que consiste en aislar el DNA por medio de columnas y reactivos incluidos en este mini kit. La pastilla de DNA obtenida de los diferentes aislamientos se resuspendió en 100 μL de agua grado milliQ. Enseguida, se les realizó una electroforesis tomando 5 μL del DNA más 3 μL de Agua milliQ y 2 μL de colorante azul de bromofenol para tener una referencia en la corrida y observar si hubo extracción de DNA y la cantidad obtenida. La solución amortiguadora de corrida y preparación de los geles de agarosa al 1% utilizados en la electroforesis fue Tris–Acetatos (Sigma) 1X (Sambrook et al, 1989). En cada pozo del gel se colocaron las muestras de DNA de los diferentes aislamientos y como referencia el marcador de peso molecular 1 Kb plus (2 μL). El tiempo de corrida utilizado fue de 1 h con 30 min a 120 voltios. Después de la corrida se tiñeron los geles con una solución de bromuro de etidio, se enjuagaron los geles y se observaron en un transiluminador de luz ultravioleta para visualizar el DNA y la cantidad obtenida por cada aislamiento. Se tomaron fotografías utilizando un equipo fotográfico marca Stratagene, modelo Eagle Eye.
Técnica de PCR para amplificar las regiones ITS. Con referencia a la selección de los iniciadores u oligonucleótidos, se escogieron los oligonucleótidos ITS1 e ITS4 mencionados por Harlton et al. (1995) y diseñados por White et al. (1990), que amplifican las secuencias del ITS–1, ITS–2 y el gen 5.8S, para posteriormente analizarlos por RFLP para establecer la relación genética entre los aislamientos. Al DNA total que se obtuvo de cada aislamiento se le calculó la cantidad obtenida mediante espectrofotometría, para saber el volumen a usar en la reacción de PCR; se le realizó una amplificación por la técnica de PCR con los oligonucleótidos ITS1 (5' TCC GTA GGT GAA CCT GCG G 3') e ITS4 (5' TCC TCC GCT TAT TGA TAT GC 3') que fueron sintetizados por el método de fosfo–triéster en un sintetizador automatizado 391 de Applied Biosistems, en la unidad de síntesis del Instituto de Biotecnología–UNAM en Cuernavaca, Morelos, México. La mezcla de reacción para la amplificación se colocó en tubos de microcentrífuga de 0.5 μL y consistió de 1 μL de cada oligonucleótido, 10 μL de solución amortiguadora + Mg, 0.5 μL de Taq DNA polimerasa marca Roche,) 0.8 μL de DNTPs, 80.2 μL de H2O y 0.5 μL de DNA de cada aislamiento. Se probaron diferentes temperaturas, tiempos y ciclos con el fin de obtener la óptima PCR, la mejor amplificación se logró con el programa de 94°C 3 min (1 ciclo); 94°C 1 min, 58°C 1 min, 72°C 1 min (30 ciclos); 72°C 5 min y 4°C (Termociclador Perkin Elmer, Thermal Cycler 480). Se incluyeron testigos negativos consistentes de la misma mezcla de reacción pero sin agregar DNA, los productos de reacción esperados fueron similares a lo reportado por Harlton et al. (1995). También se calculó el tamaño de acuerdo al esquema representado por White et al. (1990). Al finalizar el PCR, se le realizó una electroforesis usando la solución amortiguadora de Tris–Acetatos (Sigma) 1X, utilizándolo tanto en la corrida como para hacer los geles de agarosa al 1%. Se colocó en cada pozo del gel 10 μL de DNA del producto de PCR de los diferentes aislamientos, incluyendo un marcador de peso molecular (1 Kb plus) utilizándolo como referencia. El tiempo de corrida fue de 1 hora con 30 min. Los geles se tiñeron con una solución de bromuro de etidio, se enjuagaron en agua destilada, y para poder observar el producto obtenido en la amplificación se utilizó un transiluminador de luz ultravioleta. Se fotografiaron los geles para registrar la presencia y tamaño de fragmentos de DNA amplificados.
Polimorfismo en la longitud de fragmentos de restricción. A los productos obtenidos en el PCR de cada aislamiento se les realizaron digestiones independientes con las enzimas de restricción RsaI, HpaII, Sau3AI (isoquizómero de Mbo I) y MspI (Invitrogen), a cada enzima por separado y para cada producto del PCR de los diferentes aislamientos. La mezcla de reacción consistió de 12 μL del DNA obtenido en la PCR de cada aislamiento, 1.5 μL de buffer y 1.5 μL de cada una de las enzimas, y se colocó en tubos de 1.5 mL. A los testigos negativos (los cuales no llevaban DNA) también se les colocó la solución amortiguadora, la enzima y la mezcla del PCR (esto con el fin de saber si las enzimas no se encontraran caducas o contaminadas, o si en el paso del PCR hubiera algún DNA contaminante). Los tubos con la mezcla se colocaron en una incubadora a 37°C durante toda la noche. Posteriormente, para poder comparar los patrones de bandas generadas por las enzimas de restricción se realizaron las electroforesis utilizando geles de agarosa al 3%, usando como solución amortiguadora Tris–Acetatos 1X tanto para la corrida como para la preparación de los geles. El tiempo de corrida fue de 2 h 10 min a 70 voltios para tener una mejor separación de las bandas. Se utilizó toda la cantidad de las digestiones de los diferentes aislamientos para colocarlas en los pozos correspondientes de los geles. Se colocaron dos marcadores de peso molecular (100 bp y 1 Kb Plus) como referencia, para estimar el tamaño de las bandas procedentes de las digestiones. Los geles fueron teñidos con una solución de bromuro de etidio en agitación. Después de 10 min se enjuagaron con agua corriente por 15 min. Posteriormente se colocaron en un transiluminador de luz ultravioleta y se sacaron fotografías de cada uno de los geles.
Análisis de datos. De las fotografías de los geles con las digestiones realizadas por las enzimas RsaI, HpaII, MspI y Sau3AI al producto del PCR en cada aislamiento, se hicieron conteos de las bandas presentes y ausentes en cada aislamiento y con cada enzima, se les asignó un número diferente a cada banda, posteriormente se registraron en una matriz de datos para su uso posterior. Para realizar los agrupamientos de todos los aislamientos y para cada enzima de acuerdo al número y peso molecular de las bandas dadas por éstas, la matriz de datos que se realizó anteriormente se analizó el programa de cómputo que está basado en el método de algoritmo de UPGMA (Método de promedio aritmético de grupos de pares no ponderados) y Neighbor Joining, que fue implementado en el Laboratorio de Ecología Microbiana del Centro de Investigación en Ciencias Genómicas de la Universidad Nacional Autónoma de México en Cuernavaca, Morelos, México. Los datos se imprimieron y se analizaron. La construcción de los dendrogramas se realizó a mano de acuerdo a la distancia mencionada en los datos obtenidos por dicho programa. Finalmente se obtuvieron los agrupamientos y sus distancias de acuerdo a cada patrón de bandas dado por cada una de las enzimas en todos los diferentes aislamientos.
RESULTADOS
Grupos de compatibilidad micelial. Cada uno de los aislamientos de México dio un patrón diferente de compatibilidad sin tener agrupamientos, pues se obtuvo el mismo número de aislamientos como de GCM. Tomando como base los GCM de la colección mundial de Harlton et al. (1995), al confrontar éstos con los aislamientos de México se pudieron ubicar las afinidades entre ellos. Los aislamientos de Morelos de Lens esculenta, Taraxacum officinale, Nicotiana tabacum, Parthenium hysterophorus, Raphanus sativus, Phaseolus coccineus, Coriandrum sativum y el de Veracruz de Phaseolus vulgaris fueron compatibles con el aislamiento de Eleusine indica de Carolina del Norte, EUA (GCM 33); el aislamiento de Morelos de Cucurbitapepo fue compatible con el de Mississipi EUA de Cucumis sativus (GCM 29); el de Morelos de Phaseolus vulgaris fue compatible con el de Maryland, EUA de Poa annua (GCM 34); el de Guerrero de Arachys hypogaea fue compatible con el Indonesia de A. hypogaea (GCM 48); el de Veracruz de Capsicum annuum fue compatible con el de Nepal de Avena sativa (GCM 49); El resto de los aislamientos de México (Morelos, Petroselinum crispum, Pisum sativum y Allium cepa; Guerrero y Sinaloa, Lycopersicon esculentum; Guanajuato y Puebla, Allium cepa) no fueron compatibles con ningún aislamiento de la colección mundial. Entre todos los aislamientos de A. cepa (que fue el hospedero con mayor número de aislamientos) hubo compatibilidad entre los de Guanajuato y Puebla, pero no la hubo de éstos con el de Morelos ni con el de Georgia EUA.
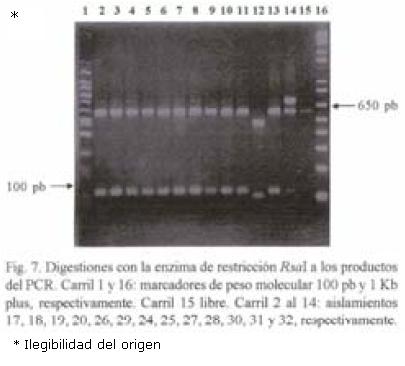
RFLP–ITS de los aislamientos. El peso molecular del producto de PCR en todos los aislamientos fue de 720 pb. Con la digestión de la enzima Hpa II se obtuvieron tres patrones diferentes: Un patrón donde aparecen cuatro bandas de 580, 480, 140 y 125; el segundo fue de cinco bandas de 600, 580, 480, 140 y 90; y el tercer patrón de cinco fragmentos (600, 480, 145, 140 y 90 pb). El fragmento de 720 pb apareció sin digerirse en cinco aislamientos de México y en uno de la colección mundial (Figs. 1 y 2). Con la digestión de MspI hubo desde 1 hasta 4 bandas en los diferentes aislamientos (Figs. 3, 4 y 5). También se pudo observar que el aislamiento número 19 que correspondió al de Puebla I–Cebolla presentó un patrón diferente a los demás aislamientos tanto de México así como de los de la colección mundial, teniendo solamente una banda que fue de 720 pb. Una posible respuesta a ello se´ria que la enzima no reconoció algún sitio para cortar, ya que se realizó una segunda digestión y dio el mismo patrón. Para el resto de los aislamientos se encontraron dos bandas de 600 y 150 pb. Ademas de estos dos fragmentos apareció la banda de 720 pb, una suposición sería que la digestión no fue eficiente, pero también existe la posibilidad de que se encuentre más copias y que la enzima no logró digerir totalmente este fragmento. en las Figuras 6 y 7 se muestra la digestión realizada con la enzima RsaI a los productos de PCR de los diferentes aislamientos, donde se encontraron cuatro bandas de 600, 490, 110 y 90 pb. En esta digestión también apareció ligeramente un fragmento de 720 pb en dos de los aislamientos de México, indicando la posibilidad de que la enzima no digirió totalmente esta banda. La mayoría de los aislamientos tanto mundiales como de México compartieron el mismo número de bandas con el mismo peso, excepto dos aislamientos mundiales que corresponden a Indonesia–cacahuate y el de Israel–papa (Fig. 6 carriles 12 y 14). Los cortes realizados con la enzima Sau3AI a los productos de PCR de los diferentes aislamientos se muestra en las Figuras 8 y 9. La digestión realizada por esta enzima fue la que tuvo mayor número de bandas de diferentepeso molecular comparado con las otras tres enzimas. El total de bandas obtenidas fue de 11, pero hubo desde 4 hasta 6 bandas en varios de los aislamientos. El aislamiento que presentó diferencias en cuanto al patrón de bandas fue el de Veracruz–chile (Fig. 8 carril 17). Con los cortes realizados al producto de PCR por las cuatro enzimas utilizadas, se hicieron los diferentes patrones de bandas encontradas con sus respectivos pesos moleculares en todos los aislamientos de S. rolfsii. Para la enzima Hpall se formaron siete patrones diferentes a lo reportado. En lo que se refiere a la enzima Rsal, se encontraron dos patrones de bandas que fueron iguales a los reportados y uno diferente que corresponde a un aislamiento de los de referencia. Con Sau3AI se obtuvieron ocho patrones diferentes a lo reportado. Se encontraron cinco patrones diferentes de las digestiones realizadas por la enzima de restricción MspI que no se pudieron comparar, ya que no se encuentra reportada por Harlton et al. (1995). En total se encontarron 11 aislamientos que pertenecen al RFLP–ITS IV y uno al IX, los 8 aislamientos restantes pertenece a un grupo nuevo.
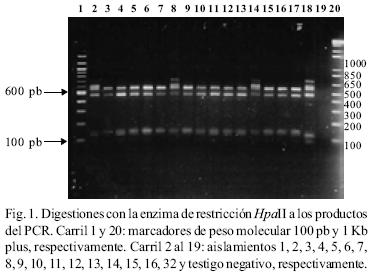
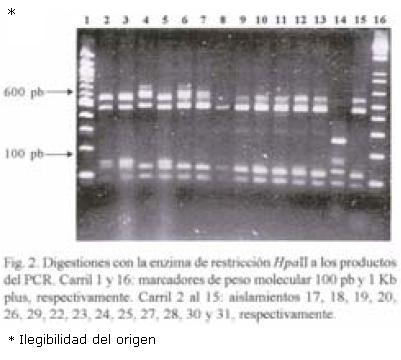

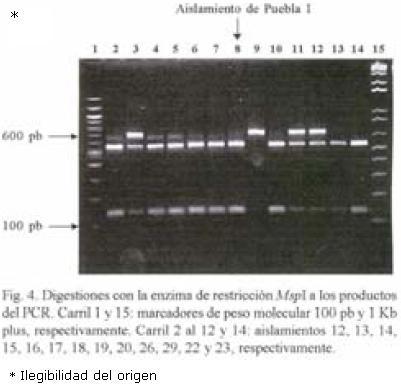
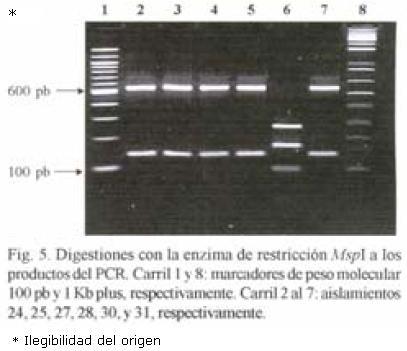



Dendrograma. Los aislamientos que quedaron dentro de los grupos de RFLP según el dendrograma fueron los siguientes: aislamientos Veracruz–chile (16) con el de Nepal–Avena (31) del grupo XI; aislamientos de Morelos diente de león (3), tabaco (4), pajarito (5), rábano (6), calabaza (8), frijol ayocote (9), cilantro (10), cebolla (11) y frijol (12), Guerrero–cacahuate (14) y Veracruz–frijol (15) con el aislamiento de North Carolina–Pasto (25) del grupo IV; Morelos –cilantro (2) con el grupo III de North Carolina–tabaco. Para los aislamientos de Morelos perejil (1) y chícharo (7), Guerrero–jitomate (13), Sinaloa–soya (17), Guanajuato–cebolla (18) y los de Puebla–cebolla (19 y 20) no se encontró grupo. En el caso del aislamiento 30 (que correspondió al de Indonesia–Cacahuate y grupo de RFLP X) en todos los dendrogramas de las diferentes enzimas, siempre se comportó alejado del resto de los aislamientos (Fig.10).
DISCUSIÓN
Grupos de compatibilidad micelial. De acuerdo a estudios anteriores, existen algunas tendencias de comportamiento de los GCM, la mayoriá de aislamientos dentro de un GCM tienden a ser de una misma área geográfica y hospedero, pero también puede ocurrir que en un GCM existan varios hospederos y varias zonas geográficas y que una misma área geográfica pueda tener una diversidad de GCM (Harlton et al., 1995; Nalim et al., 1995); en este trabajo predominó el GCM 33 en 7 aislamientos de Morelos (sobre un total de 20), pero de diferentes hospederos; en un mismo hospedero hay afinidades entre algunos de los aislamientos, pero en otros no hay compatibilidad. Todo parece indicar que los GCM no tienen relación con el hospedero de origen ni el área geográfica, ya que por ejemplo, fueron compatibles algunos aislamientos de Morelos con los de lugares tan remotos como Nepal e Indonesia y un aislamiento de una especie de la familia Poaceae (Eleusine indica) fue compatible con aislamientos procedentes de especies de plantas de muy diversas familias.
Amplificación por PCR de la región ITS. La amplificación en todos los aislamientos se obtuvo un fragmento del tamaño esperado de 720 pares de bases. Estos resultados coinciden con los reportes de Harlton et al. (1995), Okabe et al. (2000) y White et al. (1990), quienes mencionan el mismo peso molecular del producto de PCR. Cilliers et al. (2000), mencionan que diferentes tipos de marcadores han sido desarrollados para caracterizar poblaciones de patógenos de plantas, los RFLP pueden ser altamente informativos utilizando los cebadores apropiados, aunque en varios estudios se reportan pequeñas variaciones inter e intraespecíficas, dentro de las regiones ITS en varias especies de hongos y que éstas son debido principalmente a los eventos de deleción e inserción en las regiones ITS I e ITS II.
Grupos RFLP–ITS. En el reporte realizado por Harlton et al. (1995), determinaron los 12 grupos de RFLP–ITS con 4 enzimas de restricción, aún cuando en este trabajo sólo se utilizaron tres de las cuatro enzimas reportadas se tuvieron resultados similares. Con las enzimas MspI y RsaI se encontró el mismo patrón de bandas. Con Sau3AI, aunque las digestiones son un poco parciales, tampoco se encontraron bandas mayores a 445 pb, pero de acuerdo a los resultados del presente trabajo, se obtuvieron tamaños más grandes (500, 650, 700 y 720 pb), lo que demuestra diferencias notables entre los aislamientos mexicanos y los de otros países. En el presente trabajo se encontraron trece aislamientos de México que están relacionados a los aislamientos 31, 25 y 24 que pertenecen a los grupos RFLP–ITS XI, IV y III reportados previamente por Harlton et al. (1995), los siete aislamientos restantes pertenecen a tres grupos distintos según las enzimas de restricción utilizadas en esta investigación. Esto indica que se tiene una colección heterogénea de diferentes áreas geográficas y de varios hospederos y que tales diferencias pueden deberse a la influencia de las condiciones ambientales donde se desarrollan estos aislamientos (Punja y Grogan, 1983). Los aislamientos de México podrían tener más de una copia de la región ITS dentro de su genoma, ya que se observó que al realizar las digestiones presentaban una doble banda de 720 pares de bases y podría deberse al estado multinucelado de Sclerotium rolfsii. Esta situación también se reporta en otros trabajos y con otras especies donde se encontraron mezclas de diferentes tipos de rDNA. También se especula que la variación podría ser entre las copias de DNA en sitios de restricción o en sus tamaños, pues con otras especies al realizar la amplificación los productos obtenidos variaron en tamaño de pares de bases (Gardes et al., 1990). Los resultados aquí encontrados en cuanto a la particularidad de los genotipos de México, refuerzan lo encontrado en cuanto a diversidad patogénica de este hongo en el país (Flores–Moctezuma et al., 2006), lo cual plantea la necesidad de establecer estrategias de manejo de S. rolfsii de acuerdo a las características regionales de la República Mexicana.
CONCLUSIONES
Existe diversidad de GCM en los aislamientos de Sclerotium rolfsii de las regiones geográficas de México que se utilizaron en este estudio, y no se encontró relación en estos GCM con el área geográfica ni con los hospederos de origen. También mostraron variación las regiones intergénicas de los genes ribosomales de los aislamientos de México. Los patrones de RFLP–ITS obtenidos de los aislamientos de México permitieron distinguir diversos genotipos, algunos nuevos no reportados, mientras que otros se asemejan a patrones reconocidos previamente (Harlton et al., 1995), pero existen también algunos particulares del país, lo que sugiere la posibilidad de que a nivel mundial todavía sea posible encontrar más variantes que se podrían detectar en los países donde se han encontrado la mayor diversidad de hospederos o en aquellas regiones no exploradas.
LITERATURA CITADA
Almeida, A.M.R., Abdelnoor, R.V., Calvo, E.S., Tessnman, D., and Yorinori, J.T. 2001. Genotypic diversity among Brazilian isolates of Sclerotium rolfsii. Journal of Phytopathology 149:493–502. [ Links ]
Cilliers, A.J., Herselman, L., and Pretorius, Z.A. 2000. Genetic variability within and among mycelial compatibility groups of Sclerotium rolfsii in South Africa. Phytopathology 90:1026–1031. [ Links ]
Farr, D.F., Bills, G.F., Chamuris, G.P., and Rossman, A.Y. 1989. Fungi on Plants and Plant Products in the United States of America. American Phytopathological Society. St. Paul, Minnesota, USA. 1252 p. [ Links ]
Flores–Moctezuma, H.E., Montes–Belmont, R., and Nava–Juarez, R. 2006. Pathogenic diversity of Sclerotium rolfsii isolates from Mexico and its potential control through solarization and organic amendments. Crop Protection 25:195–201. [ Links ]
Gardes, M., Fortin, J. A., Mueller, G. M., and Kropp, B. R. 1990. Restriction fragment length polymorphisms in the nuclear ribosomal DNA of four Laccaria spp., L. bicolor, L. laccata, L. proxima, and L. amethystine. Phytopathology 80:1312–1317. [ Links ]
Harlton, C.E., Lévesque, C.A., and Punja, Z.K. 1995. Genetic diversity in Sclerotium (Athelia) rolfsii and related species. Phytopathology 85:1269–1281. [ Links ]
Nalim, F.A., Starr, J.L., Woodard, K.E., Segner, S., and Keller, N.P. 1995. Mycelial compatibility groups in Texas peanut field populations of Sclerotium rolfsii. Phytopathology 85:1507–1512. [ Links ]
Okabe, I., Morikawa, C., and Matsumoto, N. 2000. Variation in southern blight fungus in Japan detected by ITS–RFLP analysis. http://ss.jircas.affrc.go.jp/engpage/jarq/34–2/okabe/34–2(3).html. Consulta: febrero 17, 2003. [ Links ]
Punja, Z.K. 1985. The biology, ecology, and control of Sclerotium rolfsii. Annual Review of Phytopathology 23:97–127. [ Links ]
Punja, Z.K. 1988. Sclerotium (Athelia) rolfsii, a pathogen of many plant species. pp. 523–534. In: G.S. Sidhu (ed.). Advances in Plant Pathology. Academic Press. San Diego, California, USA. 603 p. [ Links ]
Punja, Z.K., and Grogan, R.G. 1983. Basidiocarp induction, nuclear condition, variability, and heterokarion incompatibility in Athelia (Sclerotium) rolfsii. Phytopathology 73:1273–1278. [ Links ]
Punja, Z.K., and Sun, L. 2001. Genetic Diversity among mycelial compatibility groups of Sclerotium rolfsii (teleomorph Athelia rolfsii) and S. delphinii. Mycological Research 105:537–546. [ Links ]
Qiangen, 2001. Protocolo para aislamientos de DNA de hongos. Dneasy plant minikit handbook. pp.15–17. Valencia, California, USA. 25 p. [ Links ]
Sambrook, J., Fritsch, E.F., and Maniatis, T. 1989. Gel electrophoresis of DNA. pp. 6.39–6.44. In: C. Nolan (ed.). Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York, USA. 231 p. [ Links ]
White, T.J., Bruns, T., Lee, S., and Taylor, J. 1990. Amplification and direct sequencing of fungal ribosomal DNA for phylogenetics. pp. 315–322. In: M.A. Innis, D.H. Gelfand, J.J. Sninsky, and T.J. White (eds.). PCR Protocols: A Guide to Methods and Applications. Academic Press. San Diego, California, USA. 355 p. [ Links ]














