Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.25 n.1 Texcoco 2007
Artículos científicos
Actividad Biológica in vitro de Extractos de Flourensia cernua D.C. en Patógenos de Postcosecha: Alternaria alternata (Fr.:Fr.) Keissl., Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. y Penicillium digitatum (Pers.:Fr.) Sacc.
In vitro biological activity of extracts of Flourensia cernua D.C. on postharvest pathogens: Alternaria alternata (Fr.:Fr.) Keissl., Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. y Penicillium digitatum (Pers.:Fr.) Sacc.
Eugenio Guerrero-Rodríguez(†)1, Susana Solís-Gaona1, Francisco Daniel Hernández-Castillo1, Alberto Flores-Olivas1, Víctor Sandoval-López1 y Diana Jasso-Cantú2
1 Universidad Autónoma Agraria Antonio Narro (UAAAN), Depto. de Parasitología Agrícola, Apdo. Postal 342, Km 7.5 Carr. a Zacatecas, Buenavista, Saltillo, Coahuila, México CP 25315. Correspondencia: susysolgao@gmail.com
2 UAAAN, Depto. de Fitomejoramiento.
Recibido: Octubre 31, 2006
Aceptado: Febrero 6, 2007
Resumen
Se evaluó el efecto de extractos de hojas frescas de Flourensia cernua sobre la inhibición micelial y esporulación de Alternaria alternata, Colletotrichum gloeosporioides y Penicillium digitatum. Los extractos se obtuvieron con metanol:cloroformo 1:1, y por extracción sucesiva con hexano, éter dietílico y etanol. Las concentraciones evaluadas fueron 500, 1000, 2000 y 4000 mg/ L en medio de cultivo papa-dextrosa-agar. Los análisis de espectros de infrarrojo se realizaron en espectroscopio mediante la técnica de infrarrojos transformados de Fourier (FTIR). El mayor rendimiento de resina (19.1%) se obtuvo con metanol:cloroformo. La inhibición micelial en A. alternata fue mejor con las fracciones de hexano (91.9%) y metanol:cloroformo (88.4%) a 4000 mg/L, mientras que C. gloesporioides y P. digitatum fueron inhibidos en un 93.4 y 94%, respectivamente, a partir de 500 mg/L de la fracción de etanol; en todos los casos el efecto fue fungistático. No se observaron conidios de A. alternata con los extractos de etanol a 4000 mg/L y metanol:cloroformo a 2000 y 4000 mg/L. El extracto etanólico desde 2000 mg/L provocó la menor producción de conidios en C. gloesporioides; los cuatro extractos provocaron disminución del número de conidios en P. digitatum, aunque no hubo diferencia estadística entre ellos. En general, el extracto etanólico fue el más eficiente para inhibir micelio y afectar la producción de conidios de C. gloesporioides y P. digitatum. Los espectros de FTIR de los extractos mostraron que las fracciones tienen los mismos grupos funcionales, pero en distinta proporción.
Palabras clave: Hojasén, extractos vegetales, antifúngico, antiesporulante.
Abstract
The effect of fresh leaf extracts from Flourensia cernua was evaluated for mycelial inhibition and sporulation of the pathogens Alternaria alternata, Colletotrichum gloeosporioides, and Penicillium digitatum. Extracts were obtained with methanol:chloroform (1:1), and by sequential extractions with hexane, diethyl ether, and ethanol. The concentrations evaluated were 500, 1000, 2000, and 4000 mg/ L in potato-dextrose-agar culture medium. Analysis of infrared spectrum was performed with an spectroscope using the Fourier transformation infrared technique (FTIR). The highest resin yield (19.1%) was obtained with methanol:chloroform. The highest mycelial inhibition of A. alternata ocurred with hexane fractions (91.9%) and methanol:chloroform (88.4%) at 4000 mg/L, whereas C. gloesporioides and Penicillium digitatum were inhibited 93.4% and 94%, respectively, from 500 mg/L of the ethanol fraction. All extracts showed fungistatic effect. A. alternata did not produce conidia when treated with the ethanol extract at 4000 mg/L and methanol:chloroform at 2000 and 4000 mg/L. The ethanol extract from 2000 mg/L caused the lowest conidia production by C. gloesporioides. The four extracts reduced conidia production by P. digitatum, although they were not statistical different. In general, the ethanolic extract was the most efficient to inhibit mycelial growth and conidia production of C. gloesporioides and P. digitatum. FTIR spectra of extracts showed that the fractions have the same functional groups but at different ratio.
Keywords: Tarbush, plant extracts, antifungal, antisporulation.
Actualmente, el control de hongos fitopatógenos requiere de aplicar técnicas alternativas, pues el manejo tradicional con agroquímicos sintéticos ha ocasionado diversos problemas como la toxicidad a los usuarios (Whalen et al., 2003), detención de exportaciones por residuos en producto de consumo y daños al medio ambiente (Ramírez-Legarreta y Jacobo-Cuéllar, 2002), así como afectación de organismos benéficos (Anderson et al., 2003). Otro aspecto importante es que los microorganismos fitopatógenos han generado resistencia al ingrediente activo de algunos fungicidas sintéticos (Cooke et al., 2003; Leroux, 2003), como respuesta a la presión de selección debido a las altas dosis y aplicaciones continuas, ocasionando grandes pérdidas económicas. Una alternativa económica y eficiente para el control de enfermedades, es el uso de los productos naturales derivados de las plantas (Montes, 2000; Montes y Figueroa, 1995; Wilson et al., 1999), no afectan el medio ambiente ya que sus residuos son fáciles de degradar, son potenciales de utilizar en el control de patógenos de productos agrícolas en postcosecha, y permiten la obtención de productos agrícolas con calidad de exportación (Wilson et al., 1994). De los hongos que afectan en postcosecha, existen tres de gran importancia: Alternaria alternata (Fr.:Fr.) Keissl. el cual afecta frutos de tomate (Lycopersicon esculentum Mill.) en campo y en postcosecha, puede comportarse como oportunista o infectar por si solo, y sus lesiones iniciales aumentan cubriendo el fruto con un moho negro (Rotem, 1994); Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. es el principal género causante de antracnosis en la mayoría de los cultivos en el mundo, es uno de los principales problemas de tomates destinados a la industria de conservación, y causa manchas hundidas recubiertas de pústulas de color rosa, anaranjado o negruzco en frutos de tomate (Messiaen et al., 1995); en cítricos, el moho verde causado por Penicillium digitatum (Pers.:Fr.) Sacc. constituye el problema más grave, responsable de más del 60% de pérdidas ocasionadas por hongos en frutos conservados en refrigeración (Tuset, 2000). Los extractos vegetales se han empleado desde tiempos remotos, principalmente en el ámbito medicinal para el control de enfermedades, y recientemente en el entorno agrícola contra insectos e incluso en el control de algunos microorganismos fitopatógenos, sin definir en algunos casos cual es su principio activo (Lagunes et al., 1984). En México existe un gran número de especies vegetales ampliamente distribuidas, que pueden ser evaluadas desde el punto de vista fitoquímico para determinar su actividad biológica sobre hongos fitopatógenos, como es el caso de Flourensia cernua D.C. (hojasén), la cual es abundante en las zonas áridas y semiáridas de México, y de la que se han reportado efectos de inhibición sobre Rhizoctonia solani Kühn y Phytophthora infestans (Mont.) de Bary con extractos metanólicos (Gamboa et al., 2003), así como de Colletotrichum spp. con extractos hexánicos, y contra termitas con extractos hexánicos, de éter dietílico y etanólicos (Tellez et al., 2001). Los objetivos del presente estudio fueron: a) Evaluar el efecto inhibitorio de cuatro extractos de F. cernua in vitro en el desarrollo micelial y formación de conidios de tres hongos que afectan a frutos en postcosecha: Alternaria alternata, Colletotrichum gloeosporioides y Penicillium digitatum, y b) identificar en forma preliminar, los grupos funcionales de compuestos presentes en los diferentes extractos.
MATERIALES Y MÉTODOS
Colecta del material vegetal. La colecta de las hojas de F. cernua se llevó a cabo en un sitio con gran abundancia de arbustos, en el ejido Guadalupe Victoria, Municipio de Saltillo, por la carretera 54 a Zacatecas, tomando plantas de una altura de 50 a 60 cm, con un diámetro de tallos de 5-6 cm, de las cuales se cortaron ramas de 10 a 12 cm con la mayor cantidad de hojas; el material cortado se depositó en bolsas de plástico para su traslado al laboratorio y se colocó en un cuarto frío (4°C); posteriormente, las hojas se separaron de los tallos, las cuales se guardaron en bolsas de polietileno a -18°C hasta su extracción.
Obtención de extractos y rendimiento de resina. Este proceso se llevó a cabo utilizando 460 g de hojas con 2.5 L de disolvente en frascos de 4 L color ámbar, los que se agitaron mecánicamente a 150 rpm en un baño de agitación (Brickman) durante 22 h a temperatura ambiente (25 ± 2°C), para ello se realizó una extracción secuenciada con hexano, éter dietílico y etanol (Téllez et al., 2001). Por otra parte, de otra cantidad igual de hojas (460 g), se realizó la extracción con la mezcla de metanol-cloroformo (1:1), bajo las mismas condiciones de agitación y temperatura. Al término de las extracciones, se filtró el extracto sobre papel Whatman No. 1 y se separó el disolvente de la resina en un rotavapor (Buchii). El rendimiento de resina se determinó gravimetricamente a 65°C.
Obtención de cepas de microorganismos. De frutos de tomate se aisló A. alternata y C. gloeosporioides, y de naranja [Citrus sinensis (L.) Osbeck] se obtuvo P. digitatum. El crecimiento se realizó sembrando material vegetal infectado en medio de cultivo papa-dextrosa-agar (PDA, Bioxon), posteriormente se aislaron por punta de hifa (Chairman et al., 1978), se identificaron mediante las claves de Rotem (1994) y Messiaen et al. (1995), y se conservaron a 27°C por cuatro días, tiempo de crecimiento estándar para realizar la siembra del inóculo en medio envenenado para la evaluación antifúngica.
Bioensayo por medio envenenado. Se realizó agregando la cantidad requerida de cada uno de los extractos en el medio de cultivo PDA, para obtener concentraciones de 500, 1000, 2000 y 4000 mg/L, y un testigo absoluto con sólo medio de cultivo, el cual se vació en cajas Petri y se dejó por 4 h en cámara de flujo laminar para permitir que el medio solidificara sin contaminarse, después se inocularon las cajas colocando al centro una porción de la cepa de 0.45 cm de diámetro proveniente de cepas de cuatro días de desarrollo de los microorganismos bajo estudio.
Inhibición micelial y de la esporulación y efecto fungistático. El crecimiento micelial se registró diaramiente durante siete días. El porcentaje de inhibición se determinó en base al diámetro de las colonias y al testigo absoluto, tomando dos lecturas en cruz por cada caja Petri; además, se tomaron datos del número de conidios a los siete días de la inoculación, tanto en los tratamientos como en el testigo, utilizando una cámara de Neubauer (Hemacitómetro Hausser Scientific). Para definir el efecto fungistático, se tomó micelio de los tratamientos donde se presentó una inhibición del desarrollo por arriba del 50% a los cinco días de cada bioensayo, y se sembró por punta de hifa en medio no envenenado, para observar posible desarrollo.
Diseño experimental. Para cada microorganismo se evaluó el efecto de las resinas de los cuatro extractos, con cuatro concentraciones y un testigo absoluto (PDA), teniendo cuatro repeticiones para cada concentración, considerándose cada caja Petri como una repetición. El análisis de datos se hizo mediante un diseño de parcelas divididas A x B (Little y Hills, 1989), donde A fue el efecto de los extractos y B el efecto de las concentraciones. La comparación de medias se realizó con DMS (p = 0.01) usando el paquete estadístico SAS versión 6.12 (SAS Institute, Inc., 1996).
Espectroscopía de los extractos. Los espectros de infrarrojo de extractos se obtuvieron por espectroscopía de infrarrojos transformados de Fourier (FTIR). Los extractos fueron disueltos en cloroformo seco y una película delgada de la solución se colocó en cristales de bromuro de potasio, los cuales se analizaron con un aparato FTIR Nicolet Magna 550, con una resolución de 4 cm-1 y 25 scans de barrido. Las bandas seleccionadas de los espectros se analizaron para hacer una evaluación preliminar de la composición.
RESULTADOS Y DISCUSIÓN
Rendimiento de extractos. La mayor cantidad de resina se obtuvo con el extracto de metanol:cloroformo 1:1 (Cuadro 1), si bien, no se ha reportado extracción de F. cernua con esta mezcla, existen reportes de que metanol y cloroformo por separado extraen mayor cantidad de resina de Larrea tridentata (Seesé y Moc. ex D.C.) Coville que con el etanol grado absoluto (Lira-Saldívar et al., 2003). Por otra parte, los resultados de la extracción secuenciada en este estudio, muestran mayores rendimientos que las resinas obtenidas por Téllez et al. (2001).

Inhibición micelial. Alternaria alternata. Los valores de inhibición micelial promedio de los extractos de metanol:cloroformo (1:1), hexano y etanol fueron los más eficientes estadísticamente (P < 0.01), con un promedio de 82.0, 81.6 y 80.3%, respectivamente, siendo el de éter el menos eficiente con un promedio de 67.6% (Fig. 1A). Por otro lado, la mayor inhibición micelial observada fue de 91.9 y 88.4%, las que se presentaron con los extractos hexánico y el de metanol:cloroformo ambos a 4000 mg/L, respectivamente. Estos resultados coinciden con los obtenidos con extractos de L. tridentata, los cuales fueron extraídos con cloroformo, etanol y metanol, en donde se evaluaron concentraciones similares a las de este trabajo, y a una dosis mayor de 8000 mg/L, la cual inhibió el crecimiento micelial de otra especie de Alternaria (A. solani Sorauer) en un 100% (Saldívar et al., 2003). Penicillium digitatum. El extracto etanólico fue el más eficiente para inhibir el micelio de este hongo, con un promedio de inhibición de 95.8% (Fig. 1B), siendo el extracto de hexano el menos eficiente con 65.0%. La mayor inhibición se logró con el extracto etanólico en sus dosis de 500 mg/L (94.2%) a 4000 mg/L (96.3%). Estos resultados concuerdan con evaluaciones de extractos etanólicos de semillas y hojas de huamúchil [Pithecellobium dulce (Roxb.) Benth.] que fueron eficientes contra Penicillium sp., sobre todo los extractos de hojas y semillas de plantas bajo estrés (Bautista-Baños et al., 2003), por lo cual se puede señalar que la alta polaridad del etanol, permite extraer compuestos que inhiben el micelio de Penicillium. Colletotrichum gloeosporioides. Las concentraciones de 500 mg/L de los extractos hexánico, etéreo y metanol-clorofórmico, inhibieron en menos del 60% el crecimiento micelial de C. gloesporioides (Fig. 1C); sin embargo, el análisis estadístico reveló que el extracto etanólico presentó la mayor inhibición de 92.9% a 500 mg/L y fue el más eficiente con 85.8% de inhibición promedio, seguido por la concentración de 4000 mg/L del extracto metanol:clorofórmico 1:1, el cual expresó un 90.95% de inhibición micelial. El menor efecto se presentó con el éter con un 53.63% de inhibición promedio, lo cual difiere de los resultados obtenidos por Téllez et al. (2001) quienes evaluaron extractos de F. cernua sobre C. gloeosporioides, y reportaron que el extracto de éter presentó las mayores zonas de inhibición en bioensayos en placas de cromatografía de capa fina, a dosis de 10 a 400 µg; el etanol por su parte inhibió únicamente a dosis de 400 µg, aunque a esta dosis la diferencia de inhibición fue pequeña, 10 mm para el extracto de éter y 9.7 mm para el de etanol; esta diferencia puede deberse a que el método de los bioensayos fue distinto, pues en este estudio se utilizó un medio de cultivo propicio para el crecimiento del hongo.

Actividad antiesporulante. Alternaria alternata. Los extractos que produjeron menor número de conidios de A. alternata en comparación con el testigo fueron el etanol y metanol:cloroformo 1:1 (P < 0.01) (Cuadro 2), sin embargo no se observó desarrollo de conidios con las concentraciones de 2000 y 4000 mg/L del extracto metanol:cloroformo 1:1, y a 4000 mg/L del extracto etanólico (Cuadro 3); esto pudo ser debido a que estos dos extractos presentaron la mayor inhibición micelial, por lo que es de esperarse que al haber menor cantidad de micelio la producción de conidios también fuera menor; por otro lado, el extracto de éter no afectó la esporulación, y un comportamiento inesperado se tuvo con el extracto hexánico, que había sido eficiente para inhibir el micelio de este hongo, al inducir mayor producción de conidios que el testigo a las concentraciones de 500, 1000 y 2000 mg/ L. Al respecto, se ha observado que algunas fuentes de carbono útiles para la esporulación de ciertos hongos, afectan la reproducción de otros y no necesariamente incrementan el crecimiento micelial (Greene y Barnett, 1951). Penicillium digitatum. Los cuatro extractos de F. cernua afectaron la producción de conidios en P. digitatum, aunque no hubo diferencia estadística entre ellos y entre sus concentraciones (Cuadro 2). Obagwu y Korsten (2003) reportaron que el extracto etanólico de Allium sativum se evaluó para inhibir desarrollo de P. digitatum sobre naranjas variedad Valencia; el extracto no fue efectivo cuando se utilizó solo, pero a la concentración de 1.0% + 0.1 % de aceite comestible inhibió en un 100% la germinación de los conidios. Por lo anterior, es conveniente considerar el utilizar mezclas de los extractos con mayor potencial para evaluar un posible sinergismo en el control de estos patógenos. Colletotrichum gloeosporioides. La producción de conidios de este hongo se vio más afectada por el extracto etanólico a las concentraciones de 2000 y 4000 mg/L (Cuadro 3), y en promedio, los extractos etanólico y metanol:clorofórmico afectaron de manera similar la esporulación de este hongo (Cuadro 2); estos mismos extractos presentaron la mayor inhibición micelial del hongo. El extracto hexánico, igual que para A. alternata aunque en menor proporción, estimuló mayor formación de conidios de C. gloeosporioides a la concentración de 500 mg/L; por su parte, el extracto de éter también indujo al hongo a producir mayor número de conidios en comparación al testigo; Bautista-Baños et al. (2002) reportan inhibición total de esporulación de C. gloeosporioides con cinco extractos acuosos evaluados en proporción 10:4 v/v en PDA. En forma general, la investigación del control de estos tres patógenos de postcosecha ha sido enfocada a evaluar el efecto de compuestos de origen natural tanto in vitro como en frutos inoculados; en este tópico se han evaluado compuestos de origen natural como el quitosano (Hernández-Lauzardo et al., 2005), el cual resultó efectivo a 2.5% para inhibir esporulación, crecimiento vegetativo y germinación de esporas de A. alternata (Sánchez-Domínguez et al., 2005); algunos agentes de control biológico inoculados a frutos han resultado efectivos como Bacillus subitilis Cohn, el cual disminuyó la severidad de C. gloeosporioides en frutos de mango (Mangifera indica L.) (Carrillo-Fasio et al., 2005). Por otra parte, los agentes de control biológico requieren de condiciones de temperatura y humedad óptimas para llevar a cabo su desarrollo y efecto antagónico sobre microorganismos patógenos, lo que puede restarles efectividad, por lo que extractos de origen vegetal efectivos en el control de patógenos de postcosecha pueden ser integrados. Los resultados obtenidos en este estudio dan la pauta para continuar evaluando los extractos etanólico y de metanol:cloroformo en el control de estos patógenos en bioensayos in vivo.


Efecto fungistático. Las siembras por punta de hifa en PDA, provenientes de cajas Petri con medios envenenados, que inhibieron en diferente grado a los tres hongos bajo estudio, se desarrollaron normalmente al igual que el testigo, y alcanzaron un diámetro de colonia de 7.3 cm a los seis días en el caso de C. gloeosporioides, y a los siete días en caso de A. alternata y P. digitatum, lo que confirma que el efecto de los cuatro extractos de F. cernua fue fungistático.
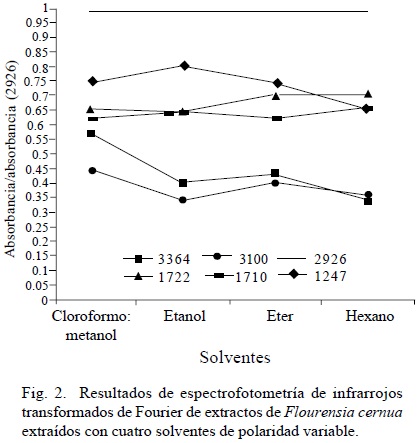
Espectroscopia de infrarrojo. Los resultados de infrarrojo (Fig. 2) manifiestan que los cuatro extractos tienen el mismo tipo de grupos funcionales: hidroxilo, carbonilo, amina e hidrocarbonos, pero en diferente proporción. Esto sugiere que la composición y los compuestos específicos tienen más efecto en cada hongo. En general, los seriales corresponden a hidroxilo, alquenos, aromáticos, aminas y aldehídos, pero se requiere un análisis detallado para determinar los compuestos químicos determinados.
CONCLUSIONES
Los cuatro extractos de F. cernua presentaron efecto de inhibición micelial de A. alternata, C. gloeosporioides y P. digitatum, aunque no todos afectaron la esporulación. Los extractos más eficientes para inhibir esporulación de A. alternata y C. gloeosporioides fueron el etanólico y el de metanol:cloroformo; éste último extracto obtuvo el mayor rendimiento de resina. Los extractos presentaron los mismos grupos químicos, pero en distinta proporción.
AGRADECIMIENTOS
Los autores agradecen a la T.A. María Guadalupe Moreno-Esquivel por su apoyo en la obtención de los extractos, y al Ing. José Omar Cárdenas-Palomo por su apoyo en la colecta de material vegetal, realización de bioensayos y toma de datos.
LITERATURA CITADA
Anderson, B.S., Hunt, J.W., Phillips, B.M., Nicely, P.A., Vlaming, V. de, Connor, V., Richard, N., and Tjeerdema, R.S. 2003. Integrated assessment of the impacts of agricultural drainwater in the Salinas River (California, USA). Environmental Pollution 124:523-532. [ Links ]
Bautista, B.S., García, D.E., Barrera, N.L., Reyes, Ch.R., and Wilson, C.L. 2003. Seasonal evaluation of the postharvest fungicidal activity of powders and extracts of huamuchil (Pithecellobium dulce): action against Botrytis cinerea, Penicillium digitatum and Rhizopus stolonifer of strawberry fruit. Postharvest Biology and Technology 29: 81-92. [ Links ]
Bautista-Baños, S., Barrera-Necha, L.L., Bravo-Luna, L., and Bermúdez-Torres, K. 2002. Antigunfal activity of leaf and stem extracts from various plant species on the incidence of Colletotrichum gloesporioides of papaya and mango fruit after storage. Revista Mexicana de Fitopatología 20:8-12. [ Links ]
Carrillo-Fasio, J.A., García-Estrada, R.S., Muy-Rangel, M.D., Sañudo-Barajas, A., Márquez-Zequera, I., Allende-Molar, R., De la Garza-Ruiz, Z., Patiño-Vera, M. y Galindo-Fentanes, E. 2005. Control biológico de antracnosis [Colletotrichum gloeosporioides (Penz.) Penz. y Sacc.] y su efecto en la calidad poscosecha del mango (Mangifera indica L.) en Sinaloa, México. Revista Mexicana de Fitopatología 23:24-32. [ Links ]
Chairman, E.I.Z., Bird, G.W., Fisher, K.D., Hickey, K.D., Lewis, F.H., Line, R.F., and Rickard, S.F. 1978. Methods for Evaluating Plant Fungicides, Nematicides, and Bactericides. The American Phytopathological Society. St. Paul, Minnesota, USA. 141 p. [ Links ]
Cooke, D.E.L., Young, V., Birch, P.R.J., Toth, R., Gourlay, F., Day, J.P., Carnegie, S.F., and Duncan, J.M. 2003. Phenotypic and genotypic diversity of Phytophthora infestans populations in Scotland (1995-97). Plant Pathology 52:181-192. [ Links ]
Gamboa-Alvarado, R., Hernández-Castillo, F.D., Guerrero-Rodríguez, E., Sánchez-Arizpe, A. y Lira-Saldívar, R.H. 2003. Inhibición del crecimiento micelial de Rhizoctonia solani Kühn y Phytophthora infestans Mont. (De Bary) con extractos vegetales metanólicos de hojasén (Flourensia cernua D.C.), mejorana (Origanum majorana L.) y trompetilla [Bouvardia ternifolia (Ca.) Schlecht.]. Revista Mexicana de Fitopatología 21:13-18. [ Links ]
Greene, L.V., and Barnett, H.L. 1951. Physiology of the Fungi. McGraw-Hill Book Company, Inc. 1a edición. New York, USA. 464 p. [ Links ]
Hernández-Lauzardo, A.N., Bautista-Baños, S., Velázquez-del Valle, M.G., Rodríguez-Ambriz, S.L., Corona-Rangel, M.L, Solano-Navarro, A. y Bosquez-Molina, E. 2005. Potencial del quitosano en el control de las enfermedades postcosecha. Revista Mexicana de Fitopatología 23:198-205. [ Links ]
Lagunes, T. A., Arenas, S.C. y Rodríguez, H.C. 1984. Extractos acuosos y polvos vegetales con propiedades insecticidas. CONACYT-CP-UACH-DGSV. México, D.F. 203 p. [ Links ]
Leroux, P. 2003. Mode of action of agrochemicals towards plant pathogens. Comptes Rendus Biologies 326:9-21. [ Links ]
Lira-Saldívar, R.H., Balvantín-García, G.F., Hernández-Castillo, F.D., Gamboa-Alvarado, R., Jasso-de-Rodríguez, D., and Jiménez-Díaz, F. 2003. Evaluation of resin content and the antifungal effect of Larrea tridentata (Sesse and Moc. ex D.C.) Coville extracts from two Mexican deserts against Pythium sp. Pringsh. Revista Mexicana de Fitopatología 21:97-101. [ Links ]
Little, T.M. y Hills, F.J. 1989. Métodos Estadísticos para la Investigación en la Agricultura. Ed. Trillas. 2a edición, 4a Reimp. México, D.F. 270 p. [ Links ]
Messiaen, C.M., Blancard, D., Rouxel, F. y Lafon, R. 1995. Enfermedades de las Hortalizas. Ed. Mundi-Prensa. 3a edición. Madrid, España. 576 p. [ Links ]
Montes, B.R. 2000. Evaluación de plantas antifúngicas y su potencial aplicación en la fitosanidad. Memorias XXXV Congreso Nacional de Entomología. Acapulco, Guerrero, México. 11-14 de junio. p. 835. [ Links ]
Montes, B.R. y Figueroa, B.R. 1995. Biocontrol de hongos en granos almacenados. pp. 26-30. En: T.K. Bermúdez y A. Jiménez P. (eds.). Plantas: Biotecnología, Agronomía, Nutrición. COFAA-IPN. México. 66 p. [ Links ]
Obagwu, J., and Korsten, L. 2003. Control of citrus green and blue molds with garlic extracts. European Journal of Plant Pathology 109:221-225. [ Links ]
Ramírez-Legarreta, M.R. y Jacobo-Cuéllar, J.L. 2002. Impacto ambiental del uso de plaguicidas en huertos de manzano del noroeste de Chihuahua, México. Revista Mexicana de Fitopatología 20:168-173. [ Links ]
Rotem, J. 1994. The Genus Alternaria: Biology, Epidemiology and Pathogenicity. The American Phytopathological Society. St. Paul, Minnesota, USA. 326 p. [ Links ]
Saldivar, R.H., Sanchez, M.D., Gamboa, R., Jasso, D., and Rodríguez, R. 2003. Fungitoxic effect of Larrea tridentata resin extracts from the chihuahuan and sonoran mexican deserts on Alternaria solani. Agroquimica 47:54-60. [ Links ]
Sánchez-Domínguez, D., Gaspar-Martínez, J., Uribe-Figueroa, M., Bautista-Baños, S. 2005. Efecto del quitosano en el desarrollo In vitro de Alternaria alternata. Memorias del XXXII Congreso Nacional de la Sociedad Mexicana de Fitopatología. Chihuahua, Chihuahua, México. Resumen L-23. [ Links ]
SAS Institute, Inc. 1996. SAS/STAT Software: Changes and enhancements through release 6.12. SAS Inst., Cary, NC. [ Links ]
Tellez, M., Estell, R., Fredrickson, E., Powell, J., Wedge, D., Schrader, K., and Kobaisy, M. 2001. Extracts of Flourensia cernua (L): volatile constituents and antifungal, antialgal, and antitermite bioactives. Journal of Chemical Ecology 27:2263-2285. [ Links ]
Tuset, J.J. 2000. Enfermedades durante la conservación. pp. 99-102. En: N. Duran-Vila y P. Moreno. Enfermedades de los Cítricos. Ed. Mundi-Prensa. Madrid, España. 165 p. [ Links ]
Whalen, M.M., Wilson, S., Gleghorn, C., and Loganathan, B. G. 2003. Brief exposure to triphenyltin produces irreversible inhibition of the cytotoxic function of human natural killer cells. Environmental Research 92:213-220. [ Links ]
Wilson, C.L., Ghaouth, A.E., Chalutz, E., Droby, S., Stevens, C., Lu, J.Y., Khan, V., and Arul, J. 1994. Potencial of induced resistance to control postharvest diseases of fruit and vegetables. Plant Disease 78:837-844. [ Links ]
Wilson, C.L., Ghaouth, A.E., and Wisniewski, M.E. 1999. Prospecting in nature's storehouse for biopesticides. Revista Mexicana de Fitopatología 17:49-53. [ Links ]




![Genetic diversity of ergot (Claviceps africana Frederickson, Mantle and de Milliano) from [Sorghum bicolor (L.) Moench.] in Mexico](/img/en/prev.gif)









