¿Qué tipo de ciencia es la química? Una posible respuesta a esta pregunta es: la química es una ciencia relacionada con las sustancias materiales y con las transformaciones químicas de las sustancias.
Los oficios de los alfareros, herreros, panaderos o curanderos, las primeras prácticas experimentales presentes en todas las culturas antiguas, son los antecedentes de lo que hoy conocemos como química. Hay que recordar que la palabra latina laborare -de donde procede nuestro término “laboratorio”- nos remite al trabajo manual, el cual era realizado, tanto en el imperio romano como en las ciudades griegas que lo precedieron, por los esclavos. Sin embargo, seguramente fue en Alejandría, hace poco más de dos mil años, donde, al entrar en contacto con otras culturas de tradición más artesanal y con aprecio por el trabajo manual, la especulación filosófica griega se concretó en una actividad práctica que desde entonces conocemos como alquimia. Los primeros laboratorios, con su respectiva dotación de instrumentos, fueron de alquimistas (Crosland 2005).
Un ejemplo importante de especulación de algunos filósofos griegos consistió en suponer que el mundo tiene un límite material, que identificaron con una entidad invisible a la que llamaron átomo, y que una multitud de esas entidades se desplazan, se agrupan, chocan y se reagrupan a través del vacío. El cambio que todos percibimos en el mundo material, resultado de este reagrupamiento, no es ni fue fácil de aceptar. Tuvieron que pasar miles de años para que esa idea alcanzara suficiente respaldo experimental y terminara por convertirse en las entidades con categoría ontológica que hoy conocemos como átomos y moléculas (Nye 1970; Chalmers 2009; Jensen 2010) y que consecuentemente se incorporara en los libros de texto y así se enseñara en todo el mundo (Chamizo y Garritz 2014).
Fue a finales del siglo XVIII y principios del XIX cuando, como resultado de la integración de diversas prácticas experimentales dedicadas al estudio de la transformación de las sustancias (la alquimia, la metalurgia y la farmacia)1 tal como se indica en el epígrafe, se estableció la química como una disciplina científica independiente. Es lo que Thomas Kuhn y otros investigadores identificaron como la revolución química2 (Kuhn 1971; McEvoy 2010). Hay que agregar que, además de asumirse como una ciencia, la química ya era desde sus inicios una industria en la que se transformaban muchas de las mismas sustancias en grandes cantidades.3
En el presente artículo identifico la química como un sistema de prácticas, diferente e independiente al de otras disciplinas. En esas prácticas examino el límite material de existencia de la sustancia química y empleo como ejemplo al carbono y, en particular, al experimento de difracción del C60. A partir de lo anterior intentaré precisar el concepto de sustancia química y su relevancia en la discusión filosófica actual.4
1. La química como un sistema de prácticas
Antes de que se desarrollara la química moderna, los alquimistas eran expertos en la observación de cambios cualitativos durante las reacciones químicas (cambios de color, claridad, volatilidad, etc.), pero hubo pocos avances en la teoría del cambio químico hasta que se reconoció que el uso cuantitativo de la balanza era decisivo.
No es sino hasta el periodo conocido en Europa como la Ilustración que se formula una definición operativa de sustancia. Ésta se debe al francés Antoine Lavoisier quien, con su propia definición, consideró 33 sustancias como elementos, es decir aquellas que no se podían “romper” en entidades más simples a través del análisis químico.5 Como explica en su famoso Tratado elemental de química de 1789:
Se extrañará seguramente no hallar en un tratado elemental de Chímica un capítulo sobre las partes constitutivas y elementales de los cuerpos; pero debo prevenir que la inclinación que tenemos a querer que todos los cuerpos de la naturaleza estén solo compuestos de tres o quatro elementos dimana de una preocupación que nos viene originalmente de los Filósofos griegos. La admisión de quatro elementos que con la variedad de sus proporciones compongan todos los cuerpos, es una mera hipótesis imaginada mucho tiempo antes que se tuvieran las primeras nociones de la Física experimental y de la Chímica [...] Todo lo que se puede decir sobre el número y la naturaleza de los elementos se limita -según pienso- a discusiones puramente metafísicas: son problemas indeterminados los que se trata de resolver, que son susceptibles de una infinidad de soluciones, pero que, muy probablemente, ninguna en particular está de acuerdo con la naturaleza. Me contentaré, por lo tanto, con decir que si [...] atribuimos el nombre de elementos o de principios de los cuerpos la idea del último término al que llega el análisis, todas las sustancias que no hemos podido descomponer todavía por ningún medio, son, para nosotros, elementos; no significa que podamos asegurar que estos cuerpos que consideramos como simples no sean ellos mismos compuestos de dos o incluso de un número más grande de principios, pero dado que estos principios no se separan jamás, o más bien, dado que no disponemos de ningún medio para separarlos, se comportan desde nuestro punto de vista como cuerpos simples, y no debemos suponerlos compuestos más que cuando la experiencia o la observación nos haya ofrecido la prueba. (Lavoisier 1990, pp. vi-viii)
Lavoisier, mediante instrumentos6 y experimentos claramente definidos, rompe con la antigua idea teórica de la constitución última del mundo, la de los principios fundamentales. Más aún, introduce una nomenclatura nueva en la que el nombre de una sustancia indica su composición elemental. En lo que después podría identificarse como “realismo pragmático”, Lavoisier hereda y contribuye a transformar una comunidad de prácticas,7 con lo que se gestó el nacimiento de la química moderna entre cuyos destacados integrantes se encontraban además Joseph Black, Alessandro Volta y John Dalton. Con la primera revolución química -una revolución de emplazamiento en lugar de las revoluciones kuhnianas de reemplazamiento-,8 esta disciplina se identificó a sí misma como cuantitativa, con instrumentos y procedimientos experimentales estables, y en particular los relacionados con el análisis químico y una entidad característica: el átomo químico (Izquierdo 2010).
Aquí hay que reconocer que las comunidades científicas son comunidades de prácticas, en las que por “práctica” se entiende la serie de actividades coordinadas y compartidas (procedimientos, propósitos, creencias) que se disciplinan mediante el cambio de normas o procedimientos “correctos” en el interior de una determinada comunidad, que es la que identifica y corrige los “errores” (Pickering 1995; Martínez y Huang 2015). Así, una práctica tiene una estructura estable con una capacidad de reproducirse a través de diferentes procesos de aprendizaje. Las comunidades de prácticas químicas son experimentales, crecieron con la incorporación de nuevos instrumentos que dieron lugar a nuevas subdisciplinas que, a su vez, fueron “descubriendo” e incorporando nuevas entidades. Las prácticas químicas toman en consideración un saber tácito (Polanyi 1966) que no puede expresarse en palabras, que es propio de diferentes actividades de investigación y que poco a poco se ha reconocido como fundamental en la filosofía de las ciencias. Una práctica específica da por sentado el conocimiento de otras prácticas diferentes y, más en general, una serie de presupuestos culturales que permiten distinguir una práctica de otra (Olivé 2008). Las prácticas químicas son también prácticas tecnológicas (Gutting 1984).
Entre 1754 y 1818 empieza la química tal y como hoy la conocemos en lo que se ha denominado la primera revolución química (Chamizo 2014). Y fue a partir de la introducción de nuevos instrumentos y del uso de nuevas técnicas experimentales, en particular de las derivadas de la incorporación de la electricidad en los laboratorios, que el número de elementos creció de manera importante. Todos los elementos son sustancias, pero no todas las sustancias son elementos; algunas están compuestas por diferentes elementos. Por ejemplo, el agua es una sustancia formada por los elementos hidrógeno y oxígeno en cantidades definidas. El agua oxigenada es otra sustancia, formada también por los elementos hidrógeno y oxígeno en cantidades definidas pero diferentes a las del agua. Quedaba claro que no sólo la composición caracterizaba a una sustancia, sino que también la proporción en la que cada elemento la constituía (Chang 2012). Todo ello se podía medir y experimentar en los laboratorios a través de prácticas químicas definidas y estabilizadas. A partir de esa época, y sobre todo a partir de la propuesta del inglés John Dalton, se fue aceptando la idea9 de que los elementos estaban compuestos por átomos iguales, que los átomos conformaban las moléculas y que, al ser ambos muy pequeños, conglomerados enormes de las mismas partículas integraban los elementos que entonces se conocían.
La tabla periódica de los elementos fue propuesta hace 150 años por el ruso Dmitri Mendeléyev para explicar la reactividad química de los elementos conocidos en la época, es decir, en la segunda mitad del siglo XIX durante la segunda revolución química. Esta revolución marcó el inicio de la química orgánica, aquella que se refiere a las sustancias formadas principalmente por carbono, hidrógeno, oxígeno y nitrógeno,10 a la consolidación del análisis químico a través de reacciones específicas y al surgimiento de la síntesis química y de la industria química como tecnociencia.11 Mendeléyev12 estableció una distinción precisa entre sustancia simple y sustancia básica o elemental. Esta última tenía un atributo que la caracterizaba siempre: el peso atómico. Así, en su tabla periódica el elemento carbón, que encabezaba la cuarta familia de elementos, era una sustancia básica, mientras que el grafito de los lápices, el diamante de las joyas o el carbón de las fogatas eran sustancias simples. Mendeléyev utilizó el concepto abstracto de elemento o sustancia básica para que desempeñara un importante papel teórico. Debido a que la química se ocupa de la explicación del cambio químico, es decir, el cambio de una sustancia a otra, los elementos “abstractos” sobreviven al cambio químico,13 lo que significa que persisten y pueden explicar las propiedades de sus compuestos. Lo anterior nos remite a la diferencia que Aristóteles estableció entre las entidades singulares que se pueden ver y apuntar con un dedo (ek-keimenon) y el sustrato universal (hupokeimenon).
Años después, con el desarrollo de nuevos instrumentos durante la tercera revolución química, se descubrieron el electrón, el núcleo atómico y los isótopos. Así, además de los átomos y las moléculas, todas estas nuevas entidades, junto con los iones, pasaron a formar parte de las prácticas químicas a pesar del escepticismo sobre su existencia que manifestaron físicos y químicos importantes de los siglos XIX y XX. Por ejemplo, el químico alemán August Kekulé, anfitrión del primer congreso internacional de química14 y de cualquier otra ciencia (el Congreso de Karlsruhe), indicó:
La pregunta sobre si existen los átomos tiene poca importancia desde el punto de vista químico: su respuesta pertenece a la metafísica [...] No tengo ninguna duda en decir que, desde el punto de vista filosófico, yo no creo en la existencia real de los átomos -tomando esta palabra en su sentido literal- como una partícula indivisible de materia. Espero que algún día encontremos para lo que llamamos átomos una representación físico-matemática que nos pueda explicar el peso atómico, la valencia y otras de las numerosas propiedades de los llamados átomos. Sin embargo, como químico, considero que la suposición de la existencia de átomos no sólo es aconsejable, sino absolutamente necesaria en química. (Kekulé 1867)15
No fue hasta la primera mitad del siglo XX que el físico-químico francés Jean Perrin demostró la realidad de los átomos y de las moléculas (Nye 1970; Chalmers 2009) dado que sólo a través de su existencia16 se pueden explicar los resultados de diversos experimentos. Desde entonces es el número atómico (Wray 2018), es decir, el número de protones en el núcleo atómico, la propiedad que identifica a un elemento, que en el caso del carbono es seis.
Aquí hay que hacer una distinción importante. Cuando dos sustancias simples diferentes contienen el mismo elemento reciben el nombre de alótropos17 (Figura 1). La composición última de las sustancias simples en el nivel atómico, es decir, en el nivel elemental, no es suficiente para su caracterización. Se requiere saber además su estructura, la cual se manifiesta en las diversas sustancias simples por sus propiedades físicas diferentes.18 A los clásicos alótropos conocidos del carbono -el carbón, el grafito y el diamante-, se le sumó en 1985 el futboleno C60, sustancia simple constituida por la primera molécula esférica conocida y que originalmente recibió ese nombre por su semejanza con el balón de futbol formado por pentágonos y hexágonos y que contiene sesenta vértices, los sesenta átomos de carbono de dicha molécula. Pocos años después, el premio Nobel de Química les fue otorgado a los químicos Robert F. Curl, Harold W. Kroto y Richard E. Smalley por su descubrimiento de los fulerenos, y en particular del C60.
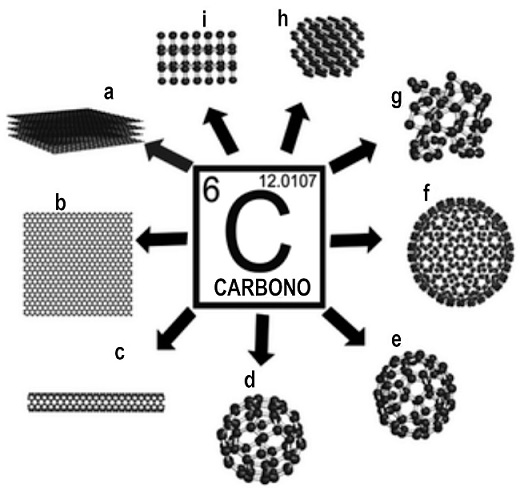
FIGURA 1 Representación de diferentes alótropos, es decir, de diferentes sustancias simples del carbono. (a) Grafito, (b) grafeno, (c) nanotubos de carbono, (d) C60, (e) C70, (f) C540, (g) carbón amorfo, (h) lonsdaleita e (i) diamante (Chamizo 2019a, p. 104).
Tras aceptar la permanencia temporal de la sustancia, es decir, su permanencia durante un tiempo “razonable” de acuerdo con las prácticas químicas disponibles hasta la primera mitad del siglo XIX, la comunidad de químicos profesionales, asociados en la International Union of Pure and Applied Chemistry (IUPAC), definió la sustancia química como “Materia de composición constante mejor caracterizada por las entidades (moléculas, átomos) de las que está compuesta. Se identifica por sus propiedades físicas tales como la densidad, el índice de refracción, la conductividad eléctrica, el punto de fusión, etc.” (IUPAC 2006).19 Sin embargo, con la incorporación de instrumentos nuevos en las prácticas químicas durante la cuarta revolución química (Chamizo 2019b), el enfoque espacio-temporal a las sustancias permitió reconocer la complejidad que ese nombre abarcaba por sí solo. Pudieron medirse reacciones cada vez más rápidas20 y poco a poco se abandonó el concepto limitado de sustancia química por el más amplio de especie química.21 Al pasar de las sustancias a las especies químicas, el campo de estudio de la química creció y se complicó de manera considerable. Los mecanismos de reacción que tanto éxito tenían en la química orgánica y que se desarrollaron a partir de la segunda revolución química (mecanismos que descomponían una reacción en una serie de rápidas reacciones sucesivas considerando la existencia de varios intermediarios), pudieron estudiarse. Muchos de esos intermediarios, como los radicales, no eran otra cosa que especies químicas. Ante esta situación, el filósofo de la química belga Jaap van Brakel, al reconocer la fragilidad de la definición de sustancia por ignorar su dimensión temporal, agregó: “quizás debemos limitar la noción de sustancia a lo que puede existir independientemente en botellas” (van Brakel 2012, p. 222).22
2. El límite material de la sustancia química
El descubrimiento del buckminsterfullereno (C60) ya se ubica como uno de los momentos más importantes en la historia de la química. A medida que se le encuentren más usos prácticos su fama sólo puede aumentar. La belleza de la molécula ha hecho mucho para revitalizar la enseñanza de la química en las escuelas. Asimismo, ha elevado la moral de los profesionales de la química con un éxito llamativo e inspirador después de años pasados a la sombra de biólogos moleculares y cosmólogos.
En las últimas décadas el filósofo canadiense Ian Hacking ha sido uno de los defensores más importantes de la variedad de papeles que desempeñan los experimentos en la producción de conocimiento (Hacking 1983). Hacia finales del siglo pasado y en coincidencia con otros filósofos,23 reconoció que gran parte de nuestro conocimiento empírico resulta de intervenciones con instrumentos, ya que sólo cuando intervenimos podemos descubrir las resistencias materiales del mundo: “la experimentación tiene vida propia e interactúa con la especulación, los cálculos, la construcción de modelos, la invención y la tecnología de numerosas maneras” (Hacking 1983, p. xiii). Para él, los fundamentos epistémicos para creer en una entidad invisible como los electrones no provienen de la teoría subyacente, sino de la capacidad de manipularla: “si puedes rociarlos, entonces son reales” (Hacking 1983, pp. 22-24), lo que lo llevó a proponer una distinción entre el realismo de las teorías y el realismo de las entidades, y que puede aplicarse muy bien en la química. Como indica la filósofa de la química francesa Bernadette Bensaude-Vincent: “los químicos son realistas. Creen en la realidad de sus entidades, lo que les permite operar en el mundo exterior o verse afectados por él” (Bensaude-Vincent 2008, p. 52). Esta conexión entre palabras y cosas, conceptos e instrumentos, permite reconocer de manera más clara las actividades que realiza una comunidad científica específica en un momento histórico particular.
En particular respecto a las entidades, Arabatzis 2008 escoge el término “entidades ocultas” para eliminar las dificultades que presentan otras taxonomías, como las “entidades teóricas”, “entidades inobservables” o “entidades hipotéticas” y decide considerar un criterio más epistemológico para establecer su estatus ontológico, es decir, su existencia. Así, la primera característica de una “entidad oculta” es que pueda manipularse experimentalmente, como también defienden Hacking 1983 o Cartwright 1983 en el denominado “realismo de las entidades”. No obstante, la manipulación experimental en la línea de pensamiento de Arabatzis no es por sí sola condición suficiente ni necesaria para demostrar su existencia. Una segunda característica atribuible a las “entidades ocultas” es que sean, además de un cuerpo de conocimiento puntual, objeto de un conjunto de prácticas desarrollado históricamente. Eludiendo el problema del realismo, Arabatzis sostiene que se le puede dar sentido a esas entidades y a su papel en la práctica científica sin suponer necesariamente su existencia. Lo anterior tiene que ver con su estabilidad social en el desarrollo histórico de una determinada práctica, ya que se las puede asociar con una constelación de efectos capaces de ser explicados por esa única “entidad oculta”. Además, la determinación repetida de las propiedades de una “entidad oculta” en diferentes entornos experimentales es una razón importante a favor de su existencia, de su reconocimiento ontológico, como fue el caso en la química de los átomos, las moléculas, los electrones, los isótopos, los radicales libres, el espín o las nanopartículas; todas ellas “entidades ocultas” que caracterizan a las diferentes revoluciones químicas (Chamizo 2014; Chamizo 2017; Chamizo 2019b).
Las comunidades químicas aceptan y defienden la realidad de sus entidades a pesar de que, cuando se comparan con las comunidades físicas, no siempre coinciden con ellas. Ambas comunidades tienen prácticas y ambiciones diferentes. A diferencia del ideal del universalismo y la búsqueda de una verdad única (que defienden los físicos), la metodología de la química proporciona un tipo de conocimiento tácito y pragmático que comparten la mayoría de las ciencias de laboratorio experimentales.24 Una práctica no es mejor que otra. Si, por ejemplo, la mecánica cuántica se reconociera equivocada, los químicos seguirían sintetizando nuevas sustancias, como ya lo hacían antes del surgimiento de esa disciplina. Por ello, con base en el pluralismo ontológico25 y el reconocimiento de que no hay una práctica sin un contexto social de transmisión (principalmente educativo) a través del cual dicha práctica se reproduce y recrea a sí misma, retomo y comparto la conclusión de Arabatzis 2008:
[N]uestra comprensión de las entidades ocultas y su papel en la práctica experimental puede mejorarse mediante la adopción de un enfoque histórico-filosófico integrado. Por un lado, la reflexión filosófica sobre el problema del realismo de las entidades tiene mucho que ganar al examinar históricamente cómo se introdujeron e investigaron esas entidades. Por otro lado, el análisis histórico del desarrollo de las entidades como objetos experimentales, puede beneficiarse de los debates filosóficos sobre su existencia. (p. 10)
Tras reconocer la diversidad de prácticas a lo largo de la historia, el filósofo de la química alemán Joachim Schummer 1998 sostiene que una propiedad material es un comportamiento reproducible en determinadas condiciones, es decir, en un contexto particular. Así, el contexto es el aspecto central con el cual se pueden caracterizar las propiedades materiales. Entre todas las propiedades materiales hay una propiedad particular que se refiere a la reacción química: la capacidad de una sustancia para reaccionar con otra. Como se mencionó en la nota al pie número 10, esta propiedad material es la que diferencia a las prácticas químicas de las de otras disciplinas como la física o la biología.
Así, la química se ocupa de las relaciones entre las sustancias a medida que experimentan un cambio radical. Por lo tanto, las propiedades químicas son relacionales, caracterizan las relaciones entre unas sustancias específicas y otras sustancias con las que interactúan y se transforman. Por otro lado, las relaciones químicas son notoriamente selectivas.
Por ejemplo, si colocamos juntas tres sustancias diferentes, carbón, azufre y salitre, obtenemos una mezcla conocida hace siglos como pólvora, que tiene la propiedad de que, al calentarse, da lugar a otras cuatro sustancias diferentes de las originales... ¡explotando!26 La intensidad de la explosión variará según la relación que guarden entre sí las cantidades originales de las sustancias involucradas. Más aún, si cambiamos una de esas tres sustancias por otra, digamos el salitre por sal, o agregamos una sustancia más, por ejemplo agua, no hay reacción, no hay explosión. Es a través de las reacciones químicas que se genera una multitud de nuevas sustancias. Ésa es una práctica química.
Del siglo XIX es la hermosa frase escrita por el químico francés Marcellin Berthelot: “la química crea su propio objeto”. Ésta recoge a la perfección el espíritu creativo de la síntesis química resultado de reacciones químicas. Los químicos de hoy, aproximadamente un poco más de tres millones de personas en todo el mundo, hacemos nuevas sustancias. El número de sustancias y de aplicaciones comerciales de las mismas ha crecido de manera impresionante a lo largo de los últimos 200 años. Se ha pasado de unas centenas en 1800 a más de 156 millones de sustancias diferentes en la actualidad, la mayoría de las cuales se comercializan, se usan y después muchas de ellas se desechan.27 A este número de sustancias se añaden más de 15,000 nuevas cada día, es decir una cada seis segundos.28 La síntesis de sustancias nuevas hace que la química sea, de entre todas las ciencias, la más productiva. Como indicó Schummer 2006, en el año 2000 el Chemical Abstracts, la base de datos que informa sobre la mayoría de publicaciones de esta disciplina, reportaba prácticamente el mismo número de publicaciones que todas las demás ciencias juntas.
Aquí hay que preguntarse si la química se reduce a la física, un asunto que se ha discutido ampliamente en los estudios especializados (Hendry 1999; Van Brakel 2000; Scerri 2007; Kim 2014) y que resume muy bien van Brakel 2014 (p. 13):
El interés de los filósofos de la ciencia anterior a 1960 se centró casi exclusivamente en la ciencia teórica. Con un énfasis ligeramente diferente, la física y la química se agruparon como ciencias naturales exactas con un enfoque en el estudio de su estructura lógica. Esto significaba que el interés estaba en las leyes formuladas como ecuaciones matemáticas que establecían relaciones entre cantidades y teorías que eran axiomáticas, al menos en principio. La filosofía de la ciencia dominante simplemente consideraba la química como una parte sin importancia de la física; la impresión general era que, con la interpretación de la mecánica cuántica del enlace químico, la química se había reducido a la física. Si hubiera existido alguna filosofía de la química en la era precuántica, con el advenimiento de la mecánica cuántica se habría vuelto irrelevante de inmediato.
Así, contra la idea generalizada y superada de que la química es sólo una “ciencia natural”29 que descubre una porción del mundo natural -“un mundo dado”-, el hecho de que con las reacciones químicas la cantidad de “objetos” o sustancias que pueblan el mundo crezca en forma extraordinaria convierte a la química en una disciplina más cercana al arte y a la ingeniería que a la física. A través de sus prácticas más generalizadas, la mayoría de las comunidades químicas no descubren, sino que diseñan, hacen o fabrican (Chamizo 2013b). Algunas de ellas, como las de los ingenieros químicos, lo hacen en grandísimas cantidades.30 El conocimiento de las propiedades químicas de una sustancia, que muchas veces genera nuevas sustancias, es prácticamente inacabable. Por ello, además de preguntarse sobre la naturaleza intrínseca de la sustancia química, que es una preocupación más de los físicos, hay que reconocer qué cantidad de esa sustancia presenta las propiedades materiales que caracterizan las prácticas químicas.
Esa pregunta nos lleva al mol. En el Sistema Internacional de Unidades el mol es la unidad de cantidad de sustancia química que permite relacionar el mundo macroscópico al que accedemos a través de nuestros sentidos con el microscópico que legitimamos mediante experimentos (Hacking 1983) o de cadenas de referencia (Latour 2001). El mol se refiere a la medición macroscópica de una sustancia que corresponde, en el nivel atómico, al número de entidades que esa sustancia contiene (Nelson 2013) y es equivalente al conocido como número de Avogadro, es decir 6,02×1023 entidades. Hay que hacer notar que un mol de cualquier sustancia tiene propiedades diferentes de las entidades que la componen. Un mol de agua (18g de agua) moja, diez moles de agua quitan la sed, mientras que una molécula de agua ni moja ni quita la sed. Una molécula de agua jamás será liquida ni tampoco hielo. El agua líquida y el hielo sólido requieren, para serlo, una enorme cantidad de moléculas de H2O.
Es durante la quinta revolución química, en particular en el año 1985, cuando se aisló y caracterizó el C60. Sin embargo, no fue hasta cinco años después cuando se pudo producir en cantidades suficientemente grandes para ser sujeto a las prácticas químicas, es decir, para hacerlo reaccionar.31 A partir de milésimas de moles de esta sustancia simple, esférica, sólida, negra y cristalina se construyeron y aún se construyen multitud de sustancias nuevas (Figura 2), algunas de las cuales constituyen el nuevo campo de la nanoquímica (Montellano López et al. 2011; Laurent 2015). También en ese periodo se difractaron, una tras otra, moléculas individuales de C60.
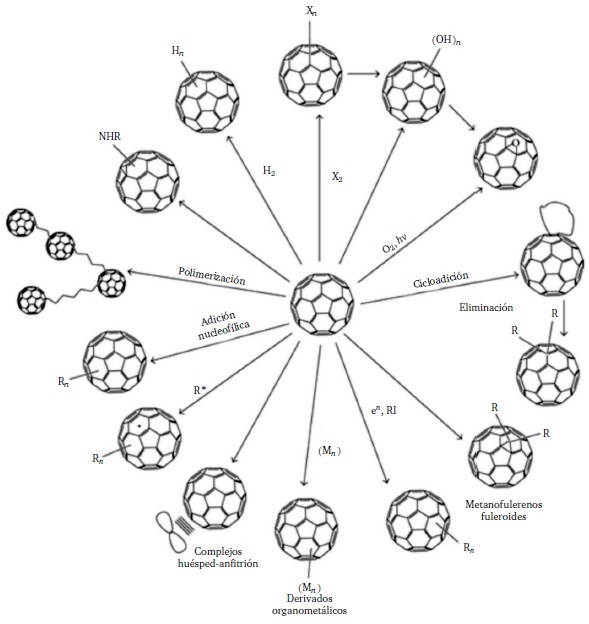
FIGURA 2 Esquema de las diferentes reacciones de la sustancia C60, es decir, de moles de C60, no de la molécula individual C60 (Djordjevic et al. 2015).
Casi un siglo después de su incorporación a la química, la palabra “átomo”, asociada con una entidad física indivisible, continuó usándose en la comunidad científica a pesar de que su nombre no remitía a lo que indicaba. En 1897, el inglés J.J. Thomson descubrió el electrón, y lo identificó como una partícula constituyente de los átomos (Achinstein 2001). No deja de ser una ironía de la historia de las ciencias que treinta años después el hijo de Joseph John Thomson, George Paget Thomson, junto con Clinton Joseph Davisson, demostró experimentalmente que el electrón no sólo se comportaba como una partícula, sino también como una onda y que, por lo tanto, podía difractarse.32 Queda claro que podemos meter átomos en botellas, aglomerados por ejemplo en forma de diamantes o de grafito. Es decir, diamantes y grafito son sustancias, mientras que los electrones o los núcleos que los conforman no. De acuerdo con van Brakel, la sustancia química es macroscópica. No hay botellas que contengan de manera independiente núcleos ni tampoco electrones.33
Como indiqué antes, a principios del siglo pasado los electrones, integrantes de los átomos que a su vez constituyen la sustancia, fueron las primeras partículas materiales que se difractaron. Los electrones presentan un comportamiento material u ondulatorio cuando son sujetos del experimento adecuado. Este resultado sorprendente de la ciencia moderna planteaba un problema de la mayor envergadura. La realidad material de los electrones podía ser comprometida a voluntad del experimentador. El filósofo de la química francés Gaston Bachelard lo explica de la siguiente forma:
Porque sería demasiado cómodo confiarse todavía a un realismo totalitario y unitario y respondernos: todo es real, el electrón, el núcleo, el átomo, la molécula, la micela, el mineral, el planeta, el astro, la nebulosa. Desde nuestro punto de vista, no todo ello es real de la misma manera y la sustancia no tiene idéntica coherencia en todos los niveles; la existencia no es una función monótona; no puede afirmarse donde quiera y siempre con el mismo tono. (Bachelard 2001, p. 47)
Uno de estos experimentos se conoce como el de la “rendija doble”. Realizado a principios del siglo pasado, en él se hace pasar un haz de electrones a través de una pantalla que tiene un par de rendijas. Inicialmente se tapa una de las dos rendijas y los electrones pueden pasar sólo a través de una de ellas. La manera clásica en la que se concebía el movimiento permitía suponer que los electrones viajan en línea recta. Así, cuando se coloca detrás de la pantalla una placa fotográfica se puede detectar el paso de los electrones por la rendija. Cuando se lanza el haz de electrones abriendo las dos rendijas se espera que unos electrones pasen por una de las rendijas y otros por la otra, con lo que se obtienen dos distribuciones de probabilidad separadas entre sí de igual modo que las rendijas. Sin embargo, el resultado del experimento fue el mismo que se obtiene cuando, en lugar de electrones, se lanza un haz de luz, que sabemos que tiene propiedades ondulatorias y que es un tipo de energía. Quedó claro que el resultado no puede explicarse si se considera que los electrones son corpúsculos clásicos, y puso en evidencia también sus propiedades ondulatorias. Uno de los fundadores de la mecánica cuántica, el alemán Werner Heisenberg, sostuvo, en la interpretación de la llamada “Escuela de Copenhague” de los fenómenos cuánticos, que la observación desempeña un papel decisivo en el suceso y que la realidad varía, según si es observada o no. Esta interpretación de los fenómenos cuánticos es la más aceptada, pero no es la única que hay.
Como los electrones son muy pequeños y su masa es prácticamente despreciable,34 al estupor inicial de la comunidad científica, y en particular el de los físicos, siguió la tranquilidad de que ese comportamiento “extraño” sólo se manifestaba cuando las entidades involucradas eran minúsculas. Entender esas “entidades ocultas” es un asunto de negociación y consenso en el seno de una determinada práctica científica, como también afirma el escocés Andrew Pickering. Es un asunto “dialéctico, en tiempo real, de acomodación y resistencia” (Pickering 1995). Por su parte, este asunto de los físicos no modificó en lo mínimo las prácticas químicas más interesadas en la producción industrial de baquelita o de amoniaco y en el control de la composición de las drogas que se consumían alegremente en todo el mundo.35
Pocos años después de este experimento con electrones, se pudo repetir con protones, la partícula que conforma el núcleo atómico de los elementos que constituyen las sustancias y que tiene una masa dos mil veces mayor a la del electrón. Los resultados fueron semejantes: ante una “rendija doble” los protones muestran propiedades ondulatorias. Al poco tiempo se desarrolló la capacidad experimental de lanzar átomos y, de manera semejante a los electrones y protones, se descubrió que los átomos se difractan ante una “rendija doble”.
A finales de 1999, en una carta a la más prestigiosa revista de ciencias, la inglesa Nature, científicos austríacos (Arndt et al. 1999) anunciaron que el C60, la bella molécula esférica, uno de los alótropos del carbono (Figura 1) que se puede comprar desde cualquier lugar del mundo a las diferentes compañías que la comercializan en botellas, sustancia simple y negra, más cara que el oro y materia prima de múltiples reacciones químicas, cuando se lanza, una molécula tras otra contra una rendija doble, ¡se difracta! Pero está muy claro que, cuando sale del instrumento que lo lanza contra la “rendija doble”, es una molécula esférica y que, cuando llega al detector, también lo es (Figura 3). En el trayecto, esa molécula esférica con sesenta átomos de carbono, deja de ser material y después se reintegra como tal. En cuanto molécula individual, en este experimento se alcanza el límite material de existencia de la sustancia química.
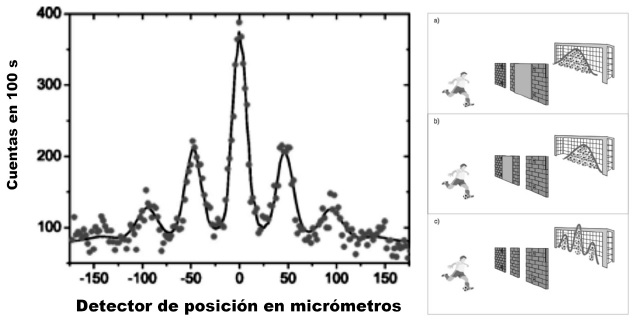
FIGURA 3 Resultado del experimento de la doble rendija y analogía entre las pelotas de futbol y las moléculas de C60 en el experimento (Arndt et al., 2002).
Ya se han hecho experimentos semejantes con moléculas de más de 2000 átomos sintetizadas por químicos a petición de los físicos a cargo de esos proyectos (Fein et al. 2019). Pronto se espera difractar virus, la sustancia viva36 conocida más pequeña. Es muy importante hacer notar que, para los químicos, lo importante es cómo sintetizar sustancias con determinadas propiedades, consolidar sus prácticas profesionales y no si esas sustancias, en un momento determinado en un contexto experimental específico alejado de dichas prácticas, dejan de serlo.37 Desde sus prácticas materiales obstinadas, estabilizadas y exitosas (Kim 2014), la inmaterialidad de la molécula individual parece ser un límite, pero no lo es. Las sustancias químicas, en su condición macroscópica, observable, con una existencia independiente “en botellas”, tienen propiedades relacionales que se sujetan a un contexto... el de su posible reacción.38
3. A manera de conclusión
La palabra “sustancia” no designa aquello que “subyace”, impenetrable por la historia, sino lo que reúne una multiplicidad de agentes y hace de ellos un todo coherente y estable. Una sustancia se parece más al hilo que enlaza las perlas de un collar que a la roca viva que permanece inalterable sin importar lo que se edifique encima [...] sustancia es un nombre que designa la estabilidad de un conjunto.
Como se ha presentado, la química es una disciplina desarrollada hace poco más de doscientos años que aglutina una diversidad de prácticas experimentales, es decir, una serie de actividades coordinadas y compartidas (reglas, técnicas, propósitos, creencias) que se disciplinan39 y a través de las cuales se construyen y transforman las sustancias. Todo ello se cultiva mediante el empleo de normas o procedimientos “correctos” que tienen una estructura estable y una capacidad de reproducirse a través de diferentes procesos de aprendizaje, muchos de ellos tácitos.
En las prácticas de la química, el laboratorio, académico o industrial, es el lugar central, el sitio donde se lleva a cabo el experimento químico (Chamizo 2013a). Los experimentos químicos involucran sustancias químicas, es decir, una cantidad enorme de entidades microscópicas, moléculas o iones que en las reacciones químicas se miden en moles. Hay una ontología para las primeras y otra para las segundas. Al participar de una práctica se sabe qué hacer y qué decir, aunque una parte del conocimiento de la misma sea tácito. Hace veinte años que los físicos lograron difractar moléculas que en cantidades molares constituyen sustancias químicas, es decir, que existen independientemente en botellas. Este experimento no modificó las prácticas químicas salvo para sintetizar nuevas sustancias con propiedades específicas y que en cantidades moleculares puedan ser difractadas.
Ya Bensaude-Vincent et al. 2011 reconoció que, en lugar de ser taxonómica, la diferencia entre la ciencia y la tecnociencia apela a diferentes propósitos de investigación y que son éstos los que configuran prácticas distintas. Lo anterior apunta a considerar a la química fundamentalmente como una tecnociencia.40 Como tales, las prácticas químicas no buscan descubrir una única esencia ontológica de las sustancias químicas, sino más bien reconocer que en sus trayectorias diferentes y entrelazadas, con sus límites particulares, las sustancias químicas no son un fin, sino un principio. Lo que, en términos más generales, lleva a la autora mencionada a sostener que:
Esta propuesta es una invitación a los filósofos de la ciencia a tomar en serio la noción de “tecnociencia” para abordar una serie de preguntas que se han descuidado hasta ahora, incluso en el contexto de la filosofía del experimento, del modelaje o de las prácticas científicas. Sugerimos que la perspectiva de la “tecnociencia” puede estimular el debate no sólo sobre la ontología de los objetos de investigación, sino también sobre el papel de la teoría en diferentes contextos de investigación, sobre diferentes estilos de razonamiento científico, sobre diferentes interpretaciones de la tecnología, sobre el modelaje y la explicación o sobre el papel de las leyes de conservación en las prácticas de investigación [...] En el caso de la ciencia, la ontología de los objetos depende de la ontología de los hechos. (Bensaude-Vincent et al. 2011, pp. 370-372)41











 nueva página del texto (beta)
nueva página del texto (beta)


