Introducción
Los bosques, selvas y otras asociaciones vegetales han presentado un proceso de degradación ambiental, atribuido a la deforestación y a la fragmentación, por la ampliación de la frontera agrícola-pecuaria (Raman et al., 1998; Hansen et al., 2013). En México se pierden y/o degradan hasta 200,000 ha de selvas y bosques anualmente (Hansen et al., 2013), sobrepasando en cinco veces el promedio mundial anual (0.5 %; FAO, 2011). Un ejemplo de lo anterior es la Selva Lacandona, ubicada en el estado de Chiapas, México. Esta selva alta perennifolia presenta severas transformaciones antropogénicas y un alto grado de fragmentación a nivel paisajístico (Fernández-Montes de Oca et al., 2015). A comienzos de los años 80 se removió casi el 50 % (584 mil ha) de la cobertura selvática Lacandona (Challenger & Caballero, 1998) y en los años subsiguientes se deforestaron otras 142 mil ha (11 %; Stegen et al., 2009). Actualmente, se pretende revertir esta situación con diversos programas sociales (González & Pérez, 2015). Sin embargo, los cambios drásticos de la vegetación originados por la deforestación y la fragmentación modifican las comunidades faunísticas presentes, especialmente las aves (Warkentin et al., 1995).
Desde hace algunas décadas, se ha discutido cómo varía la diversidad de la avifauna a través de los cambios estructurales y composicionales de la vegetación tropical y sus consecuencias (Raman & Sukumar, 2002). Los resultados de estas investigaciones sugieren que, si se alteran las asociaciones vegetales consecuentemente se modificará la disponibilidad de recursos utilizados por las aves, particularmente los alimenticios (Holmes & Recher, 1986), y se incrementarán los mecanismos de parasitismo, depredación y competencia (MacGarigal & McComb, 1995). Lo anterior repercute directamente en la estructura, composición, número de interacciones y funcionalidad de las comunidades aviares en los ecosistemas (Brotons et al., 2004).
Una manera de evaluar los posibles efectos de las actividades antropogénicas en los ecosistemas es a través del análisis de los gremios tróficos (Pearman, 2002; Gray et al., 2007). El concepto de “gremio” es definido como: “un grupo de especies que explotan la misma clase de recursos ambientales en una forma similar” (Root, 1967). Los recursos ambientales a los que hizo referencia Root son: alimento, refugio, sitios para anidar, entre otros (Kornan & Kropil, 2014). Por lo tanto, los gremios tróficos (GT) están integrados por un grupo de especies que comparten o explotan un recurso alimenticio en común y lo obtienen de una manera similar (Holmes, 1990; Karr et al., 1990; MacNally, 1994).
Los GT se emplean frecuentemente para analizar la respuesta de la avifauna ante una perturbación ambiental relacionada con actividades humanas (Gray et al., 2007; Pineda-Diez et al., 2012). Utilizar los GT en estudios ecológicos conlleva ciertas ventajas como: 1) no es necesario que se compartan especies entre los sitios seleccionados (Terborgh & Robinson, 1986), 2) las distancias taxonómicas de las especies en los GT son poco relevantes (Recher & Davis, 1998), 3) son considerados dinámicos, la presencia de los GT fluctuará a medida que fluctúe la disponibilidad del recurso alimentario dominante (Bailey et al., 2004) y, 4) con base en los GT se pueden establecer estrategias de conservación para un conjunto de especies con mayor probabilidad de sufrir extinciones (Olivier & van Aarde, 2016).
Por su parte, la disponibilidad del alimento depende de la escala espacio-temporal (Wiens & Rotenberry, 1981). Espacialmente, la complejidad estructural (representada por el número de asociaciones vegetales) se ve reflejada en la cantidad y disponibilidad de recursos. Temporalmente, las estaciones del año determinan la cantidad de recursos, debido a la fenología de las plantas y los ciclos de vida de los artrópodos (Poulin et al., 1992).
Pese a su relevancia en el campo de la ecología de comunidades y la ecología funcional, las investigaciones en torno a los gremios tróficos aviares han tenido mayor énfasis en años recientes (Dale et al., 2000; Watson et al., 2004; Hodgson et al., 2007). Asimismo, la controversia en torno a este concepto también ha ido en aumento (González-Salazar et al., 2014). En algunas investigaciones se agrupan a las especies bajo un único criterio: la fuente principal de energía (e. g. frugívoros), dejando de lado la manera en cómo obtienen el recurso (e. g. recolector sobre el suelo o en el dosel). O bien, son agrupados con base en la literatura disponible y no en las observaciones directas en campo (Blondel, 2003; González-Salazar et al., 2014). Para reducir la subjetividad al analizar los GT se debe optar por estudios a posteriori, donde la categorización de las especies se realiza con base en las observaciones del campo y no necesariamente, en la literatura (a priori; Jaksic, 1981). Los objetivos del presente estudio fueron: 1) analizar las variaciones en la riqueza, abundancia y composición de las comunidades avifaunísticas, en tres diferentes condiciones de cobertura vegetal, en una región de la Selva Lacandona, Chiapas, México y 2) caracterizar la vegetación y las variables ambientales que determinan la presencia de gremios tróficos aviares en las tres condiciones ambientales seleccionadas. Se hipotetizó que el número de especies y de GT serán más representativos en los ecotonos selváticos (ECO), debido a que en estos sitios coexisten comunidades de aves selváticas con cierta tolerancia a los cambios en el entorno y comunidades de aves típicas de zonas abiertas. Además, la heterogeneidad paisajística repercute en la disponibilidad de alimento que explotan las aves (Sekercioglu et al., 2002). También se hipotetizó que, los frugívoros que se alimentan en el suelo o en la parte inferior de los árboles, los insectívoros que se alimentan sobre la corteza, en el dosel inferior, medio y alto, y los nectarívoros estarán restringidos al interior del bosque y disminuirá su presencia conforme se simplifique el número de estratos de la vegetación (Arriaga-Weiss et al., 2008; Leyequién et al., 2014). Por el contrario, los granívoros, omnívoros, carroñeros, frugívoros de tamaño corporal pequeño, e insectívoros cribadores, serán dominantes en las zonas estructuralmente simplificadas (Barlow et al., 2002, Donoso et al., 2004; Pineda-Diez et al., 2012).
Materiales y métodos
Área de estudio. El estudio se realizó en el ejido “Reforma Agraria” (16° 15’ 18” N y 90° 51’ 33.7” O), municipio de Marqués de Comillas, Chiapas (Fig. 1). El ejido “Reforma Agraria” se ubica dentro de la Selva Lacandona, pero está fuera del polígono de la Reserva de la Biosfera de Montes Azules (REBIMA; Márquez, 2002). El clima predominante de la región es cálido y húmedo, con abundantes lluvias en primavera-verano (Am(f); ~87 %) y en menor medida, cálido subhúmedo con lluvias en verano (Aw0; ~13 %). La precipitación pluvial oscila entre los 1,500 y 3,500 mm por año. Las lluvias se concentran en dos cuencas: Lacantún y Chixoy, las cuales pertenecen a la región hidrológica Grijalva-Usumacinta. La temperatura promedio en primavera-verano es de 32° C y en otoño-invierno es de 28° C. Por su parte, la vegetación dominante es la selva alta perennifolia (~73 %), el resto de la cobertura vegetal está repartida entre selva mediana perennifolia, acahuales, potreros, zonas agrícolas y asentamientos humanos (~ 27 %; INEGI, 2015).
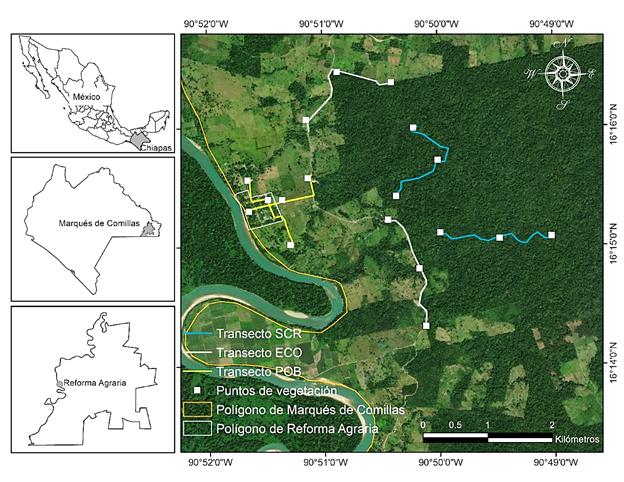
Figura 1 Transectos avifaunísticos (líneas), cuadrantes de vegetación (cuadrados) y ubicación del ejido “Reforma Agraria”, Municipio Marqués de Comillas, Chiapas, México.
Diseño del muestreo. Tres condiciones ambientales fueron seleccionadas con base en las asociaciones vegetales, número de estratos de la vegetación, accesibilidad a los sitios, seguridad personal y por recomendaciones de la asamblea ejidal: 1) El fragmento de selva con regeneración (SCR) es una reserva ejidal con aproximadamente 1,500 ha de selva alta perennifolia, destinadas voluntariamente a la conservación de la Guacamaya Roja (Ara macao) y del Venado Cola Blanca (Odocoileus virginianus) desde hace aproximadamente 10 años. Actualmente, está estrictamente prohibida la caza de animales y la tala con fines comerciales. Sin embargo, hace más de 20 años fue impactada por tala clandestina y en menor medida por tala comercial (R. Ramírez, com. pers.). En la SCR se diferenciaron cuatro estratos de la vegetación, A) herbáceo (de 0 a 1.20 m de altura) con representación de las familias Hymenophyllaceae (e. g. Trichomanes), Arecaceae (e. g. Camaedorea), Hypodematiaceae (e. g. Didymochlaena), Cyclanthaceae (e. g. Aspelundia), entre otras. B) arbustivo (hasta los 2.5 m de altura) integrado por las familias Piperaceae (e. g. Piper), Arecaceae (e. g. Astrocaryum), Heliconiaceae (e. g. Heliconia), entre otros arbustos. C) arbóreo inferior (hasta los 8 m de altura) con presencia de las familias Lauraceae (e. g. Licaria), Araliaceae (e. g. Dendropanax arboreus), Burseraceae (e. g. Bursera simaruba), y, por último, D) estrato emergente (hasta 25 m de altura) conformado por Cedrela odorata, Swietenia macrophylla, Bursera simaruba, Dialium guianense, Ceiba pentandra, entre otras especies de árboles emergentes (Durán-Fernández et al., 2016). Algunos árboles presentaban una altura superior a los 25 m (e. g. Brosimum alicastrum), no obstante, fueron minoría y se encontraban dispersos por la zona. En la SCR se recorrieron dos transectos con una longitud de 2.09 y 2.17 km, respectivamente. 2) Ecotono (ECO): Hace aproximadamente 15 años se finalizó la construcción de la carretera de Chajul a Pico de Oro, la cual divide la SCR de las áreas antropogénicas (potreros y tierras de cultivo abandonadas). En este sitio, los estratos de la vegetación son similares a los de la SCR, pero cruzando la carretera la vegetación ha sido alterada casi en su totalidad. La poca cobertura vegetal de las áreas antropogénicas son las cercas vivas y árboles dispersos, principalmente de Gliricidia sepium, Guazuma ulmifolia, Cecropia spp., Cedrela odorata, y Manilkara zapota. El estrato herbáceo está dominado por Arundinella spp., Panicum maximum, Megathyrsus maximus, Cynodon spp., y Sporobolus spp., entre otras herbáceas (Durán-Fernández et al., 2016; R. Ramírez com. pers.). Los dos transectos tuvieron una longitud de 2.2 km y se ubicaron en las afueras del poblado, sobre la carretera. 3) Poblado (POB): el ejido “Reforma Agraria” fue establecido a principios de los años 80, para ello se removió la vegetación original casi en su totalidad (R. Ramírez, com. pers.). Posteriormente, se privilegió el crecimiento de árboles tipo sombra, frutales y de ornato. Dentro del POB se pueden diferenciar tres estratos de la vegetación: A) el estrato arbustivo estaba conformado por una gran variedad de plantas ornamentales de hasta 2.5 m de altura, algunas de ellas exóticas (e. g. Cordyline fruticosa, Geranium spp., Etlingera elatior, Hibiscus spp.) y otras especies nativas (Lockhartia oerstedii, Dahlia spp., Petrea volubilis). Mientras que, B) el estrato arbóreo inferior estuvo representado por árboles frutales (Mangifera indica, Manilkara zapota, Persea americana, Psidium guajava, Pouteria sapota, Byrsonima crassifolia, Nephelium lappaceum, Theobroma cacao, entre otras especies; Durán-Fernández et al., 2016). También se observaron árboles que pertenecían al estrato emergente (e. g. Dialium guianense), no obstante, correspondían a la vegetación ribereña, árboles dispersos, muertos, o en las afueras del ejido. Los transectos en el POB tuvieron una longitud de 1.5 y 1.7 km, respectivamente. La distancia fue menor en los transectos del POB porque es un ejido relativamente pequeño, con apenas 20 ha de superficie (INEGI, 2015).
Los muestreos se llevaron a cabo en marzo, junio, julio y agosto del 2020. Por situaciones extraordinarias, no se visitaron los transectos en abril y mayo (2020). En cada condición ambiental se establecieron dos transectos, cada uno fue visitado aleatoriamente dos veces por mes. La duración mensual en el campo fue de doce días, teniendo un total de 48 días de muestreo.
Muestreo de aves. Se recorrieron los seis transectos para registrar a la avifauna, empleando la técnica de búsqueda intensiva (Ralph et al., 1996). Los recorridos se iniciaron al amanecer y se concluyeron aproximadamente tres horas después. Al detectar un ave dentro de un radio de 50 m, se registró la hora, especie, número de individuos, posición, altura del ave (respecto al suelo), sustrato, y su comportamiento al momento de ser observado. Si el comportamiento era de tipo alimentario, se determinó el GT del organismo con base en la selección del alimento y la manera en que lo obtuvo.
La posición de los individuos registrados en la columna de la vegetación se determinó midiendo la altura de la planta y dividiéndola en tres partes: estrato inferior (más próximo al suelo) “1”, estrato medio “2” y estrato superior (más alejado al suelo) “3”. También se consideró el suelo, hojarasca y pasto como estrato “0” y a la columna de aire por encima del dosel como el estrato “4”. Las mediciones se realizaron con la ayuda de un telémetro Bushnell (Yardage PRO-SPORT 450).
Los sustratos considerados fueron: agua, aire, corteza, flor(es), hoja(s), rama primaria (más gruesa y cercana al fuste), rama secundaria (nace de un nudo de una rama primaria), rama terciaria (nace de un nudo de una rama secundaria; Urbina, 2001), suelo, sustrato artificial (e. g. concreto), liana, madera muerta y pasto. Cabe señalar que tanto el gremio “INSem”, como los últimos cuatro sustratos no estuvieron contemplados por González-Salazar et al. (2014). No obstante, algunas especies de aves hicieron uso de estos sustratos y GT, por lo que fueron incluidos en este estudio, como propuesta propia. Los registros de las golondrinas (Hirundinidae) y vencejos (Apodidae) que conformaron mayoritariamente los “INSed” fueron excluidos de los análisis de GT, debido a que fue difícil determinar la condición ambiental en donde obtuvieron el alimento. Estas aves presentan una gran movilidad al alimentarse y algunos de ellos (e. g. Streptoprocne zonaris) estaban presentes en las tres condiciones ambientales casi al mismo tiempo.
Los GT y sustratos estuvieron basados en la propuesta de González-Salazar et al. (2014): carnívoros (CRNc= forrajea en el aire, CRNca= forrajea en los árboles, CRNcs= forrajea sobre el suelo, CRNnn= nocturno y CRNaa= forrajea en agua dulce), frugívoros (FRGsei= forrajea desde el suelo a la parte inferior de la vegetación y FRGes= forrajea en el estrato medio y superior de la vegetación), granívoros (GRNsm= forrajea sobre el suelo y en las malezas y GRNeis= forrajea del estrato inferior al estrato superior de la vegetación), insectívoros (INSed= forrajea en el aire, por encima del dosel, INSdd= forrajea en el aire, por debajo del dosel, INSex= forrajea excavando, INSlc= forrajea sobre la corteza, INSgl= forrajea sobre el suelo, INSei= forrajea en el la parte inferior de la vegetación, INSem= forrajea en el estrato medio de la vegetación, INSes= forrajea en el estrato superior, INSnn= nocturno), nectarívoros= NCT, carroñeros= CRÑ, herbívoros= HRBs, y omnívoros (OMNfa= forrajeo sobre los árboles, y OMNfs= forrajeo sobre el suelo). Las categorías de especies que no fueron contempladas por González-Salazar et al. (2014; mayoritariamente especies acuáticas) fueron obtenidas del estudio de González-García (1993).
Muestreo de vegetación. Paralelamente al registro avifaunístico, se realizó un inventario de la vegetación, para evaluar la fisionomía de las asociaciones vegetales y cómo se distribuyen los GT en las diferentes coberturas vegetales. En cada condición ambiental se establecieron seis cuadrantes (n= 18), de 25 m2. Tres cuadrantes se ubicaron en cada transecto, 50 m después de iniciar el transecto para aves, otra a la mitad del transecto y la tercera a 50 m antes de terminar el transecto. Todos los cuadrantes fueron georreferenciados, registrando las especies arbóreas, altura de cada árbol (m), diámetro a la altura del pecho de los árboles (DAP ≥ 5 cm), área basal del árbol, densidad de árboles (número de árboles/25m2), número de estratos y la cobertura de sombra en el área seleccionada. Una vez obtenidos los datos en los cuadrantes, se calculó el índice de diversidad de Shannon para cada condición ambiental. La medición de la vegetación se realizó en junio del 2020.
Datos anemométricos. Las variables climáticas como: temperatura, humedad relativa, humedad absoluta, punto de rocío, e intensidad luminosa, permitieron analizar cuáles de ellas influían en la distribución de los GT en las tres condiciones ambientales. Estas variables fueron registradas cada 60 segundos, empleando un recolector de datos Hobo (modelo H08-004-02). La velocidad del viento, dirección del viento y temperatura ambiental, fueron obtenidos con un anemómetro digital y por medio de la aplicación Physics Toolbox Suite se registró la intensidad luminosa y los decibeles en el entorno. Para estimar la cobertura de las nubes, se dividió el campo visual del cielo en ocho partes (octas). La octa igual a 0 hace referencia a un cielo despejado y las octas cernas a ocho refieren cielos cubiertos por nubosidad (Agencia Estatal de Meteorología, sin fecha).
Análisis de datos. Comunidades avifaunísticas. El esfuerzo de muestreo en cada condición ambiental fue evaluado con base en las curvas de acumulación de especies (Gotelli & Colwell, 2001). Para ello, se empleó el estimador de riqueza “Chao 2”, el cual está basado en la incidencia de las especies en una muestra (presencia-ausencia; Espinosa, 2003). Las curvas fueron elaboradas con el programa EstimateS (versión 8.2; Colwell & Elsensohn, 2014). Mientras que, con las curvas de rango-abundancia (o curvas de Whittaker) se compararon la estructura (dominancia) de las comunidades avifaunísticas en cada condición ambiental. Las abundancias de las especies fueron transformadas a su logaritmo (log), para linealizar los datos (Magurran, 1998). La abundancia relativa se calculó dividiendo el número total de los registros de cada especie entre el total de registros de la especie más abundante, y multiplicando el resultado por 100 (Magurran, 1998). Una vez obtenido el porcentaje, se ubicó dentro de alguna categoría de acuerdo con Pettingill (1985): rara (1-9.9 %), no común (10-30.9 %), moderadamente común (31-64.9 %), común (65-89.9 %) y abundante (90-100 %). Utilizamos el índice de similitud de Bray-Curtis para cuantificar la semejanza de las comunidades avifaunísticas en las tres condiciones ambientales, considerando sus abundancias. Este análisis fue desarrollado con el programa PAST (versión 4.05; Hammer et al., 2001).
Gremios tróficos. Para visualizar las abundancias relativas de los GT y su agrupación en función de los sitios muestreados, se realizó un mapa de calor o Heat map. El mapa de calor es una técnica de visualización de datos bidimensional, con la cual se representa la magnitud de un determinado fenómeno. Para este estudio, las tonalidades más brillantes correspondieron a los GT con mayor abundancia relativa en cada condición ambiental. Además, esta técnica provee de conglomerados en cada dimensión de los datos, basados en una matriz de distancia euclidiana (Wilkinson & Friendly, 2009).
Las variaciones de las abundancias entre los GT y en las tres condiciones ambientales, fueron analizadas con los Modelos Lineales Generalizados Mixtos (GLMM). Los GLMM son empleados cuando los datos provienen de conteos de individuos (O´Hara & Kotze, 2010). Sin embargo, este tipo de datos suelen presentar sobre dispersión. Para corregir la sobre dispersión, se utilizó la ecuación de cuasi verosimilitud o Quasi-Possion (Ver Hoef & Boveng, 2007). Las pruebas estadísticas fueron consideradas como significativas cuando p ≤ 0.05 (McCullagh & Nelder, 1983).
Con el objetivo de elegir entre un análisis de correspondencia canónica (CCA; distribución unimodal) o un análisis de redundancia (RDA; distribución lineal), realizamos un análisis de correspondencia (DCA). Los resultados del DCA mostraron una longitud del gradiente entre 1.49 (eje 1) y 1.33 desviaciones estándar (eje 4), al ser valores inferiores a 4 desviaciones estándar, utilizamos el análisis de redundancia (ter Braak & Smilauer, 1998). El RDA es una técnica multivariante con la que se pretende estudiar una posible relación entre una matriz de variables de respuesta (Y) y una matriz de variables explicativas (X; Legendre et al., 2011). En el presente estudio, se utilizó el RDA para determinar las posibles relaciones entre las abundancias de las especies de aves, las cuales conforman a los GT, y las variables climáticas obtenidas en campo (humedad absoluta [g/m3], humedad relativa [%], intensidad luminosa [lx], nubosidad [%], ruido ambiental [dB], temperatura [°C] y velocidad de viento [m/s]), las variables fisionómicas de la vegetación (altura [m], área basal [m2], cobertura sombra [%], DAP [diámetro a la altura del pecho; cm], densidad [número de árboles/25 m2], Índice de diversidad de Shannon [H’], número de estratos [de uno a cuatro]) y las variables del registro de cada ave en la vegetación al capturar su alimento (altura [m] y posición [0, 1, 2, 3, 4]). Los valores de las variables al presentar diferentes unidades se estandarizaron a puntuaciones Z. La significancia de los ejes canónicos fue determinada con las aleatorizaciones de Monte Carlo (Good, 2000). Debido a que ciertas especies de aves hicieron un uso indistinto de sustratos, estratos y recursos alimenticios, se optó por clasificar a estas especies con base en la frecuencia de los registros. En los casos en que la misma especie presentó el mismo número de registros, pero en dos GT diferentes, se implementó como criterio la literatura disponible (e. g. Nocedal, 1990; González-García, 1993; González-Salazar et al., 2014). Los análisis multivariados se realizaron con el programa PAST (versión 4.05; Hammer et al., 2001).
El listado taxonómico avifaunístico fue de acuerdo con la American Ornithological Society (AOU, 1998) y el suplemento más reciente hasta el momento de redactar el documento (Chesser et al., 202). Los nombres comunes en español fueron de acuerdo con Berlanga et al. (2015), el estatus migratorio se obtuvo de Howell y Webb (1995), las categorías de riesgo por la NOM-059-SEMARNAT-2010 (SEMARNAT, 2019) y la sensibilidad de las especies de aves estuvieron basadas en Stotz et al. (1996).
Resultados
Comunidades avifaunísticas. En total se registraron 6,190 individuos, pertenecientes a 201 especies de aves. Las familias mejor representadas fueron Tyrannidae (22 especies), Parulidae (19 especies) y Thraupidae (17 especies). Por el contrario, 15 familias estuvieron representadas por una sola especie (Anexo 1). Del total de especies observadas, 159 (~79 %) fueron residentes permanentes, 38 (~19 %) migratorias neotropicales, tres (1.5 %) migratorias de verano y Vireo olivaceus (0.5 %) como especie transitoria (Howell & Webb, 1995). Por su parte, 48 especies de aves (23.9 %) se encuentran protegidas por la NOM-059 (SEMARNAT, 2019). De las cuales, cuatro especies están “en Peligro de extinción” (Amazona farinosa, Ara macao, Onychorhynchus coronatus, Pyrilia haematotis), 13 especies (6.5 %) son reportadas como “Amenazadas” (A; e. g. Crax rubra, Heliothryx barroti, Trogon massena) y, 32 especies (15.9 %) están “Sujetas a protección especial” (Pr; e. g. Ictinia plumbea, Pteroglossus torquatus, Xenops minutus) (Anexo 1).
En el ECO se obtuvo un mayor porcentaje de especies esperadas (90 %), después la SCR (87 %) y finalmente el POB (79 %). Las especies más abundantes en el ECO fueron: Ara macao (n= 166), Eupsittula nana (n= 99), y Amazona autumnalis (n= 97). Mientras que en la SCR fueron: Habia fuscicauda (n= 54), Formicarius analis (n= 52), y Henicorhina leucosticta (n= 46) y en el POB las especies más abundantes fueron: Quiscalus mexicanus (n= 281), E. nana (n= 212), y Pyrilia haematotis (n= 152; Fig. 2).
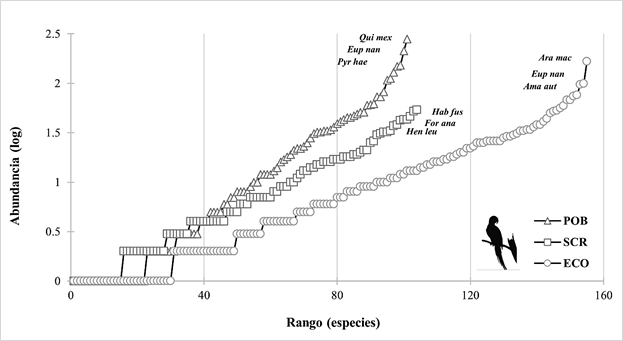
Figura 2 Curvas de rango-abundancia de las comunidades avifaunísticas del ejido “Reforma Agraria” y sus alrededores, Municipio de Marqués de Comillas, Chiapas, México, correspondientes a los cuatro meses muestreados. Códigos de las especies: Qui mex= Quiscalus mexicanus, Eup nan= Eupsittula nana, Pyr hae= Pyrilia haematotis, Hab fus= Habia fuscicauda, For ana= Formicarius analis, Hen leu= Henicorhina leucosticta, Ara mac= Ara macao, Ama aut= Amazona autumnalis. Sitios: SCR= selva con regeneración, ECO= ecotono y POB= poblado.
En el ECO se registró la mayor riqueza de especies de aves con 155 (24 exclusivas), seguido por la SCR con 104 especies (23 exclusivas), y el POB con 101 especies (20 exclusivas). La SCR y el ECO compartieron 51 especies, mismo número de especies en el ECO y el POB. Mientras que, entre la SCR y el POB no se compartieron especies. Treinta y dos especies se compartieron en las tres condiciones. Las comunidades avifaunísticas con mayor similitud entre sí, en cuanto a la composición de especies, fue entre el POB y el ECO (53 %), mientras que la SCR tuvo una baja similitud con las comunidades del POB y del ECO (23 %; Fig. 3). La clasificación de las especies de acuerdo con sus abundancias relativas fue similar en las tres condiciones ambientales, donde las especies “raras” y las “no comunes” estuvieron bien representadas (SCR= 50 y 28, ECO= 111 y 33 y POB= 71 y 22, respectivamente; Fig. 4).
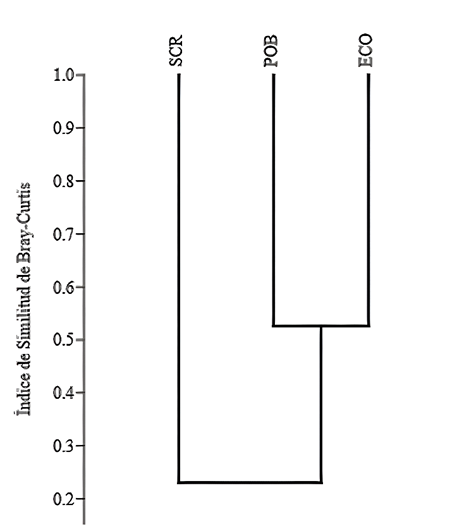
Figura 3 Índice de similitud de Bray-Curtis basado en las comunidades avifaunísticas de la SCR (selva con regeneración), POB (poblado) y ECO (ecotono), del ejido “Reforma Agraria” y sus alrededores, Municipio de Marqués de Comillas, Chiapas, México.

Figura 4 Número de especies dentro de cada categoría de abundancia relativa, según Pettingill (1985). Ra= rara, NC= no común, MC= moderadamente común, CO= común y AB= abundante, correspondientes a los cuatro meses muestreados en el ejido de “Reforma Agraria” y sus alrededores, Municipio de Marqués de Comillas, Chiapas, México. Sitios: SCR= selva con regeneración, ECO= ecotono y POB= poblado.
Vegetación. En los seis cuadrantes de la SCR se registraron 12 especies de árboles, (dos de ellos sin identificar) y 27 individuos. La altura de los árboles, la densidad de los árboles y el porcentaje de cobertura sombra fueron mayores en la SCR respecto a las otras condiciones ambientales (Cuadro 1). En el ECO se registraron 23 individuos de 18 especies de árboles (seis especies sin identificar y cinco identificadas hasta género), y se presentó la diversidad más alta de los tres sitios H’= 2.89 (versus POB H’= 2.44 y SCR H’= 2.23). Sin embargo, esta diversidad no fue estadísticamente significativa entre los tres sitios muestreados (MGLM= 4.77, g. l.= 8, p= 0.058), aunque el valor de probabilidad está en el límite. Finalmente, en el POB se observaron 14 individuos de 11 especies de árboles (una especie no identificada) y una especie en el estrato arbustivo (Cedrela odorata). Los valores del DAP y el área basal fueron mayores en los árboles del POB, que en los otros sitios.
Cuadro 1 Variables registradas en los cuadrantes de vegetación del ejido “Reforma Agraria”, Municipio de Marqués de Comillas, Chiapas, México. S= riqueza de especies, N.A.= número de árboles, H’= índice de diversidad de Shannon, ICI-ICS= intervalos de confianza inferior y superior del índice de diversidad de Shannon, altura= altura promedio de los árboles, DAP= diámetro a la altura de pecho promedio de los árboles, área basal= área basal promedio de los árboles, densidad= densidad promedio de los árboles (número de individuos/25m2) y sombra (%)= porcentaje promedio de sombra. Sitios: SCR= selva con regeneración, ECO= ecotono y POB= poblado.
| Sitio | S | N.A. | H’ | ICI-ICS | altura (m) | DAP (cm) | área basal (m2) | densidad (ind/25 m2) | sombra (%) |
|---|---|---|---|---|---|---|---|---|---|
| SCR | 12 | 27 | 2.23 | 1.87-2.37 | 15.25 | 82.96 | 0.54 | 0.18 | 84 % |
| ECO | 19 | 24 | 2.89 | 2.28-2.81 | 11.4 | 70 | 0.38 | 0.15 | 54 % |
| POB | 12 | 14 | 2.44 | 1.87-2.44 | 7.4 | 87.67 | 0.60 | 0.09 | 32 % |
Gremios tróficos. Se observaron 1,719 individuos (de 157 especies de aves) alimentándose en por lo menos una de las tres condiciones ambientales. Sin embargo, clasificamos a 1,384 individuos dentro de GT principales. El ECO presentó el mayor número de GT con 15 (ocho insectívoros, dos carnívoros, dos frugívoros, dos granívoros, y un nectarívoro) correspondientes a 101 especies de aves y 483 individuos (Cuadro 2). Posteriormente el POB presentó 11 GT (ocho insectívoros, un frugívoro, un granívoro, y un nectarívoro) con 72 especies de aves y 641 individuos. Y en la SCR también se registraron 11 GT (siete insectívoros, dos frugívoros, un granívoro, y un nectarívoro) con 64 especies y 260 individuos. Los gremios con un mayor número de individuos en ECO fueron los FRGes (35.4 %), los GRNsm (21.3 %) y los INSes (9.3 %). En el POB fueron también los FRGes (37.2 %), los INSgl (20.7 %) y los GRNsm (12.8 %), pero en la SCR los insectívoros presentaron el mayor número de individuos, los INSes (30.8 %), los INSlc (22.3 %) y los INSei (9.2 %; Fig. 5).
Cuadro 2 Número de especies y abundancia de individuos de cada GT en las tres condiciones ambientales muestreadas. GT códigos: CRNc= forrajea en el aire, CRNcs= forrajea sobre el suelo, FRGsei= forrajea desde el suelo a la parte inferior de la vegetación, FRGes= forrajea en el estrato medio y superior de la vegetación, GRNsm= forrajea sobre el suelo y en las malezas, GRNeis= forrajea del estrato inferior al estrato superior de la vegetación, INSed= forrajea en el aire, por encima del dosel, INSdd= forrajea en el aire, por debajo del dosel, INSex= forrajea excavando, INSlc= forrajea sobre la corteza, INSgl= forrajea sobre el suelo, INSei= forrajea en el la parte inferior de la vegetación, INSem= forrajea en el estrato medio de la vegetación, INSes= forrajea en el estrato superior, NCT= nectarívoros. Sitios: SCR= selva con regeneración, ECO= ecotono y POB= poblado.
| GT | SCR | ECO | POB | |||
|---|---|---|---|---|---|---|
| Riqueza | Abundancia | Riqueza | Abundancia | Riqueza | Abundancia | |
| CRNc | 0 | 0 | 1 | 1 | 0 | 0 |
| CRNcs | 0 | 0 | 1 | 1 | 0 | 0 |
| FRGes | 7 | 16 | 24 | 171 | 15 | 239 |
| FRGsei | 5 | 14 | 2 | 3 | 0 | 0 |
| GRNeis | 0 | 0 | 1 | 3 | 0 | 0 |
| GRNsm | 1 | 2 | 9 | 103 | 7 | 82 |
| INSdd | 4 | 9 | 7 | 11 | 9 | 34 |
| INSed | 0 | 0 | 2 | 6 | 2 | 8 |
| INSei | 7 | 24 | 7 | 24 | 4 | 8 |
| INSem | 5 | 10 | 4 | 7 | 1 | 3 |
| INSes | 17 | 80 | 19 | 45 | 8 | 38 |
| INSex | 5 | 21 | 6 | 30 | 5 | 27 |
| INSgl | 2 | 7 | 4 | 7 | 9 | 133 |
| INSlc | 7 | 58 | 5 | 34 | 3 | 7 |
| NCT | 4 | 19 | 9 | 37 | 9 | 62 |
| Total | 11 (64) | 260 | 15 (101) | 483 | 11 (72) | 641 |
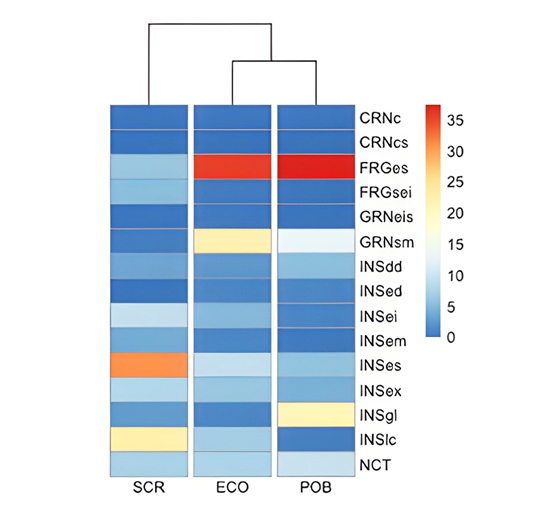
Figura 5 Mapa de calor generado con las abundancias relativas de los individuos que componen los 15 GT (filas), en las tres condiciones ambientales (columnas). Códigos GT: CRNc= forrajea en el aire, CRNcs= forrajea sobre el suelo, FRGsei= forrajea desde el suelo a la parte inferior de la vegetación, FRGes= forrajea en el estrato medio y superior de la vegetación, GRNsm= forrajea sobre el suelo y en las malezas, GRNeis= forrajea del estrato inferior al estrato superior de la vegetación, INSed= forrajea en el aire, por encima del dosel, INSdd= forrajea en el aire, por debajo del dosel, INSex= forrajea excavando, INSlc= forrajea sobre la corteza, INSgl= forrajea sobre el suelo, INSei= forrajea en el la parte inferior de la vegetación, INSem= forrajea en el estrato medio de la vegetación, INSes= forrajea en el estrato superior, NCT= nectarívoros. Sitios: SCR= selva con regeneración, ECO= ecotono y POB= poblado.
Los individuos por GT variaron significativamente en las tres condiciones ambientales estudiadas y a lo largo de los cuatro meses muestreados (Cuadro 3). Los FRGes fueron más abundantes en el ECO que en la SCR (MGLM= 16.09, g. l.= 1; 60, p <0.0002), y más abundantes en el POB que en la SCR (MGLM= 4.94, g. l.= 1; 60, p <0.030). Los GRNsm también fueron más abundantes en el POB que en la SCR (MGLM= 4.28, g. l.= 1; 24, p <0.05). La distribución de las abundancias de los insectívoros (INSes, INSem, INSei, INSlc, INSdd, INSed, INSex), de los frugívoros del estrato inferior y del suelo (FRGsei), de los granívoros (GRNeis, GRNsm), de los carnívoros (CRNc, CRNcs) y de los nectarívoros (NCT), no presentaron diferencias significativas entre dos sitios (p= 0.06 - p= 0.99; Cuadro 3). Sin embargo, al comparar las abundancias de los GT en los tres sitios, los FRGes (MGLM= 3.2, g. l.= 2; 90, p <0.04), los INSdd (MGLM= 3.13, g. l.= 2; 45, p <0.05) y los INSgl (MGLM= 3.15, g. l.= 2; 36, p <0.05) fueron diferentes (Cuadro 3).
Cuadro 3 Variación de las abundancias de los GT en las tres condiciones ambientales, con base en los Modelos Lineales Generalizados Mixtos. MGLM= Valor del Modelo Lineal Generalizado Mixto, g.l.= grados de libertad, ᵜ= tamaño de la muestra, N/A= no aplica, *= diferencias estadísticamente significativas. GT códigos: CRNc= forrajea en el aire, CRNcs= forrajea sobre el suelo, FRGsei= forrajea desde el suelo a la parte inferior de la vegetación, FRGes= forrajea en el estrato medio y superior de la vegetación, GRNsm= forrajea sobre el suelo y en las malezas, GRNeis= forrajea del estrato inferior al estrato superior de la vegetación, INSed= forrajea en el aire, por encima del dosel, INSdd= forrajea en el aire, por debajo del dosel, INSex= forrajea excavando, INSlc= forrajea sobre la corteza, INSgl= forrajea sobre el suelo, INSei= forrajea en el la parte inferior de la vegetación, INSem= forrajea en el estrato medio de la vegetación, INSes= forrajea en el estrato superior, NCT= nectarívoros. Sitios: SCR= selva con regeneración, ECO= ecotono y POB= poblado.
| GT | MGLM (g. l.) | p valor | Sitios comparados | MGLM (g. l.) | p valor | Sitios comparados |
|---|---|---|---|---|---|---|
| CRNc | N/A | N/A | N/A | N/A | N/A | N/A |
| CRNcs | N/A | N/A | N/A | N/A | N/A | N/A |
| FRGes | 3.2 (2; 90ᵜ) | 0.04* | SCR, ECO y POB | 16.09 (1; 60ᵜ) | 0.0002* | SCR ≠ ECO |
| 4.94 (1; 60ᵜ) | 0.030* | SCR ≠POB | ||||
| 0.44 (1; 60ᵜ) | 0.51 | ECO = POB | ||||
| FRGsei | 1.99 (2; 18ᵜ) | 0.17 | SCR, ECO y POB | 2.70 (1; 12ᵜ) | 0.13 | SCR = ECO |
| 0.00 (1; 12ᵜ) | 0.99 | SCR = POB | ||||
| 0.00 (1; 12ᵜ) | 0.99 | ECO = POB | ||||
| GRNeis | N/A | N/A | N/A | N/A | N/A | N/A |
| GRNsm | 1.78 (2; 36ᵜ) | 0.18 | SCR, ECO y POB | 3.82 (1; 24ᵜ) | 0.06 | SCR = ECO |
| 4.28 (1; 24ᵜ) | 0.05* | SCR ≠ POB | ||||
| 0.19 (1; 24ᵜ) | 0.66 | ECO = POB | ||||
| INSdd | 3.13 (2; 45ᵜ) | 0.05* | SCR, ECO y POB | 0.10 (1; 30ᵜ) | 0.76 | SCR = ECO |
| 3.20 (1; 30ᵜ) | 0.09 | SCR = POB | ||||
| 3.52 (1; 30ᵜ) | 0.07 | ECO = POB | ||||
| INSed | 0.00 (2; 9ᵜ) | 0.99 | SCR, ECO y POB | 0.00 (1; 6ᵜ) | 0.99 | SCR = ECO |
| 0.00 (1; 6ᵜ) | 0.99 | SCR = POB | ||||
| 0.06 (1; 6ᵜ) | 0.81 | ECO = POB | ||||
| INSei | 0.89 (2; 39ᵜ) | 0.42 | SCR, ECO y POB | 0.00 (1; 26ᵜ) | 0.99 | SCR = ECO |
| 1.81 (1; 26ᵜ) | 0.19 | SCR = POB | ||||
| 1.81 (1; 26ᵜ) | 0.19 | ECO = POB | ||||
| INSem | 0.76 (2; 18ᵜ) | 0.49 | SCR, ECO y POB | 0.28 (1; 12ᵜ) | 0.61 | SCR = ECO |
| 1.38 (1; 12ᵜ) | 0.27 | SCR = POB | ||||
| 0.62 (1; 12ᵜ) | 0.45 | ECO = POB | ||||
| INSes | 1.4 (2; 102ᵜ) | 0.25 | SCR, ECO y POB | 2.47 (1; 68ᵜ) | 0.12 | SCR = ECO |
| 1.68 (1; 68ᵜ) | 0.20 | SCR = POB | ||||
| 0.09 (1; 68ᵜ) | 0.77 | ECO = POB | ||||
| INSex | 0.14 (2; 24ᵜ) | 0.87 | SCR, ECO y POB | 0.38 (1; 16ᵜ) | 0.55 | SCR = ECO |
| 0.11 (1; 16ᵜ) | 0.75 | SCR = POB | ||||
| 0.02 (1; 16ᵜ) | 0.88 | ECO = POB | ||||
| INSgl | 3.15 (2; 35ᵜ) | 0.05* | SCR, ECO y POB | 0.00 (1; 24ᵜ) | 0.99 | SCR = ECO |
| 2.28 (1; 24ᵜ) | 0.15 | SCR = POB | ||||
| 2.39 (1; 24ᵜ) | 0.14 | ECO = POB | ||||
| INSlc | 2.08 (2; 20ᵜ) | 0.15 | SCR, ECO y POB | 0.62 (1; 14ᵜ) | 0.45 | SCR = ECO |
| 3.71 (1; 14ᵜ) | 0.08 | SCR = POB | ||||
| 3.37 (1; 14ᵜ) | 0.09 | ECO = POB | ||||
| NCT | 0.97 (2; 32ᵜ) | 0.39 | SCR, ECO y POB | 0.9 (1; 22ᵜ) | 0.35 | SCR = ECO |
| 1.54 (1; 22ᵜ) | 0.22 | SCR = POB | ||||
| 0.43 (1; 22ᵜ) | 0.52 | ECO = POB |
Las variables climáticas con mayor nivel de predictibilidad para la presencia de la avifauna fueron: la humedad absoluta, la velocidad del viento, y la intensidad luminosa. Mientras que, el índice de diversidad de Shannon, el número de estratos y el porcentaje de cobertura de sombra, fueron las variables fisionómicas de la vegetación con los valores predictivos más altos (Cuadro 4). El 44.98 % de la varianza fue explicada por tres ejes (eje 1= 26.62 %, eje 2= 17.56 %, eje 3= 0.80 %; F= 46.15; p <0.001). Además, el RDA mostró una relación alta entre las abundancias de los GT y las variables analizadas, en el primer eje fue de 0.78, en el segundo eje de 0.68, y 0.02 para el tercer eje. Las abundancias de los GT afines a la SCR (e. g. FRGsei, INSei, INSem, INSes, INSlc) estuvieron correlacionadas positivamente con el número de estratos, cobertura sombra, altura de los árboles, densidad de los árboles y la humedad absoluta, pero correlacionadas negativamente con la velocidad del viento, intensidad luminosa, DAP y temperatura (Fig. 6). Por el contrario, los GT que fueron representativos del ECO y del POB (e. g. FRGes, GRNsm, INSdd, INSed, INSgl, NCT) se correlacionaron positivamente con la velocidad del viento, intensidad luminosa, índice de diversidad de Shannon y con la presencia de viento. Otros GT como los INSex no mostraron una asociación por algún tipo de condiciones en particular (Fig. 6).
Cuadro 4 Autovalores y porcentaje de varianza explicado por el Análisis de redundancia (RDA), correcciones de Pearson (r) entre las variables empleadas (climáticas, fisionomía de la vegetación y de la avifauna) y los tres ejes canónicos. También se presenta el resultado de la prueba de Monte Carlo. Z (variable)= variable estandarizada.
| Análisis de Redundancia | Eje 1 | Eje 2 | Eje 3 |
|---|---|---|---|
| Autovalores | 0.80 | 0.53 | 0.02 |
| Correlación especies-variables | 0.78 | 0.68 | 0.20 |
| Varianza porcentual acumulada de los datos de abundancia de las especies | 26.62 | 44.18 | 44.98 |
| Variables de la avifauna | |||
| Z Altura (Aves) | 0.12 | -0.20 | 0.27 |
| Z Posición | 0.14 | -0.05 | -0.81 |
| Variables climáticas | |||
| Z Humedad absoluta | 0.18 | -0.12 | 0.35 |
| Z Intensidad luminosa | -0.17 | 0.00 | 0.27 |
| Z Nubosidad | -0.03 | 0.04 | -0.02 |
| Z Ruido ambiental | 0.08 | -0.07 | 0.22 |
| Z Temperatura | 0.18 | 0.06 | 0.05 |
| Z Velocidad del viento | -0.33 | 0.19 | -0.22 |
| Variables de la vegetación | |||
| Z Altura de los árboles | 0.42 | -0.56 | 0.13 |
| Z Cobertura sombra | 0.50 | -0.69 | 0.01 |
| Z DAP | 0.18 | 0.17 | 0.04 |
| Z Densidad de árboles | 0.26 | -0.64 | 0.06 |
| Z Índice de diversidad de Shannon | -0.46 | -0.76 | -0.15 |
| Z Número de estratos | 0.41 | -0.74 | -0.01 |
| Prueba de Monte Carlo (999 permutaciones) | F | p-valor | |
| Significancia de todos los ejes | 46.15 | 0.001 |
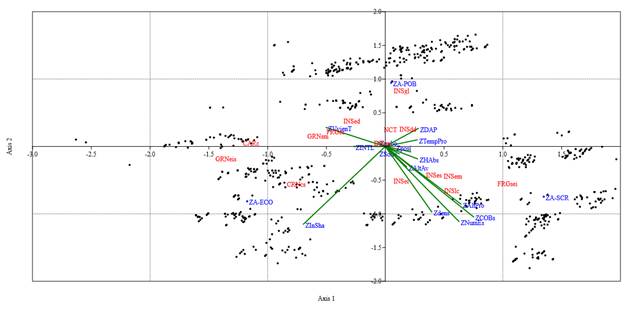
Figura 6 Análisis de redundancia (RDA) donde se muestra la asociación estadística entre las abundancias de las especies de aves en los 15 GT y las variables climáticas estandarizadas (ZHAbs= humedad absoluta, ZINTL= intensidad luminosa, ZNubo= nubosidad, ZSono= ruido ambiental, ZTemPro= temperatura, ZVvienT= velocidad del viento), las variables de la fisionomía de la vegetación estandarizadas (ZAlt Pro= altura de los árboles, ZCOBs= cobertura sombra, ZDAP= DAP, Zdens= densidad de los árboles, ZInSha= índice de diversidad de Shannon, ZNumEs= número de estratos) y las variables correspondientes a la avifauna estandarizadas (Zposi= posición, ZAltAv= altura de las aves). ZA-SCR= abundancias de las especies en la SCR, ZA-ECO= abundancias de las especies en el ECO y, ZA-POB abundancias de las especies en el POB.
Discusión
Las comunidades avifaunísticas y los GT aviares presentaron variaciones en la composición y riqueza de especies, así como sus abundancias en las tres condiciones ambientales. De manera general, en el ECO se obtuvo la mayor riqueza de especies (155) y el mayor número de GT (15). Sin embargo, en la SCR las especies residentes y con mayor grado de sensibilidad fueron más abundantes. Además, en la SCR los gremios especialistas fueron más comunes (e. g. INSlc, INSes). Mientras que, en el POB se distribuyeron las especies, y GT generalistas y poco sensibles a los cambios ambientales.
Comunidades avifaunísticas. El listado taxonómico de las especies de aves registradas en este estudio fue de 201 especies. Esta riqueza de especies representa el 17.9 % del total de aves reportadas en México (1,123 especies, Navarro-Sigüenza et al., 2014), el 29 % de las especies registradas en Chiapas (694; Rangel-Salazar et al., 2013) y el 44.8 % de las especies observadas en la Selva Lacandona (449; Enríquez, com. pers.). La superficie conjunta entre la reserva ejidal (1,463 ha) y la superficie en el ejido “Reforma Agraria” (aproximadamente 20 ha) no supera las 1,500 ha. Sin embargo, la riqueza avifaunística podría ser considerada como alta para una superficie relativamente pequeña. Por ejemplo, en la Reserva de la Biosfera de Montes Azules (REBIMA), con una superficie superior a las 330 mil ha, se han reportado 340 especies de aves (González-García 1993; SERMANAT-INECOL-CONABIO, 1995). En el Monumento Natural Bonampak (ubicado en Chiapas y con 4,357 ha), fueron reportadas 300 especies de aves. La heterogeneidad paisajística puede influir a que en este tipo de fragmentos selváticos exista un elevado número de especies (MacArthur & MacArthur, 1961). La presencia de varios tipos de vegetación y los acomodos espaciales de los parches ofrecen una gran variedad de condiciones para que diferentes comunidades avifaunísticas puedan coexistir (Turner et al., 2003).
Las especies más abundantes en el POB y en el ECO fueron aquellas especies con comportamientos gregarios (Álvarez-Álvarez et al., 2018), como algunos pericos (Eupsittula nana), loros (Amazona autumnalis, Pyrilia haematotis) y la Guacamaya Roja (Ara macao). Lo anterior podría sugerir que sitios estructuralmente simplificados y rodeados de zonas boscosas (poco perturbadas), son un entorno favorecedor para el mantenimiento y conservación de las poblaciones de psitácidos a corto y mediano plazo (Carreón-Arroyo, 2006). Debido a su capacidad de desplazamiento y a la disponibilidad de alimento relativamente constante en estos sitios (Álvarez-Álvarez et al., 2018). Cabe mencionar que, A. macao, P. haematotis (en Peligro de extinción), A. autumnalis (Amenazada) y, E. nana (Sujeta a protección especial) se encuentran en alguna categoría de riesgo para su conservación (NOM-059-SEMARNAT-2019).
El ECO presentó la mayor riqueza avifaunística de los tres sitios, con 155 especies (24 exclusivas). Sin embargo, nuestros resultados difieren considerablemente con el trabajo de González-García (1993), realizado en la REBIMA, dónde registró 42 especies de aves asociadas a los ecotonos selváticos y 171 especies en el interior de la selva. Por su parte, Nocedal (1990) identificó 19 especies en los ecotonos y 68 especies de aves en la selva alta perennifolia. La reducción del número de especies de aves en las cercanías de los bordes posiblemente sea por cambios en la estructura y composición de las asociaciones vegetales (Baier et al., 2002), a cambios microclimáticos asociados a la perturbación de la vegetación (Laurance et al., 1997; Beier et al., 2002) como la luz solar, velocidad del viento, temperatura y humedad (Laurance, 2001) o bien, al tiempo y diseño del muestreo (Hill & Hamer, 2004). No obstante, en el presente estudio los ecotonos fueron sitios clave para la presencia de algunas rapaces (e. g. Accipiter cooperii, Ictinia plumbea, Geranospiza caerulescens), la abundancia de algunos psitácidos (e. g. Pionus senilis, Amazona farinosa, Ara macao) y de paseriformes residentes (e. g. Euphonia gouldi, Stilpnia larvata, Ramphocelus sanguinolentus) e incluso especies migratorias (Setophaga dominica, Pheucticus ludovicianus, Leiothlypis celata).
Es probable que la alta riqueza de especies en el ECO esté asociada a la heterogeneidad paisajística. En estos sitios interactúan especies con afinidad forestal, con cierta tolerancia a la perturbación, y las comunidades de aves que son habituales en condiciones depauperadas o colonizadoras de espacios abiertos (Sekercioglu et al., 2002; MacGregor-Fors et al., 2010; MacGregor & Schondube, 2011; Pineda-Diez et al., 2012). No obstante, existe evidencia de que las especies con alta sensibilidad a los cambios en su entorno están restringidas al interior de la selva (Beier et al., 2002; Arriaga-Weiss et al., 2008). En el presente estudio, la SCR tuvo ocho especies consideradas como altamente sensibles a los cambios en el entorno (7.6 %), y tres especies se distribuyeron en el ECO (1.9 %; Stotz et al., 1996). También las especies con sensibilidad media fueron más comunes en la SCR (71 especies; 67 %) que en el ECO (69 especies; 43.7 %), a pesar de que esta última condición ambiental tuvo 52 especies más que la SCR.
Gremios tróficos. Nuestros resultados sugieren que la riqueza de especies, la abundancia y/o composición de los GT, variaron entre las tres condiciones ambientales. El sitio con mayor número de GT fue el ECO (15 gremios), aunque en el POB se registró la abundancia más alta de individuos dentro de los GT (641 individuos). Los gremios considerados como generalistas (e. g. GRNsm, INSed, INSdd; O’Conell et al., 2000) estuvieron bien representados en el POB y en el ECO, mientras que los gremios especialistas y con mayor sensibilidad a los cambios ambientales (e. g. FRGsei, INSes, INSei, INSem, INSlc; O’Conell et al., 2000) fueron más abundantes en la SCR.
Insectívoros. Los ocho GT que componen a los insectívoros fueron registrados en las tres condiciones ambientales (con excepción de los INSed en la SCR), este gremio es considerado como el más numeroso en los trópicos (Blake & Loiselle, 2001). Los INSes estuvieron bien representados en la SCR (17 especies y 80 individuos) y en el ECO (19 especies y 45 individuos), y en menor medida en el POB (ocho especies y 38 individuos). Los INSes se correlacionaron positivamente con la densidad de árboles, altura de los árboles, porcentaje de cobertura de sombra, número de estratos y a la humedad del ambiente. De acuerdo con Leyequién et al. (2014), los INSes no solo estarían relacionados con la alta densidad y altura de los árboles, sino también con el área basal y la edad de los árboles. Este gremio es considerado bioindicador, sensible a las modificaciones estructurales del entorno y la mayoría de ellos están restringidos a las copas de los árboles (e. g. Microrhopias quixensis, Polioptila plumbea, Tunchiornis ochraceiceps) por lo que también se les considera especialistas en la búsqueda y obtención de su alimento (O’Connell et al., 2000).
Los INSem estuvieron mejor representados en la SCR (cinco especies y 10 individuos), que en el ECO (cuatro especies y siete individuos) o en el POB (tres individuos de una especie). Por lo que, es probable que este gremio se vea afectado negativamente por la pérdida de cobertura vegetal. Sin embargo, la escasa literatura disponible complica las comparaciones con estudios previos (e. g. Nocedal, 1990; González-García, 1993; Pineda-Diez et al., 2012; Levey et al., 2021). De cualquier manera, especies como Habia fuscicauda y Schiffornis veraepacis (especies con poca tolerancia a los cambios estructurales de la vegetación; Stotz et al., 1996) estuvieron restringidas a la SCR. Otras especies como Attila spadiceus, Mionectes oleagineus y Xenops minutus fueron registradas en la SCR y el ECO. Mientras que, en el POB Todirostrum cinereum fue la única especie representativa de este gremio.
Los INSei estuvieron conformados por siete especies y 24 individuos tanto en la SCR como en el ECO, y por cuatro especies y ocho individuos en el POB. Las especies que conformaron a los INSei en la SCR fueron especies residentes permanentes y sensibles a los cambios en el entorno (e. g. Dysithamnus mentalis, Henicorhina leucosticta, Lipaugus unirufus; Stotz et al., 1996). Mientras que, en el POB los INSei estuvieron conformados por especies con baja sensibilidad a los cambios ambientales y por especies migratorias neotropicales (e. g. Cardellina pusilla, Setophaga magnolia, S. ruticilla). El ECO presentó una mezcla de especies residentes (e. g. Arremonops chloronotus, Geothlypis poliocephala) y migratorias neotropicales (e. g. Icteria virens, Setophaga citrina) todas ellas con baja sensibilidad a los cambios ambientales (Stotz et al., 1996). Los INSei estuvieron asociados positivamente al sotobosque tropical, a la entomofauna del sotobosque y ciertas variables microclimáticas (humedad relativa alta, poca luminosidad, poca variación de la temperatura ambiental y ausencia de viento; Barlow et al., 2002; Arriaga-Weiss et al., 2008). Por lo que, la simplificación de la cobertura vegetal pone en riesgo inminente a los INSei del interior del bosque (Sekercioglu et al., 2002; Tscharntke et al., 2008), debido a su alta especificidad (Sekercioglu, 2002; Sekercioglu et al., 2002) y a que son especialistas en la búsqueda y captura de su alimento (Robison, 1969; O’Conell et al., 2000).
Por su parte, los INSgl fueron más numerosos en el POB (nueve especies y 133 individuos) y poco representativos en el ECO (cuatro especies y siete individuos) o en la SCR (dos especies y siete individuos). Las abundancias relativamente altas de Q. mexicanus (n= 78) y de Crotophaga sulcirostris (n= 31) en el POB, probablemente contribuyeron a esta diferencia. Nuestros resultados sugieren que este gremio es favorecido por la simplificación de la cobertura vegetal, lo cual contradice lo reportado por Jhons (1991), Rosenberg (1993), Kattan et al. (1994) y Renjifo (2001), quienes consideraron que los INSgl son característicos del interior del bosque tropical y altamente sensibles a la pérdida de cobertura vegetal. En la SCR únicamente se observaron dos especies de aves alimentándose de insectos sobre el suelo (n= 7; Formicarius analis y Seiurus aurocapilla).
La mayor representatividad de los INSlc ocurrió en la SCR con siete especies y 58 individuos, donde especies de aves con afinidad forestal, sensibles a los cambios ambientales y residentes permanentes, fueron dominantes en este hábitat, como los trepatroncos (e. g. Dendrocolaptes sanctithomae, Glyphorynchus spirurus, Xyphorhynchus flavigaster). En el POB se registró la riqueza y abundancia más baja de INSlc con tres especies y siete individuos, de las cuales dos tienen una baja sensibilidad a los cambios ambientales (Lepidocolaptes souleyetii y Mniotilta varia). Quizá la poca representatividad de los INSlc en el POB, y en menor medida en el ECO, se debió a que este gremio se correlaciona positivamente con la alta densidad de árboles (Jhons, 1991; Raman et al., 1998), la altura de los árboles, el DAP, y la superficie de la corteza (Jhons, 1991; Arriaga-Weiss et al., 2008; Leyequién et al., 2014). Por el contrario, responden negativamente a la perturbación antropogénica (Arriaga-Weiss et al., 2008; Santamaría-Rivero et al., 2016) y a la pérdida de cobertura vegetal (Rosenberg, 1993).
Los INSex fueron ligeramente más numerosos en el ECO (seis especies y 30 individuos), que en la POB (cinco especies y 27 individuos) o en la SCR (cinco especies y 21 individuos). Las especies con mayor sensibilidad a las perturbaciones antropogénicas fueron más abundantes en la SCR y el ECO (e. g. Celeus castaneus, Campephilus guatemalensis, Melanerpes pucherani). Por el contrario, especies con baja sensibilidad a los cambios ambientales fueron comunes en los sitios desprovistos de vegetación (e. g. Melanerpes aurifrons, Dryocopus lineatus; Stotz et al., 1996), Presumiblemente, los INSex no se ven seriamente afectados por la simplificación de la cobertura vegetal y podrían tener cierta tolerancia a los sitios perturbados (Levey et al., 2021).
Los INSdd tuvieron mayor riqueza de especies y abundancia de individuos en el POB (nueve especies y 34 individuos), en comparación con el ECO (siete especies y 11 individuos) y la SCR (cuatro especies y nueve individuos). En el POB y el ECO los INSdd pertenecieron en su mayoría a la familia Tyrannidae e Hirundinidae, los cuales capturan insectos en pleno vuelo y evitan sitios densamente arbolados (dos Anjos et al., 1997), además son consideradas especies generalistas (Pineda-Diez et al., 2012). Mientras que, en la SCR fueron representados por dos especies migratorias, con baja sensibilidad hacia el entorno (Geothlypis abbas y Myiodynastes luteiventris), y dos especies residentes permanentes y sensibles a los cambios ambientales (Onychorhynchus coronatus y Trogon caligatus). Finalmente, los INSed fueron observados en el POB (dos especies de ocho individuos) y el ECO (dos especies y seis individuos). Los INSed son típicos de áreas antropogénicas, generalistas (Pineda-Diez et al., 2012) y las especies que componen a este gremio tienen baja sensibilidad a los cambios en el entorno (Stotz et al., 1996).
Las especies insectívoras que componen a los gremios especialistas como los INSes, los INSem, los INSei y los INSlc, se distribuyen en sitios estructuralmente complejos, con poca perturbación antropogénica y son sensibles a los cambios ambientales (Jhons, 1991; Gray et al., 2007; Arriaga-Weiss et al., 2008). Alteraciones drásticas en las asociaciones vegetales pueden desencadenar procesos de extinciones locales o reducción de los tamaños poblacionales para estas especies (Laurance et al., 2004; Barlow et al., 2007; Banks-Leite et al., 2010).
Frugívoros. Los frugívoros fueron el segundo GT mejor representado en nuestro estudio (después de los insectívoros), como se ha reportado previamente en otras regiones tropicales (Kissling et al., 2007; 2009). A diferencia de los insectívoros, los frugívoros fueron en su mayoría especies residentes (n= 35; 97 %). En el ECO, los FRGes estuvieron conformados por 24 especies de aves y 171 individuos, mientras que en el POB fueron 15 especies y 239 individuos y, en la SCR tan solo siete especies y 16 individuos. En hábitats abiertos (POB) y semi-abiertos (ECO), se observó que árboles de los géneros Ficus, Inga, Cecropia, Byrsonima, Spondias y otros árboles frutales, repercutieron positivamente en la presencia y abundancia de frugívoros pequeños como Thraupis abbas, T. episcopus, Euphonia hirundinacea y frugívoros medianos como Eupsittula nana, Ara macao, Pteroglossus torquatus, entre otras especies de aves. Coincidiendo con lo reportado por Luck & Daily (2003), Eshiamwata et al. (2006) y Kissling et al. (2007) en diferentes zonas tropicales. De acuerdo con los datos obtenidos en campo, los FRGes se ven favorecidos por la simplificación de la cobertura vegetal (baja densidad de árboles, baja altura de los árboles, mayor cantidad de intensidad luminosa y presencia de viento). Recientemente se ha reportado que los FRGes no están estrechamente relacionados con la complejidad estructural de la vegetación (Kissling et al., 2007; Mulwa et al., 2012; Ferger et al., 2013) o con la heterogeneidad paisajística (Kissling et al., 2012). Más bien, los frugívoros responden positivamente a la presencia de árboles frutales (Kissling et al., 2007; Chasar et al., 2014), los cuales muestran gran alternancia en su disponibilidad de frutos durante el año (Wirminghous et al., 2001; Kissling et al., 2009). La distribución aleatoria de los árboles frutales condiciona a que los frugívoros se desplacen por grandes áreas en la búsqueda y obtención de su alimento (Chasar et al., 2014), inclusive haciendo uso de hábitats depauperados con relativa frecuencia (Eshiamwata et al., 2006; Berens et al., 2008).
Al contrario de los FRGes, los FRGsei estuvieron relacionados positivamente con la densidad de los árboles, número de estratos, la altura de los árboles y a mayor humedad relativa del ambiente. La presencia de los FRGsei fue mayor en la SCR (cinco especies y 14 individuos), que en el ECO (dos especies y cinco individuos), mientras que en el POB estuvieron ausentes. La correlación positiva entre los FRGsei y la complejidad estructural de la vegetación también fue observada en la selva tabasqueña (Arriaga-Weiss et al., 2008), en la Península de Yucatán (Leyequién et al., 2014) y en Palenque, Chiapas (Levey et al., 2021). Los FRGsei son altamente sensibles a los cambios en el entorno y tienen mayor probabilidad de ser extirpados localmente ante la fragmentación y la degradación de su hábitat (Lees & Peres, 2008; Sekercioglu, 2012). La pérdida de ciertas especies de árboles no solo condiciona la disponibilidad de fruta durante el año, sino que también influye en las tasas de reproducción de las especies que conforman a los FRGsei (Forshaw & Cooper, 1977).
Granívoros. Los GRNsm estuvieron influenciados positivamente por la reducción en el número de estratos y la baja densidad de los árboles en el ECO y en el POB. En el ECO se registró mayor riqueza y abundancia de especies granívoras que forrajean sobre el suelo y en las malezas (nueve especies y 103 individuos), seguido por el POB (siete especies y 82 individuos). Mientras que, en la SCR únicamente se observó a dos individuos de Arremon aurantiirostris alimentándose de semillas sobre el suelo. En el POB se registró menor número de estratos, menor densidad de árboles y menor altura de los árboles, en comparación con el ECO, aunque en esta última condición ambiental se registró la mayor riqueza y abundancia de GRNsm. Lo anterior probablemente se deba a que en el POB las malezas son podadas mensualmente. Mientras que, el pasto que crece en el ECO no es podado periódicamente y es aprovechado como forraje para el ganado (Donoso et al., 2004). Además, los granívoros que forrajean sobre el suelo y en las malezas fueron observados exclusivamente en los potreros y no del lado de la SCR. De acuerdo con algunas investigaciones, la remoción del estrato arbóreo y arbustivo propicia que el estrato herbáceo se torne dominante (Barlow et al., 2002) y los granívoros aprovechan estas condiciones para alimentarse (Gray et al., 2007; MacGregor & Schondube, 2011). Los GRNsm no son considerados especialistas en la búsqueda de alimento, más bien oportunistas y, en general, tienen baja sensibilidad a la perturbación ambiental (O’Connell et al., 2000; e. g. Columbina talpacoti, Sporophila morelleti, Tiaris olivaceus), particularmente a la perturbación antropogénica (Gray et al., 2007).
Nectarívoros. La presencia de NCT fue más notoria en el POB (nueve especies y 62 individuos) que en el ECO (nueve especies y 37 individuos) y en la SCR (cuatro especies y 19 individuos), sin que las abundancias hayan sido diferentes estadísticamente. La buena representatividad de los NCT en el POB sugiere que este gremio puede usar ambientes simplificados, al menos para alimentarse (Jhons, 1991; Stouffer & Bierregaard, 1995; dos Anjos et al., 1997; Blake & Loiselle, 2001; Watson et al., 2004; Vetter et al., 2011). Además, los NCT responden positivamente a la disponibilidad de recursos florales provenientes de plantas ornamentales y árboles productores de néctar en asentamientos humanos (French et al., 2005; Young et al., 2007). En el POB ciertas especies de plantas fueron cruciales para la presencia de nectarívoros como Spathodea campanulata, Inga spp. e Hibiscus spp. Mientras que, en el ECO y en la SCR los NCT estuvieron influenciados por la abundancia de herbáceas, puntualmente de las heliconias. Estas plantas son comúnmente asociadas con colibríes como Phaethornis longirostris, P. striigularis, y en menor medida Amazilia tzacatl, porque son sus principales polinizadores aviares (Jhons, 1991; Pearman, 2002; Snow & Texeira, 2005).
No obstante, algunas investigaciones sugieren un escenario completamente distinto para los NCT, ya que este gremio estaría estrechamente relacionado con amplios fragmentos selváticos (Pearman, 2002; Arriaga-Weiss et al., 2008), con la complejidad estructural de la vegetación (Arizmendi et al., 2010), y con poca presencia humana (Tejada-Cruz & Sutherland, 2004). Un posible consenso para los NCT es que pueden distribuirse en sitios fragmentados, pero pueden estar ausentes con la remoción completa de vegetación y los recursos florales asociados (Kattan et al., 1994; Renjifo, 1999; Pearman, 2002).
Plasticidad trófica (oportunismo alimentario). La disponibilidad heterogénea de los recursos alimenticios en las zonas tropicales condiciona a que ciertas especies de aves modifiquen su dieta temporalmente o bien, exploren otros tipos de hábitats en busca de alimento (Karr, 1976; Foster, 1977). Hasta hace algunas décadas, se afirmaba que la mayoría de las especies de aves, con afinidad tropical, eran especialistas en la búsqueda y obtención de su alimento (e. g. Poulin et al., 1994). Sin embargo, se ha documentado que las aves pueden presentar un alto grado plasticidad trófica u oportunismo alimenticio (Santamaría-Rivero et al., 2016; Ruíz-Bruce-Taylor et al., 2017). Por ejemplo, los frugívoros complementan su dieta incorporando artrópodos y las especies insectívoras pueden consumir fruta en determinadas estaciones del año (Poulin et al., 1994; Carnicer et al., 2008). Otro ejemplo es la dualidad alimenticia de los nectarívoros, los cuales están adaptados fisiológicamente para la ingesta de néctar, aunque pueden ampliar su dieta consumiendo insectos (Remsen et al., 1986; Poulin et al., 1994).
Asimismo, la avifauna no está restringida a un solo estrato o sustrato en un hábitat determinado. La mayoría de las especies de aves pueden visitar dos o más estratos y utilizar diferentes técnicas de alimentación en cada uno de ellos (Young et al., 2007), dificultando su clasificación gremial (González-Salazar et al., 2014). En este sentido, nuestros datos sugieren que 75 de las 157 especies de aves (47.8 %) no presentaron plasticidad en su dieta (Anexo 2). Lo anterior no significa necesariamente que no pueden explotar otros sustratos u otros recursos alimenticios, simplemente se debe al limitado número de observaciones, ya que 57 especies tuvieron menos de tres comportamientos alimenticios observados. Cuarenta y tres especies (27.2 %) complementaron su dieta con un recurso alimenticio adicional, o bien, explotaron dos sustratos diferentes al alimentarse. Por ejemplo, siete especies de colibríes (70 %) consumieron mayoritariamente néctar, sin embargo, también se les observó cazar insectos, como lo sugieren Remsen et al. (1986), Jhons (1991) y Arizmendi et al. (2010). Por último, 39 especies (25 %) presentaron una amplia plasticidad trófica, haciendo uso indistinto de los estratos presentes o explotando diferentes recursos alimenticios. En este sentido, Dumetella carolinensis, S. petechia, S. magnolia, T. cinereum y Uropsila leucogastra se alimentaron de insectos hasta en cuatro sustratos diferentes. Mientras que, especies como Icterus galbula, Psilorhinus morio, Q. mexicanus y Tiaris olivaceus pueden alimentarse de tres recursos alimenticios sin relación aparente (e. g. insectos, fruta y semillas), como lo harían las especies generalistas (Poulin et al., 1994). Mientras que, los tiránidos (mosqueros) de zonas abiertas y algunos pícidos (carpinteros) enriquecieron su dieta con frutos en la temporada de lluvia (de mayo a septiembre). Al parecer, el cambio alimenticio temporal de estas especies está influenciado por la abundancia y disponibilidad de los recursos frutales (Levey et al., 1984).
La plasticidad trófica puede ser la clave para que un conjunto de especies esté presente en un sitio (Bhagwat et al., 2008). Por el contrario, las especies con dietas específicas o de comportamientos especializados en la captura de presas, tendrán menor probabilidad de adaptarse a los cambios ambientales y extinguirse localmente (Jhons, 1991; Laurance, 2007).
Temporalidad. En las regiones tropicales y subtropicales, la temporalidad dictamina las dinámicas de las comunidades avifaunísticas (Loiselle & Blake, 1991). Dichas fluctuaciones están asociadas a las migraciones locales de las especies en búsqueda de alimento (Symes et al., 2002; Herrera & García, 2009) o a las migraciones estacionales de larga distancia (Poulin et al., 1994; Cox, 2010). No obstante, las migraciones estacionales incrementan sustancialmente la riqueza y abundancia de GT en la región Neotropical (Rangel-Salazar et al., 2009; Ronchi-Virgolini et al., 2013). Por su parte, los recursos alimenticios como las frutas, granos y artrópodos también varían estacionalmente (Loiselle & Blake, 1991; Poulin et al., 1992) y su dominancia está limitada a una o dos temporadas anualmente (Borghesio & Liolo, 2004). En la temporada de lluvias (de mayo a septiembre) los artrópodos alcanzan tamaños poblacionales considerables. Mientras que, los árboles frutales tienen su punto más álgido en la temporada de estiaje (de noviembre a abril; Poulin et al., 1993; Almazán-Núñez et al., 2015).
En este estudio, las comunidades avifaunísticas también variaron de acuerdo con la temporalidad. Las especies de aves migratorias (neotropicales y veraniegas) incrementaron el número de especies que componen los GT en marzo y en menor medida en agosto, particularmente en el ECO (29 especies), y en el POB (27 especies). Las especies migratorias neotropicales que arriban a las zonas boscosas están conformadas en su mayoría por especies insectívoras, aunque pueden incorporar con relativa frecuencia otros elementos a su dieta como néctar, fruta y granos (Nocedal, 1980; González-García, 1993). La alternancia cíclica en las fuentes de alimento conlleva a que los GT se modifiquen constantemente y sean dinámicos (Bailey et al., 2004), por lo que no se debería subestimar la respuesta de las aves a la temporalidad (Loiselle & Blake, 1991).
Conservación. Los bosques primarios y los bosques secundarios tropicales son estructuralmente más complejos que las zonas urbanas, las tierras de cultivo o de pastoreo (Miller et al., 2004). Debido a esta complejidad, la vegetación puede ofrecer mayor número de sustratos, estratos y condiciones ambientales para que las aves afines a estas condiciones puedan distribuirse, reproducirse y alimentarse (Miller et al., 2004). Sin embargo, el ser humano cuenta con un gran potencial de alterar el entorno (Jhons, 1991), reduciendo el espacio físico de los ecosistemas y subsecuentemente alterando la disponibilidad de los recursos alimenticios (Sodhi, 2002; Somasundaram & Vijayan, 2008). Para aquellas especies de aves con baja afinidad a su entorno, los sitios desprovistos de vegetación son hábitats ideales en los cuales pueden alimentarse oportunamente (Bhadwat et al., 2008). Sin embargo, las especies con mayor sensibilidad y baja movilidad requieren de condiciones más específicas para su sobrevivencia (Stouferr & Bierregaard, 1995). Los bosques secundarios o selvas en regeneración pueden cubrir las demandas para estas especies, pero se debe de optar por hábitats más prístinos (Laurance, 2007).
La deforestación y el cambio de uso de suelo en las regiones tropicales desencadenan el aumento de fragmentos selváticos cada vez más pequeños. Estos fragmentos tienen menor probabilidad de sustentar la diversidad biológica y tienen mayor probabilidad de que ocurran extinciones locales (Pearman, 2002). Sin embargo, no solo podríamos perder una gran parte de la diversidad biológica, sino que también se perderán las funciones ecológicas que desarrollan los diferentes grupos taxonómicos en los trópicos (Sekercioglu, 2006; Tscharntke et al., 2008). Fragmentos selváticos asociados a coberturas boscosas, como en el presente estudio, son relevantes para mantener y conservar la diversidad biológica de la región (González-García, 1993; Pineda-Diez et al., 2012) e inclusive son relevantes desde un punto de vista social (De la Maza, 2015).
Limitaciones y recomendaciones. Estudios espacial y temporalmente amplios pueden brindar información más robusta de las fluctuaciones de los GT, así como las variables que afectan (positiva o negativamente) la presencia de los GT (Gray et al., 2007). Debido a la actual contingencia sanitaria provocada por el coronavirus de tipo 2 (SARS-CoV 2), no se muestreó mayo y junio del 2020 y los meses a finales del año. Por lo que el estudio está limitado temporalmente. Una investigación más completa podría comprender un ciclo anual (o varios) e incluir otros tipos de vegetación como selva alta perennifolia, selva mediana perennifolia, tierras de cultivo, otros asentamientos humanos y vegetación ribereña de las cercanías.
El diseño de muestreo también puede influir en la obtención de los datos y su futura interpretación (Hill & Hammer, 2004). Generalmente los muestreos son iniciados minutos antes del amanecer y en pocas ocasiones se efectúan muestreos vespertinos o nocturnos. Probablemente al incrementar los muestreos en estos horarios se obtenga más información de las comunidades avifaunísticas y a su vez de los GT.











 nueva página del texto (beta)
nueva página del texto (beta)



