INTRODUCCIÓN
La dieta es el proceso natural por medio del cual los animales ingieren, digieren y utilizan los nutrientes necesarios en su metabolismo para tener éxito reproductivo y sobrevivir (Ojasti & Dallmeier, 2000; Fuller & Sievert, 2001). Una especie en vida silvestre consume el alimento disponible en el medio donde habita y, por lo tanto, la dieta o alimentación de una especie es el proceso que enlaza los recursos del hábitat con la dinámica de sus poblaciones y es un factor que determina el equilibrio de los ecosistemas (Ojasti & Dallmeire, 2000). Los estudios de dieta permiten comprender las relaciones tróficas en las comunidades bióticas, las funciones ecológicas como la dispersión de semillas (Villalobos et al., 2014; Viteri-Pasch & Mármot-Kattán, 2019), los daños atribuidos a especies que consumen animales domésticos como aves de corral, ganado o cultivos, así como la cantidad y calidad del alimento consumido (Ojasti & Dallmeier, 2000; Cruz-Espinoza et al., 2010).
La abundancia, por otro lado, es un parámetro de las poblaciones que puede variar en función del tiempo y del espacio. Este parámetro es de importancia para muchas especies de fauna silvestre que están sujetas a manejo, conservación o son de importancia en los ecosistemas, debido a que el cálculo de abundancia permite realizar comparaciones poblacionales, dar seguimiento a variaciones temporales y pueden hacer una evaluación indirecta de la calidad del hábitat (Walker et al., 2000; Lira-Torres & Briones-Salas, 2012).
La zorra gris, Urocyon cinereoargenteus Schreber, 1775, es una especie de la familia Canidae que pertenece al nivel trófico de los mesocarnívoros. Es bastante adaptable a las condiciones variables del ambiente en el que vive (Harmsen et al., 2019); regularmente sube a los árboles trepando con ayuda de sus garras semirretráctiles (Fuller & Cypher, 2004; Villalobos et al., 2014). Esta especie se encuentra distribuida ampliamente en el continente americano, desde el sureste de Canadá hasta el norte de Colombia y Venezuela (Fritzell & Haroldson, 1982; Aranda, 2000). En México, es considerada una especie cosmopolita debido que se encuentra en todos los estados del país (Leopold, 1977; Hall, 1982; Fritzell & Haroldson, 1982; Servín et al., 2014). Se reconoce también que puede encontrase en casi cualquier ambiente, incluyendo sitios antropizados de las zonas rurales y urbanas (Fuller, 1978; Novaro et al., 1995; Aranda, 2000).
La dieta de la zorra gris es omnívora, y es considerada de hábitos generalistas y oportunistas debido a la gran variedad y disponibilidad de las especies animales y vegetales de las que se alimenta (Zúñiga et al., 2008; Reid, 2009). En México, son pocas las investigaciones formales que documenten el tipo de alimentación de esta especie, pero en general la dieta de este mamífero se clasifica en materia vegetal, vertebrados terrestres (aves, reptiles y mamíferos) e invertebrados (ortópteros y coleópteros, principalmente; Fritzell & Haroldson, 1982). Dentro de estas investigaciones la dieta suele ser similar en categorías, pero diferente en elementos presa presentes. Por ejemplo, Villalobos et al. (2014) realizaron un estudio en Oaxaca en selva baja caducifolia, en el cual la dieta de U. cinereoargenteus está compuesta por especies vegetales (74.61 %), vertebrados terrestres (60 %) e invertebrados (53.33 %). En el estado de Jalisco en selva baja caducifolia, se obtuvo una dieta compuesta por semillas vegetales (38.16 %), invertebrados (26.97 %) y vertebrados, en particular mamíferos (24.34 %; Guerrero et al., 2002). En otro estudio, en el estado de Baja California Sur, en un matorral sarcocaule, se obtuvo una dieta constituida principalmente por vertebrados terrestres (97.80 %), invertebrados (34.60 %) y materia vegetal (14.8 %) (Arnaud & Acebedo, 1990).
En cuanto a la abundancia relativa de la zorra gris, se conoce de manera general que esta especie es más abundante en sitios con topografía rocosa y con diferentes tipos de vegetación (Servín et al., 2014), y se ha estimado su índice de abundancia relativa (IAR) en la región central del estado de Veracruz a través del registro de excretas en transectos en cañaverales, cafetales de sombra y fragmentos de bosque mesófilo. El IAR más alto para este estudio se presentó en el cañaveral y el más bajo en el bosque mesófilo de montaña (Gallina et al., 2016).
Es importante hacer notar que, a pesar de la amplia distribución de la zorra gris en México, son pocos los estudios que se han realizado sobre esta especie con respecto a su dieta y abundancia a través del registro de excretas y, hasta la fecha, no se tiene un estudio en la región noreste del país. El noreste de México incluye los estados de Coahuila, Nuevo León y Tamaulipas; esta región comprende diversos hábitats, desde zonas áridas del desierto chihuahuense hasta matorral tamaulipeco, pasando por hábitats templados característicos de la Sierra Madre Oriental (Wilson et al., 1985). El noreste de México, al tener una gran variedad de ambientes y algunos con gran diversidad de recursos naturales distintos al centro y sur del país, presenta un potencial de investigación poco explorado para realizar una evaluación de los recursos naturales que estos otorgan como dieta y permiten la presencia de la especie U. cinereoargenteus.
El objetivo de este estudio fue determinar la dieta y abundancia relativa de la zorra gris (U. cinereoargenteus) a través del registro de excretas, en el Área Natural Protegida Altas Cumbres (ANPAC), ubicada en el estado de Tamaulipas, México.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se realizó en el Área Natural Protegida Altas Cumbres (ANPAC), la cual está situada dentro de la provincia fisiográfica de la Sierra Madre Oriental y es parte del estado de Tamaulipas, México; el ANPAC está próxima a Ciudad Victoria, la capital de la entidad, y cuenta con una superficie total de 30,327.85 ha. La precipitación media anual es de 577.0 mm, y los meses con mayor precipitación son de mayo a septiembre (temporada de lluvia) y los de menor precipitación de octubre a abril (temporada de sequía). Esta área cuenta con altitudes que oscilan entre los 450 y 2,100 m, las cuales brindan una gran diversidad de tipos de vegetación como agricultura de riego, agricultura de temporal, bosque de encino, bosque de encino-pino, bosque pino-encino, matorral submontano, pastizal cultivado, pastizal cultivado con agricultura de temporal, selva baja espinosa, y presenta área urbana (INEGI, 2017; Fig. 1). El ANPAC cuenta con una diversidad biológica muy amplia y hasta el momento se tienen registradas 394 especies vegetales, de las cuales nueve son especies de algas, cuatro son líquenes, cuatro son pteridofitas y 340 fanerógamas. En cuanto a fauna silvestre se han registrado 283 especies de vertebrados terrestres, de los cuales 58 % corresponden a aves, 22 % a mamíferos, 14 % son reptiles, 4 % son anfibios y 2 % son peces. Algunas de estas especies son felinos que se encuentran bajo la protección de la Norma Oficial Mexicana 059 (NOM-059) (SEMARNAT, 2010), como Panthera onca, Leopardus pardalis y Leopardus wiedii (Gobierno del Estado de Tamaulipas-Instituto de Ecología Aplicada-UAT, 2014).
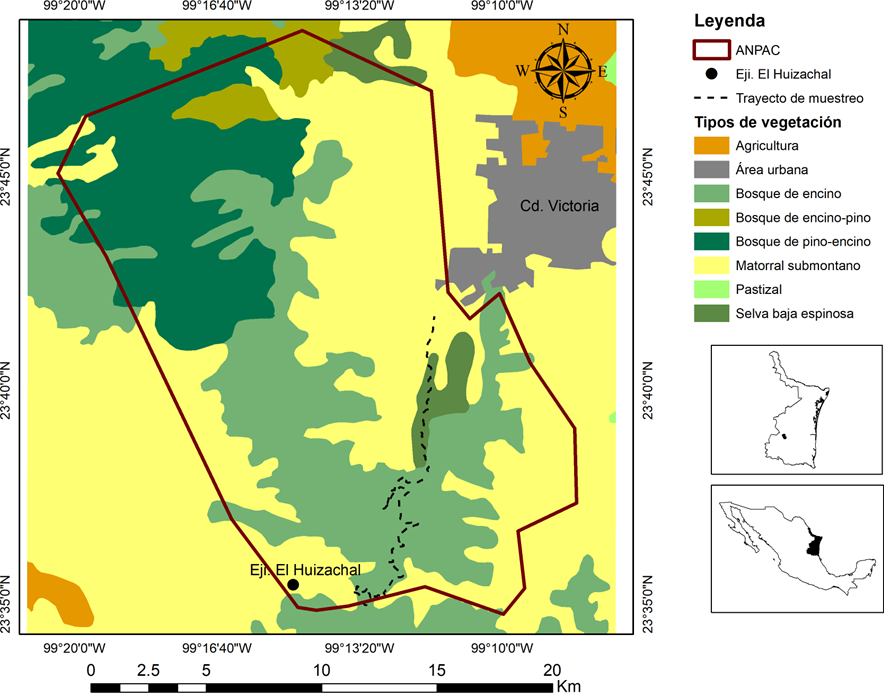
Figura 1 Localización geográfica del Área Natural Protegida Altas Cumbres (ANPAC), Tamaulipas, México y ubicación del transecto donde se realizó la colecta de excretas de la zorra gris (Urocyon cinereoargenteus).
La colecta de excretas se realizó en un transecto de 20.1 kilómetros de longitud, con 6 + 2 m de ancho, localizado en la zona sur del polígono del ANPAC que se encuentra dentro del bosque de encino, selva baja espinosa y matorral submontano (Fig. 1). Este transecto se ubica a dos kilómetros de la mancha urbana de Ciudad Victoria y forma parte de la carretera federal 101 del tramo que conecta a Ciudad Victoria-Tula (13.4 km) y, es parte de un camino rural de terracería que conecta al ejido El Huizachal (6.7 km; Fig. 1). Se eligió este transecto por su fácil acceso y por la abundante cantidad de excretas de zorra gris encontradas.
Trabajo de campo. El muestreo se realizó durante un periodo de 16 meses, de agosto de 2017 a noviembre de 2018. Se llevaron a cabo salidas mensuales para recorrer el transecto y colectar excretas de zorra gris. La búsqueda se realizó sobre la carretera, el filo de la carretera y zonas rocosas. Para lograr identificar las excretas de la especie U. cinereoargenteus se utilizó el manual para el rastreo de mamíferos silvestres de México (Aranda, 2000; Fig. 2). Las excretas se colectaron de forma manual, se guardaron en bolsas de plástico y se etiquetaron con sus medidas, coordenadas geográficas, fecha y lugar de colecta para su transporte y posterior análisis en el laboratorio. Las excretas que no estaban completas no se consideraron en el análisis y se eliminaron de los transectos para facilitar la colecta de los siguientes muestreos.

Figura 2 Excretas de zorra gris (Urocyon cinereoargenteus) con semillas de la palma de la sierra madre (Brahea berlandieri) y ubicadas sobre la carretera del Área Natural Protegida Altas Cumbres (ANPAC), Tamaulipas. Del lado derecho se observan las hojas de B. berlandieri.
La identificación de los componentes presa presentes en las excretas se realizó mediante el procedimiento propuesto por Korschgen (1987) y citado por Zúñiga et al. (2008). Cada una de las muestras colectadas fueron secadas por 48 horas a temperatura ambiente, luego se colocaron en una malla de lycra y nailon, y se sumergieron en un recipiente con una solución a base de agua y detergente comercial por dos horas. Posteriormente, las excretas fueron lavadas a chorro de agua directo para eliminar la materia fecal. Los materiales resultantes o componentes presa de las excretas fueron secados nuevamente para facilitar su manipulación. Una vez secas, las excretas se colocaron en una charola y se separaron los componentes que comparten características similares como huesos, pelos, plumas, materia vegetal (semillas y restos de plantas), restos de invertebrados, conchas u otra característica en común (Zúñiga et al., 2008). La determinación de estos componentes se realizó al nivel taxonómico más específico posible.
Para realizar la identificación de la materia vegetal, las semillas y restos de plantas, se cotejó con ejemplares de la colección científica de plantas arborizadas del estado de Tamaulipas que se encuentra en el Herbario UAT "Francisco González Medrano" del Instituto de Ecología Aplicada de la Universidad Autónoma de Tamaulipas (UAT). Para la identificación de mamíferos y aves se recurrió a investigadores expertos del Instituto de Ecología Aplicada de la Universidad Autónoma de Tamaulipas y al Instituto Tecnológico de Ciudad Victoria. La identificación de los invertebrados se realizó con base en los restos encontrados y comparados con ejemplares de colecciones científicas del Instituto Tecnológico de Ciudad Victoria.
Para cuantificar la importancia de las presas identificadas en cada excreta de zorra gris, se utilizaron como estimadores la frecuencia de aparición (FA) y el porcentaje de aparición (PA; Maehr & Brady, 1986).
La frecuencia de aparición se obtuvo utilizando la siguiente fórmula: FA = f/n X 100. En donde f = número de veces en las que aparece la especie presa, y n = es el número total de excretas analizadas.
El porcentaje de aparición (PA) se obtuvo con la fórmula: PA = fi/f1 X 100, donde: fi = número de veces en las que aparece la presa i y f1 = es la suma de las apariciones de todos los elementos presa de todas las excretas. Este último valor expresa qué presas son utilizadas con mayor frecuencia por la especie objetivo (Maehr & Brady, 1986; Aranda, 2000).
Mediante una prueba no paramétrica de PERMANOVA se determinó si hubo diferencias significativas en las frecuencias de consumo de presas en la dieta entre las temporadas de lluvia (mayo a septiembre) y sequía (octubre a abril). Esta comparación se realizó debido a que las diferencias climáticas pueden influir en la disponibilidad de recursos en el ANPAC.
La amplitud de nicho de la zorra gris, que indica que tan especializada es su dieta, se determinó con el índice estandarizado de Levins (Best; Krebs, 1999) a través de la fórmula Best = (B-1)/n-1, en donde B = 1/Σ Pi 2 y Pi = proporción de individuos encontrados en el recurso i. Este índice expresa la amplitud de nicho en una escala de 0 a 1, en donde valores menores a 0.60 indican que la especie es especialista y valores superiores la consideran generalista o que utiliza un número elevado de presas sin tener preferencia por alguna en particular (Krebs, 1999).
Con el número de excretas colectadas, se calculó el índice de abundancia relativa (IAR) para la zorra gris en el ANPAC. Este índice es obtenido a partir del número de excretas encontradas mensualmente y dividido entre el total de la distancia recorrida (Silveira et al., 2003): IAR = Número de excretas/kilómetros recorridos (unidad de esfuerzo). Mediante una prueba no paramétrica de U de Mann-Whitney se realizó una comparación de la abundancia relativa de la zorra gris entre las temporadas de lluvia y sequía.
RESULTADOS
Análisis de la dieta de la zorra gris. Con un total de 938 excretas analizadas de la zorra gris, se determinó que la dieta de esta especie está conformada principalmente por tres categorías; materia vegetal (PA = 83.71 %), invertebrados (PA = 13.36 %) y vertebrados (PA = 2.92 %). Respecto a la materia vegetal se logró identificar 10 especies, las más representativas son la Brahea berlandieri, también conocida como palma de la sierra madre (PA = 18.24 %), Litsea glaucescens o laurel de la sierra (PA = 10.80 %), Diospyros texana o chapote negro (PA = 10.09 %) y Diospyros palmeri o chapote manzano (PA = 9.56 %). Entre los invertebrados, las presas de mayor consumo fueron las del Orden Miriapoda (FA = 20.58 %) y de los vertebrados el Orden Rodentia (FA = 8.64 %; Cuadro 1).
Cuadro 1 Frecuencia de aparición (FA) y porcentaje de aparición (PA) de los elementos presa presentes en la dieta de la zorra gris (Urocyon cinereoargenteus) del Área Natural Protegida Altas Cumbres (ANPAC), Tamaulipas, México.
| Elementos presa | FA | PA | |
|---|---|---|---|
| N = 938 | F1 = 3629 | ||
| Materia vegetal | Fi | ||
| Brahea berlandieri | 662 | 70.58 | 18.24 |
| Litsea glaucescens | 392 | 41.79 | 10.80 |
| Diospyros texana | 366 | 39.02 | 10.09 |
| Diospyros palmeri | 347 | 36.99 | 9.56 |
| Prosopis sp. | 281 | 29.96 | 7.74 |
| Opuntia sp. | 259 | 27.61 | 7.14 |
| Annona globiflora | 236 | 25.16 | 6.50 |
| Leucaena sp. | 211 | 22.49 | 5.81 |
| Helianthus annuus | 185 | 19.72 | 5.10 |
| Smilax sp. | 99 | 10.55 | 2.73 |
| Invertebrados | |||
| Miriapoda | 193 | 20.58 | 5.32 |
| Pyrgomorphidae | 154 | 16.42 | 4.24 |
| Acrididae | 138 | 14.71 | 3.80 |
| Vertebrados | |||
| Rodentia | 81 | 8.64 | 2.23 |
| Turdidae | 25 | 2.67 | 0.69 |
Con respecto a la dieta de la zorra gris en las dos temporadas, se analizaron 406 excretas durante los meses de lluvia y 532 en los meses de sequía (Cuadro 2). Los resultados de la dieta muestran que la materia vegetal tiene los más altos porcentajes en ambas temporadas (PA = 84.7 % lluvia; PA = 82.93 % sequía). Los invertebrados presentaron porcentajes de aparición menor (PA = 12.7 % lluvia; PA = 13.86 % sequía), y por último los vertebrados (PA = 2.6 % lluvia; PA = 3.2 % sequía). Los resultados de la prueba de PERMANOVA indicaron que no hubo diferencias significativas en el consumo de las presas entre las dos temporadas del año (F = 1.98; p > 0.05). Entre las presas de materia vegetal, B. berlandieri fue la mejor representada en ambas temporadas. Entre los invertebrados fue el Orden Miriapoda, y entre vertebrados el Orden Rodentia (Cuadro 2).
Cuadro 2 Frecuencia de aparición (FA) y porcentaje de aparición (PA) de los elementos presa presentes en la dieta de la zorra gris (Urocyon cinereoargenteus) durante la temporada de lluvia y sequía del Área Natural Protegida Altas Cumbres (ANPAC), Tamaulipas, México.
| Temporada | ||||
|---|---|---|---|---|
| Lluvia | Sequía | |||
| FA | PA | FA | PA | |
| Elementos presa | n = 406 | F1 = 159 | n = 532 | F1 = 2034 |
| Materia vegetal | ||||
| Brahea berlandieri | 76.4 | 19.4 | 66.17 | 17.31 |
| Diospyros palmeri | 42.6 | 10.8 | 32.71 | 8.55 |
| Litsea glaucescens | 40.9 | 10.4 | 42.48 | 11.11 |
| Diospyros texana | 37.9 | 9.7 | 39.85 | 10.42 |
| Prosopis sp. | 30.0 | 7.6 | 29.89 | 7.82 |
| Opuntia sp. | 29.1 | 7.4 | 26.50 | 6.93 |
| Annona globiflora | 23.4 | 6.0 | 26.50 | 6.93 |
| Leucaena sp. | 21.9 | 5.6 | 22.93 | 6.00 |
| Helianthus annuus | 20.0 | 5.1 | 19.55 | 5.11 |
| Smilax sp. | 10.6 | 2.7 | 10.53 | 2.75 |
| Invertebrados | ||||
| Miriapoda | 19.5 | 5.0 | 21.43 | 5.60 |
| Pyrgomorphidae | 16.3 | 4.1 | 16.54 | 4.33 |
| Acrididae | 14.3 | 3.6 | 15.04 | 3.93 |
| Vertebrados | ||||
| Rodentia | 7.1 | 1.8 | 9.77 | 2.56 |
| Turdidae | 3.0 | 0.8 | 2.44 | 0.64 |
Por otro lado, el índice de amplitud de nicho (Índice Estandarizado de Levins) en la dieta de la zorra gris durante la temporada de lluvia fue de Best = 0.63 y en la sequía de Best = 0.61. Ambos resultados muestran que se comportó como una especie generalista en el consumo de sus presas y se asume que la especie consume un gran número de presas sin tener preferencia por alguna en particular.
Análisis de la abundancia de la zorra gris. El índice de abundancia relativa (IAR = número de excretas/km) para la zorra gris en el ANPAC fue variable y la abundancia fue mayor durante el primer mes de muestreo (agosto de 2017) con un IAR de 7.91, y el más bajo se encontró en el mes de octubre de 2017 (IAR = 0.9; Fig. 3). La prueba de U de Mann-Whitney mostró evidencia de que existieron diferencias significativas entre las temporadas de lluvia y sequía (W = 8; p = 0.01); el promedio del IAR para la temporada de lluvia fue 2.58 y el de la temporada de sequía fue 3.34.
DISCUSIÓN
La dieta de la zorra gris en el ANPAC está constituida principalmente por materia vegetal (PA = 83.71 %), invertebrados (PA = 13.36 %) y vertebrados (PA = 2.92 %); estas categorías son similares a las descritas en otros estudios (Arnaud & Acebedo, 1990; Novaro et al., 1995; Guerrero et al., 2002; Villalobos et al., 2014; Viteri-Pasch & Mármot-Kattán, 2019). Sin embargo, la mayoría de las especies presa que se identificaron dentro de cada categoría fueron diferentes a las descritas en los trabajos citados.
En la categoría de la materia vegetal, la especie presa mejor representada en la dieta de la zorra gris, tanto en temporada de lluvia como de sequía, fue la palma de la sierra madre (B. berlandieri; Cuadro 2). Esta planta es endémica del noreste de México, se restringe a los bosques de encino de la Sierra Madre Oriental (Quero, 2004), y está sujeta a protección especial de acuerdo con la norma NOM-059 (SEMARNAT, 2010). La segunda especie más importante que se identificó en la dieta fue el laurel de la sierra (L. glaucescens; Cuadro 1), una planta que se encuentra en peligro de extinción (SEMARNAT, 2010). Es una especie forestal no maderable y con un aprovechamiento alto en México, ya que puede ser utilizada en la medicina o como condimento en la alimentación y tiene potencial industrial en la perfumería (Luna-Vega, 2003; Hernández-Flores & Vargas-Licona, 2020). El chapote negro y manzano formaron parte de la dieta en tercer y cuarto lugar, respectivamente, y aunque en menor porcentaje la Annona globiflora, Leucaena sp., Helianthus annuus y Smilax sp. (Cuadro 1) también estuvieron presentes. Es importante destacar que ninguna de estas especies vegetales se había registrado como parte de la dieta para la zorra gris en estudios anteriores (Arnaud & Acebedo, 1990; Novaro et al., 1995; Guerrero et al., 2002; Villalobos et al., 2014; Viteri-Pasch & Mármot-Kattán, 2019). En el caso específico de los géneros Prosopis y Opuntia identificados en este estudio, ya se habían registrado como parte de la dieta de la zorra en los trabajos de Arnaud & Acebedo (1990) y Guerrero et al. (2002).
La razón del porque la zorra gris se alimenta de presas vegetales distintas a otros estudios puede deberse a que algunas de las especies que consume solo limitan su distribución al noreste de México, por ejemplo; B. berlandieri (Quero, 2004) o Diospyros texana (García et al., 2015) y, por otro lado, también influye el tipo de vegetación donde se realizaron los estudios de dieta. En el ANPAC, las excretas se obtuvieron en bosque de encino, selva baja espinosa y matorral submontano (Fig. 1), Arnaud y Acebedo (1990) las obtuvieron en matorral sarcocaule, Novaro et al. (1995) en bosques de hoja ancha, bosques de palmeras y pantanosos, Guerrero et al. (2002) en bosque tropical caducifolio y manglares, Villalobos et al. (2014) en selva baja subcaducifolia, Gómez-Ortiz et al. (2015) en bosque de encino, pino-encino y selva baja, y Viteri-Pasch y Mármot-Kattán (2019) en bosques de pino-encino. Aunado a lo anterior, también se puede considerar que la disponibilidad de la palma y el laurel sea alta en el ANPAC. Aunque no hay estudios ecológicos que muestren esta evidencia, existe información que describe que la palma es utilizada por los habitantes locales para elaborar adornos y artesanías (Pulido & Coronel-Ortega, 2015), mientras que el laurel se utiliza como condimento en la alimentación. Además, la zorra gris se caracteriza por ser una especie generalista y oportunista que consume presas abundantes y de fácil acceso (Leopold, 1977; Fritzell & Haroldson, 1982; Guerrero et al., 2002).
La zorra gris, al tener una dieta constituida principalmente por materia vegetal en el ANPAC (PA = 83.71 %), puede llegar a ser una especie con un rol ecológico importante en el ecosistema funcionando como dispersor de semillas. Aunque en este estudio no se comprobó su importancia como dispersor, Villalobos et al. (2014) en la costa de Oaxaca comprobaron que el paso de las semillas por el tracto digestivo de la zorra gris incrementó la velocidad y el porcentaje de la germinación en especies de Byrsonima crassifolia, Ehretia tinifolia y nanche montés. Se sugiere que en el ANPAC se analice y evalúe la viabilidad de semillas, sobre todo de B. berlandieri y L. glaucescens, debido a que se encuentran en alguna categoría de protección y la zorra gris, al alimentarse de ellas, puede tener un efecto positivo en la germinación, contribuyendo con ello en el mantenimiento, regeneración y conexión entre las poblaciones vegetales.
Por otro lado, los invertebrados y vertebrados se registraron en porcentajes bajos en la dieta de la zorra gris (Cuadro 1), y los órdenes que se describen son similares que en otros trabajos (Arnaud & Acevedo, 1990; Guerrero et al., 2002; Villalobos et al., 2014; Viteri-Pasch & Mármot-Kattán, 2019), a excepción de la familia Turdidae que no se había registrado como parte de la dieta de la zorra gris. Adicionalmente, se esperaba que la dieta de la zorra gris estuviera compuesta por alimentos característicos de las zonas urbanas, debido a que el transecto que se muestreo se localiza a dos kilómetros de la mancha urbana de Ciudad Victoria (Fig. 1). Sin embargo, los análisis de este estudio no mostraron evidencia de la presencia de restos de animales domésticos, de basura o alguna especie vegetal asociada a las zonas urbanas. La ausencia de este tipo de alimentos puede ser un indicador de que en el ANPAC los recursos alimentarios silvestres son suficientes para mantener a la zorra gris en condiciones naturales.
De manera general, la dieta de la zorra gris en el ANPAC fue constante a lo largo del muestreo y no se encontraron diferencias significativas al comparar la dieta entre las temporadas de lluvia y sequía; esto pude explicarse porque algunas especies vegetales consumidas por la zorra tienen periodos de fructificación en ambas temporadas. Por ejemplo, las semillas de B. berlandieri se registraron en este estudio en toda la temporada de lluvia (mayo-septiembre), pero también estuvieron presentes en altos porcentajes en los meses de octubre a marzo que corresponden a la temporada de sequía. De acuerdo con la literatura, los frutos de D. palmeri y D. texana se presentan de abril a octubre y pueden extenderse hasta diciembre (Treviño et al., 2001); en este estudio se registraron de abril a enero. En el caso de A. globiflora y Leucaena sp., sus frutos pueden estar presentes durante 10 meses al año (Vidal & Martínez, 2006), y en este estudio se registraron de marzo a diciembre, aunque los mayores porcentajes se presentaron en temporada de lluvia.
Los resultados del índice de amplitud de nicho mostraron que la zorra gris en el ANPAC es considerada una especie generalista en ambas estaciones del año, lo que significa que se alimenta de una gran variedad de especies presa sin preferir alguna en particular. Este comportamiento le confiere ventajas en su supervivencia, ya que no depende de un solo tipo de presa y posiblemente se alimente de las más abundantes y disponibles. Otros autores han corroborado también que la zorra gris es un cánido con comportamiento generalista en su dieta (Guerrero et al., 2002; Zúñiga et al., 2008; Reid, 2009), aunque en otras zonas se ha reportado con una amplitud especialista intermedia entre los carnívoros tope especialistas y los mesocarnívoros generalistas (Gómez-Ortiz et al. 2015).
El índice de abundancia para la zorra en el ANPAC fue variable (intervalo de IAR de 0.9 a 7.91 número de excretas/km; Fig. 3) y los resultados de algunos meses fueron mayores en comparación a lo que se ha registrado para bosques mesófilos de montaña (IAR de 4 a 6), e inferiores a los que se obtuvieron en cafetales (IAR de 8 a 16) y cañaverales de un estudio realizado en el centro de Veracruz (IAR de 8 a 18; Gallina et al., 2016). El IAR de la zorra en el ANPAC no se comparó entre los tres tipos de vegetación debido a la cercanía que hay entre ellos (Fig. 1), la diferencia en la longitud de los transectos en cada tipo de vegetación y debido a que la mayoría de las excretas se colectaron en el bosque de encino (862 muestras), mientras que en la selva baja espinosa se obtuvieron 58 y en el matorral submontano solo 18. Es probable que el mayor número de excretas de zorra en el bosque de encino se deba a que en este tipo de vegetación se encuentran las poblaciones de B. berlandieri (Quero, 2004).
Por otro lado, considerando el número de excretas que se colectaron en este estudio, las de zorra gris fueron más abundantes en comparación a las de otros carnívoros. Durante el periodo de muestreo se lograron colectar solo dos excretas de L. pardalis y tres de Canis latrans (coyote), este número bajo de excretas puede indicar que la abundancia de estas especies es baja. Algunos autores que han estudiado la competencia que hay entre los mesocarnívoros como coyote, lince y zorra gris, mencionan que existe una relación negativa entre la abundancia de los coyotes y la zorra (Fedriani et al., 2000), es decir, que cuando la abundancia de alguna especie es alta, la de la otra es baja o ausente.
La abundancia relativa de la zorra gris entre las temporadas de lluvia y sequía mostró diferencias significativas y la abundancia fue mayor durante la temporada de sequía. Esta diferencia se puede atribuir a que durante las lluvias se encontró un menor número de excretas, probablemente debido a que el escurrimiento del agua eliminó algunas excretas y, al tratarse de una carretera con asfalto para el paso de vehículos, la probabilidad de que se formen corrientes de agua y se desintegren las excretas es mayor.
En conclusión, la zorra gris presentó hábitos generalistas y se alimentó principalmente por materia vegetal; las presas de mayor consumo fueron B. berlandieri y L. glaucescens, especies que se caracterizan por estar sujetas a protección especial y en peligro de extinción, respectivamente. La abundancia relativa de la zorra gris, por otro lado, se considera abundante y esta fue mayor durante la temporada de sequía











 nueva página del texto (beta)
nueva página del texto (beta)




