INTRODUCCIÓN
El playero arenero Calidris alba (Charadriiformes: Scolopacidae) (Pallas, 1764) es un migrante boreal que habita las zonas marinas y humedales costeros del continente americano (Morrison, 1984). Se reproduce en el norte del continente y migra hacia el sur el resto del año en busca de climas más cálidos (Rappole et al., 1993; García-Olaechea et al., 2018). Tiene una conocida predilección por ambientes cercanos a la línea de rompeolas y zonas de rompientes de olas donde cubren sus necesidades básicas de reposo y alimentación (Ruiz-Guerra, 2004). Es abundante principalmente en la temporada de primavera-verano y es visto frecuentemente en los humedales costeros del Pacifico, uno de ellos es el Humedal Costero Poza de la Arenilla (HCPA), ubicado en el distrito de la Punta, Callao, Perú (Podestá et al., 2017; García-Olaechea et al., 2018).
La longitud del cuerpo desde la punta del pico hasta la punta de la cola de C. alba es de entre 19 y 21 cm (Schulenberg et al., 2010). Posee un plumaje claro con una línea blanca acentuada en las alas, cobertores alares menores negros y la parte dorsal posee lentejuelas negras. El plumaje juvenil es similar al básico de la etapa adulta, y el plumaje alterno tiene la parte dorsal y el pecho de rojo intenso (Sardón, 2017).
Calidris alba está clasificado como una especie de preocupación menor (BirdLife Internacional, 2016), sin embargo, es una especie de gran preocupación debido a la tendencia de la disminución de la población, la pérdida de su hábitat y el incremento del nivel del mar debido al cambio climático (Payne, 2010). Galbraith et al. (2014) predijeron el efecto del cambio climático en las aves playeras; el playero arenero depende del recurso alimenticio que proveen los huevos del cangrejo herradura, invertebrado marino que puede verse afectado por los cambios de temperatura que modifican el tiempo de eclosión de sus huevos, interrumpiendo la sincronicidad entre las puestas de huevos y la migración de C. alba en primavera. La familia Scolopacidae se encuentra también en el apéndice II del listado de especies con un estado de conservación desfavorable por la Convención sobre la Conservación de las Especies Migratorias de Animales Silvestres, (Convention on the Conservation of Migratory Species of Wild Animals [CMS], 2015).
Actualmente se reconocen diferentes patrones del comportamiento del playero arenero en estado silvestre: forrajeo, acicalamiento, correr y dormir, etc. Sin embargo, esta información es escasa (Gray, 2006). Resulta importante identificar los diferentes patrones de comportamiento de una especie a través de la elaboración de etogramas y de estudios básicos cuantitativos motores que están relacionados con la salud y el estado psicológico de los individuos en condiciones naturales y que pueden verse modificados por los diferentes impactos ambientales. Esto proporciona herramientas para el manejo y conservación in situ de la especie estudiada (Porto & Piratelli, 2005; Ibáñez & Iannacone, 2011), principalmente frente a los cambios y presiones que sufren los ecosistemas de esta región (Carazas et al., 2015), en especial de origen antrópico. Además, en condiciones in situ los comportamientos relacionados al estrés responden a la alteración del hábitat por la actividad humana, aunque el estrés aumenta en condiciones de encierro y cautiverio (Griggio & Hoy, 2006; Córdova-Rojas & Iannacone, 2011). Debido a esto, este trabajo tiene como objetivo elaborar el etograma y caracterizar cada uno de los patrones registrados del comportamiento de la especie migratoria C. alba en el HCPA, La Punta, Callao, Perú. Esta información servirá para identificar comportamientos entre individuos de una misma población, lo cual genera gastos energéticos y afecta sus patrones de comportamiento.
MATERIALES Y MÉTODOS
Área de estudio. El Humedal Costero Poza de la Arenilla está ubicado en la orilla sur del distrito de La Punta, Provincia Constitucional del Callao, entre las coordenadas geográficas 12° 04’ 50.32’’ S, 77° 09’ 15’’ O y 12° 04’ 18.39’’ S, 77° 09’ 40.65’’ O (Fig. 1). Este humedal costero posee una profundidad no mayor de 2 m., lo cual facilita el ingreso de luz de manera directa e impulsa el crecimiento de la flora acuática y, por ende, facilita la supervivencia de diferentes organismos agrupados en todos los niveles de la cadena trófica como aves, peces y crustáceos (Sánchez Rivas et al., 2014). En los últimos años, las diferentes construcciones en el área para diversas actividades turísticas modificaron el paisaje; a la fecha el HCPA es una zona de aguas litorales semiestancadas formada por dos rompeolas que encierran un remanso de agua que se pobló de organismos acuáticos con 14 zonas (biotopos) (Troll, 2000), actualmente diferenciada en 11 zonas (Cotillo et al., 2018).

Figura 1 Área de Estudio. A) Ubicación del país. B) Ubicación de la Provincial Constitucional del Callao. C) Ubicación del Humedal Costero Poza de la Arenilla, La Punta, Callao. Se muestra la ubicación de Calidris alba en tres zonas: O.A.1, C.R.1 y O.A.2.
Método de observación. Para la identificación de los tipos de comportamiento del playero arenero, se efectuaron observaciones in situ del 29 de agosto al 30 de septiembre del 2019, siendo 12 días de evaluación y en horarios de marea media y baja. Las observaciones de los comportamientos se realizaron en tiempo real y mediante videograbaciones, y se tomaron fotografías de los comportamientos observados. Los periodos de observación tuvieron una duración de 10 min., llevándose a cabo varias observaciones de 600 seg. (10 min.) a lo largo del día, haciendo el seguimiento de un individuo focal sin distinción de sexo y sin tomar en cuenta su edad. En cada periodo se siguieron y registraron datos de un individuo diferente. El total de individuos focales evaluados fue de 67. La técnica utilizada fue el muestreo focal, la cual consiste en una observación exhaustiva del comportamiento de un individuo en una población (Hämäläinen et al., 2016).
La ubicación del observador fue enfrente de la población de aves a una distancia máxima de 30 m. desde una zona de orilla, de tal modo que el observador no sea detectado por el ave. Estudios previos mostraron que a distancias menores a 15 m. se incrementan los comportamientos extraños en el animal, los cuales pueden ser considerados comportamientos influenciados por algún tipo de presencia o comportamiento extraño a este grupo (Maruyama et al., 2010). El o los individuos a ser observados fueron seleccionados al azar. Se eligió el mes de septiembre para realizar las observaciones y la elaboración del etograma debido a que estudios previos han determinado que en esas fechas se presenta la llegada de los playeros areneros en periodo no reproductivo (Torres et al., 2006; Podestá et al., 2017, Cotillo et al., 2018). Las sesiones no excedieron cinco horas cada día, durante horas de la mañana y tarde, especialmente en periodos de marea media y baja, escenario ideal para la presencia de aves playeras (Carmona et al., 2003). Estas sesiones fueron realizadas por un equipo de tres personas, los cuales realizaron diferentes funciones: registros (apuntes), control del tiempo, uso de binoculares y, para reducir la perturbación de los observadores, se empleó ropa de camuflaje. Para el registro de fotografías (como apoyo de las observaciones) y videos se utilizó una cámara DSRL Nikon D300S. Cada video de 10 min. fue verificado y analizado para una mejor identificación de los comportamientos de las aves.
Elaboración del etograma. Para la elaboración del etograma, los comportamientos fueron identificados y definidos en C. alba a partir de los datos cualitativos y cuantitativos obtenidos de todas las observaciones (con una duración total de 40,200 seg.) realizadas previamente, y fueron comparados con comportamientos registrados en otros estudios de aves, siendo agrupados además en las categorías propuestas por dichos estudios: descanso, forrajeo, vuelo, locomoción, acicalamiento, baño, alerta y social agonístico (Rivadeneyra et al., 2000; Gray, 2006; Iannacone et al., 2012; Bonifaz et al., 2017; Da Silva et al., 2018). La mayoría de los tipos de comportamientos identificados y adaptados en el playero arenero fueron propuestos por el autor de este artículo, así como sus definiciones (Cuadro 1). Para la elaboración de las ilustraciones de cada comportamiento fueron documentados previamente en campo por observación directa y posteriormente dibujados en una libreta de registro con la ayuda de videograbaciones realizadas en campo, para luego esquematizarlas digitalmente y presentarlas en el presente trabajo, las cuales muestran de manera ilustrativa cada tipo de comportamiento.
Cuadro 1 Etograma de los comportamientos observados en Calidris alba. Ts= Tiempo de observación (segundos).
| Nº | Categorías de comportamiento | Descripción de la conducta | Código | Ts |
|---|---|---|---|---|
| Descanso | ||||
| 1 | Descanso | Tipo de descanso donde el ave permanece sobre sus patas. | D | 5394 |
| 2 | Descanso con pico entre las alas | Comportamiento donde el ave permanece sobre sus dos patas y el pico oculto en el dorso entre las dos alas. | DPEA | 6031 |
| 3 | Descanso sobre una pata | El ave permanece sobre una pata. | D1P | 1131 |
| 4 | Descanso con pico entre las alas sobre una pata | El ave permanece sobre una pata y el pico oculto en el dorso entre las dos alas. | DPEA1P | 1932 |
| 5 | Descanso sobre sustrato | Comportamiento donde el ave permanece sobre el sustrato. | DS | 285 |
| 6 | Descanso con pico entre las alas sobre sustrato | Forma de descanso en donde el ave mantiene el pico oculto entre las alas en la parte del dorso mientras permanece sobre el sustrato. | DPEAS | 210 |
| Forrajeo | ||||
| 7 | Búsqueda de alimento | El ave realiza una pequeña inclinación del cuerpo hacia adelante en busca de alimento durante el forrajeo. | BA | 391 |
| 8 | Picoteo | Es la actividad propia de alimentación donde el ave introduce el pico sobre el sustrato de manera pausada y continua. | P | 2957 |
| 9 | Sondeo | Esta actividad es propia de la alimentación introduciendo el pico completo por debajo del ojo sobre el sustrato por un periodo de tiempo corto y/o prolongado. | S | 902 |
| Vuelo | ||||
| 10 | Vuelo corto | El ave vuela de un lado a otro durante poco tiempo dentro de la zona de estudio. | Vc | 410 |
| 11 | Vuelo largo | El ave vuela por un periodo largo de tiempo por fuera de la zona de estudio y, puede regresar o no a la zona de estudio. | Vl | 2211 |
| 12 | Asentamiento | Este comportamiento se genera al terminar el vuelo cuando el ave se acerca al suelo. | A | 183 |
| Locomoción | ||||
| 13 | Caminar | El ave se desplaza lentamente de un lado a otro, esta conducta puede cubrir cortas y grandes distancias. | Ca | 3763 |
| 14 | Corretear | En este comportamiento el ave se desplaza de manera rápida de un lado a otro, este puede cubrir cortas y grandes distancias. | Co | 5381 |
| 15 | Saltar con dos patas | El ave da un salto por encima del suelo sobre sus dos patas, esta conducta puede realizarse con un desplazamiento horizontal. | Sa | 44 |
| 16 | Saltar con una pata | El ave da un salto por encima del suelo con una pata levantada, este comportamiento puede realizarse con un desplazamiento horizontal. | Sa1P | 266 |
| 17 | Saltar con dos patas y aleteo | Salto con el cuerpo completo elevado y agitación de alas. | SaAl | 601 |
| 18 | Saltar con una pata y aleteo | Salto con el cuerpo completo elevado, con una pata levantada y agitación de alas. | Sa1Pal | 40 |
| 19 | Caminar en círculo | El ave desarrolla una caminata con una distancia corta de forma circular. | CC | 35 |
| 20 | Despliegue de alas | El ave inclina el cuerpo hacia adelante con las alas erguidas hacia arriba mientras mantiene las patas estiradas sobre el suelo. | Da | 405 |
| Acicalamiento | ||||
| 21 | Acicalamiento con el pico en el ala izquierda | Comprende el acicalamiento del ave con el pico en diferentes lugares del ala del lado izquierdo. | AcPiAliz | 559 |
| 22 | Acicalamiento con el pico en el ala derecha | Este tipo de conducta comprende el acicalamiento del ave con el pico en diferentes lugares del ala del lado derecho. | AcPiAlde | 481 |
| 23 | Acicalamiento con el pico en ala izquierda sobre una pata | Este comportamiento es el acicalamiento con el pico en el ala izquierda y, con una pata levantada. | AcPiAliz1P | 11 |
| 24 | Acicalamiento con el pico en ala derecha sobre una pata | Comprende también el acicalamiento con el pico en el ala derecha y, con una pata levantada. | AcPiAlde1P | 36 |
| 25 | Estira ala derecha y estira pata derecha | El ave se inclina levemente hacia adelante a poca distancia del suelo y, estira completamente el ala del lado derecho y levanta la pata del mismo lado haciendo un movimiento rígido en posición horizontal. | EAldeEpde | 9 |
| 26 | Estira ala izquierda y estira pata izquierda | En este comportamiento el ave se inclina levemente hacia adelante a poca distancia del suelo y, estira completamente el ala del lado izquierdo y levanta la pata del mismo lado haciendo un movimiento rígido en posición horizontal. | EAlizEpiz | 28 |
| 27 | Sacude cabeza | Esta conducta comprende la sacudida fuerte de la cabeza. | SaC | 101 |
| 28 | Sacude cuerpo completo | El ave sacude fuertemente el cuerpo. | SaCC | 377 |
| 29 | Sacude parte trasera del cuerpo | En este comportamiento el ave sacude fuertemente la parte trasera del cuerpo (la cola) y hace una elevación pronunciada durante un corto periodo de tiempo. | SaPTC | 71 |
| 30 | Sacude alas | Sacudida fuerte de las alas. | SaAl | 356 |
| 31 | Aleteo | Movimiento rápido de las alas de un lado hacia otro mientras el ave permanece sobre sus dos patas sin desplazarse. | Al | 185 |
| 32 | Acicalamiento con el pico en el pecho | El ave permanece sobre sus dos patas e inclina su cabeza en dirección al pecho y realiza su acicalamiento. | AcPiPE | 1017 |
| 33 | Acicalamiento con el pico en el pecho sobre una pata | En este comportamiento el ave permanece sobre una pata e inclina su cabeza en dirección del pecho y realiza el acicalamiento con una pata levantada. | AcPiPE1P | 21 |
| 34 | Acicalamiento con el pico en el cuello | El ave está sobre sus dos patas e inclina su cabeza en dirección al cuello y realiza el acicalamiento. | AcPiCu | 115 |
| 35 | Acicalamiento con el pico en el cuello sobre una pata | El ave está permanece sobre una pata e inclina su cabeza en dirección al cuello y realiza el acicalamiento. | AcPiCu1P | 58 |
| 36 | Acicalamiento con el pico entre las alas | El acicalamiento es en la parte del dorso entre las dos alas. | AcPiEalas | 653 |
| 37 | Acicalamiento con el pico entre las alas sobre una pata | El ave se acicala en la parte del dorso entre las dos alas mientras mantiene una pata levantada. | AcPialas1P | 6 |
| 38 | Acicalamiento de la cola con el pico | El ave gira la cabeza en dirección a la cola y acicala las plumas de la parte posterior. | AcCoPi | 348 |
| 39 | Fricción de la cabeza con el dorso | El ave frota la cabeza en sentido lateral sobre el dorso. | FCD | 39 |
| 40 | Fricción de la cabeza en el pecho | El ave frota la cabeza sobre el pecho en sentido lateral. | FCP | 3 |
| 41 | Rascar la cabeza con pata izquierda | Aquí la pata rasca o acomoda la pluma de la cabeza con la pata izquierda. | RaCaPiz | 240 |
| 42 | Rascar el cuello con pata izquierda | La pata rasca o acomoda las plumas de la zona del cuello del ave entre la cabeza y el pecho. | RaCuPiz | 107 |
| 43 | Rascar la cabeza con pata derecha | Aquí la pata rasca o acomoda la pluma de la cabeza con la pata derecha. | RaCaPde | 136 |
| 44 | Rascar el pico con pata izquierda | La pata rasca el pico con la pata izquierda. | RPPI | 13 |
| 45 | Limpieza del pico en ala izquierda | El ave pasa el pico lateral y alternadamente varias veces de derecha a izquierda sobre el ala izquierda. | LPAI | 30 |
| 46 | Limpieza del pico en ala derecha | El ave pasa el pico lateral y alternadamente varias veces de derecha a izquierda sobre el ala derecha. | LPAD | 17 |
| 47 | Limpieza del pico con ala estirada izquierda | El ave pasa el pico lateral y alternadamente varias veces de derecha a izquierda sobre el ala estirada. | LPAEI | 6 |
| 48 | Limpieza del pico en el dorso | El individuo pasa el pico lateral y alternadamente varias veces de derecha a izquierda sobre el dorso. | LPD | 30 |
| 49 | Limpieza del pico en el pecho | el individuo pasa el pico lateral y alternadamente varias veces de derecha a izquierda sobre el dorso. | LPP | 256 |
| Baño | ||||
| 50 | Baño cabeza | El ave introduce la cabeza en el agua durante un periodo de tiempo. | BC | 946 |
| 51 | Baño cuerpo completo | El ave introduce la cabeza y el cuerpo en el agua durante un periodo de tiempo. | BCC | 462 |
| 52 | Sacudir cuerpo en el agua | El ave sacude fuertemente el cuerpo completo en el interior del agua. | SaCua | 125 |
| 53 | Sacudir cola en el agua | En este comportamiento el ave sacude fuertemente la parte posterior del cuerpo (la cola) y hace una elevación pronunciada durante un corto periodo de tiempo. | SaCoa | 43 |
| 54 | Baño lateral izquierda | El ave realiza una inclinación del lado izquierdo del cuerpo introducido en el agua. | BLI | 131 |
| 55 | Baño lateral derecha | El ave realiza una inclinación del lado derecho del cuerpo introducido en el agua. | BLD | 57 |
| Alerta | ||||
| 56 | Centinela | El ave muestra el cuello erguido hacia arriba mirando hacia su alrededor. | C | 491 |
| 57 | Centinela sobre una pata | El ave muestra el cuello erguido hacia arriba y mira a su alrededor mientras se mantiene sobre una pata. | C1p | 1 |
| Social agonístico | ||||
| 58 | Agresión entre dos individuos | Esta conducta comprende la pelea entre dos individuos. | AI | 63 |
Análisis estadístico. Se construyó una curva de acumulación según el método de Mao Tao (Colwell et al., 2004) para determinar si los comportamientos registrados representan una alta proporción de los comportamientos totales que pueden mostrar los individuos de C. alba, es decir, para verificar si el esfuerzo de muestreo fue adecuado.
Por otro lado, los comportamientos y tipos de comportamiento se expresaron en porcentaje de ocurrencia con la finalidad de determinar cuáles son los comportamientos más frecuentes.
RESULTADOS
La curva de acumulación mostró que el esfuerzo de muestreo empleado ha permitido detectar la gran mayoría de comportamientos existentes a través de la formación de una asíntota (Fig. 2). En total fueron observados e identificados 58 tipos de comportamientos (Cuadro 1) agrupados en ocho categorías: descanso, forrajeo, vuelo, locomoción, acicalamiento, baño, alerta y social agonístico. Cada categoría presentó un tiempo total en segundos con el siguiente orden: descanso 14,983, locomoción 10,535, acicalamiento 5,309, forrajeo 4,250, vuelo 2,804, baño 1,764, alerta 529 y social agonístico (conducta que comprende la agresión entre dos individuos) 63 seg.
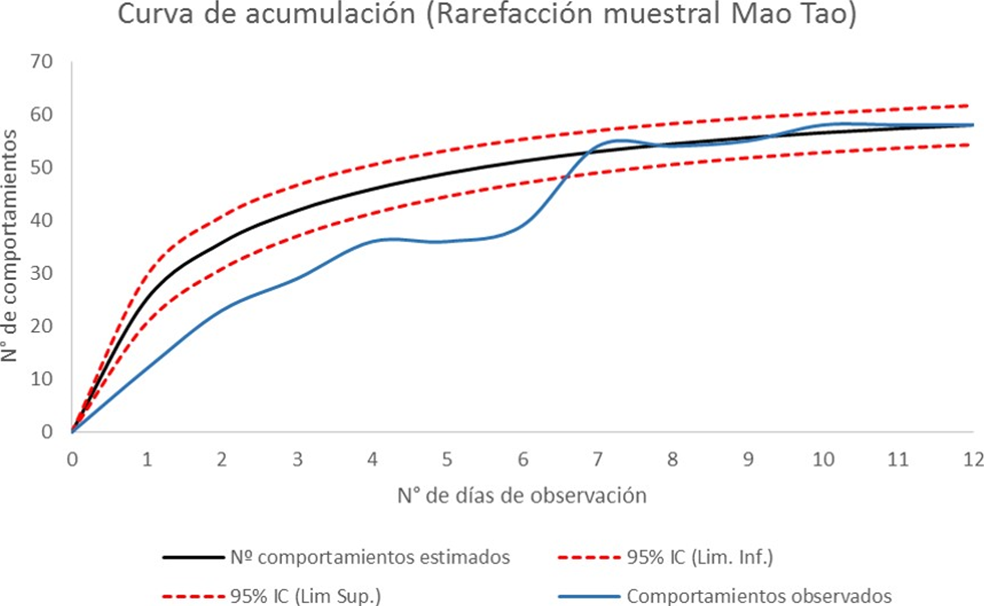
Figura 2 Curva de acumulación de los patrones de comportamiento de Calidris alba. La curva azul (sin ajustar) corresponde al número de comportamientos acumulados a lo largo de los días de evaluación. La curva negra está ajustada según el método de Mao Tao. Las curvas punteadas rojas corresponden a los intervalos de confianza (IC) al 95%.
Estos resultados muestran un total de 40,200 segundos entre todas las conductas registradas. De las ocho categorías de comportamiento asignadas se observó la siguiente secuencia (en orden porcentual decreciente) respecto al orden total del tiempo de observación: descanso (37 %), locomoción (26 %), acicalamiento (13 %), forrajeo (11 %), vuelo (7 %), baño (5 %), alerta (1 %) y social agonístico menos de 1 % (Fig. 3A).
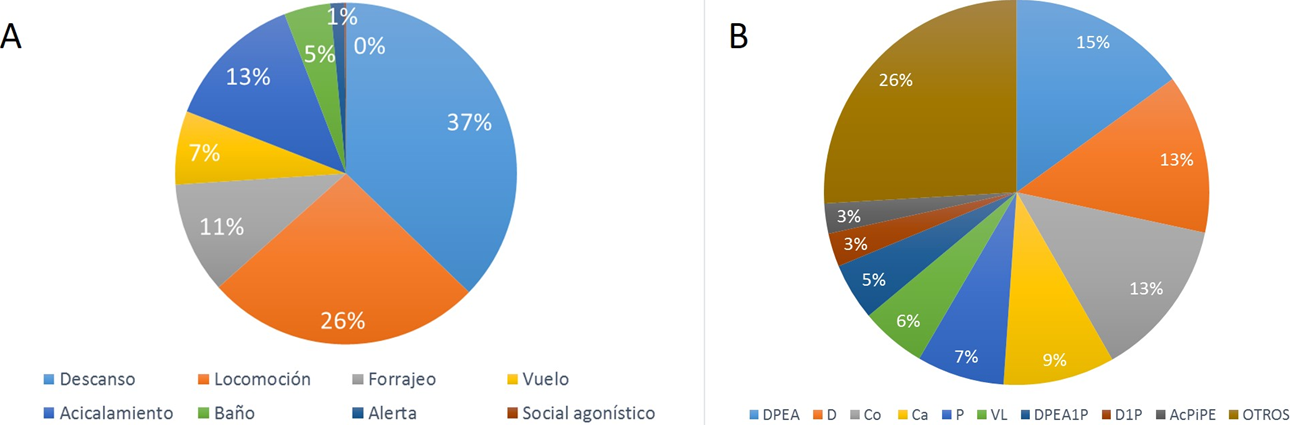
Figura 3 A) Gráfico de frecuencia de categorías de comportamiento observados en Calidris alba. B) Gráfico de frecuencia de tipo de comportamientos observados en C. alba. DPEA: descanso con pico entre las alas; D: descanso; Co: corretear; Ca: caminar; P: picoteo; Vl: vuelo largo; DPEA1P: descanso con pico entre las alas sobre una pata; D1P: descanso sobre una pata; AcPiPE: acicalamiento con el pico en el pecho.
Se encontró que de acuerdo con el tiempo total de observación C. alba realizó los siguientes nueve comportamientos específicos: descanso con pico entre las alas (15 %), descanso (13 %), corretear (13 %), caminar (9 %), picoteo (7 %), vuelo largo (6 %), descanso con pico entre las alas sobre una pata (5 %), descanso sobre una pata (3 %) y acicalamiento con el pico en el pecho (3 %); los otros comportamientos ocuparon el 26 % del total (Fig. 3B). Adicionalmente, se realizaron ilustraciones como apoyo visual para identificar los comportamientos descritos en C. alba (Fig. 4A-H).
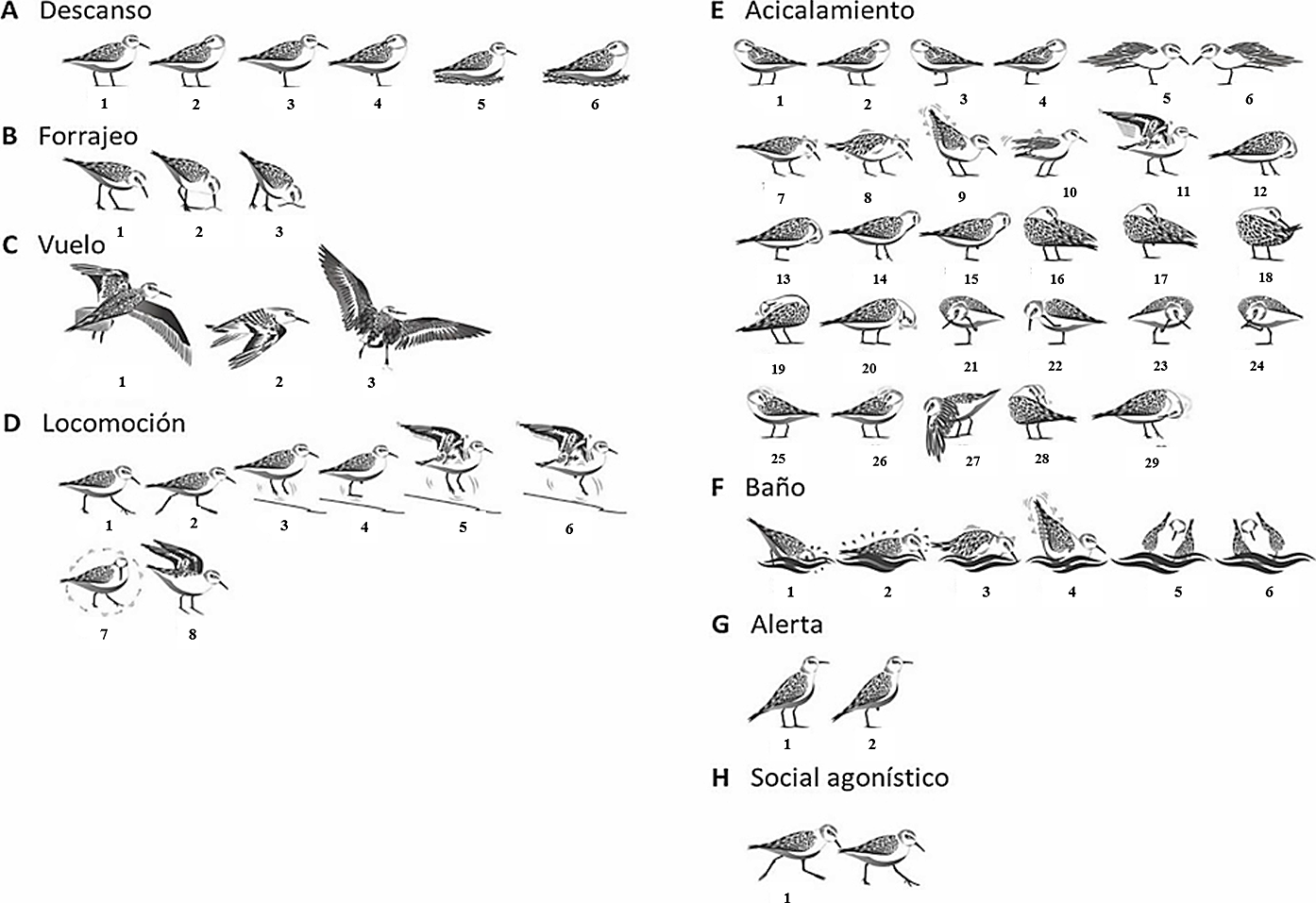
Figura 4 Etograma de los comportamientos observados en Calidris alba. A) Descanso: (1) Descanso; (2) Descanso con pico entre las alas; (3) Descanso sobre una pata; (4) Descanso con pico entre las alas sobre una pata; (5) Descanso sobre sustrato; (6) Descanso con pico entre las alas sobre sustrato. B) Forrajeo: (1) Búsqueda de alimento; (2) Picoteo; (3) Sondeo. C) Vuelo: (1) Vuelo corto; (2) Vuelo largo; (3) Asentamiento. D) Locomoción: (1) Caminar; (2) Corretear; (3) Saltar con dos patas; (4) Saltar con una pata; (5) Saltar con dos patas y aleteo; (6) Saltar con una pata y aleteo; (7) Caminar en círculo; (8) Despliegue de alas. E) Acicalamiento: (1) Acicalamiento con el pico en el ala izquierda; (2) Acicalamiento con el pico en el ala derecha; (3) Acicalamiento con el pico en ala izquierda sobre una pata; (4) Acicalamiento con el pico en ala derecha sobre una pata; (5) Estira ala derecha y estira pata derecha; (6) Estira ala izquierda y estira pata izquierda; (7) Sacude cabeza; (8) Sacude cuerpo completo; (9) Sacude parte trasera del cuerpo; (10) Sacude alas; (11) Aleteo; (12) Acicalamiento con el pico en el pecho; (13) Acicalamiento con el pico en el pecho sobre una pata; (14) Acicalamiento con el pico en el cuello; (15) Acicalamiento con el pico en el cuello sobre una pata; (16) Acicalamiento con el pico entre las alas; (17) Acicalamiento con el pico entre las alas sobre una pata; (18) Acicalamiento de la cola con el pico; (19) Fricción de la cabeza con el dorso; (20) Fricción de la cabeza en el pecho; (21) Rascar la cabeza con pata izquierda; (22) Rascar el cuello con pata izquierda; (23) Rascar la cabeza con pata derecha; (24) Rascar el pico con pata izquierda; (25) Limpieza del pico en ala izquierda; (26) Limpieza del pico en ala derecha; (27) Limpieza del pico con ala estirada izquierda; (28) Limpieza del pico en el dorso; (29) Limpieza del pico en el pecho. F) Baño: (1) Baño cabeza; (2) Baño cuerpo completo; (3) Sacudir cuerpo en el agua; (4) Sacudir cola en el agua; (5) Baño lateral izquierda; (6) Baño lateral derecha. G) Alerta: (1) Centinela; (2) Centinela sobre una pata. H) Social Agonístico: (1) Agresión entre dos individuos.
DISCUSIÓN
El descanso (37 %) fue el comportamiento más empleado por C. alba en este humedal costero, lo que concuerda con la importancia de estos ambientes para el reposo y la alimentación de aves residentes y migratorias (Blanco, 1999). Estudios realizados en humedales con aves de hábitos en su mayoría nocturnos, mostraron que los comportamientos realizados durante el día por aves Charadriiformes son la alimentación y el descanso, mientras que el resto de tiempo es empleado en otras actividades, con un tiempo corto dedicado al acicalamiento (Mcneil et al., 1992). Sin embargo, otros estudios muestran al acicalamiento como una categoría predominante en otras aves del mismo orden taxonómico como Recuvirostra americana (Gmelin, 1789) (Boettcher et al., 1994; Martrenchar et al., 1999). Además, el acicalamiento forma parte importante del aseo como despulgamiento y despiojado, actuando en la línea de defensa contra los ectoparásitos (Weeks et al., 1995; Maier, 2001; Mooring et al., 2004; Tingle et al., 2003).
La locomoción (26 %) es una categoría de comportamiento que indica relajamiento, lo cual va en la misma línea que el comportamiento de descanso, el cual es una categoría de comportamiento aparentemente de relajamiento en otras especies (Iannacone et al., 2012). Por otra parte, la locomoción y el forrajeo son dos categorías de comportamientos cruciales para C. alba; existe un gasto de energía en la exploración para la captura de sus presas (Zweers & Gerritsen, 1996; Gutiérrez, 1998). Esto sugiere que la locomoción y el forrajeo estarían relacionados a categorías de comportamiento que no indican relajación en C. alba, como lo han propuesto otros autores (Iannacone et al., 2012), sino más bien de mucha actividad energética. Por ejemplo, en situaciones de estrés ante la presencia humana se demuestra que comportamientos como caminar y correr resultan en un escape ante actividades humanas (Blankestijn et al., 1986; Ramos Alarcón & Pisconte Vilca, 2021).
El forrajeo (11 %) es un comportamiento observado en la mayoría de los individuos de C. alba y se encuentra ubicado en cuarto lugar de las categorías con mayor tiempo empleado en este estudio. Estudios realizados en calidrinos pequeños: Calidris alpina (Linnaeus, 1758), Calidris mauri (Cabanis, 1857), Calidris pusilla (Linnaeus, 1766) y Calidris minutilla (Vieillot, 1819), revelan que la alimentación está condicionada por las horas diurnas. Blanco y Villavicencio (2017) sugieren que las especies de escolopácidos, en este caso C. alba, prefieren alimentarse durante el día a pesar del gasto de energía que esto implica. Sin embargo, Nebel et al. (2005) mostraron que la luz del día no es un factor decisivo para la alimentación de estas aves ya que, de acuerdo con sus resultados, el forrajeo se realiza con más frecuencia durante horas de la noche. También, condiciones ambientales como el cambio de marea y el clima influyen en las aves para suplir sus alimentos durante el horario diurno (Colwell & Dodd, 1997; Conklin & Colwell, 2007). Por ejemplo, en datos obtenidos en la bahía de Fundy, Canadá, otra especie de la misma familia C. pusilla emplea estrategias de alimentación nocturna para lo cual aprovecha periodos de bajamar debido al poco tiempo empleado durante el día para dicha actividad (MacDonald et al., 2012). La hipótesis preferencial señala también que la alimentación de los calidrinos durante la noche sirve para no exponerse a depredadores a la luz del día y para aprovechar el comportamiento nocturno de algunas de sus presas en las planicies intermareales (McNeil et al., 1992). El acicalamiento (13 %) es la categoría de comportamiento con más patrones de comportamiento identificados (29) (Fig. 4c).
Si bien es cierto que el número de patrones de comportamiento identificados para esta categoría es el más alto, esto no indica que el tiempo empleado en el acicalamiento sea el más alto. Por ejemplo, Giraldo y Botero (2017) atribuyen el acicalamiento a una categoría de comportamiento relacionado al post forrajeo (alimentación) en patos de torrente. Este comportamiento se observó también en C. alba, principalmente en orillas arenosas y roquedales, áreas donde esta especie desarrolla esta actividad tiempo después de alimentarse (Cotillo et al., 2018). Esta tendencia también se observa con otras categorías de comportamientos y forrajeo de C. alba. Otros autores señalan el acicalamiento como un patrón cíclico de aseo en las aves, de cuidado y atención de la superficie del cuerpo (Ruiz-Guerra, 2004; Iannacone, 2006; Nonato-Mamani & Iannacone, 2011). Calidris alba utiliza zonas con características de dormidero donde descansa y comparte patrones de comportamiento con el acicalamiento (Ruiz-Guerra, 2004). El acicalamiento está relacionado también a eventos de estrés de aves marinas y mamíferos terrestres, algo que ocurre también con aves playeras (Henson et al., 2011, Mooring et al., 2004). El amplio repertorio de este comportamiento registrado en este estudio en zonas cercanas al disturbio o la actividad humana también podría estar relacionado al tránsito de personas que desarrollan actividades de pesca en uno de los roquedales de la zona adyacente a la zona de cantos rodados (zona pedregosa) y extractores de invertebrados marinos y algas en zonas cercanas a una de las orillas de este humedal costero (Cotillo et al., 2018), además de personas que ingresan a zonas cercanas donde se realizaron estos muestreos. Otro punto notable es que en algunas aves se correlaciona positivamente con bajas temperaturas y altas humedades ambientales (Henson et al., 2007; Iannacone et al., 2012), características ambientales que se cumplen en la Arenilla. De igual manera, el alto número de conductas de acicalamiento también puede relacionarse con humedades por encima del 80 % y temperaturas por encima de los 20 °C en los meses evaluados (agosto-setiembre, 2019) en el Callao, al tiempo que se mantiene el aislamiento térmico del plumaje, lo cual es una condición adecuada para su estadía en este humedal costero. Podestá et al. (2017) atribuyen la ausencia de aves playeras (como C. alba) en la temporada de verano en zonas claves en el humedal debido a la afluencia masiva de público y actividades antropogénicas. Esto sumado a los niveles altos de marea que hace que diferentes especies pierdan zonas específicas de descanso (Blanco et al., 2012; Giner & Perez-Emán, 2015; Senner et al., 2017).
Social agonístico (1 %) es una categoría con un tipo de comportamiento (agresión entre dos individuos) con un bajo porcentaje de tiempo empleado en el periodo de estudio, resultados similares han sido identificados en Burhinus superciliaris (Tschudi, 1843) y Molothrus bonariensis (Gmelin, 1789), donde no sobrepasan más de dos conductas (Porto & Piratelli, 2005; Iannacone et al., 2012). El uso del hábitat determina la frecuencia de interacciones agonísticas en aves playeras, afectando la frecuencia de las tasas de alimentación (Isola et al., 2000). Otro factor relacionado al espacio es la abundancia en un espacio reducido, lo cual puede acortar la distancia interindividual aumentando tensiones y agresiones entre individuos de una población (Recher, 1969; Tripp & Collazo, 1997). El tiempo reducido mostrado en el comportamiento social agonístico por C. alba podría estar relacionado a la abundancia de la población y el uso del hábitat en este humedal y, más aún, a la metodología aplicada en el presente estudio: muestreo focal, donde se realiza el seguimiento exhaustivo de un individuo de la población. Otro factor importante relacionado a interacciones agonísticas es la estrategia a la hora de alimentarse. Recher y Recher (1969) han indicado que las aves que se alimentan con técnicas visuales son más agresivas de las que utilizan técnicas táctiles. Por ejemplo, en Calidris fuscicollis (Vieillot, 1819) se observó el uso de la técnica táctil para conseguir su alimento en comparación con otra especie de charadriido (D’Amico et al., 2004), esta técnica también es usada por C. alba en su búsqueda de alimento, lo cual generaría una baja interacción intraespecífica (Barbosa, 2019).
De las ocho categorías de comportamiento consideradas en el presente estudio, es notable que el 87 % de los comportamientos corresponden a cuatro de esas categorías: descanso, locomoción, acicalamiento y forrajeo (Fig. 3a). Debido a que C. alba es una especie gregaria que conforma grupos muy grandes, se espera que comportamientos orientados a disminuir el riesgo de depredación, como la postura de alerta, no sean demasiado frecuentes. Esto es confirmado por nuestros resultados que muestran que sólo el 1 % del tiempo es empleado en dicha categoría de comportamiento, la principal estrategia orientada a disminuir el riesgo de depredación en esta especie es el efecto de dilución, lo que permite una mayor cantidad de tiempo disponible para otras actividades vitales (Fernández-Juricic & Tran, 2007). Sin embargo, en otros estudios realizados para conocer los patrones de comportamiento de diferentes especies como Huerequeque, el comportamiento de alerta se encuentra en segundo lugar entre las categorías de comportamiento más importantes (con un 28.3 %), mientras que categorías de relajamiento como la locomoción se encuentra en tercer lugar; esto puede estar relacionado al tipo de lugar y espacio donde se encuentran los individuos estudiados y el grado de amenaza que pueden afectar su comportamiento (Ibáñez & Iannacone, 2011; Iannacone et al., 2012). Otro estudio realizado en Minas Gerais muestra que en Vanellus chilensis (Molina, 1782) el comportamiento de alerta (31.67 %) se ubica en primer lugar, lo cual se debe al grado de presión antropogénica y riesgo de depredación (Beauchamp, 2003; Maruyama et al., 2010), esto muestra la importancia por conservar estos ecosistemas ante posibles amenazas, lo cual podría tener un cambio sustancial en poblaciones de aves, involucrando a los diferentes actores, entre ellos, los tomadores de decisiones.
Por otro lado, en el caso de los comportamientos desagregados (es decir, todos los comportamientos sin agrupar dentro de las categorías establecidas), de un total de 58, nueve representan el 74 % del tiempo total de observación (Fig. 3b). Los nueve comportamientos específicos (descanso con pico entre las alas, descanso, corretear, caminar, picoteo, vuelo largo, descanso con pico entre las alas sobre una pata, descanso sobre una pata y acicalamiento con pico en pecho) corresponden a las cuatro categorías más frecuentes (descanso, locomoción, acicalamiento y forrajeo). De esta manera, tanto las frecuencias por categorías como las de los comportamientos específicos sin agrupar muestran la misma tendencia. Este trabajo contiene el primer etograma que detalla y define cada tipo de comportamiento para C. alba en el Perú. Por otro lado, muestra la variedad de tipos de comportamientos para esta especie, facilita su identificación y ayuda a comprender su funcionalidad, así como a plantear hipótesis acerca de esta. Continuar con estudios de investigación en la etología de C. alba es fundamental para ampliar el repertorio de los patrones de su comportamiento, aportando información para la identificación de patrones relacionados al estrés y relajamiento de esta especie, lo cual servirá para su conservación. El presente estudio puede servir también como modelo para otras investigaciones en etología animal, enfocadas especialmente en el grupo de aves y por concerniente en aves playeras.











 nueva página del texto (beta)
nueva página del texto (beta)



