INTRODUCCIÓN
Entender cómo se estructuran las comunidades ecológicas y como varía su diversidad y composición en el tiempo y espacio en paisajes heterogéneos permitirá identificar sitios importantes para la conservación y restauración de bosques. Uno de los ecosistemas que son prioritarios para la conservación por su diversidad y presencia de especies endémicas, pero también por su importancia en los ciclos hidrológicos y de nutrientes, son los bosques de montaña (CONABIO, 2010). Los bosques tropicales de montaña en Mesoamérica, son el segundo más importante hot spot de biodiversidad para el mundo (Myers et al., 2000), son reconocidos por su alto endemismo (Renjifo et al., 1997), pero son uno de los ecosistemas más amenazados (Kappelle & Brown, 2001). Esta amenaza es debido al cambio en el uso del suelo para áreas de uso agrícola, pastoreo, tala para leña y uso forestal y crecimiento urbano (Stattersfield et al., 1998), pero también por cambios naturales como tormentas tropicales, incendios y plagas forestales.
Las aves desempeñan un importante papel en la dinámica y funcionalidad de los ecosistemas (Şekercioḡlu, 2006; Sohdi et al., 2011), y estudiarlas ha permitido entender procesos ecológicos y funcionales (Şekercioḡlu, 2006). En estos bosques de montaña se concentra una alta diversidad de especies de aves, en México, el 47% de las especies en el país se distribuyen en estos bosques (Navarro-Singüenza et al., 2014). Las aves son un grupo taxonómico que ha sido modelo para identificar áreas prioritarias de conservación e implementar estrategias de conservación y manejo (Navarro-Sigüenza et al., 2011).
La pérdida de cobertura forestal en Chiapas se estimó que para un lapso de casi 20 años (1990-2009) fue de 2,202 km2, y la degradación forestal (cobertura menor al 30%) ascendió a 7,693 km2 (Paz et al., 2010). Particularmente, en el Parque Nacional Lagunas de Montebello (PNLM, en adelante) Chiapas, que es reconocido por la belleza escénica de sus lagos, aún resguarda remanentes característicos de bosques de montaña. Con el decreto del parque en 1959, se creó una frontera de conservación en donde las localidades aledañas se vieron limitadas en el aprovechamiento de sus recursos naturales. Pero durante el periodo del 2005 al 2009, la poligonal del parque (6,425 ha) presentó una transformación de su masa forestal de 43 hectáreas (33.9%), por el aumento del cultivo de maíz y café (Jiménez-Cruz & Pulido-Argüello, 2009). A pesar de estos cambios en el área, poca información se ha generado sobre los cambios y variaciones en las comunidades avifaunísticas. Rangel-Salazar et al. (2009), estudiaron la comunidad de aves en el PNLM en diferentes condiciones de perturbación y encontraron que el sitio más perturbado no presentó la mayor riqueza, pero si la menor diversidad de aves. Nuestra predicción fue que la riqueza, diversidad y composición de especies de aves presentarán una variación de acuerdo con el tipo de vegetación, y también habrá una variación temporal. Este tipo de análisis son una herramienta útil que además de tener un enfoque de conservación, evalúa los cambios en los ambientes naturales y perturbados (Toledo, 1994). En este estudio el objetivo fue evaluar la variación espacial y temporal de la diversidad y composición de aves en diferentes tipos de vegetación en el Parque Nacional Lagunas de Montebello, Chiapas, México. Esto permitirá la formulación de estrategias de manejo con los pobladores de las comunidades aledañas al parque, para continuar con las actividades productivas de la región pero que mitiguen la transformación de estos ecosistemas.
MATERIALES Y MÉTODOS
Zona de estudio. El Parque Nacional Lagunas de Montebello está localizado en la región sur-sureste del estado de Chiapas, en la frontera con Guatemala. Sus coordenadas extremas son 16° 09’ 31’’ y 16° 04’ 48’’ Latitud Norte y 91° 47’ 39’’ y 91° 38’ 39’’ Longitud Oeste (Fig. 1). Presenta una extensión territorial de 6,425 ha en su poligonal y una zona de influencia con una superficie de 8,530 ha que incorpora 13 comunidades humanas mexicanas y guatemaltecas (CONANP, 2007). En el Parque Nacional Lagunas de Montebello se encuentran bosques de pino, pino-encino y pino-encino-liquidambar, como tipos de vegetación dominantes. En menor proporción se encuentra el bosque mesófilo de montaña. También existen numerosos cuerpos de agua, áreas inundables de popal-tular y en la periferia, áreas agrícolas, huertos familiares, cafetales, pastizales inducidos por la acción del ganado o fuego y asentamientos humanos (CONANP, 2007).
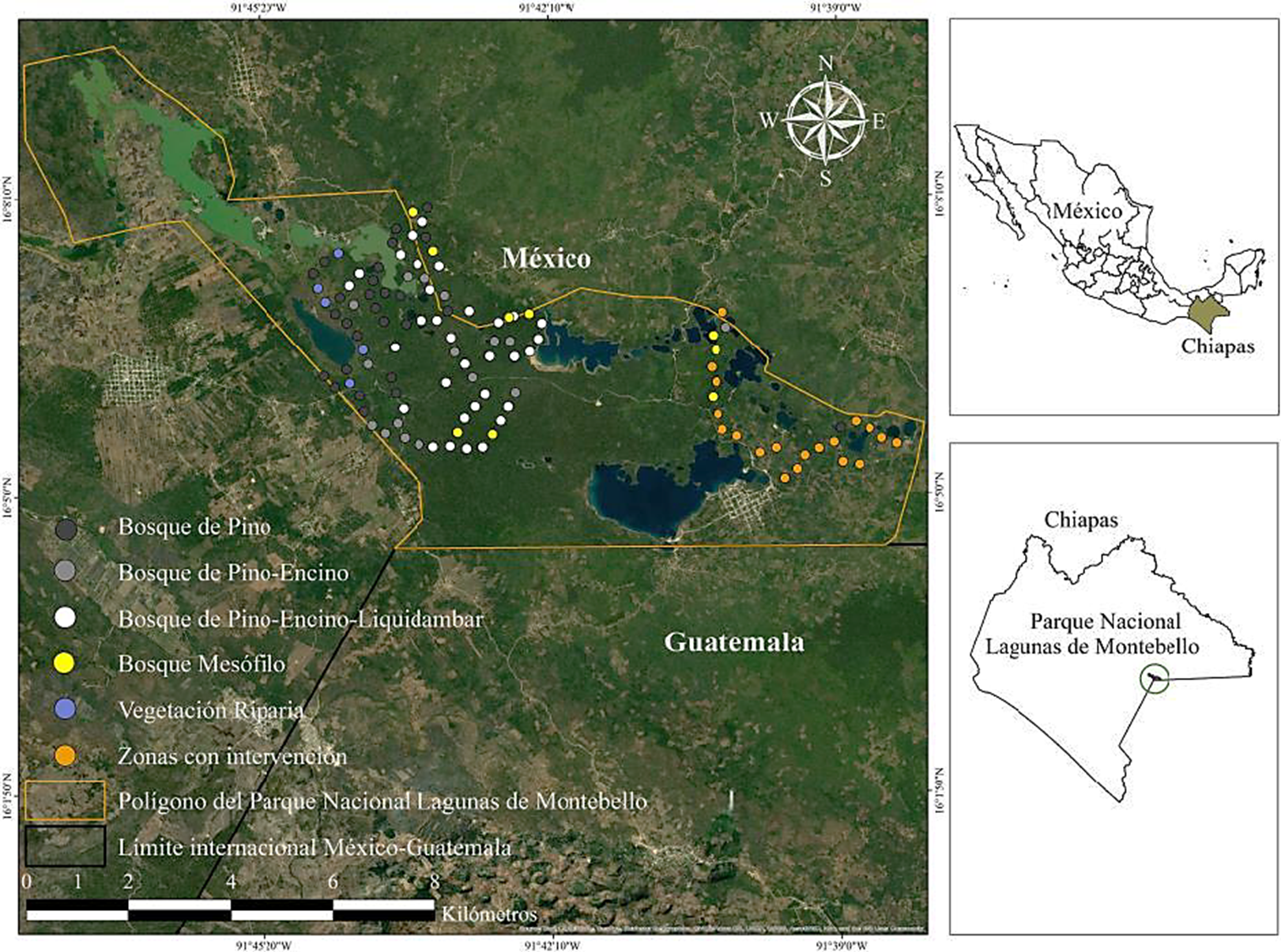
Figura 1 Localización geográfica del Parque Nacional Lagunas de Montebello, Chiapas y de los puntos de conteo por tipo de vegetación.
Diseño del muestreo. Se recorrieron senderos o caminos rurales para establecer los puntos de muestreo e identificar los tipos de vegetación. Las características que se consideraron fueron sitios accesibles, de recorrido seguro, y tener los permisos con las autoridades institucionales del parque y ejidales correspondientes. Inicialmente se establecieron 116 unidades de muestreo separadas entre sí por 300 m, las cuales estuvieron distribuidas en 10 senderos de longitud variable. La distancia entre unidades (puntos de conteo) es la distancia sugerida para permitir independencia en los registros (Hutto et al., 1986; Ralph et al., 1996). Durante el muestreo, seis puntos tuvieron que ser eliminados por razones de seguridad. Las unidades de muestreo se agruparon de acuerdo con las características de la vegetación: 28 unidades en bosque de pino (BP); 17 en bosque de pino-encino (BPE); 32 en bosque de pino-encino-liquidambar (BPEL); 5 en vegetación riparia (VR); 9 en bosque mesófilo de montaña (BMM) y 19 en zonas con intervención (ZI; Fig. 1). La vegetación dominante en el área son los bosques de pino, pino-encino y pino-encino-liquidambar, y a continuación se describe cada uno de estos bosques. Las zonas con intervención se definieron como unidades que no presentan una comunidad florística definida y que son consecuencia de factores naturales o antropogénicos (i.e. cultivos de maíz, cafetales, potreros, cultivos abandonados o sitios afectados por incendios forestales). Aunque en la zona intervenida estos ambientes pueden ser contrastantes, son ambientes que fueron transformados casi completamente de su vegetación original, por esta razón se consideraron como zonas intervenidas. Hay especies de aves características de bosques que no se encontraron en estos ambientes intervenidos.
El bosque de pino presenta una amplia distribución en el PNLM, abarcando toda la porción centro-oeste. Es florísticamente pobre, la mayoría de estas especies están adaptadas a condiciones extremas de temperatura y radiación solar. Este bosque está asociado a sitios con menor pendiente y elevación dentro del parque, además, es donde la afectación por incendios forestales superficiales ha sido frecuente (Melo & Cervantes, 1986; CONANP, 2007). El bosque de pino-encino presenta especies de Pinus y Quercus que dominan el dosel. La co-dominancia del encino permite una gran riqueza y abundancia de epífitas, como bromelias, orquídeas y helechos (González-Espinosa & Ramírez-Marcial, 2013). El bosque de pino-encino-liquidambar se distribuye en la parte este del parque, su característica distintiva es la presencia de Liquidambar styraciflua en codominancia con Quercus spp. y Pinus spp. Este bosque presenta una alta riqueza de especies florísticas y, además, resguarda un número importante de especies vegetales asociadas a sitios pocos perturbados. El bosque mesófilo de montaña presenta una distribución reducida en comparación con las otras asociaciones forestales. En el 2005 se reportó una superficie de 458 ha (7.13%) y está restringido a áreas con características de topografía abrupta y laderas, específicamente en la parte noreste y central del parque (Jiménez-Cruz & Pulido-Arguello, 2009). Este tipo de bosque presenta una gran riqueza de especies leñosas, frecuentemente numerosas lauráceas y especies importantes que se encuentran bajo alguna categoría de riesgo (CONANP, 2007). La vegetación riparia está asociada a los lechos poco profundos de la orilla de algunos lagos y se reconoce principalmente por la presencia de tulares (Typha sp.) y carrizales (Pragmites sp.; CONANP, 2007). Es importante mencionar, que el criterio utilizado para agrupar estas unidades de muestreo (N= 5) fue principalmente por poseer >50% de los elementos florísticos que caracterizan a este tipo de vegetación.
En cada punto seleccionado, se realizó el conteo de aves (vistas o escuchadas) con un radio fijo de 25 m durante 10 min (Bibby, 2000). Los muestreos se llevaron a cabo de 6:00 am a 11:00 am. Cada unidad de muestreo fue visitada una vez al mes por seis meses, tres en la temporada de secas (febrero- abril de 2017) y tres en lluvias (mayo-julio de 2017). Para disminuir los sesgos de observación, los recorridos iniciaron a diferentes horarios y de forma aleatoria, y la separación temporal entre visitas en un mismo punto fue de 30 días.
Para los análisis de la composición de la comunidad de aves, las especies se agruparon en gremios tróficos: granívoros-frugívoros-insectívoros (GFI), insectívoros (I), omnívoros (O), insectívoros-vertebrados pequeños (IVp), insectívoros-nectarívoros (IN), granívoros (G), frugívoros-insectívoros-vertebrados pequeños (FIVp), insectívoros-invertebrados acuáticos-vertebrados pequeños (IAcVp) e insectívoros-frugívoros (IF), con base en Rangel-Salazar et al. (2009), Ruiz-Bruce-Taylor et al. (2017) y The Cornell Lab of Ornithology (2017). Con respecto al estrato de forrajeo, las especies fueron clasificadas en: agua (Ag), terrestre (Te), sotobosque (So), estrato medio (EM), estrato alto (EA) y aéreo (V); por su sensibilidad se siguió la propuesta de Stotz et al. (1996) como especies con baja (B) sensibilidad a la perturbación, con media (M) sensibilidad y alta (A) sensibilidad, y por su estatus migratorio en residentes y migratorias latitudinales. El listado taxonómico fue con base al listado del American Ornithologist´s Union (Chesser et al., 2019).
Análisis de Datos. La diversidad qD (sensu Jost, 2006) se midió como números efectivos de Hill (1973) en tres órdenes q= 0, 1 y 2. Se realizó este análisis, porque transformar los índices o entropías a números efectivos de especies es importante para una mejor interpretación unificada de la diversidad, ya que se obtiene una medida de similitud general, estable y es de fácil interpretación (Jost, 2006; Chao, 2014). De esta forma 0D corresponde a la riqueza total de especies en la muestra, 1D mide la diversidad considerando todas las especies con un peso exactamente proporcional a su abundancia, además que es una medida equivalente al exponencial del índice de Shannon, y 2D mide la diversidad de las especies más dominantes y es una medida equivalente al inverso del índice de Simpson (Jost, 2006). Estos tres valores de diversidad se calcularon de manera general para todo el inventario por temporada y tipo devegetación. La cobertura de la muestra y las medidas de diversidad se estimaron con R con el paquete iNEXT (Hsieh et al., 2016) Se realizaron análisis de varianza (ANOVA) y Kruskal-Wallis, para comparar las variables según fuera el caso mediante el programa InfoStat versión 2008.
RESULTADOS
En total se registraron 3,143 individuos de aves durante seis meses, pertenecen a 13 órdenes, 31 familias y 123 especies. La Familia Parulidae fue la mejor representada en riqueza y abundancia (17 especies y 398 individuos), seguida de Turdidae (11 especies y 630 individuos). En contraste, Alcedinidae tuvo un individuo de la especie Megaceryle torquata. Las especies abundantes fueron Myadestes occidentalis (260 individuos), Myioborus miniatus (258 individuos), Icterus chrysater (245 individuos), Ortalis vetula (212 individuos) y Chlorospingus flavopectus (168 individuos). El 62.9% de la riqueza total de aves fueron especies poco comunes, con abundancias ≤10 individuos, y la cobertura de la muestra estimada con el esfuerzo de muestreo invertido para el parque fue del 99% (Apéndice 1).
La diversidad 1D y 2D fue de 41.67 y 24.79 especies efectivas, respectivamente (Cuadro 1). Al realizar las comparaciones de estas estimaciones entre ambas temporadas, todas fueron diferentes: 0D: F5,6= 14.3, P= 0.01, 1D: F5,6= 29.9, P= 0.005 y 2D: F5,6= 20.5, P= 0.01; en estos tres parámetros, los valores fueron mayores en la temporada de lluvias. Las estimaciones de diversidad fueron diferentes entre los tipos de vegetación (0D: F5,18= 23.9, P= <0.0001; 1D: H5,18= 12.3, P= 0.03, 2D: H5,18= 13.9, P= 0.01). Las zonas con intervención (ZI) presentaron la mayor diversidad total1D= 48.35 y 2D= 32.33) con respecto a toda el área muestreada (Cuadro 1). En contraste, el bosque de pino-encino (BPE) presentó los valores más bajos de diversidad 1D y 2D (Cuadro 1).
Cuadro 1 Diversidad de especies de aves por temporada y tipo de vegetación en el Parque Nacional Lagunas de Montebello, Chiapas, México.
| PNLM | Números efectivos de especies | |||
|---|---|---|---|---|
| 0D | 1D | 2D | ||
| 123 | 41.67 | 24.79 | ||
| Temporada | Lluvias | 107 | 41.4 | 25.53 |
| Secas | 87 | 31.52 | 19.43 | |
| Tipo de vegetación | ZI | 87 | 48.35 | 32.33 |
| BP | 72 | 32.7 | 22.3 | |
| BPEL | 66 | 26.03 | 16.58 | |
| BPE | 54 | 24.09 | 16.29 | |
| BMM | 49 | 27.31 | 18.54 | |
| VR | 40 | 27.73 | 21.75 | |
Número efectivo de especies: 0D: riqueza; 1D: diversidad de orden 1; 2D: diversidad de orden 2. Tipos de vegetación: ZI= Zonas con intervención; BP= Bosque de pino; BPEL= Bosque de pino-encino-liquidambar; BPE= Bosque de pino-encino; BMM= Bosque mésofilo de montaña; VR= Vegetación riparia.
Con respecto a la composición de especies de aves en la comunidad, la mayoría fueron especies residentes y un 6.8% (20) migratorias latitudinales. Los gremios mejor representados fueron los granívoros-frugívoros-insectívoros (GFI) con 53 especies y los insectívoros con 24 especies (Apéndice 1). Por otra parte, los insectívoros-frugívoros (IF) y los frugívoros-insectívoros-vertebrados pequeños (FIVp) fueron los menos representados con dos y cuatro especies, respectivamente (Fig. 2). El estrato alto (Ea) fue el más utilizado por la comunidad de aves para forrajear, seguido del estrato medio-alto (Em, Ea) y el sotobosque-estrato medio (So, Em). La mayor riqueza y abundancia de aves se registró durante la temporada de lluvias (mayo-julio) con 1,950 individuos de 107 especies, respecto a la temporada de secas (febrero-abril) con 1,194 individuos de 87 especies.

Figura 2 Gremios tróficos en seis tipos de vegetación de febrero-julio de 2017 en el Parque Nacional Lagunas de Montebello, Chiapas. Gremios: GFI=granívoro-frugívoro-insectívoro; I=Insectívoro; O=Omnívoro; IVp=Insectívoro-vertebrados pequeños; IN=Insectívoro-nectarívoro; G=Granívoro; FIVp=Frugívoro-insectívoro-vertebrados pequeños; IAcVp= Insectívoro-invertebrados acuáticos-vertebrados pequeños; IF= Insectívoro-frugívoro.
Las zonas con intervención (ZI) presentaron la mayor riqueza de especies (87 especies). Veinticuatro especies se registraron exclusivamente en estas zonas y la mayoría de ellas presentan de baja a mediana sensibilidad a la perturbación de acuerdo con la clasificación de Stotz et al. (1996) (Apéndice 1). El bosque de pino (BP) presentó 72 especies y 844 individuos, y el bosque de pino-encino-liquidambar (BPEL) 66 especies y 790 individuos (Cuadro 1). Las aves presentes en el BPEL fueron, en su mayoría, especies de mediana a alta sensibilidad a la perturbación. Generalmente, las especies emplearon el estrato alto para forrajear, aunque en el BMM y la VR la mayoría de las especies forrajearon en el estrato medio-alto.
DISCUSIÓN
Las estimaciones de diversidad y composición espacial y temporal en diferentes tipos de vegetación permiten entender cómo se estructuran las comunidades y cómo éstas varían en el tiempo. En este estudio se registraron en total 123 especies de aves, que representaron el 17.5% del total de aves reportadas para el estado de Chiapas (Rangel-Salazar et al., 2013) y el 44.4% de las especies de aves registradas en el PNLM (CONANP, 2007). El esfuerzo de muestreo realizado en este estudio presentó una buena cobertura de la muestra. Se ha reportado que, en bosques, el utilizar los registros auditivos de aves permite detectar aquellas especies raras, poco conspicuas o las que son muy activas en el dosel y dificultan su registro visual (Celis-Murillo et al., 2012; Suárez-García et al., 2017). Por lo tanto, es importante utilizar ambos métodos (visual y auditivo) para tener una mejor aproximación de los resultados.
Las Familias Parulidae y Turdidae han sido reportadas como representativas del parque (Martínez-Sánchez, 2005; Rangel-Salazar et al., 2009) así como en algunos bosques de Chiapas, Guerrero y el Estado de México (Bojoges-Baños, 2004; Almazán-Núñez et al., 2009; Rangel-Salazar et al., 2013). En contraste, una de las familias menos representada fue Alcedinidae, con un solo individuo de Megaceryle torquata. En la zona donde se registró esta especie hay cierto grado de perturbación con constante afluencia de paso vehicular, de pescadores y un lago impactado con una disminución de peces (Maya-García, 2017). De acuerdo con Durán (2017), las poblaciones de M. torquata pueden verse afectadas por la disminución de sus recursos dulceacuícolas y pérdida de sus sitios de nidificación.
Las especies que presentaron mayores abundancias (I. chrysater, O. vetula, M. occidentalis, M. miniatus, y C. flavopectus) se registraron en ambas temporadas, pero también presentaron una amplia distribución con registros en todos los tipos de vegetación. Las especies Myadestes occidentalis, Mioborus miniatus y Chlorospingus flavopectus son consideradas comunes en las Lagunas de Montebello, pero también en otros bosques templados del país (Martínez-Sánchez, 2005; Navarro & Peterson, 2007; Rangel-Salazar et al., 2009; Almazán-Núñez et al., 2009; Rangel-Salazar & Enríquez, 2013). Asimismo, en estos bosques de montaña también son características las especies raras o endémicas, las cuales son prioritarias para la conservación. En este estudio se registraron Setophaga chrysoparia (1), Cyanolyca pumilo (2), Pharomachrus mocinno (2), Cyanolyca cucullata (4), Aspatha gularis (7) y Catharus frantzii (8), ya que además de ser poco comunes, son consideradas especies amenazadas o en peligro de extinción en México (NOM-059 SEMARNAT-2010; (Apéndice 1). La comunidad de aves estuvo integrada en su mayoría por especies de baja a mediana sensibilidad a la perturbación de acuerdo con la clasificación de Stotz et al. (1996). Sobresalen Penelopina nigra, Turdus infuscatus, Dendrocolaptes picumnus, A. gularis y C. pumilo por ser especies con alta sensibilidad a la perturbación (Apéndice 1).
La zona intervenida (ZI) presentó la mayor riqueza de especies (87 especies). De todos los sitios estudiados, esta zona tuvo la mayor heterogeneidad por los diferentes usos de suelo presentes en el área, lo que permiten una mayor diversidad y riqueza de especies. En la vegetación riparia (VR) se registraron especies que utilizan hábitat abiertos como Zenaida asiática y Amazilia cyanocephala (Van Perlo, 2006). Por otro lado, I. chrysater y O. vetula no se han reportado abundantes en bosques, pero también en vegetación secundaria (CONANP, 2013). Posiblemente, los hábitos generalistas de estas especies, su baja sensibilidad a la perturbación, su gran movilidad en ambientes perturbados y la ubicación del parque como corredor biológico con la Selva Lacandona, sean características que están favoreciendo la ocurrencia de estas especies en el parque.
La diversidad de especies efectivas dominantes (2D) reportadas en este estudio fue 1.8 veces mayor (55.14%) que la diversidad reportada anteriormente (Rangel-Salazar et al., 2009), posiblemente por los métodos de muestreo utilizados (redes de niebla utilizadas en el estudio previo), y características espacio-temporales de los muestreos. Las redes de niebla están sesgadas a las aves de sotobosque y cubren menor área por unidad de tiempo; a diferencia de los puntos de conteo, que además de cubrir una mayor área, permiten detectar especies raras, poco conspicuas y de dosel (Ralph et al., 1996). Esta diferencia en la diversidad de aves de Montebello indica que la estructura de la comunidad puede ser una asociación peculiar y altamente dinámica (con pérdida y ganancia de especies), aun cuando la estructura básica permanezca (Halffter & Moreno, 2005). Asimismo, la variabilidad encontrada refleja la necesidad de realizar estudios a largo plazo, que permitan entender la dinámica de la diversidad en la comunidad avifaunística como respuesta a factores naturales (e.g. incendios forestales) o antropogénicos (e.g. cambio de uso de suelo) que inciden en el área protegida (Jiménez-Cruz & Pulido-Arguello, 2009; Sohdi et al., 2011).
La temporada de lluvias presentó un aumento en la diversidad 1D y 2D que se explica por el incremento en la abundancia de las especies comunes, principalmente las especies insectívoras (I), granívoras-frugívoras-insectivoras (GFI) e insectívoras-nectarívoras (IN). La abundancia de estos gremios responde positivamente al incremento en los niveles de recursos (néctar, insectos, frutos) durante esta temporada, los que a su vez se asocian por la disponibilidad estacional de los recursos en los sitios (e.g. presencia de flores para insectos polinizadores; madera en descomposición para coleópteros; Codesido & Bilenca, 2004). De igual forma, las lluvias favorecen la abundancia de insectos con ciclos de vida cortos (e.g. Melolonthidae), lo que se traduce en una mayor oferta de recursos para las aves. Estudios a largo plazo permitirán comparar las fluctuaciones estacionales de los recursos y su efecto en la estructura de la comunidad avifaunística del parque.
La diversidad de aves en los bosques que presentan una mayor riqueza de especies florísticas y sitios menos perturbados como el BMM, BPEL y BPE fueron menores con relación a los tipos de vegetaciones de zonas abiertas (ZI, VR y BP). Es posible que la densa cobertura del dosel en estos bosques, la experiencia del observador y el tipo de muestreo hayan influido en el menor registro de especies y abundancia de aves y, por ende, menor diversidad. Se ha reportado que, en follajes densos o muy altos, la detección de las aves se dificulta existiendo omisiones en los registros (González-Ortega & Morales-Pérez, 1998). Sin embargo, sobresale la composición de especies en estos sitios boscosos, por ser aves residentes con mediana y alta sensibilidad a la perturbación, principalmente, Atlapetes albinucha, Penelopina nigra y Pharomachrus mocinno (Stotz et al., 1996). Además, son especies de bosque (carpinteros, trepatroncos, trogones, zorzales, mirlos, y tángaras) que dependen de los árboles para sobrevivir (Lammertink et al., 1996).
En contraste, la diversidad de aves en la vegetación riparia, zona con intervención y bosque de pino estuvo compuesta principalmente por especies dominantes con baja sensibilidad a la perturbación. En cada tipo de vegetación, se registraron especies exclusivas asociadas a hábitats abiertos, así como algunas especies de interior de bosque (e.g. Turdus infuscatus). Nuestros resultados sugieren que estos tipos de vegetación representan una opción para las aves residentes que pueden desplazarse entre ambientes en búsqueda de recursos (Şekercioḡlu et al., 2002).
En las ZI, Cyanerpes cyaneus, Volatinia jacarina y Sporophila torqueola fueron especies exclusivas en estos sitios. Para Dendrocygna autumnalis, la VR fue adecuada para anidar por la presencia de pastizales densos y su cercanía a los cuerpos de agua. Debido a la constante trasformación de los hábitats originales, es importante mantener sitios naturales y modificados para conservar la estructura y complementariedad de una comunidad (Ramírez-Albores, 2006). También, sobresale la presencia de Bubulcus ibis en las zonas con intervención, al ser una especie exótica genera competencia por sitios de anidación y alimento con las aves residentes y transportan la bacteria Clostridium botulinum que puede afectar a otras aves y mamíferos (Sánchez-García, 2012).
Por otra parte, es probable que la diversidad en el BP esté moldeada por la intensa actividad de reforestación y el manejo forestal para la erradicación de la plaga de descortezador, que involucra principalmente el derribo de árboles infestados. Esta apertura del dosel podría beneficiar aquellas especies que utilizan hábitats abiertos, como Zenaida asiática, Quiscalus mexicanus, O. vetula e I. chrysater, que fueron abundantes en estos sitios. La modificación en el dosel (mayores claros), la heterogeneidad y arquitectura de la vegetación, influyen en la diversidad, surgiendo mecanismos que favorecen la coexistencia de las especies. Asimismo, la familia Picidae fue representativa en términos de riqueza de especies y abundancia de individuos en el BP; por lo que podrían ser indicadoras del disturbio causado por el manejo forestal en estos sitios. De acuerdo con Sobrino-Galdámez (2011), estas aves son anidadoras primarias de cavidades, y pueden verse afectadas de manera directa y negativa por un manejo constante del bosque y afectar de forma indirecta a otras especies participantes en las redes de anidación en bosques templados.
En este estudio, los gremios GFI, I y O fueron representativos en términos de riqueza, como se reportó previamente por Rangel-Salazar et al. (2009). Los GFI e I son de vital importancia para la dispersión de semillas y el control de plagas en el parque, además, están relacionados a hábitats con mayor complejidad estructural y florística (Ramírez-Albores, 2006). Las especies insectívoras son sensitivas y vulnerables a la fragmentación, y su persistencia depende de la capacidad para moverse entre ambientes perturbados. Si estas especies son poco móviles y exclusivas de interior de bosque, están más amenazadas a desaparecer (Şekercioḡlu et al., 2002). En este trabajo, las especies insectívoras fueron más abundantes en el BPEL (bosque maduro), pero también en ZI (zonas con intervención). Respecto al alto número de especies omnívoras (O) en el parque, puede deberse a un reflejo de la heterogeneidad de la vegetación, ya que son especies que requieren hábitats menos específicos y un uso más amplio del espacio (Ramírez-Albores, 2006; Pineda-Diez de Bonilla et al., 2012). Estos resultados indican que esta variación en la composición de las comunidades avifaunísticas puede resultar en ocasiones en comunidades menos especializadas y que pueden reducir la función en estos ecosistemas y afectar los servicios ecosistémicos (Şekercioḡlu et al., 2012).
Este estudio permitió la inclusión de cuatro especies al listado avifaunístico del parque (e.g. Dryocopus lineatus, Xiphorhynchus flavigaster, Sayornis nigricans y Setophaga pensylvanica) y nuevas áreas de avistamiento del quetzal. Por la composición de la diversidad avifaunística en el BMM, BPEL y BPE, se enfatiza la necesidad de implementar estrategias de restauración del bosque, formular alternativas de aprovechamiento forestal con los pobladores de las comunidades aledañas al parque y estrategias encaminadas a la ordenación de los espacios de uso público. Para la VR y ZI, es necesario establecer un manejo que evite su transformación en áreas agropecuarias más intensivas. Debido al contexto histórico y social del parque Nacional Lagunas de Montebello, es indispensable considerar la participación de los actores sociales para combinar conocimiento técnico y tradicional y formular alternativas de conservación y manejo en el parque.











 nova página do texto(beta)
nova página do texto(beta)


