INTRODUCCIÓN
Los bosques tropicales son ecosistemas que contienen una alta biodiversidad, pero también se encuentran sometidos a una rápida y severa transformación por las distintas actividades humanas, como la agricultura, la ganadería extensiva, la industria y el crecimiento de asentamientos humanos (Hansen et al., 2013; Sánchez-Colón et al., 2009). En el sur de México, este proceso de modificación de cambio de uso de suelo ha generado paisajes compuestos por pequeños fragmentos de hábitat original, inmersos en una matriz de ambientes modificados (Sommer & Oropeza-Orozco, 2010; Schmitter-Soto et al., 2016). Ante esta problemática, una de las estrategias de conservación más difundidas para la protección de la biodiversidad ha sido el establecimiento de Áreas Naturales Protegidas (ANPs; Naughton-Treves et al., 2005).
Las ANPs terrestres en México pueden ser clasificadas, de acuerdo con su tipo de gobernanza, en tres categorías: las de carácter gubernamental, que pueden ser municipales, estatales o federales; las de carácter comunitario, las cuales son manejadas comúnmente por comunidades rurales o ejidos; y las de carácter privado, que son conocidas como Áreas Protegidas Privadas (APPs). Éstas últimas son definidas por la Unión Internacional para la Conservación de la Naturaleza (IUCN, por sus siglas en inglés) como “un espacio geográfico claramente definido, reconocido, dedicado y manejado, a través de medios legales u otros medios efectivos, para lograr la conservación a largo plazo de la naturaleza, bajo gobernanza privada, ya sea de individuos o instituciones” (Stolton et al., 2014).
Dado que el número de APPs en México es considerable, al menos 407 certificadas por instituciones gubernamentales y 285 no certificadas (Bezaury-Creel, 2014), su contribución para la conservación de la biodiversidad en el escenario actual de transformación de la cobertura vegetal en el país, podría ser significativa; sin embargo, dicha contribución ha sido poco evaluada (Cruz-Bazán et al., 2017). Entre las primeras tareas necesarias para determinar el aporte a la conservación de la biodiversidad de un APP, está examinar la diversidad biológica que alberga y evaluar el número de especies amenazadas que contiene. Además, se puede comparar su diversidad de especies con la de áreas protegidas cercanas para evaluar su complementariedad. Con base en esta información, se pueden generar planes de manejo y conservación para distintos grupos taxonómicos, adecuados a las características del APP y las condiciones del paisaje circundante.
Los anfibios y reptiles son componentes clave de los ecosistemas, ya que son importantes consumidores de insectos y se encuentran entre las presas más consumidas por otros grupos de vertebrados, como aves, mamíferos y de otros reptiles (Cortés-Gómez et al., 2015). Estos dos grupos biológicos se encuentran amenazados a nivel global, debido principalmente a la destrucción o modificación de su hábitat (Wake, 1991; Böhm et al., 2013). En México, la mitad de las especies de anfibios y una décima parte de los reptiles se encuentran en alguna categoría de amenaza de la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza [UICN] (IUCN, 2017) o de la lista de especies en riesgo de la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (SEMARNAT, 2010). No obstante, el sistema de áreas naturales protegidas gubernamentales en México no garantiza la protección de todos los anfibios y reptiles del país (Urbina-Cardona & Flores-Villela, 2010; Ochoa-Ochoa et al., 2009), por lo que resulta necesario explorar la contribución de las APPs para la conservación de estos grupos biológicos (Cruz-Elizalde et al., 2015).
Como parte de los esfuerzos para la conservación de la biodiversidad de los bosques tropicales en el sur de México, en 1998 se estableció la Reserva de la Biosfera Los Tuxtlas, bajo administración federal (CONANP, 2006). A partir de esa fecha, una serie de áreas naturales de carácter privado se han establecido en el sur de México, como el Parque Ecológico Jaguaroundi (PEJ, Herrera et al., 2008) creado en 1998, el Parque Ecológico Tuzandepetl (PET, Cruz-Silva, 2012) creado en 1999 y el Área de Protección y Desarrollo de Ceratozamia (APDC) creada en el año 2015 (SEDEMA, 2015). En las dos primeras APPs se ha examinado ya la riqueza y la composición de especies de herpetofauna que contienen (Herrera et al., 2008; Cruz-Silva, 2012) pero de la última no se tiene conocimiento sobre los anfibios y reptiles que ahí habitan.
El objetivo de este estudio fue evaluar la importancia del Área de Protección y Desarrollo de Ceratozamia, ubicada en una zona altamente transformada de bosque tropical del sur de México, para la conservación de anfibios y reptiles, considerando el número e identidad de las especies, así como su estado de conservación de acuerdo con la NOM-059-SEMARNAT-2010, la Lista Roja de la UICN y el Puntaje de Vulnerabilidad Ambiental. Adicionalmente, se examinó la contribución complementaria del APCD (diferencia en composición de especies) con respecto a otras dos áreas protegidas privadas, localizadas en la misma zona, y al área natural protegida de carácter gubernamental más próxima.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se realizó en el Área Protegida Privada denominada Área de Protección y Desarrollo de Ceratozamia (APDC), localizada en el Municipio de Ixhuatlán del Sureste, estado de Veracruz, en el sur de México (Fig. 1). El área tiene una altitud promedio de 60 m, una precipitación media anual de 1,800 mm y una temperatura media anual de 27°C. El tipo de vegetación original en la zona corresponde a bosque tropical subcaducifolio (Castillo-Campos et al., 2011). El APDC tiene una superficie de 100 hectáreas, de las cuales 50 ha corresponden a un área abierta dominada por pasto inducido para la ganadería y otras 50 ha corresponden a bosque tropical subcaducifolio conservado. La zona de pastizal está dominada por pastos inducidos para la ganadería (Paspalum fasciculatum y Setaria geniculata), con algunos árboles aislados (Coccoloba hondurencis), algunas palmas (Attalea liebmannii) y con cercas vivas compuestas por C. hondurencis, Guazuma ulmifolia, Bursera simaruba y Gliciridia sepium. El área de remanentes de bosque tropical subcaducifolio tiene un estrato arbóreo con una altura máxima de 25 m, donde las especies más representativas son Miconia argentea, Guazuma ulmifolia, Cupania dentata, C. hondurencis, Bursera simaruba, Enterolobium cyclocarpum, Cecropia obtusifolia, Vochysia hondurensis, Pithecellobium lanceolatum. En el estrato arbóreo bajo, las especies dominantes son Tabernaemontana alba y Dendropanax arboreus.
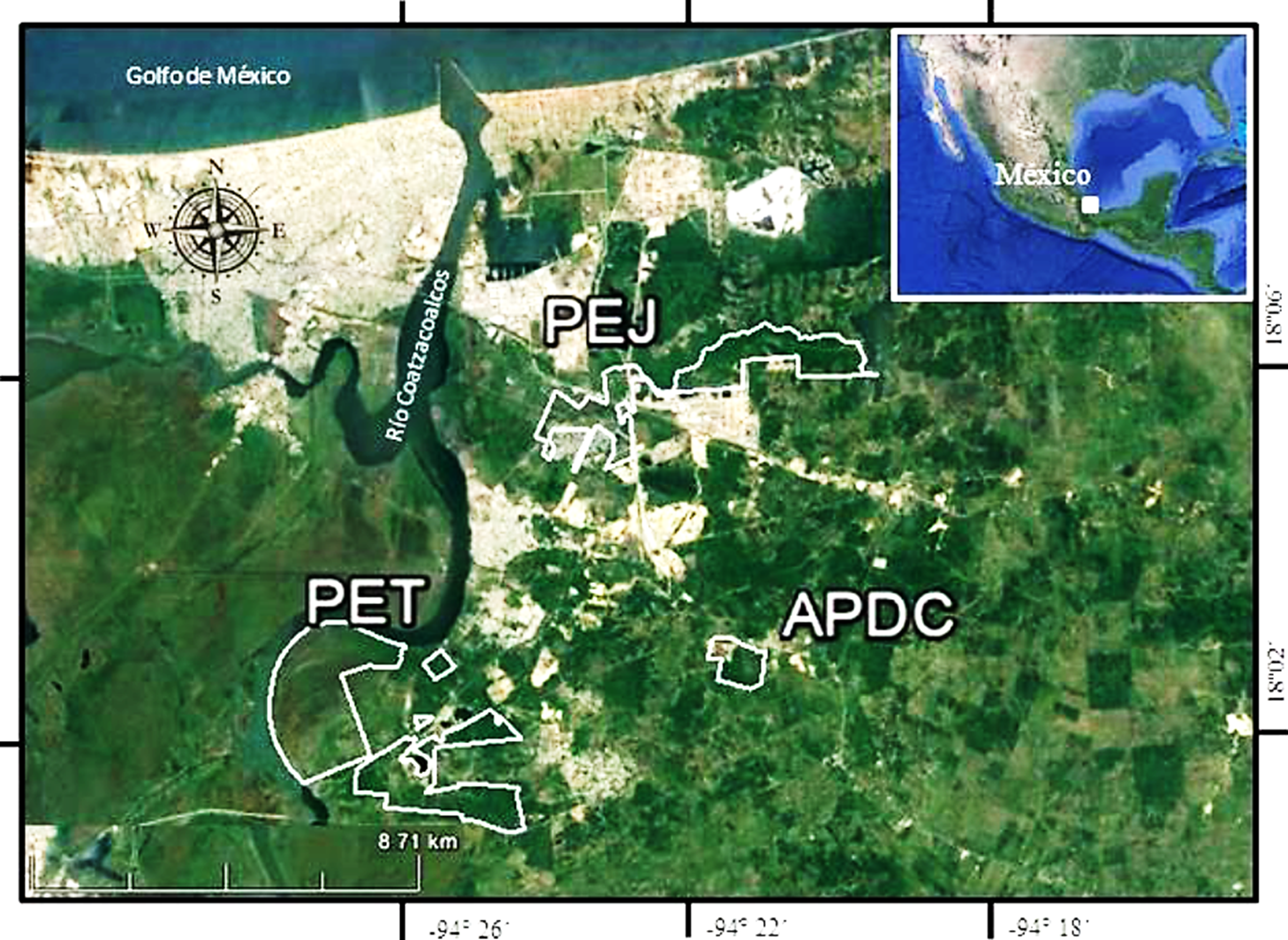
Figura 1 Ubicación del Área de Protección y Desarrollo de Ceratozamia (APDC), el Parque Ecológico Jaguaroundi (PEJ) y el Parque Ecológico Tuzandepetl (PET), en el sur de Veracruz, México. Las líneas blancas representan los polígonos de cada una de las áreas protegidas.
Trabajo de campo. Los muestreos se realizaron durante ocho días en tres épocas del año: temporada de secas (abril), temporada de lluvias (julio) y temporada de nortes (diciembre), durante 2015 y 2016, tanto en bosque tropical conservado como en pastizal, para detectar el mayor número de especies posible. Los muestreos fueron realizados por dos personas, empleando las técnicas de búsqueda libre restringida por tiempo (Crump & Scott, 1994), tanto en horario diurno de 06:30-10:30 horas, como vespertino-nocturno de 16:00-20:00 horas. El esfuerzo de muestreo por tipo de uso de suelo fue de 384 horas-persona, dando como resultado un esfuerzo total de muestreo de 768 horas-persona. Todos los individuos capturados fueron registrados, fotografiados e identificados con guías de campo (Köhler, 2008; 2011) para posteriormente ser liberados en el mismo sitio de su captura. La nomenclatura de las especies de anfibios se basó en Amphibian Species of the World 6.0 (Frost, 2017) y en el caso de los reptiles se consultó Reptile Database (Uetz et al., 2018). El estado de conservación de cada una de las especies registradas se determinó con base en la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (SEMARNAT, 2010), la Lista Roja de la UICN (2017) y en el Puntaje de Vulnerabilidad Ambiental (EVS= Environmental Vulnerability Score) propuesto por Wilson et al. (2013a; b), el cual considera la extensión geográfica, la extensión de la distribución ecológica (tipo de vegetación) y el modo reproductivo (en anfibios) o el grado de amenaza por el humano (en reptiles). Las categorías de vulnerabilidad son baja (B: de 3 a 9 puntos), media (M: de 10 a 13 puntos) y alta (A: de 14 a 20 puntos).
Análisis de datos. Para determinar el grado de completitud del inventario en el APDC se estimó la riqueza esperada, calculada con los estimadores no paramétricos Chao 2 y Jacknife de primer orden y de segundo orden (Moreno, 2001), los cuales se basan en datos de presencia-ausencia agrupados en muestras. Para ello se empleó el programa EstimateS versión 9.1 (Colwell, 2013).
Se determinaron las diferencias en composición de especies entre el APDC y otras dos APPs, el Parque Ecológico Jaguaroundi (PEJ, Herrera et al., 2008) y el Parque Ecológico Tuzandepetl (PET, Cruz-Silva, 2012) ubicadas muy cerca geográficamente (distancia máxima entre áreas de 6.5 km en línea recta), en el sur de Veracruz (Fig. 1). Para esto se empleó la propuesta de Carvalho et al. (2012), en la cual se calcula la diferencia total en composición (Bcc) de especies entre dos sitios o entidades, con la fórmula:
la proporción de la diferencia en composición debida al reemplazo de especies (B-3):
y la proporción de la disimilitud debida a la diferencia en riqueza de especies (Brich):
En todas las fórmulas, a es el número de especies presentes en ambos sitios, b el número de especies exclusivamente en el primer sitio y c el número de especies presentes exclusivamente en el segundo sitio. La suma de los valores derivados del reemplazo de especies (B-3) y de la diferencia en riqueza de especies da como resultado la diferencia total en composición (Bcc). Los valores obtenidos de Bcc van de 0 (comunidades compuestas por las mismas especies) a 1 (comunidades compuestas por especies totalmente distintas). La especie Hemidactylus frenatus no fue considerada en este análisis por ser una especie exótica.
RESULTADOS
En el APDC se registraron 20 especies de anfibios (tres de salamandras y 17 de anuros) y 35 de reptiles (13 lagartijas, 16 serpientes y seis tortugas; Cuadro 1). De las 20 especies de anfibios, dos se encontraron exclusivamente en el bosque conservado, siete exclusivamente en el pastizal y 11 en ambos ambientes; mientras que, de las 35 especies de reptiles, 15 se registraron exclusivamente en el bosque tropical subcaducifolio, 11 exclusivamente en el pastizal y nueve en ambos ambientes (Cuadro 1). La riqueza estimada indica que el nivel del inventario para anfibios se encuentra entre el 91 y 100% de completitud y que es probable que falten por registrar dos especies; mientras que, en el caso de los reptiles, el inventario se encuentra entre el 70 y 79% de completitud, faltando por registrar, entre nueve y 15 especies (Cuadro 2).
Cuadro 1 Especies de anfibios y de reptiles registradas en el Área de Protección y Desarrollo de Ceratozamia (APDC); (BTS = Bosque Tropical Subcaducifolio, PAS = Pastizal para ganado) y su estado de conservación según la NOM-059-SEMARNAT-2010 (NOM-059; PR = Sujeta a protección especial, A = Amenazada), la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (UICN; LC = Least Concern o Preocupación Menor, VU = Vulnerable o Vulnerable, NT = Near Threatened o Casi Amenazada, NE = No Evaluada) y el Puntaje de Vulnerabilidad Ambiental (EVS) y categoría de vulnerabilidad (B = baja, M = media y A = alta).
| Clase Orden Suborden | Familia | Especie | Ambiente | Conservación | |||
|---|---|---|---|---|---|---|---|
| BTS | PAS | NOM-059 | UICN | EVS | |||
| Amphibia Anura | Bufonidae | Incilius valliceps | X | X | LC | 6 (B) | |
| Rhinella horribilis | X | LC | 3 (B) | ||||
| Craugastoridae | Craugastor alfredi | X | VU | 11 (M) | |||
| Craugastor loki | X | X | LC | 10 (M) | |||
| Eleutherodactylidae | Eleutherodactylus leprus | X | VU | 12 (M) | |||
| Hylidae | Agalychnis callydrias | X | X | LC | 11 (M) | ||
| Dendropsophus ebraccatus | X | X | LC | 10 (M) | |||
| Dendropsophus microcephalus | X | LC | 7 (B) | ||||
| Scinax staufferi | X | X | LC | 4 (B) | |||
| Smilisca baudinii | X | X | LC | 3 (B) | |||
| Tlalocohyla loquax | X | LC | 7 (B) | ||||
| Tlalocohyla picta | X | X | LC | 8 (B) | |||
| Trachycephalus typhonius | X | LC | 4 (B) | ||||
| Leptodactylidae | Leptodactylus fragilis | X | LC | 5 (B) | |||
| Leptodactylus melanonotus | X | LC | 6 (B) | ||||
| Ranidae | Lithobates brownorum | X | X | PR | NE | 8 (B) | |
| Lithobates vaillanti | X | X | LC | 9 (B) | |||
| Caudata | Plethodontidae | Bolitoglossa mexicana | X | X | PR | LC | 11 (M) |
| Bolitoglossa platydactyla | X | PR | NT | 15 (M) | |||
| Bolitoglossa rufescens | X | X | PR | LC | 9 (B) | ||
| Reptilia Squamata Lacertilia | Corytophanidae | Basiliscus vittatus | X | LC | 7 (B) | ||
| Corytophanes hernandesii | X | PR | LC | 13 (M) | |||
| Dactyloidae | Anolis beckeri | X | NE | 12 (M) | |||
| Anolis lemurinus | X | X | NE | 8 (M) | |||
| Anolis sericeus | X | X | NE | 8 (M) | |||
| Gekkonidae | Hemidactylus frenatus | X | LC | ||||
| Iguanidae | Iguana iguana | X | X | PR | NE | 12 (M) | |
| Ctenosaura acanthura | X | PR | NE | 12 (M) | |||
| Phrynosomatidae | Sceloporus variabilis | X | LC | 5 (B) | |||
| Scincidae | Marisora brachypoda | X | LC | 6 (B) | |||
| Scincella cherriei | X | NE | 8 (B) | ||||
| Sphaerodactylidae | Sphaerodactylus glaucus | X | PR | LC | 12 (M) | ||
| Teiidae | Holcosus amphigrammus | X | NE | ||||
| Serpentes | Boidae | Boa imperator | X | X | NE | ||
| Colubridae | Coluber mentovarius | X | A | LC | 6 (B) | ||
| Drymarchon melanurus | X | LC | 6 (B) | ||||
| Drymobius margaritiferus | X | X | NE | 6 (B) | |||
| Leptophis mexicanus | X | LC | 6 (B) | ||||
| Oxybelis aeneus | X | X | NE | 5 (B) | |||
| Spilotes pullatus | X | NE | 6 (B) | ||||
| Dipsadidae | Coniophanes fissidens | X | X | NE | 7 (B) | ||
| Imantodes cenchoa | X | PR | NE | 6 (B) | |||
| Leptodeira annulata | X | PR | NE | ||||
| Leptodeira septentrionalis | X | NE | 8 (B) | ||||
| Ninia sebae | X | X | LC | 5 (B) | |||
| Rhadinaea decorata | X | NE | 9 (B) | ||||
| Tropidodipsas sartorii | X | PR | LC | 9 (B) | |||
| Leptotyphlopidae | Epictia phenops | X | NE | ||||
| Viperidae | Bothrops asper | X | X | NE | 12 (M) | ||
| Testudines | Chelydridae | Chelydra rosignonii | X | VU | 17 (A) | ||
| Emydidae | Trachemys ornata | X | NE | 19 (A) | |||
| Geomydidae | Rhinoclemmys areolata | X | A | NT | 13 (M) | ||
| Kinosternidae | Claudius angustatus | X | NT | 14 (A) | |||
| Kinosternon leucostomum | X | PR | NE | 10 (M) | |||
| Staurotypus triporcatus | X | A | NT | 14 (A) | |||
Cuadro 2 Riqueza de especies de anfibios y de reptiles observadas y estimadas en el Área de Protección y Desarrollo de Ceratozamia basadas en métodos no paramétricos. La completitud es un porcentaje de los valores estimados mínimos y máximos con respecto a la riqueza de especies observada.
| Estimador de riqueza de especies | Anfibios | Reptiles |
|---|---|---|
| Especies observadas | 20 | 35 |
| Chao 2 | 20 | 44 |
| Jacknife de primer orden | 22 | 47 |
| Jacknife de segundo orden | 22 | 50 |
| Completitud | 91-100 | 70-79 |
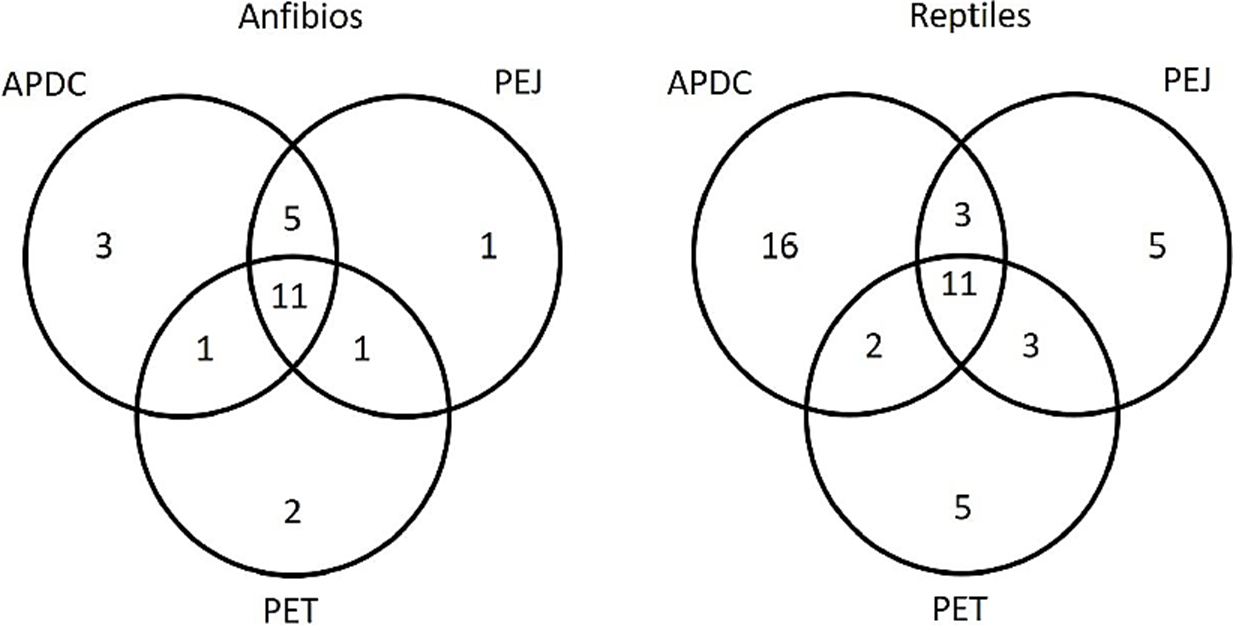
Figura 2 Diagramas de Venn que indican el número de especies exclusivas y compartidas de anfibios y reptiles entre las tres áreas privadas protegidas. Área de Protección y Desarrollo de Ceratozamia (APDC), Parque Ecológico Jaguaroundi (PEJ) y Parque Ecológico Tuzandepetl (PET).
De las especies registradas, cuatro de anfibios y 11 de reptiles se encuentran incluidas en alguna categoría de riesgo de la NOM-059-SEMARNAT-2010, mientras que dos especies de anfibios y una de reptil están incluidas en categorías altas de riesgo de extinción según la UICN. En cuanto a las especies que no han sido evaluadas por la UICN encontramos una de anfibio y 20 de reptiles (Cuadro 1). Con respecto al Puntaje de Vulnerabilidad Ambiental, 13 especies de anfibios se encuentran en categoría de vulnerabilidad baja (B) y siete especies en vulnerabilidad media (M). En el caso de los reptiles, 16 se consideran en vulnerabilidad baja (B), 10 en vulnerabilidad media (M) y cuatro en vulnerabilidad alta (A), mientras que tres especies no tienen asignado un puntaje de vulnerabilidad (Cuadro 1).
Las diferencias en composición de especies entre reservas oscilaron entre el 27 y 47% en anfibios y entre 46 y 69% en reptiles. Las mayores diferencias en composición de especies de anfibios se presentaron entre el APDC y PET (47%) y en los reptiles entre el APDC y PEJ (69%), mientras que el valor más bajo para anfibios se presentó entre APDC y PEJ (27%) y para reptiles entre PEJ y PET (46%). En ambos grupos biológicos, las diferencias en composición estuvieron mayormente explicadas por el reemplazo de especies, con valores entre el 18 y 28% para anfibios y entre 34 y 38% para los reptiles (Cuadro 3).
Cuadro 3 Valores de las diferencias en composición total de especies de anfibios y de reptiles (Bcc), la proporción debida al reemplazo de especies (B-3) y la proporción debida a las diferencias en riqueza de especies (Brich) entre pares de reservas. APDC = Área de Protección y Desarrollo de Ceratozamia, PEJ = Parque Ecológico Jaguaroundi, PET = Parque Ecológico Tuzandepetl.
| Anfibios | Reptiles | |||||
|---|---|---|---|---|---|---|
| Áreas protegidas | Bcc | B-3 | Brich | Bcc | B-3 | Brich |
| APDC-PEJ | 0.27 | 0.18 | 0.09 | 0.69 | 0.38 | 0.30 |
| APDC-PET | 0.47 | 0.26 | 0.21 | 0.66 | 0.34 | 0.31 |
| PEJ-PET | 0.42 | 0.28 | 0.14 | 0.46 | 0.38 | 0.07 |
En cuanto al estado de conservación de la herpetofauna, el conjunto de las tres reservas alberga tres especies de anfibios y una de reptil incluidas en categorías de riesgo en la UICN y cinco especies de anfibios y 13 de reptiles en la NOM-059-SEMARNAT-2010. El número de especies no evaluadas por la UICN en el conjunto de reservas es de 23.
DISCUSIÓN
La presencia de las especies en el bosque tropical subcaducifolio o en el pastizal para ganado en el APDC, puede explicarse por los requerimientos ambientales y los hábitos de cada especie, tanto de anfibios como de reptiles (Suazo-Ortuño et al., 2011). En el caso de los anfibios, la presencia de un mayor número de especies en el pastizal para ganado se puede deber a que en este ambiente se ubican cuerpos de agua intermitentes, donde se registraron varias especies como Rhinella horribilis, Dendropsophus microcephalus, Tlalocohyla loquax, Trachycephalus typhonius, Leptodactylus fragilis y L. melanonotus, que se caracterizan por tener una alta tolerancia a la perturbación y por estar asociadas a cuerpos de agua para su reproducción (Lee, 1996; Campbell, 1998). La presencia de un mayor número de especies de reptiles en las zonas de bosque (24 especies), puede deberse a que varias especies de reptiles registrados son de hábitos arborícolas, como Corytophanes hernandesii, Anolis beckeri, Sphaerodactylus glaucus, Imantodes cenchoa, Leptophis mexicanus y Spilotes pullatus (Lee, 1996; Campbell, 1998), lo que restringe su distribución a zonas arboladas.
El APDC, con una extensión de 100 hectáreas (de las cuales sólo la mitad mantiene bosque tropical conservado), alberga una riqueza de especies de anfibios y reptiles mayor a la reportada en las otras dos áreas protegidas privadas de la zona, es decir, en el PEJ, con una extensión casi nueve veces mayor (960 hectáreas), se han registrado 17 especies de anfibios y 24 de reptiles (Herrera et al., 2008); mientras que en el PET, con una extensión 10 veces mayor (1,100 hectáreas) se han registrado 15 especies de anfibios y 22 de reptiles (Cruz-Silva, 2012). Es posible que parte de esta diferencia en el número de especies registradas entre las áreas naturales protegidas se deba a las técnicas y esfuerzo de muestreo empleadas en cada estudio (Herrera et al., 2008; Cruz-Silva, 2012). Sin embargo, este mismo patrón de riqueza se ha observado en mamíferos (Ortiz-Lozada et al., 2017), lo que podría indicar que el APDC realmente representa un reservorio de la biodiversidad de los bosques tropicales del sur de México.
La riqueza de especies en el APDC podría ser mayor a la informada en el presente estudio, pues los resultados de los cálculos de los estimadores de especies sugieren que el inventario de especies para esta APP es incompleto. De ser así, es necesario incrementar el esfuerzo de muestreo con el fin de registrarlas. Entre las especies de posible presencia en el APDC se encuentran los anfibios Anotheca spinosa, Craugastor pygmaeus, Hypopachus ustus y Gastrophryne elegans, y los reptiles Anolis rodriguezii, A. uniformis, A. tropidonotus, Aspidoscelis deppii, Plestiodon sumichrasti, Clelia scytalina, Mastigodryas melanolomus, Coniophanes imperialis, C. quinquevittatus, Ninia diademata, Micrurus diastema y Crocodylus moreletii. Algunas de estas especies fueron registradas en las otras dos APPs de la zona, en el mismo tipo de vegetación o en otros tipos como encinar-palmar, manglar y popal (Herrera et al., 2008; Cruz-Silva, 2012). Otras especies han sido registradas históricamente en el mismo tipo de vegetación (Aguilar-López & Canseco-Márquez, 2006) o bien en otros tipos de vegetación (Pelcastre-Villafuerte & Flores-Villela, 1992; Carmona, 2005) en distintos sitios de la región sur del estado de Veracruz.
Nuestros resultados indican que el APDC no alberga una alta proporción de especies de anfibios en elevadas categorías de riesgo de extinción (20% según la NOM-059, dos especies según la UICN; Fig. 3). En el caso de los reptiles, aunque la proporción de especies amenazadas presentes en el APDC es mayor que en anfibios (una tercera parte (32%) según la NOM-059-SEMARNAT-2010, una especie según la UICN y 12% de las especies en categoría de vulnerabilidad ambiental alta; Fig. 3), tampoco podría considerarse alta. Sin embargo, para los reptiles es de resaltar que casi dos tercios (58%) de las especies presentes en el APDC no han sido evaluadas por la UICN; el registro de estas especies aporta información sobre su distribución y ecología que puede ser útil para que les sea asignada la categoría de riesgo de extinción más adecuada.

Figura 3 Especies de anfibios y de reptiles registradas en el Área de Protección y Desarrollo de Ceratozamia, en alguna categoría de riesgo de acuerdo con la Unión Internacional para la Conservación de la Naturaleza o la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 y en categorías de vulnerabilidad ambiental media y alta. a= Bolitoglossa mexicana, b= Bolitoglossa platydactyla, c= Bolitoglossa rufescens, d= Craugastor alfredi, e= Eleutherodactylus leprus, f= Lithobates brownorum, g= Corytophanes hernandesii, h= Sphaerodactylus glaucus, i= Imantodes cenchoa, j= Tropidodipsas sartorii, k= Kinosternon leucostomum y l= Chelydra rosignonii.
Las diferencias en composición de herpetozoos entre las tres reservas (APDC, PEJ, PET) muestran escenarios distintos para anfibios y reptiles. Por un lado, los anfibios tienen una composición de especies relativamente similar (valores de Bcc entre 0.27 y 0.48), mientras que la composición de reptiles tiende a ser distinta (valores de Bcc entre 0.46 y 0.69). Las diferencias en composición en ambos grupos pueden deberse a que cada reserva tiene algún tipo de vegetación distinto, como en el caso de PEJ, donde hay áreas cubiertas por bosque tropical perennifolio (Herrera et al., 2008) o en el caso de PET, que tiene áreas cubiertas por vegetación halófila, zonas de palmar, manglar y vegetación inundable (Cruz-Silva, 2012). En el caso de los reptiles, las diferencias en composición necesitan ser consideradas con precaución, puesto que es posible que los valores obtenidos se deban, en parte, a los bajos niveles de completitud (por debajo del 80%) en el inventario de especies en el APDC.
Nuestros resultados indican que por la riqueza de especies que alberga, las especies amenazadas de extinción y el número de especies (principalmente de reptiles) aún no evaluadas por la UICN, el APDC contribuye a la conservación de poblaciones de anfibios y reptiles en una zona altamente transformada del sur de México, en conjunto con las otra dos APPs, donde no existen otras áreas naturales protegidas (Bezaury-Creel et al., 2011) que garanticen la conservación de los herpetozoos (Urbina-Cardona & Flores-Villela, 2010). En conjunto, las tres reservas albergan el 53% (24 especies) de los 45 anfibios y el 43% (47 especies) de los 108 reptiles registrados en la región sur del estado de Veracruz (Pelcastre-Villafuerte & Flores-Villela, 1992) y el 20% de las 120 especies anfibios y el 17.5% de las 270 especies de reptiles registradas para el sureste de México (Johnson et al., 2010). El APDC y las otras dos APPs complementan la función de conservación biológica de la Reserva de la Biosfera de Los Tuxtlas bajo gobernanza gubernamental, localizada a 50 km en línea recta, pues aunque casi la totalidad de las especies de herpetozoos presentes en las tres reservas (excepto Bolitoglossa mexicana y Sceloporus variabilis) han sido registradas en Los Tuxtlas (López-Luna, 2017), su presencia en las tres APPs permite garantizar la permanencia de poblaciones en distintos puntos de su distribución.
Para garantizar el mantenimiento del mayor número de especies de anfibios y de reptiles, y potencialmente de otros grupos biológicos en la zona donde se ubican el APDC y las otras dos reservas privadas, es necesario implementar actividades que han probado ser efectivas en la conservación de anfibios y reptiles en paisajes modificados. Por ejemplo 1) la restauración ecológica de bosques que fueron transformados en pastizales inducidos y otros ambientes modificados (Smith et al., 2015; Díaz-García et al., 2017), 2) la protección de los bosques ribereños (Rodríguez-Mendoza & Pineda, 2010), 3) el establecimiento de cercas vivas (Pérez, 2002; Harvey et al., 2005) que ayudan al movimiento de algunas especies a través del paisaje y 4) proteger las zonas de vegetación secundaria en proceso de sucesión (Gillespie et al., 2012). Finalmente, se sugiere implementar programas de educación ambiental, con énfasis en la protección de las serpientes, las cuales son exterminadas por miedo (Wojnowski, 2010); así como de tortugas e iguanas que son consumidas con fines alimenticios (Morales-Mávil & Villa-Cañedo, 1998).











 nueva página del texto (beta)
nueva página del texto (beta)


