Introducción
Todo organismo posee una morfología de modo que satisfaga sus múltiples demandas funcionales (Aznar et al., 2002); un ejemplo de ello son los parásitos, que tienden a optimizar sus características de historia de vida para adaptarse localmente al entorno proporcionado por sus hospederos. Para lograr este objetivo, los organismos moldean sus características morfológicas, fisiológicas, conductuales, entre otras (Bush, 2009). En un contexto evolutivo y funcional, diversos aspectos de la morfología del Phyllum Acanthocephala (gusanos de cabeza espinosa), son modificados por los requerimientos de una fijación adecuada al microambiente (Petrochenko, 1956), por lo que poseen estructuras de anclaje que varían significativamente entre especies (Poulin, 2007). Otros autores han documentado diferencias entre especies en cuanto al tamaño, número, distribución y patrón de crecimiento en estructuras de fijación primaria (e.g. ganchos y probóscide) y secundaria (e.g. espinas troncales), así como en el cuerpo del gusano (Poulin, 2007; Hernández-Orts et al., 2012); también existen estudios que demuestran la existencia de variación fenotípica en estas estructuras a nivel intraespecífico (Aznar et al., 1999; Aznar et al., 2002) e intrasexual (Hernández-Orts et al., 2012); razones por las cuales se argumenta que los cambios morfológicos aparentemente simples, pueden haber desencadenado una cascada de modificaciones, así como nuevas funciones durante la adaptación de los acantocéfalos (Aznar et al., 1999).
No obstante lo anterior, estudios previos se han basado únicamente en morfometría lineal, que hace imposible dividir el tamaño y la forma de estructuras anatómicas para análisis separados, además de no proporcionar vías gráficas para localizar y comparar esta variación; entregándonos herramientas limitadas debido a que el tamaño, como dato numérico, es la base de sus análisis y no considera la geometría del objeto como una representación abstracta de la estructura (Corti et al., 2001; Toro et al., 2010). Estos límites han sido superados por la introducción de la morfometría geométrica, que tiene su origen en la estadística multivariada de datos geométricos (Rohlf & Marcus, 1993; Corti, 2001; Toro et al., 2010) y en donde la forma del objeto en estudio no se describe en términos de sus dimensiones, sino de la relación espacial entre sus partes y por lo tanto, la información relativa a la geometría de los objetos se puede recuperar; esto permite la visualización de los cambios morfológicos y señalar a posteriori, tanto estadística como visualmente, qué región o estructura está siendo modificada (Toro et al., 2010).
En el presente estudio, se utilizaron los dos tipos de morfometría para examinar la variación intraespecífica en Polymorphus trochus de dos aves acuáticas: Gallinula galeata y Fulica americana, ambas residentes del humedal Chimaliapan, Estado de México. Los análisis se enfocaron exclusivamente en los morfotipos y medidas de la probóscide, así como longitud de los ganchos, ya que estos caracteres son considerados las estructuras de fijación primaria por ser las principales responsables de mantener al parásito dentro del lumen intestinal. Se describe la anatomía del sistema de fijación de Polymorphus trochus, que es el acantocéfalo más común de la gallareta americana y raramente se encuentra en patos de Norteamérica (McDonald, 1988). Estos gusanos presentan un cuerpo ligeramente ensanchado en la parte anterior y cubierto con espinas cuticulares, el cuello es semi-cilíndrico, con forma de barril, sin espinas. Las hembras son de mayor longitud que los machos; además, esta especie tiene la particularidad de que su probóscide muestra dimorfismo sexual: es piriforme, muy hinchada en la base y con la porción terminal que se estrecha en una punta lisa en hembras y cilindroide pero con un ligero ensanchamiento terminal en machos (Van Cleave, 1945; Petrochenko, 1958; Amin, 1992).
Materiales y métodos
Sitio de estudio: colecta de hospederos y parásitos
Las aves acuáticas se obtuvieron por donación de cazadores locales durante el periodo comprendido entre febrero de 2016 y abril de 2017, en el Humedal Chimaliapan (19º 11’ 20’’ N; 99º 29’ 30’’ O; Martínez-Haro et al., 2012) perteneciente al Ejido de San Pedro Tultepec, en el municipio de Lerma, Estado de México (Fig. 1). Se utilizaron las guías de campo de Preston (1998) y de Van Perlo (2006) para la identificación taxonómica de las aves.

Figura 1 Ubicación del Humedal Chimaliapan (flecha pequeña). Tomado y modificado de Colón-Quezada (2009).
Las aves se trasladaron inmediatamente al laboratorio de Sistemas Biosustentables de la UAEMex, en donde se realizaron las necropsias y los exámenes helmintológicos de los intestinos de cada ave mediante el uso de un microscopio estereoscópico Olympus SZX7. Los acantocéfalos se extrajeron con ayuda de agujas de disección con cuidado de preservar la probóscide; a continuación, se colocaron en agua destilada y fueron sometidos a refrigeración por 24 horas para permitir la eversión de la probóscide (Salgado-Maldonado, 2009). Se fijaron con formol caliente al 4% y se conservaron en alcohol al 70% para posteriormente teñirlos con Paracarmín de Meyer y montarlos en preparaciones permanentes con bálsamo de Canadá (Salgado-Maldonado, 2009).
La identificación de especies parásitas se realizó de manera tradicional mediante las claves de Yamaguti (1963), McDonald (1988) y Amin (1992). El sexo de cada individuo se distinguió con base en el dimorfismo que presenta la probóscide de esta especie, así como a la observación de los órganos sexuales (Van Cleave, 1945; Petrochenko, 1958; Amin, 1992).
Se utilizaron un total de 81 P. trochus: 65 de F. americana en dos diferentes microhábitats, que corresponden a dos diferentes zonas del intestino delgado (1: yeyuno y 2: íleon); y 16 de G. galeata, ubicados únicamente en íleon (microhábitat 2). Las zonas del intestino se reconocieron mediante análisis microscópicos y macroscópicos (Sisson & Grossman, 2002).
Del total de gusanos, se eligieron 51 para los análisis de morfometría geométrica y 34 para los análisis de morfometría lineal; para ambos se utilizaron fotografías de la probóscide de los acantocéfalos tomadas a objetivo de 10x con un microscopio óptico Olympus BX41 con cámara integrada Olympus E-620. Ambos análisis se centraron específicamente en comparar los patrones de forma y variación del tamaño en relación con el sexo del parásito, la especie de hospedero y el microhábitat de los parásitos.
Morfometría lineal
Se utilizó el programa ImageJ para obtener las medidas lineales de largo y ancho de la probóscide de cada individuo, así como de la longitud y base de cada gancho de una hilera lateral completa (Petrochenko, 1956). La dimensionalidad de las variables obtenidas se redujo mediante el Análisis de Componentes Principales; posteriormente, una prueba de ANOVA permitió comparar las variables por hospedero, microhábitat y sexo del acantocéfalo. Estos datos también se emplearon en un análisis de conglomerados, que mediante el índice de disimilitud de Distancia Euclidiana reflejó las relaciones de similitud morfológica entre las especies en un dendrograma construido por el método de neighbor joining (Sneath & Sokal, 1973; Calle et al., 2008; Klingenberg et al., 2010).
Morfometría geométrica
Se analizó la probóscide mediante análisis de morfometría geométrica basada en puntos geométricos, y a partir de diferentes módulos del programa Integrated Morphometrics Package IMP6 y de la serie TPS (Zelditch et al., 2004), el cual genera un par de coordenadas (x, y) para cada marca registrada (Moreno-Barajas et al., 2013).
La forma de la probóscide se obtuvo mediante 2 landmarks en la base de la misma y 22 semilandmarks por todo el contorno de esta estructura, ubicados mediante 1 peine trazado con 2 puntos de apoyo localizados en la parte anterior y posterior (Fig. 2). Para todos los ejemplares analizados, se utilizaron los programas Makefan6 y tpsDig2.

Figura 2 Colocación de los puntos geométricos en la probóscide: 2 landmarks y 22 semilandmarks alrededor de la probóscide de P. trochus machos (1) y hembras (2). Los semilandmarks se ubicaron a partir de 2 puntos de apoyo y 1 peine.
Para evaluar la variación en la forma de la probóscide, las configuraciones de las marcas de cada organismo se ajustaron mediante el análisis de Procrustes en el módulo CoordGen6f, con la finalidad de eliminar toda la información no relacionada con la forma; posteriormente, se alinearon con el método de superimposición de Procrustes y un protocolo de alineación con el programa Semiland6, para eliminar el efecto de la ubicación, orientación y el tamaño (Moreno-Barajas et al., 2013). Los datos obtenidos se trabajaron con un Análisis de Componentes Principales en el software PCAGen6p, para identificar los caracteres que aportan mayor variación intraspecífica; además, permitió visualizar las variaciones de la forma mediante vectores y gradillas de deformación de cada grupo con la función de interpolación thin plate spline (Bookstein, 1991).
Finalmente, con el software CVAGen6 se realizó un Análisis de Variables Canónicas con reducción a 2 CP, para identificar la posible segregación entre grupos en función del sexo del acantocéfalo, hospedero y microhábitat (Moreno-Barajas et al., 2013).
Resultados
Morfometría lineal
De acuerdo con la dispersión de los datos mostrada en el Análisis de Componentes Principales (Fig. 3), los dos primeros componentes explican el 48.9% de la variación de los datos; gráficamente se observa una separación de acuerdo con el sexo de los organismos, en los que de acuerdo con el CP1 (26.4%), las hembras presentan mayor longitud en los ganchos 9 y 10, así como en la base de los ganchos 8 y 10, mientras que los machos presentan menor longitud en el gancho 1 así como su base. El CP2 (22.5%) indica que las hembras tienen una mayor anchura en la probóscide y los machos menor longitud en los ganchos 5, 6 y la base del gancho 1; el análisis no señala variación de acuerdo con el microhábitat. Posteriormente, el análisis de ANOVA (Fig. 4) demostró la existencia de diferencias significativas intersexos en el tamaño de los ganchos, siendo las hembras las que presentaron los de mayor tamaño. Entre los machos, se observa que los ubicados en el íleon mostraron los ganchos más grandes (F(5,28) 6.52, p = 0.0004).

Figura 3 Variación de los datos de acuerdo con el Análisis de Componentes Principales. El CP1 explica 26.4% y el CP2 el 22.5%. Se notan agrupaciones de acuerdo con el sexo, en donde las hembras tienen las mayores cargas en las variables medidas.

Figura 4 Comparación intragrupos de medias ± DE del CP1, componente compuesto por la contribución parcial de cada variable morfométrica medida.
En el dendrograma del análisis de conglomerados (Fig. 5), se observa la formación de cuatro grupos (Distancia Euclidiana = 0.75) con base en los ganchos y la probóscide; el grupo I (35.3% del total) y II (29.4%) está constituido por hembras, excepto los individuos 29 y 30 que son machos, los grupos III (29.4%) y IV (5.8%), se constituyen únicamente por machos. No se muestra una agrupación debido a la especie de hospedero ni al microhábitat
Morfometría geométrica
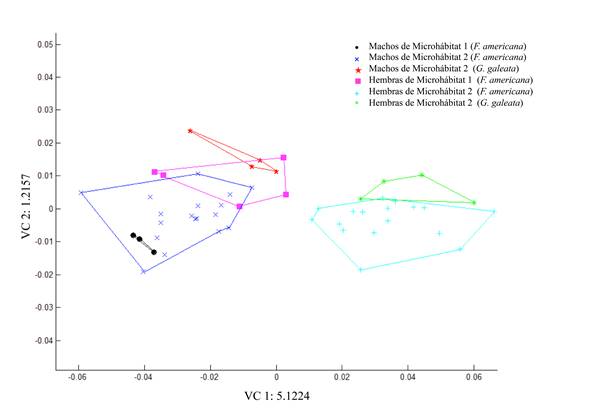
Los morfotipos obtenidos a partir de las gradillas de deformación indican que el cambio en la forma de la probóscide está relacionado con el grosor de la base a la parte media de esta estructura. En las hembras del microhábitat 2 de ambas especies de hospederos, este ensanchamiento es más pronunciado y direccionado hacia el centro de esta estructura; el resto de los organismos (machos y hembras del microhábitat 1) muestran desplazamientos hacia el exterior de la probóscide. Con respecto al tamaño, los desplazamientos hacia el exterior son más pronunciados en los gusanos encontrados en el microhábitat 2 y más aún en aquellos de G. galeata, por lo que tienden a ser de mayor tamaño (Fig. 6). El Análisis de Componentes Principales indica que los dos primeros componentes explican más del 78% de la varianza de la forma de las probóscides analizadas (Fig. 7).
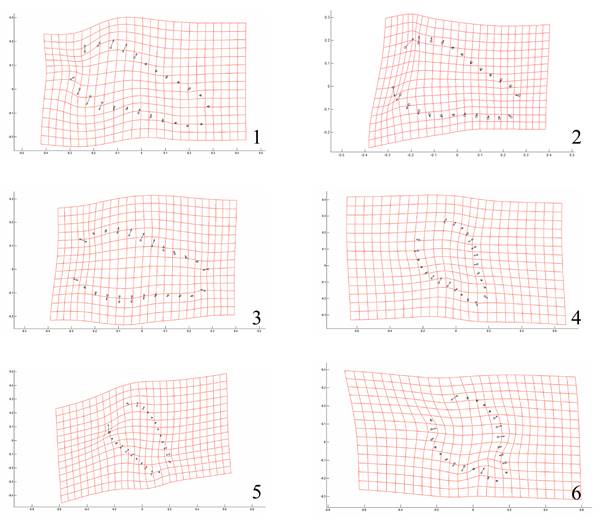
Figura 6 Gradillas de deformación de la probóscide de P. trochus por sexo, microhábitat y hospedero (1: machos de yeyuno de F. americana; 2: hembras de yeyuno de F. americana, 3: machos de íleon de F. americana; 4: hembras de íleon de F. americana; 5: machos de íleon de G. galeata; 6: hembras de íleon de G. galeata). Los puntos indican la media, y las flechas la deformación de la estructura.
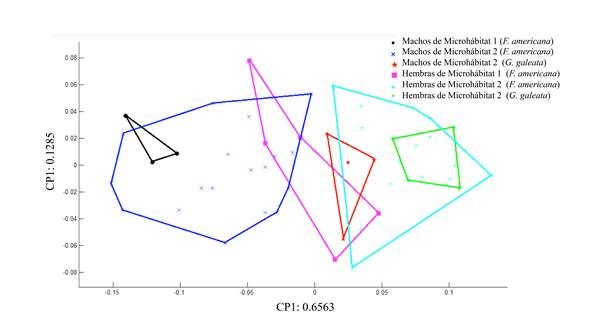
Figura 7 Análisis de Componentes Principales que indica la variación de la forma de la probóscide de P. trochus por sexo, microhábitat y hospedero.
El Análisis de Variables Canónicas (VC1: 5.1224 y VC2: 1.2157; eje1: λ = 0.0464, χ2 = 135.0723, df = 30, p = 2.77556e-015; eje2: λ = 0.2843, χ2 = 55.3462, df = 20, p = 3.64449e-005) separa los datos en dos grupos, de acuerdo con el microhábitat y el sexo. El Grupo 1 (a la derecha de la VC1) está integrado por hembras del microhábitat 1 de F. americana y todos los machos de ambos hospederos en ambos microhábitats. En el Grupo 2 (izquierda de la VC1), se ubican las hembras colectadas en el microhábitat 2 de ambos hospederos (Fig. 8).
Discusión
El presente estudio sugiere que existen variaciones morfológicas de la probóscide de los acantocéfalos de acuerdo con el sexo, lo que confirma de manera analítica el dimorfismo característico de la especie registrado por Van Cleave (1945); sin embargo, este autor únicamente indica diferencias en la forma, mientras que en este estudio se observa que existe también dimorfismo de acuerdo con el tamaño de los ganchos. El microhábitat también modificó la forma de esta estructura, ya que el grupo de hembras encontradas en el íleon muestran morfotipos distintos a todos los machos y a las hembras encontradas en el yeyuno.
La similitud en la probóscide de machos con las hembras del yeyuno está moldeada por el desarrollo del gusano y los procesos reproductores, ya que diversas especies (como es el caso de los géneros Corynosoma, Moniliformis, entre otros) presentan patrones de migración a través del lumen intestinal hacia el yeyuno inferior y el íleon, mientras maduran, copulan y ovipositan; por lo tanto, las formas observadas, pueden ser el resultado de dinámicas de fijación, competencia intraespecífica o ambas, hasta llegar a su fijación permanente en el intestino (George-Nascimento & Marin, 1992; Aznar et al., 2004). Esto se complementa con las fases reproductoras que se observaron para las hembras localizadas en el yeyuno, las cuáles presentaron estructuras reproductoras en diferentes estadios de maduración y de menor tamaño, mientras que las encontradas en el íleon tenían el aparato reproductor completamente desarrollado y en su mayoría se encontraban grávidas (Abele & Gilchrist, 1977; Aznar et al., 2001).
Por otra parte, se ha descrito en estudios previos que las hembras jóvenes al madurar, trasladarse y establecerse en el íleon, modifican la estructura de fijación para permanecer en el hospedero definitivo el mayor tiempo posible (Petrochenko, 1956). En el presente estudio, dicha modificación consiste en un ensanchamiento de la probóscide, que da como resultado una forma abultada e irregular, capaz de mantener una sujeción mayormente efectiva en las paredes intestinales, que les permita a las hembras incubar y expulsar los huevos en este microambiente, y así iniciar nuevamente el ciclo de vida.
Los resultados del presente estudio concuerdan con lo observado en la probóscide de otras especies de acantocéfalos (e. g. Filicolis, Polymorphus y Pomphorhynchus spp.), los cuales experimentan cambios progresivos al establecerse en el hospedero definitivo, donde una hinchazón de tamaño considerable se presenta justo en la base de la estructura, lo que permite una inserción total en la pared intestinal (Van Cleave, 1952, Bush et al., 2001).
Con respecto a los machos, que son más activos ya que se mueven para alcanzar y copular a tantas hembras como sea posible (Parshad & Crompton, 1981), presentan estructuras adaptadas a una activa fijación y desprendimiento de la pared intestinal para ir en contra del movimiento peristáltico y forma sigmoidea del intestino (Abele & Gilchrist, 1977). Estos resultados permiten sugerir que tanto los machos como las fases inmaduras de las hembras, presentan morfologías de la probóscide similares como una adaptación a la migración dentro del intestino, hasta su fijación permanente.
Por otro lado, los análisis de morfometría lineal no arrojaron variaciones en la longitud de los ganchos a nivel interhospedero, lo cual puede deberse a que, de acuerdo con lo reportado para varias especies, la inversión en la fijación se hace antes de establecerse en el hospedero definitivo, por lo tanto los ganchos están casi o completamente desarrollados en la fase de cistacanto dentro del hospedero intermediario, quizás como una prioridad de inversión energética del gusano en el desarrollo para asegurar el establecimiento exitoso al llegar al hospedero definitivo (Van Cleave, 1952; Petrochenko, 1956; Podesta & Holmes, 1970; Miller & Dunagan, 1985; Taraschewski, 2000) lo cual está en proceso de validación para esta especie.
La variación intraespecífica sugiere que P. trochus desarrolla estructuras de fijación de acuerdo con los requerimientos de fijación permanente del parásito dentro de los diferentes microhábitats. Además, los análisis geométricos fueron más significativos que los lineales al separar las hembras y los machos con respecto al microambiente y fase reproductora. Finalmente, en este estudio se comprueba de manera analítica que el dimorfismo sexual en esta especie no se limita a la forma, como tradicionalmente se ha descrito, sino que también debe considerarse el tamaño y la forma de la probóscide, así como la longitud de los ganchos.











 nueva página del texto (beta)
nueva página del texto (beta)