Introducción
México posee una alta riqueza florística y faunística que le confieren el título de país megadiverso (Flores-Villela & Canseco-Márquez, 2004; Ochoa-Ochoa & Flores-Villela, 2006). Su territorio representa el 1.4% de la superficie de la tierra, y alberga entre el 10 y 12% de la biodiversidad del planeta (Sarukhán et al., 2009; Wilson & Johnson, 2010). En cuanto a su herpetofauna, esta comprende 1,292 especies (394 anfibios y 898 reptiles), es decir, el 9.8% de las especies del mundo y el 64% de las especies de Mesoamérica, de las cuales, el 68.3% de los anfibios (269 especies) y el 58.4% de los reptiles (524 especies) son endémicos a México (Ochoa-Ochoa & Flores-Villela, 2006; Wilson & Townsend, 2010; Johnson et al., 2017; Wilson et al., 2017). Esta diversidad es producto de la variada topografía y de la diversidad de climas que presenta el país, además de su intrincada historia geológica y de su posición geográfica entre las regiones Neártica y Neotropical (Flores-Villela & Canseco-Márquez, 2004; Espinosa-Organista et al., 2008). La herpetofauna mexicana se distribuye en diferentes regiones fisiográficas de México, como la Faja Volcánica Transmexicana (FVT), la cual se caracteriza por su alta riqueza y endemicidad de especies (Johnson et al., 2017; Woolrich-Piña et al., 2017). Esta región ha sido objeto de diversos estudios que analizan la riqueza y diversidad de anfibios y reptiles tanto en ambientes templados como tropicales (p.e. Vite-Silva et al., 2010; Medina-Aguilar et al., 2011; Ramírez-Bautista et al., 2014; Chávez-Ávila et al., 2015; Cruz-Elizalde et al., 2016; Díaz de la Vega-Pérez et al., 2016; Cruz-Elizalde et al., 2018), los cuales destacan su importancia herpetofaunística.
A pesar de que el conocimiento sobre anfibios y reptiles de México ha avanzado en los últimos años, aún existen varias áreas del país con poca información acerca de su riqueza específica y diversidad. Tal es el caso del área natural protegida Parque Nacional Iztaccíhuatl-Popocatépetl-Zoquiapan (PNIPZ) del cual, a pesar de su importancia, solo se cuenta con inventarios parciales (ver Lemos-Espinal & Amaya-Elías, 1985; Vega-López & Álvarez-Solórzano, 1992; Uribe-Peña et al., 1999; Ramírez-Bautista et al., 2009; Woolrich-Piña et al., 2017; Cruz-Elizalde et al., 2018).
Dentro del PNIPZ se encuentra la Estación Forestal Experimental Zoquiapan (EFEZ), un área dedicada a la enseñanza, investigación, protección, conservación, difusión y manejo sustentable de los recursos naturales. La mayor parte de los estudios efectuados en la estación han sido orientados a la ecología de poblaciones y reproducción tanto de anfibios como de lacertilios (p.e. Eliosa-León, 1990; Cuéllar et al., 1996; Andrews et al., 1997; Andrews et al., 1999; Hernández-Gallegos et al., 2002; Rodríguez-Romero et al., 2002; Zúñiga-Vega et al., 2008; Bastiaans, 2013). Sin embargo, hay pocos estudios enfocados a ecología de comunidades (ver Maass et al., 1981; Pérez-Roblero, 2014), los cuales no representan cuantitativamente la diversidad de anfibios y reptiles de la EFEZ y de sus hábitats. Esto hace evidente la necesidad de desarrollar estudios que proporcionen información actualizada y confiable sobre las comunidades herpetofaunísticas.
Este trabajo tuvo por objetivo analizar la composición, riqueza, abundancia y diversidad de las comunidades de anfibios y reptiles en los principales hábitats templados (Pino, Pino-Aile y Pino-Oyamel) que se encuentran en la EFEZ. Adicionalmente, se proporciona información sobre el estatus de distribución y conservación de las especies presentes en el área de estudio. Se espera que los resultados de este trabajo permitan el planteamiento de estudios en ecología, que den la pauta para el desarrollo de iniciativas futuras de manejo y conservación de este grupo de vertebrados.
Materiales y métodos
Área de estudio
La Estación Forestal Experimental Zoquiapan (EFEZ) (19° 12' 30'' y 19° 20' 00'' N, 98° 30' 00'' y 98° 42' 30'' O), con una superficie de 1,636 ha, presenta elevaciones que van de los 3,080 a 3,690 msnm. Se ubica en los límites del Estado de México y Puebla, en la porción norte del Parque Nacional Iztaccíhuatl-Popocatépetl-Zoquiapan (PNIPZ) (Fig. 1). Forma parte del sistema orográfico de la Sierra Nevada, región centro-oriental de la FVT (Maass et al., 1981; CONABIO, 2011). Su clima es templado subhúmedo tipo C (w2’’) (w) (b’) ig, con un régimen de lluvias en verano e inviernos secos. La temperatura media anual es de 7.4°C, la máxima se presenta en junio y la mínima entre noviembre y enero. La precipitación media anual es de 964.1 mm, la máxima ocurre en junio y la mínima en marzo (Mendoza, 1977).

Figura 1 Ubicación de la Estación Forestal Experimental Zoquiapan, México (mapa desarrollado por el Biól. Gilberto Hernández Cárdenas).
La vegetación está conformada por comunidades de Pinus (Pinus hartwegii, P. montezumae, P. leiophylla, P. pseudostrobus, P. rudis y P. teocote), Abies (Abies religiosa), Alnus (Alnus firmifolia y A. jorullensis) y Quercus (Quercus laurina, Q. rugosa, Q. peduncularis y Q. crassipes), así como por sotobosque compuesto por varias especies de pasto tipo zacatal, de los géneros Festuca, Muhlenbergia y Agrostis (Rzedowski, 2006).
Previo al trabajo de campo se seleccionaron tres hábitats con diferentes características de vegetación y pendientes, con base a la propuesta de Zavala (1984), quien caracterizó la comunidad vegetal de la EFEZ. Los hábitats seleccionados fueron: a) Pino, conformado por bosque de P. hartwegii, con terrenos casi planos o poca pendiente, b) Pino-Aile, conformado por bosque de P. hartwegii-A. firmifolia, con pendientes de 10 a 30%, c) Pino-Oyamel, conformado por bosque de P. hartwegii-A. religiosa y pendientes de 30 a 50%. Cabe señalar, que estos tres tipos de asociaciones vegetales son las más representativas dentro de la EFEZ.
Muestreo de anfibios y reptiles
El trabajo de campo se llevó a cabo en tres periodos, en los meses de mayo-julio y septiembre-noviembre de 2015, y de enero-marzo de 2016. Durante cada periodo se realizaron tres salidas a cada uno de los hábitats mencionados previamente, con una duración de tres días cada una. El esfuerzo de muestreo fue de 9 h/persona por hábitat y sesión de muestreo, resultando en 243 h/persona por hábitat al final del estudio. El método de muestreo para cada uno de los hábitats consistió en recorridos sistemáticos a lo largo de transectos en banda de 1,000 m de largo por 10 m de ancho (Brower et al., 1997; p. 87; Gallina & López, 2011; p. 44), en un horario de 10:00 a 19:00 horas. Los organismos se observaron y capturaron mediante encuentros visuales y búsquedas activas en todos los microhábitats disponibles como son rocas, troncos, tocones, cortezas, árboles, arbustos, hierbas, hojarasca, suelo, oquedades y cuerpos de agua (charcas y arroyos) (Casas-Andreu et al., 1991; p. 26).
La captura de los anfibios y reptiles se efectuó mediante técnicas convencionales propuestas por Casas-Andreu et al. (1991). Los anfibios se capturaron directamente con la mano; las lagartijas con ayuda de ligas herpetológicas para inmovilizarlas, lazadas y con la mano; las serpientes no venenosas fueron capturadas directamente con la mano y las venenosas con la ayuda de ganchos, guantes y tubos herpetológicos. Cada individuo capturado u observado en campo fue identificado in situ a nivel de especie utilizando las claves taxonómicas y descripciones de Vega-López y Álvarez-Solórzano (1992), Flores-Villela et al. (1995), Uribe-Peña et al. (1999) y Ramírez-Bautista et al. (2009). Posteriormente fueron liberados en el mismo lugar de su captura.
Análisis de datos
Se generaron curvas de acumulación de especies para cada uno de los hábitats y para la EFEZ (Colwell et al., 2004). Para estimar el número de especies esperadas se utilizaron los estimadores no paramétricos ACE y Chao 1, debido a que éstos se basan en la abundancia de cada especie a partir de una muestra representativa (Halffter et al., 2001). Se utilizó como unidad de esfuerzo el número de días de muestreo y las curvas se construyeron con 100 aleatorizaciones, para ello se usó el programa EstimateS, versión 8.2 (Colwell, 2006).
Los datos de riqueza y abundancia cumplieron con los supuestos de normalidad y homocedasticidad, por lo que se usó un ANDEVA para determinar si existían diferencias entre los distintos hábitats en cuanto a su riqueza y abundancia. Posteriormente, se realizó una prueba de Tukey-Kramer para identificar cuáles de estos hábitats fueron diferentes entre sí, utilizando para ello el programa NCSS, versión 11.0.12 (NCSS 11 Statistical Software, 2016).
La diversidad de anfibios y reptiles se calculó para cada hábitat mediante el exponencial del índice Shannon, como medida de diversidad de primer orden (Jost, 2006, 2007), en el cual todas las especies son consideras en el valor de diversidad, ponderadas proporcionalmente según su abundancia en la comunidad (Hill, 1973; Jost, 2006; Tuomisto, 2010a, b; Moreno et al., 2011). La ecuación se representa 1 D = exp(H'), donde 1 D es la diversidad verdadera de orden 1, y exp(H') es el exponencial del índice de entropía de Shannon. Esta medida de diversidad se calculó empleando el programa PAST, versión 3.23 (Hammer et al., 2001).
La distribución observada de la abundancia de anfibios y reptiles se comparó con distintos modelos teóricos de distribución de abundancias de las especies (Serie geométrica, Serie logarítmica, Normal logarítmica y Vara quebrada) (Magurran & McGill, 2011) con una prueba de bondad de ajuste de (2, utilizando para ello el programa PAST, versión 3.23 (Hammer et al., 2001).
Para comparar gráficamente la composición, abundancia y dominancia de las especies entre los hábitats, se elaboraron curvas de rango-abundancia o de Whittaker, usando el logaritmo de la abundancia relativa de cada especie registrada (Feinsinger, 2003).
Con la información obtenida de los registros en campo se elaboró una lista de las especies y se determinó su estatus de distribución y conservación. El estatus de distribución de las especies se consideró a partir de su endemicidad: endémica o no a México, y a la FVT, de acuerdo con Johnson et al. (2017) y Woolrich-Piña et al. (2017). El estatus de conservación de las especies se determinó con base en la NOM-059-2010 (SEMARNAT, 2018) y la lista roja de la IUCN (2018).
Resultados
Con un total de 4,762 individuos, la herpetofauna de la EFEZ está integrada por tres órdenes, siete familias, diez géneros y 15 especies (cinco anfibios y diez reptiles) (Cuadro 1). Para los anfibios, la familia Plethodontidae fue la de mayor riqueza con tres especies (60%). En los reptiles, las lagartijas de la familia Phrynosomatidae (cuatro especies; 40%) y las culebras de la familia Natricidae (tres especies; 30%) fueron los reptiles mejor representados (Cuadro 2).
Cuadro 1 Herpetofauna de la Estación Forestal Experimental Zoquiapan, México.
| Clase | Orden | Suborden | Familias | Géneros | Especies |
|---|---|---|---|---|---|
| Amphibia | Anura | 1 | 1 | 2 | |
| Caudata | 1 | 3 | 3 | ||
| Reptilia | Squamata | Lacertilia | 3 | 3 | 6 |
| Serpentes | 2 | 3 | 4 | ||
| Total | 7 | 10 | 15 |
Cuadro 2 Lista de especies de anfibios y reptiles registradas en la Estación Forestal Experimental Zoquiapan, México. Hábitat: P = Pino, PA = Pino-Aile, PO = Pino-Oyamel. Endemicidad: EM = Endémica a México, EFVT = Endémica a la Faja Volcánica Transmexicana, NE = No Endémica a México. Categorías de conservación. NOM-059-2010 (SEMARNAT, 2018): A = Amenazada, Pr = Sujeta a Protección especial, NE = No enlistada. Lista roja de la IUCN (2018): EN = En peligro, VU = Vulnerable, NT = Casi amenazada, LC = De preocupación menor. El acrónimo (letra) hace referencia a cada especie en la Figura 4.
| Nombre científico | Tipos de hábitat | Endemicidad | Categorías de conservación | Acrónimo | |||
|---|---|---|---|---|---|---|---|
| P | PA | PO | NOM-059 | IUCN | |||
| Clase Amphibia | |||||||
| Orden Anura | |||||||
| Familia Hylidae | |||||||
| Dryophytes eximius Baird, 1854 | X | X | X | EM | NE | LC | A |
| Dryophytes plicatus Brocchi, 1877 | X | X | X | EFVT | A | LC | B |
| Orden Caudata | |||||||
| Familia Plethodontidae | |||||||
| Aquiloeurycea cephalica (Cope, 1865) | X | X | X | EFVT | A | NT | C |
| Chiropterotriton orculus (Cope, 1865) | X | EFVT | Pr | VU | D | ||
| Pseudoeurycea leprosa (Cope, 1869) | X | X | X | EFVT | A | VU | E |
| Clase Reptilia | |||||||
| Orden Squamata | |||||||
| Suborden Lacertilia | |||||||
| Familia Anguidae | |||||||
| Barisia imbricata (Wiegmann, 1928) | X | X | X | EM | Pr | LC | F |
| Familia Phrynosomatidae | |||||||
| Sceloporus aeneus Wiegmann, 1828 | X | X | X | EFVT | NE | LC | G |
| Sceloporus bicanthalis Smith, 1937 | X | X | X | EFVT | NE | LC | H |
| Sceloporus grammicus Wiegmann, 1828 | X | X | X | NE | Pr | LC | I |
| Sceloporus mucronatus Cope, 1885 | X | X | X | EFVT | NE | LC | J |
| Familia Scincidae | |||||||
| Plestiodon copei (Taylor, 1933) | X | X | X | EFVT | Pr | LC | K |
| Suborden Serpentes | |||||||
| Familia Natricidae | |||||||
| Storeria storerioides (Cope, 1865) | X | X | X | EM | NE | LC | L |
| Thamnophis eques (Reuss, 1834) | X | X | NE | A | LC | M | |
| Thamnophis melanogaster (Peters, 1864) | X | X | X | EM | A | EN | N |
| Familia Viperidae | |||||||
| Crotalus triseriatus (Wagler, 1830) | X | X | X | EFVT | NE | LC | Ñ |
Los estimadores no paramétricos ACE y Chao 1 predijeron un total de 16 especies, con un 100% de la completitud del inventario. Por hábitat, en Pino se registraron 14 especies de las 16 y 15 especies estimadas por ACE y Chao 1, con una completitud del inventario del 88% y 93%, respectivamente. En Pino-Aile se encontraron 15 especies de las 16 esperadas por ACE, lo que indica que falta por registrar solo el 6% para completar el inventario. Mientras que en Pino-Oyamel el 100% de las especies de anfibios y reptiles fueron colectados (13 especies) (Fig. 2).
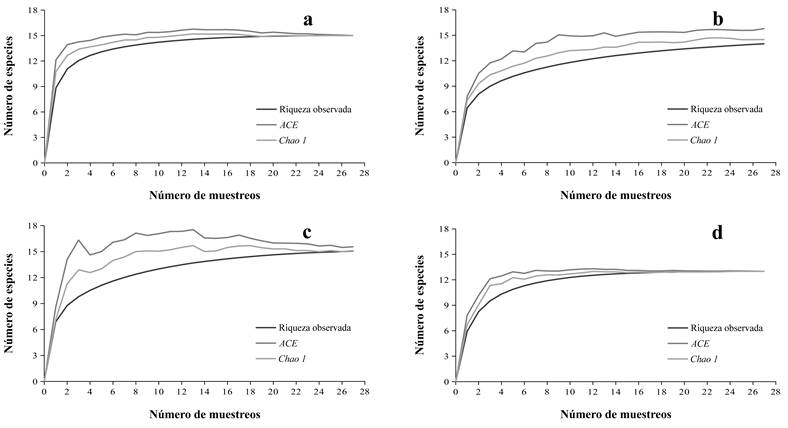
Figura 2 Curvas de acumulación de especies de anfibios y reptiles para la EFEZ y por hábitat: a) Total, b) Pino, c) Pino-Aile, d) Pino-Oyamel. Riqueza observada y estimada (ACE y Chao 1) de la Estación Forestal Experimental Zoquiapan, México.
El hábitat con mayor cantidad de especies fue Pino-Aile con 15, seguido por Pino y Pino-Oyamel con 14 y 13 especies, respectivamente. Sin embargo, no se encontraron diferencias significativas entre los hábitats (F = 2.34; g.l. = 2; P = 0.10). En cuanto a la abundancia, los hábitats Pino (
De acuerdo con los valores de diversidad verdadera de Shannon, el hábitat Pino-Aile presentó el mayor valor con 1 D = 5.16 que, a su vez, presentó el mayor número de especies, seguido por Pino-Oyamel con 1 D = 4.01, y por último Pino, con 1 D = 3.84. Esto significa, que Pino-Aile es 1.29 (22.3%) veces más diverso que Pino-Oyamel y 1.34 (25.6%) veces más que Pino. Mientras que Pino-Oyamel tiene 1.04 (4.2%) veces mayor diversidad que Pino.
La distribución de abundancias de las especies se ajustó al modelo de la serie logarítmica de Fisher (pocas especies abundantes y muchas especies raras) (McGill, 2011) con ( = 5.61 y x = 0.93 (Fig. 3). La diferencia entre la distribución esperada y la observada no fue significativa ((2 = 12.52; g.l. = 15; P = 0.08).
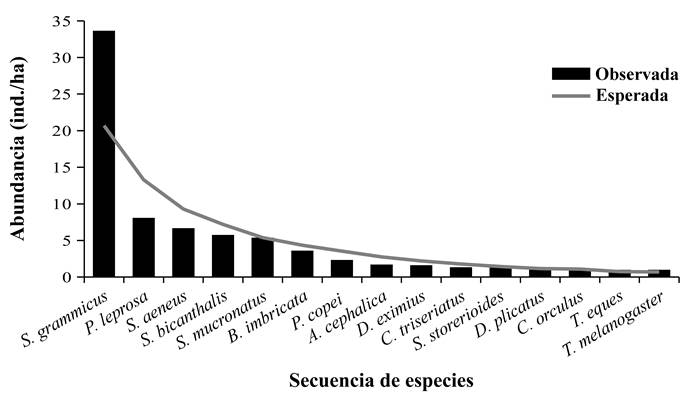
Figura 3 Distribución de abundancias de las especies de anfibios y reptiles de la Estación Forestal Experimental Zoquiapan, México.
Las curvas de rango-abundancia mostraron que la composición y distribución de abundancias de las especies entre hábitats fueron muy similares, una especie muy abundante y muchas especies raras (Fig. 4). La lagartija Sceloporus grammicus (I) fue la especie dominante en los tres hábitats. Las especies que presentaron mayor abundancia por debajo de S. grammicus, difirieron entre los hábitats. En el caso de Pino fueron las lagartijas Sceloporus bicanthalis (H) y Sceloporus mucronatus (J), y la salamandra Pseudoeurycea leprosa (E), aunque la distribución de abundancias de las especies fue la menos equitativa. En Pino-Aile fueron la salamandra P. leprosa (E) y las lagartijas Sceloporus aeneus (G) y S. mucronatus (J). En Pino-Oyamel fueron la lagartija Barisia imbricata (F), la salamandra P. leprosa (E), y la lagartija S. bicanthalis (H). En el grupo de las serpientes todas fueron especies raras debido a su baja representatividad en los tres hábitats.
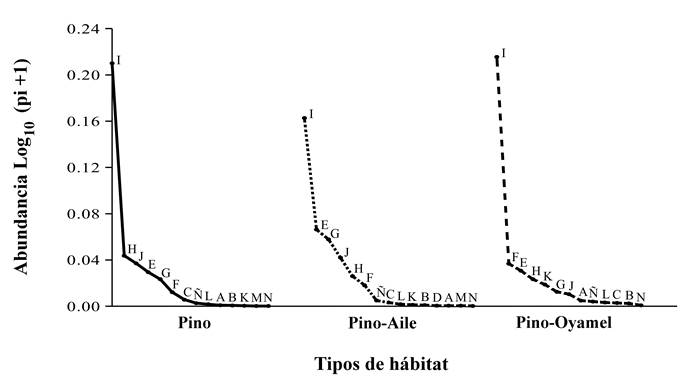
Figura 4 Curvas de rango-abundancia de anfibios y reptiles para cada hábitat (Pino, Pino-Aile y Pino-Oyamel) de la Estación Forestal Experimental Zoquiapan, México. Las letras representan a las especies (ver Cuadro 2).
De las 15 especies registradas, 13 son endémicas a México y nueve a la FVT. Un total de nueve especies se encuentran en alguna categoría de riesgo en la Norma Oficial Mexicana NOM-059-2010 (SEMARNAT, 2018), cinco como amenazadas y cuatro sujetas a protección especial, mientras que en la lista roja de la IUCN (2018) 11 especies se consideran en preocupación menor, dos vulnerables, una casi amenazada y una en peligro (Cuadro 2).
Discusión
La EFEZ representa el 4.1% de la superficie del PNIPZ y tiene una riqueza que concentra el 27.8% del total de especies registradas para el parque. Adicionalmente, ocupa solo el 0.22% de la superficie del Valle de México e incluye el 21.7% de su herpetofauna. Respecto al número de especies registradas en otros parques nacionales del centro de México, la zona de estudio posee una cifra cercana a La Malinche y El Chico, con 21 y 22 especies respectivamente, los cuales presentan una superficie mayor (Cuadro 3). Por lo que, en términos de la relación especies-área se podría considerar que la riqueza de anfibios y reptiles de la EFEZ es alta. De esta manera, el número de especies obtenido en la zona demuestra la importancia ecológica de esta respecto a la diversidad biológica que alberga la región. Asimismo, denota la necesidad de llevar a cabo estudios acerca de la riqueza y distribución de los anfibios y reptiles que habitan en los bosques templados del PNIPZ.
Cuadro 3 Comparación de la superficie y número de especies de anfibios y reptiles de la Estación Forestal Experimental Zoquiapan (EFEZ), con respecto al Valle de México (VM), Parque Nacional La Malinche (PNM), Parque Nacional Iztaccíhuatl-Popocatépetl-Zoquiapan (PNIPZ), Parque Nacional Pico de Orizaba (PNPO), Parque Nacional El Chico (PNCH) y Parque Nacional Cumbres del Ajusco (PNCA). Fuentes: 1Ramírez-Bautista et al. (2009); 2Cruz-Elizalde et al. (2016); 3Sánchez (2005); 4Uribe-Peña et al. (1999); 5Woolrich-Piña et al. (2017); 6Cruz-Elizalde et al. (2018); 7Granados-Sánchez et al. (2004); 8Presente estudio.
| Superficie (ha) | Anfibios | Reptiles | Total | |
|---|---|---|---|---|
| VM1,2 | 750,000 | 24 | 45 | 69 |
| PNM3,5 | 45,711 | 7 | 14 | 21 |
| PNIPZ4,1,5,6 | 39,819 | 18 | 36 | 54 |
| PNPO5 | 19,750 | 15 | 37 | 52 |
| PNCH6 | 2,739 | 8 | 14 | 22 |
| PNCA7 | 920 | 6 | 13 | 19 |
| EFEZ8 | 1,627 | 5 | 10 | 15 |
La riqueza de herpetozoos obtenida se puede atribuir a la ubicación de la zona de estudio. Esta es parte de la cadena montañosa Sierra Nevada, un área importante desde el punto de vista biogeográfico puesto que forma parte de la FVT, un centro importante de endemismos y diversificación (Arriaga et al., 2000; Ramírez-Bautista et al., 2009; Woolrich-Piña et al., 2017). Aunado a ello, los bosques templados de montaña, como los del presente estudio, albergan una alta riqueza de especies (Flores-Villela & Martínez-Salazar, 2009), debido a la combinación de los factores bióticos y abióticos que originan heterogeneidad ambiental y favorecen la presencia de una herpetofauna diversa (Wilson et al., 2010).
Las curvas de acumulación de especies para la EFEZ y para el hábitat Pino-Oyamel, alcanzaron una fase asintótica definida. Esto indica que no se requiere aplicar un mayor esfuerzo de muestreo y que el inventario está completo, registrándose el 100% de las especies estimadas. Por otra parte, en los hábitats Pino y Pino-Aile, las curvas de acumulación presentaron una tendencia asintótica, indicando que el inventario de especies está prácticamente completo, observándose entre 88% y 94% de las especies esperadas, un porcentaje considerado como una buena representatividad del muestreo (Villarreal et al., 2006). Si bien, los resultados demuestran la efectividad de los muestreos, de intensificarse el esfuerzo de muestreo, existe la posibilidad de adicionar al inventario otras especies que se distribuyen en el área, principalmente aquellas con una baja abundancia, como son las serpientes, ya que en tanto más especies raras se tengan reportadas, el número de especies que queden por registrar será mayor (Jiménez-Valverde & Hortal, 2003). Estas especies podrían ser encontradas particularmente en los hábitats Pino-Aile y Pino, donde las curvas de acumulación de especies generadas no alcanzaron la asíntota. Por ejemplo, se podría adicionar a la lista de especies del presente estudio a Thamnophis scaliger (Jan, 1863), una especie poco frecuente reportada en la EFEZ (ver Pérez-Roblero, 2014). No obstante, el presente trabajo constituye un aporte sustancial para la herpetofauna que se distribuye en el PNIPZ.
Los hábitats Pino y Pino-Aile presentaron el mayor número de especies y abundancia de individuos, en particular de lacertilios. Una explicación de ello puede deberse a que estos hábitats han sido sujetos a la tala de árboles (Maass et al., 1981; Zavala, 1984; Cibrián & Cibrián, 2007; Arriola-Padilla et al., 2014). Se ha reportado que la abundancia de la herpetofauna frecuentemente se incrementa en las áreas taladas (Fredericksen & Fredericksen, 2002), debido a que esta práctica genera claros en los bosques por la apertura del dosel, los cuales son ocupados por especies generalistas como los lacertilios, aumentando sus abundancias poblacionales (Vitt et al., 1998) debido al incremento de la temperatura (Pearman, 1997; Fredericksen et al., 2000).
Por el contrario, se ha observado que esta práctica limita el establecimiento y permanencia de especies con requerimientos específicos de hábitat (Aldape-López & Santos-Moreno, 2016). Por ejemplo, se ha demostrado que la abundancia de algunas especies de anfibios decrece en las áreas taladas, debido a su alta filopatría a sitios húmedos, y en particular, porque no encuentran el ambiente con las condiciones microclimáticas que favorezcan su permanencia (Petranka et al., 1994; Dupuis et al., 1995; Pearman, 1997; Waldick, 1997; Vitt et al., 1998; Fredericksen et al., 2000; Pineda & Halffter, 2004). Bajo este escenario, los anfibios pudieron verse restringidos en los hábitats Pino y Pino-Aile, posiblemente por la mayor incidencia directa del sol sobre el suelo, al aumento en la temperatura microambiental y, por ende, al descenso de la humedad, derivadas de la tala (Pearman, 1997; Fredericksen et al., 2000; García-R et al., 2005).
Otra particularidad de los hábitats Pino y Pino-Aile del presente estudio son sus características topográficas como el relieve accidentado (Zavala, 1984). Este factor, junto con la actividad humana (tala), podría también explicar la preponderancia de lacertilios en estos hábitats. Se ha observado que estos factores proporcionan heterogeneidad ambiental para la herpetofauna, contribuyendo a una mayor variedad de tipos de microhábitats disponibles (Pianka, 1966). Algunos estudios señalan que, si el número de microhábitats es alto, las poblaciones de saurios también serán abundantes, debido a la alta explotación de los mismos (Cruz-Elizalde & Ramírez-Bautista, 2012; Vitt & Caldwell, 2014).
En contraste, el menor número de especies y abundancia de individuos se encontraron en Pino-Oyamel. Esto puede deberse posiblemente a que este hábitat presenta alta humedad y un dosel cerrado (SEMARNAT & CONANP, 2013), lo cual limita la entrada de luz a los estratos más bajos (sotobosque), restringiendo a los reptiles el acceso a la radiación solar, fundamental para realizar sus funciones básicas (Estrella-Morales & Piedra-Castro, 2018). Por el contrario, algunos anfibios como los anuros Dryophytes eximius y D. plicatus pudieron verse favorecidos en este ambiente, debido a la existencia de cuerpos de agua (charcas y arroyos) (Zavala, 1984), los cuales utilizan y son necesarios para llevar a cabo sus ciclos de vida (Duellman, 2001; Zug et al., 2001; Ramírez-Bautista et al., 2009).
Por otro lado, el hábitat Pino-Aile presentó el valor más alto de diversidad. En contraste, los hábitats Pino-Oyamel y Pino presentaron valores bajos; sin embargo, Pino-Oyamel mostró un valor de diversidad más alto que Pino, el cual cuenta con una especie más. Estos resultados se pueden atribuir a las diferencias en el número de individuos entre las especies presentes en cada hábitat, ya que la medida de diversidad verdadera pondera a todas las especies proporcionalmente según su abundancia en la comunidad (Jost, 2006). Para Pino-Aile, además de presentar una mayor cantidad de especies, las abundancias de cada una de estas son más proporcionales, como se observa en las curvas de Whittaker (Fig. 4). Caso contrario en Pino-Oyamel y Pino, donde el número de individuos de una especie es muy alto; no obstante, en Pino, la alta abundancia de S. grammicus y la baja equitatividad entre las abundancias de las especies se reflejó en una menor diversidad. Esto sugiere que las condiciones de estos ambientes favorecen en mayor medida a S. grammicus, que tiene una amplia capacidad de explotar los recursos (Vite-Silva et al., 2010; Ramírez-Bautista et al., 2014). Este patrón ha sido registrado en otros trabajos realizados en ambientes templados (p.e. Cruz-Elizalde & Ramírez-Bautista, 2012; Acevedo et al., 2016).
La distribución de abundancias de las especies se ajustó al modelo de la serie logarítmica, un patrón que es común en aquellos ambientes en que uno o pocos factores ambientales determinan la abundancia de las especies (May, 1975; Magurran, 1981), como es el caso de la temperatura en regiones templadas (Wolda, 1988; Potts, 2003). Asimismo, se ha encontrado que el ajuste de las abundancias a la serie logarítmica suele observarse en ambientes con un grado de perturbación poco severo (Hill & Hamer, 1998; Aguirre-Calderón et al., 2008). Por lo que el patrón obtenido podría indicar que el área se encuentra alterada. Esto aunado a que se ha encontrado evidencia de problemas de deterioro en la EFEZ, derivadas principalmente de la actividad humana como explotación forestal, apertura de caminos de acceso, pastoreo de ganado vacuno, entre los principales (Maass et al., 1981; Zavala, 1984; Cibrián & Cibrián, 2007; Arriola-Padilla et al., 2014).
Las curvas de rango-abundancia mostraron que las comunidades de anfibios y reptiles de los hábitats están representadas por pocas especies abundantes y muchas especies raras. Para los anfibios, se observó que P. leprosa fue la más común en los tres hábitats. Por un lado, esta salamandra es una de las más abundantes y ampliamente distribuidas en los ambientes templados de montaña de la FVT (Vega-López & Álvarez-Solórzano, 1992; Ramírez-Bautista et al., 2009). Y por el otro, esta especie está asociada a zonas con alta humedad, específicamente habita en microhábitats como troncos caídos y cortezas en estado de descomposición que tienen humedad alta y que son comunes en bosques de Abies y Pinus (Vega-López & Álvarez-Solórzano, 1992; Parra-Olea et al., 1999). Su mayor abundancia en los hábitats de Pino-Aile y Pino podría deberse a que estos son más heterogéneos, producto de sus características topográficas y de la actividad humana, que proporcionan mayor disponibilidad de microhábitats que pueden ser usados por esta especie.
Para los reptiles, la lagartija S. grammicus fue la especie más abundante en los tres tipos de hábitat. Esta especie suele encontrarse en una gran variedad de ambientes y es común en asentamientos humanos o en sitios perturbados (Uribe-Peña et al., 1999; Lemos-Espinal & Smith, 2007). Esto se debe a que es generalista y de hábitos oportunistas (Gutiérrez & Sánchez-Trejo, 1990; Leyte-Manrique et al., 2005; Durán, 2012), dado que posee una amplia tolerancia a los cambios ambientales drásticos y mayor capacidad de explotar los recursos disponibles (Vite-Silva et al., 2010; Ramírez-Bautista et al., 2014). La mayor abundancia de esta especie, respecto a otros lacertilios, ha sido documentada en otros estudios de ambientes templados (p.e. Ramírez-Bautista et al., 2010; Cruz-Elizalde & Ramírez-Bautista, 2012).
Por otra parte, las serpientes presentaron una abundancia baja en los tres hábitats, por lo que se consideraron especies raras. Este patrón es consistente con otros trabajos tanto de ambientes templados como tropicales (p.e. Rueda-Solano & Castellanos-Barliza, 2010; Cruz-Elizalde & Ramírez-Bautista, 2012; Leyte-Manrique et al., 2016). El bajo número de individuos de las serpientes puede deberse a patrones de distribución característicos de estos organismos que se reflejan en abundancias bajas en la escala espacial del muestreo realizado y, a que estas especies tienen hábitos hipogeos o crípticos que hacen difícil detectarlas en campo (Carvajal-Cogollo et al., 2007; Vitt & Caldwell, 2014). De esta manera, el número de especies raras (por tener poblaciones escasas) denota la relevancia de conservar los hábitats analizados para proteger la mayor biodiversidad presente en ellos.
De las 15 especies registradas en la EFEZ, el 86.7% (13 especies) son endémicas a México, y de éstas, el 69.2% (nueve especies) son endémicas a la FVT (Cuadro 2). Adicionalmente, la estación comprende el 34.2% del total de especies endémicas que se distribuyen en el PNIPZ (38 especies) (Ramírez-Bautista et al., 2009; Woolrich-Piña et al., 2017; Cruz-Elizalde et al., 2018). Al igual que con la riqueza, este porcentaje es alto dada la pequeña superficie que abarca el área de estudio con respecto al parque. Además, la presencia de endemismos refleja la alta especialidad de las especies de anfibios y reptiles hacia las asociaciones vegetales de la zona.
Por otro lado, un 33.3% (cinco especies) de los anfibios y reptiles se encuentran en la lista mexicana de especies amenazadas NOM-059-2010 (SEMARNAT, 2018) y un 26.7% (cuatro especies) están en la categoría de sujeta a protección especial. En la lista roja de la IUCN (2018), 11 especies se encuentran bajo la categoría de preocupación menor, una especie en peligro (6.7%), dos especies como vulnerables (13.3%) y una especie casi amenazada (6.7%) (Cuadro 2). El alto número de especies endémicas a la FVT (69.2%) e identificadas en alguna categoría de riesgo (60%) en el presente trabajo, deben ser una prioridad para su conservación, en particular se debe poner mayor atención en aquellas especies con baja abundancia y presencia como Chiropterotriton orculus y Thamnophis eques, que además están en la categoría de protección especial y amenazada, respectivamente. Por lo tanto, se sugiere que la EFEZ se considere una zona relevante para la preservación de la herpetofauna que habita en ella, y desde una perspectiva regional.
En términos generales, las especies arbóreas, las características topográficas y la actividad antrópica en los hábitats Pino y Pino-Aile posiblemente estén beneficiando a las poblaciones de lacertilios debido a su amplia tolerancia a las condiciones ambientales, y limitando a los anfibios por sus requerimientos específicos de hábitat. El dosel cerrado y la disponibilidad de cuerpos de agua en Pino-Oyamel, son factores que podrían estar restringiendo a los lacertilios debido a la menor incidencia solar, y estaría favoreciendo a las poblaciones de anuros. Por otra parte, las serpientes presentaron abundancias semejantes en los tres hábitats. Por lo que las características particulares de cada hábitat podrían estar determinando la diversidad de anfibios y reptiles, en específico la abundancia de cada especie. Sin embargo, se requiere de estudios para medir la respuesta diferencial de las especies a dichos factores para corroborar estas inferencias.
A pesar de la riqueza que presenta el área de estudio, así como la alta proporción de especies endémicas y en alguna categoría de riesgo, no se habían realizado estudios que analizaran espacialmente los valores de diversidad. El presente trabajo es el primero en aportar información confiable y sólida referente a la abundancia, riqueza, diversidad y distribución de los anfibios y reptiles de la EFEZ. No obstante, es necesario llevar a cabo estudios que analicen la estructura y función de comunidades, así como el efecto antrópico sobre las poblaciones, que permitan implementar estrategias tendientes al manejo y conservación de la herpetofauna a largo plazo.











 nueva página del texto (beta)
nueva página del texto (beta)


