INTRODUCCIÓN
Los nidos de las aves son un microhábitat óptimo para el establecimiento de una gran diversidad de artrópodos, ya sea de forma temporal o definitiva, la cual es reflejo de la composición, estructura y tamaño del nido, así como de las actividades del ave (Tryjanowski et al., 2001), ya que las condiciones del nido están sujetas a cambios cíclicos y dependen de la biología del ave (Bajerlein et al., 2006). Las interacciones que se desarrollan entre las aves y los artrópodos pueden llegar a establecerse a través del tiempo y tener un carácter co-evolutivo, y pueden asumir diversas formas (Bajerlein et al., 2006; Bloszyk et al., 2011). El componente más abundante de la artropodofauna asociada a nidos son los ácaros (Davidova & Vasilev, 2012) los cuales, en su mayoría, comprenden a la fauna asociada con el microambiente del nido; este microambiente les confiere una alta dispersión y aislamiento, a excepción de los nidos de aves coloniales (Bajerlein et al., 2006).
El mayor número de registros de ácaros asociados a nidos de aves son en el orden Passeriformes (Krištofík et al., 1993; Krištofík et al., 2007; Bloszyk et al., 2009; Silva et al., 2018), comparado con los nidos de aves rapaces, en especial del orden Accipitriformes; a pesar de que estas pueden albergar una gran diversidad de invertebrados (Krištofík et al., 2009). Se han registrado 21 familias de ácaros asociadas con Accipitriformes que habitan sus plumas, cálamo, piel, tejido subcutáneo, tracto respiratorio y nidos (Philips, 2000). Según Philips y Dindal (1979), la artropodofauna de los nidos de aves rapaces puede dividirse en tres grupos: 1) la microfauna parásita, formada por los parásitos de las aves; 2) los animales saprófitos, que incluye a los invertebrados asociados con la descomposición de la carroña, excretas, egagrópilas y mudas, y 3) los organismos del humus, que incluye a aquellos invertebrados asociados con el material del nido como la madera y el suelo.
El águila real (Aquila chrysaetos canadensis Linnaeus, 1758) (Falconiformes: Accipitridae), se distribuye en Norteamérica, desde Alaska hasta el centro de México (Watson, 2010). Construye de uno a 14 nidos ubicados dentro de una superficie de 11 a 152 km2, área conocida como territorio de anidación (Kochert et al., 2002; Watson, 2010); estos nidos se localizan principalmente en paredes rocosas inaccesibles, pero también en árboles e inclusive en infraestructura humana (Kochert et al., 2002). El inicio de la temporada reproductiva, está definida con los primeros comportamientos de cortejo, los cuales consisten en la defensa del territorio, “vuelos nupciales” y la emisión de vocalizaciones; asimismo, y una vez seleccionado el sitio y/o nido, se inicia con la construcción y/o reparación del mismo con ramas y hojas frescas (Ferguson-Lees & Christie, 2001; Kochert et al., 2002; Kochert & Steenhof, 2012), la adición de material fresco al nido se mantiene después de la eclosión del polluelo, con el fin de mantener la higiene en el nido y repeler a los ectoparásitos (Wimberger, 1984; Heinrich, 2013). Por otra parte, la puesta consiste en uno a cuatro huevos, la incubación dura de 43 a 45 días y los pollos permanecen en el nido aproximadamente 10 semanas (Watson, 2010).
El objetivo del presente trabajo fue explorar la riqueza y diversidad de ácaros asociados a los nidos de águila real en México y aportar información sobre la asociación ácaros-nido.
MATERIALES Y MÉTODOS
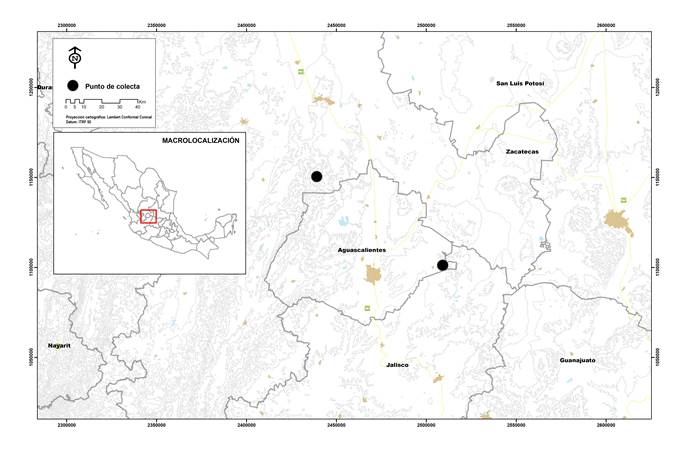
Se recolectaron dos nidos de águila real el 19 de julio de 2013 por un mismo equipo de trabajo, y toda vez que se comprobó que en éstos no hubiera actividad de crianza. El Nido I se obtuvo de la localidad La Saladita, Sierra Fría, municipio de Genaro Codina, en el estado de Zacatecas. La Sierra Fría es una Región Prioritaria para la Conservación (RPC) dominada por bosques de encino, aunque también se presentan matorrales templados, áridos y subtropicales, chaparral, matorral (crasicaule, espinoso y rosetófilo) y pastizal natural (CONABIO, 2000). La hora de recolecta del Nido I fue entre las 9:00 y 12:00 horas. Por otra parte, el Nido II se recolectó en la Serranía de Juan Grande, municipio de El Llano, Aguascalientes (Fig. 1). El tipo de vegetación de esta serranía incluye pastizal-huizachal, matorral crasicaule y bosques de encino tipo arbustivo abierto (IMAE, 2006). La hora de recolecta de este nido fue entre las 19:00 y 20:30 horas.

Figura 2 Vista del Nido I, localizado en la localidad La Saladita, Sierra Fría, municipio de Genaro Codina, Zacatecas.

Figura 3 Vista del Nido II, recolectado en la Serranía de Juan Grande, municipio de El Llano, Aguascalientes.
Para ambas áreas de muestreo, se descendió con equipo de rapel, ya que los nidos se ubicaron en paredes rocosas (Figs. 4, 5); se desmontó la parte superficial de los nidos, lo cual correspondió a la región central y periférica de los nidos, aproximadamente 50 cm de área de los mismos, el material fue colocado en bolsas de plástico y en lugar fresco para su posterior procesamiento. Dos días después de la recolecta, el material fue procesado durante cinco días con la técnica de los embudos de Berlese-Tullgren con fuente de calor para acelerar el desecado, dicha técnica fue realizada en el laboratorio anexo al Laboratorio de Acarología “Dra. Isabel Bassols Batalla” de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (ENCB-IPN); los organismos obtenidos fueron depositados en frascos de vidrio con alcohol etílico al 70%, algunos de los organismos fueron aclarados con lactofenol durante 24 a 72 horas, para posteriormente elaborar laminillas semipermanentes con líquido de Hoyer, las que se llevaron a secado en una estufa a 45º C durante siete días. Se utilizó la clasificación de Lindquist et al. (2009a) para categorías superiores de la subclase Acari y la identificación de los ejemplares se realizó con el apoyo de guías especializadas de Balogh y Balogh (1992a,b), Lindquist et al. (2009b), McDaniel (1979) y Walter et al. (2009). Los ácaros fueron depositados en la colección del Laboratorio de Acarología “Dra. Isabel Bassols Batalla”, ENCB-IPN. La mayoría de los organismos se identificaron a nivel de género, debido al estadio de desarrollo encontrado, así como a la escaza literatura para la identificación a nivel de especie.
Se calculó el porcentaje de abundancia relativa (Ai%) para ambos nidos, el cual está expresado como el número de individuos de la especie i entre el número total de individuos de la muestra x 100 (modificado de Moreno, 2001); a partir de las abundancias obtenidas se calcularon rangos de abundancia para los dos nidos, obtenidos como la diferencia existente entre los valores máximo y mínimo observados y divididos entre cinco (no. de intervalos seleccionados) (Álvarez-González, s/a) (Cuadro 1).
Cuadro 1 Rangos de abundancia de ácaros para los nidos de águila real.
| RANGO DE ABUNDANCIA | NIDO I | NIDO II |
|---|---|---|
| 1 | 40.561-50.621 | 10.899-13.614 |
| 2 | 30.501-40.561 | 8.188-10.899 |
| 3 | 20.441-30.501 | 5.477-8.188 |
| 4 | 10.381-20.441 | 2.766-5.477 |
| 5 | 0.321-10.381 | 0.055-2.766 |
Mediante el programa Past Versión 3.20 (Øyvind, 2018) se calculó la diversidad de especies a través de los índices de Simpson (
RESULTADOS
Ambos nidos presentaron una constitución y estructura similares, variando en el tamaño: 100 cm de ancho x 150 cm de largo (NI) (Fig. 2) y 150 cm de ancho x 200 cm de largo (NII) (Fig. 3); constituidos principalmente por ramas de encino (Quercus sp.) y sotol (Dasylirion sp.); asimismo, presentaron restos de mamíferos de talla pequeña (Sylvilagus spp.), siendo el Nido I el que presentó mayor proporción de restos.
Para los dos nidos de águila real se encontraron 2,141 ácaros de 68 especies ubicados en 49 familias; en el Nido I se obtuvieron 312 ácaros de 26 especies de los cuales, nueve especies (ocho familias) pertenecen al orden Mesostigmata, cinco especies (cinco familias) al suborden Prostigmata, dos especies (dos familias) al cohorte Astigmatina y 10 especies de nueve familias pertenecientes al suborden Oribatida s.str. En cuanto al Nido II, se contabilizaron 1,829 ejemplares de 57 especies, de los cuales, 12 especies (nueve familias) pertenecen al orden Mesostigmata, 14 especies (10 familias) al suborden Prostigmata, cuatro especies dentro de tres familias al cohorte Astigmatina y 27 especies de 20 familias al suborden Oribatida s.str. Para ambos nidos, los adultos fueron la fase de desarrollo mejor representada, siendo las hembras las de mayor abundancia, con valores de 85.57% para el Nido I (267 ♀, 44 ♂ y una Larva (L)) y 74.30% para el Nido II (1,359 ♀, 122 ♂, 56 Deutoninfas (D), 59 Protoninfas (P) y 233 (L)).
Para el Nido I, la especie más abundante fue Macrocheles mexicanus (Evans & Hyatt, 1963) (Macrochelidae) (Fig. 2), con un valor del 50.64%, siendo las hembras más abundantes que los machos (119 ♀, 39 ♂), la segunda especie más abundante fue Iponemus truncatus (Ewing, 1939) (Tarsonemidae) con una abundancia del 33.01%, donde se contabilizaron sólo hembras (103 ♀) (Cuadro 1, 2).
Cuadro 2 Listado de las especies de ácaros identificadas en los nidos de águila real. ♀- Hembra; ♂- Macho; D- Deutoninfa; P- Protoninfa; L- Larva; Ai%-Porcentaje de abundancia relativa.
| TAXON | NIDO I | Ai% | NIDO II | Ai% |
|---|---|---|---|---|
| SUPERORDEN PARASITIFORMES ORDEN MESOSTIGMATA |
||||
|
Diplogyniidae Cryptometasternum ca. natalense |
- | - | 1♂ | 0.055 |
|
Thinozerconidae Thinozercon sp. |
1♂ | 0.321 | - | - |
| Urodinychidae Uroobovella sp. | - | - | 1♀, 3♂ | 0.219 |
|
Zerconidae Zercon farrieri Monozercon sp. |
1♂ - | 0.321 - | - 2♀, 6♂ | - 0.437 |
|
Parasitidae Vulgarogamasus sp. Leptogamasus sp. |
- - |
- - |
2♂ 2♂ |
0.109 0.109 |
|
Veigaiidae Gorirossia sp. |
1♂ | 0.321 | - | - |
|
Digamasellidae Dendrolaelaps sp. |
1♂ | 0.321 | 19♀, 27♂ | 2.515 |
|
Rhodacaridae Rhodacarus sp. |
1♂ | 0.321 | 1♀, 7♂ | 0.437 |
|
Eviphididae Alliphis ritcheri |
- | - | 2♀ | 0.109 |
|
Macrochelidae Macrocheles mexicanus |
119♀, 39♂ | 50.641 | 132♀, 61♂ | 10.552 |
|
Ascidae Asca aphidioides Melichares (=Blatisocius) dentriticus Melichares (=Blatisocius) pomorum |
1♀ - - |
0.321 - - |
4♀, 4♂ 1♀, 1♂ 3♂, 1L |
0.437 0.109 0.219 |
|
Laelapidae Haemogamasus occidentalis Ololaelaps sp. |
1♀ 1♀ |
0.321 0.321 |
- - |
- - |
| SUPERORDEN ACARIFORMES ORDEN TROMBIDIFORMES SUBORDEN PROSTIGMATA |
||||
|
Bdellidae Bdella ca. ueckermanni Bdella longicornis Cyta spuria |
- - - |
- - - |
6♀ 15♀, 1L 1♀ |
0.328 0.875 0.055 |
|
Cunaxidae Cunaxa capreolus Lupaeus minutus |
- - |
- - |
4L 3♀ |
0.219 0.164 |
|
Eupodidae Protereunetes sp. |
- | - | 1♀ | 0.055 |
|
Ereynetidae Ereynetes sp. |
2♀ | 0.641 | - | - |
|
Tydeidae Coccotydaeulus sp. Orthotydeus sp. |
2♀ - |
0.641 - |
2♀ 15♀, 1L |
0.109 0.875 |
|
Caeculidae Caeculus sp. |
1♀ | 0.321 | 5♀ | 0.273 |
|
Smarididae Smaris sp. |
1♀ | 0.321 | 1♀ | 0.055 |
|
Camerobiidae Neophyllobius sp. |
- | - | 1L | 0.055 |
|
Tenuipalpidae Aegyptobia sp. |
- | - | 16♀ | 0.875 |
|
Tetranychidae Petrobia sp. |
- | - | 1♀ | 0.055 |
|
Tarsonemidae Iponemus truncatus |
103♀ | 33.013 | 215♀ | 11.755 |
| SUBORDEN ORIBATIDA COHORTE ASTIGMATINA |
||||
|
Acaridae Acarus farris |
- | - | 2♂ | 0.109 |
| Tyrophagus similis | 3♀ | 0.962 | 6♀ | 0.328 |
|
Pyroglyphidae Pyroglyphus sp. |
- | - | 1♀ | 0.055 |
|
Anoetidae Myanoetus sp. |
1♀ | 0.321 | 15♀ | 0.820 |
| SUBORDEN ORIBATIDA (EXCLUYENDO ASTIGMATINA) | ||||
|
Brachychthoniidae Brachychthonius immaculatus Verachthonius sp. |
- 10♀ |
- 3.205 |
20♀, 1D 6♀, 3D |
1.148 0.492 |
|
Cosmochthoniidae Cosmochthonius ca. lanatus Phyllozetes ca. latifolius |
- - |
- - |
89 ♀, 1L 1♀ |
4.921 0.055 |
|
Haplochthoniidae Amnemochthonius ca. taeniophorus Haplochthonius ca. sanctaeluciae |
- - |
- - |
31♀, 3P, 1L 88♀ |
1.914 4.811 |
|
Sphaerochthoniidae Sphaerochthonius splendidus |
- | - | 16♀, 2D, 2P, 3L | 1.258 |
|
Eulohmanniidae Eulohmannia sp. |
- | - | 8♀, 40D, 30P, 171L |
13.614 |
|
Epilohmanniidae Elliptochthonius sp. |
- | - | 88♀, 12L | 5.467 |
|
Collohmanniidae Collohmannia sp. |
- | - | 32♀, 7D, 5P, 48L | 5.030 |
|
Euphthiracaridae Rhysotritia ca. comteae |
1♀ | 0.321 | 1♀ | 0.055 |
|
Phthiracaridae Hoplophorella sp. |
1♀ | 0.321 | - | - |
|
Camisiidae Neonothrus sp. |
- | - | 8♀, 1D, 3P | 0.656 |
|
Trhypochthoniidae Archegozetes sp. 1 Archegozetes sp. 2 |
- - |
- - |
23♀, 2D, 4P, 1L 3♀ |
1.640 0.164 |
|
Gymnodamaeidae Joshuella sp. |
- | - | 109♀ | 5.960 |
|
Damaeidae Allobelba sp. |
8♀ | 2.564 | - | - |
|
Oppiidae Vietoppia sp. Pseudoamerioppia sp. Arcoppia sp. |
- 1♀ - |
- 0.321 - |
25♀ - 194♀ |
1.367 - 10.607 |
|
Tectocepheidae Tectocepheus velatus |
- | - | 2♀ | 0.109 |
|
Cymbaeremaeidae Scapheremaeus mahunkaius |
- | - | 1♀ | 0.055 |
|
Micreremidae Micreremus sp. |
1D | 0.321 | - | - |
|
Passalozetidae Passalozetes sp. |
1♀ | 0.321 | 10♀ | 0.547 |
|
Haplozetidae Mancoribates sp. Rostrozetes sp. |
- 1♀ |
- 0.321 |
62♀ 1♀ |
3.390 0.055 |
|
Oribatulidae Lucoppia felderi |
- | - | 42♀, 3♂ | 2.460 |
|
Oripodidae Oripoda sp. |
- | - | 1♀ | 0.055 |
|
Zetomotrichidae Zetomotrichidae bidentata |
- | - | 1♀ | 0.055 |
|
Galumnidae Pilogalumna sp.1 Pilogalumna sp.2 Galumna unica |
- 5♀ 4♀ |
- 1.603 1.282 |
14♀ - 18♀ |
0.765 - 0.984 |
En relación al Nido II, las especies más abundantes fueron Eulohmannia sp. (Eulohmanniidae) (13.61%), I. truncatus (11.75%), Arcoppia sp. (Oppiidae) (10.60%) y M. mexicanus (10.55%); donde Eulohmannia sp. presentó hembras, deutoninfas, protoninfas y larvas (8 ♀, 40 D, 30 P, 171 L), mientras que en I. truncatus y Arcoppia sp. sólo se observaron hembras con valores de 215 ♀ y 194 ♀, respectivamente. En un segundo rango de abundancia, se encontraron únicamente adultos de M. mexicanus, siendo las hembras las más abundantes (10.55%; 132 ♀, 61 ♂); en un tercer rango, Joshuella sp. (Gymnodamaeidae) presentó un porcentaje de abundancia del 5.96%, constituido sólo por hembras (109 ♀) (Cuadro 1, 2).
Diversidad y riqueza de especies en los dos nidos de águila real. La diversidad de los dos nidos de águila real mediante el índice de Simpson (1-D) fue de 0.632 para el Nido I y de 0.927 para el Nido II; para el índice de Margalef (DMg),fue de 4.353 para el Nido I y 7.455 para el Nido II, ambos índices en conjunto infieren que los dos nidos presentan valores de diversidad altos, debido a que presentan una distribución de abundancias más equitativa entre las especies; por otra parte, el Nido II es el que presenta una mayor diversidad de especies, ya que registró un total de 57 especies en comparación a las 26 del Nido I (Cuadro 3).
DISCUSIÓN
La presencia y abundancia de ácaros en los nidos de águila real está determinada por diferentes factores, entre los que destacan: las actividades del ave previas al vuelo del juvenil, la composición y tamaño del nido y el tiempo de abandono por parte del juvenil con respecto al día de recolecta. Las rapaces, incluyendo el águila real, adicionan material fresco de vegetación a los nidos para disminuir la cantidad de ectoparásitos; sin embargo, esta actividad es realizada pocos días después de la eclosión del polluelo (Wimberger, 1984; Heinrich, 2013); después de este evento, las actividades principales de los padres se basan, en el cuidado de las crías, el suministro de alimento y en la protección del área cercana al nido (Watson, 2010), por lo que, al garantizar el éxito reproductivo del polluelo, los padres dejan de adicionar material vegetal fresco al nido, lo cual crea la oportunidad de establecimiento y colonización de ácaros sobre estas estructuras. En relación al tamaño de los nidos, entre más grande sea la estructura, mayor cantidad de ácaros pueden albergar (Tryjanowski et al., 2001); por otro lado, el abandono de los nidos por parte del juvenil lleva consigo la ausencia en el suministro de alimento para la acarofauna y demás artrópodos nidícolas, este abandono también implica la degradación paulatina de la estructura del nido (composición y forma), por lo que ambos sucesos resultan en una disminución de las poblaciones residentes de los nidos, al ser éste un microhábitat dependiente del águila real (Bajerlein et al., 2006).
En referencia al abandono de los nidos en 2013, éste aconteció en diferentes tiempos: el abandono del Nido I ocurrió a finales de mayo, mientras que el abandono del Nido II sucedió a mediados de junio, por lo que, con aproximadamente un mes y medio de abandono del Nido I con respecto a la fecha de recolecta, y al presentar un menor tamaño en comparación al Nido II, el Nido I presentó una menor abundancia y diversidad de especies con tan sólo 312 organismos contabilizados, 26 especies determinadas y un índice de riqueza del 4.353, contrario a lo obtenido en el Nido II (N= 1,829; S= 57; DMg = 7.455).
En relación al orden Mesostigmata, se observó que las hembras de M. mexicanus fueron más abundantes respecto a los machos (NI: 119 ♀, 39 ♂; NII: 132 ♀, 61 ♂), debido a que éstas son más longevas, se ha documento que en varios arácnidos los machos mueren después de que se reproducen, mientras que las hembras se mantienen vivas durante un periodo de tiempo mayor, por lo que la proporción de sexos estará orientada hacia las hembras (Bruce & Wrensch, 1990; Beccaloni, 2009). La mayoría de las hembras de ambos nidos se encontraron en estado grávido y se observó que eran huéspedes de las hembras de I. truncatus, las cuales se encontraron adheridas a la placa dorsal del macroquélido hembra, generalmente en la región posterior de esta placa. Se conoce que las hembras de I. truncatus son parásitas de escarabajos descortezadores (Lindquist, 1969); por lo que, para el presente estudio, estas podrían considerarse parásitas o bien, puede estarse llevando a cabo una relación forética entre ambas especies, donde las hembras de M. mexicanus favorecen la dispersión del prostigmado dentro del nido, puesto que estas presentan un tamaño mayor respecto al prostigmado (♀ M. mexicanus: L= 723 μm x A= 285 μm; ♀ I. truncatus: L= 165 μm x A= 88 μm).
El suborden Prostigmata estuvo representado por cinco especies en el Nido I y 14 especies en el Nido II, donde I. truncatus fue la especie más abundante de este suborden con valores de 33.01% (NI) y 11.75% (NII), esta abundancia de individuos se asume a la acumulación del material orgánico presente en los nidos, la cual favorece la disponibilidad de alimento, así como la presencia de otras especies y que con ello favorece la dispersión de I. truncatus. Las especies de este suborden son comunes en hojarasca, musgo, liquen y en hábitats similares; asimismo, la mayoría de las especies determinadas para este estudio, son de hábitos depredadores (Bdella ca. ueckermanni, Cunaxa capreolus, Caeculus sp., Neophyllobius sp.) y fitófagos (Aegyptobia sp., Petrobia sp., Cunaxa capreolus) (De León, 1958; Zaher et al., 1975; Otto, 1993; Walter et al., 2009; Vieira de Souza, 2010; Hernandes et al., 2011; Muhammad & Muhammad, 2011; Khanjani et al., 2013; Skvarla et al., 2014), a excepción de Orthotydeus sp., quien es un organismo saprófago y micetófago, el cual obtiene su alimento de la materia orgánica en descomposición presente en el Nido II (Pérez-Otero & Mansilla-Vázquez, 1997).
El cohorte Astigmatina fue el grupo menos representativo de los dos nidos de águila real, con tan sólo dos especies para el Nido I y cuatro para el Nido II. Para el Nido I, la especie más abundante fue Tyrophagus similis (Volgin, 1949) con tres hembras contabilizadas. Esta especie ha sido recolectada en pajareras de Ara ararauna (Linnaeus, 1758) (guacamayo azul) y Nymphicus hollandicus (Kerr, 1792) (cacatúa ninfa) siendo una especie dominante (Solarz et al., 2004); esta referencia nos indica, que la especie no encuentra las condiciones óptimas para su establecimiento es lugares con abundancia de materia orgánica. Por otra parte, Myanoetus sp. fue el más abundante en el Nido II con 15 hembras, se conoce que este género es común sobre insectos y otros artrópodos (McDaniel, 1979), y que al encontrase estos organismos en el nido (hormigas, psudoescopiones y coleópteros), se asume a que contribuyen a la presencia de este género en el nido.
Los ácaros oribátidos son uno de los grupos mejor representados en cuanto al número de especies y abundancias (Urhan et al., 2008), y para este estudio, no fueron la excepción, ya que se determinaron diez especies para el Nido I (33 ejemplares) y 27 para el Nido II (1,237 ejemplares). Su abundancia en comparación con las demás categorías superiores de la Subclase Acari se asume a que el suelo de los nidos presenta una alta porosidad, así como grandes cantidades de materia orgánica (Andrén & Lagerlöf, 1983; Pertersen & Luxton, 1982) que favorecen la abundancia y diversidad de estos organismos. Para el Nido I, la especie más abundante fue Brachychthonius immaculatus (Forsslund, 1942) con diez hembras, esta especie se ha encontrado asociada a liquen, musgo y suelos (Schatz, 1995); por otra parte, Allobelba sp., fue el segundo organismo más abundante dentro del nido y generalmente se le encuentra asociado al detritos orgánico (McDaniel, 1979); de este género se contabilizaron ocho hembras grávidas con un aproximado de cinco a seis huevos en su interior, siendo registrada nuevamente esta proporción orientada a las hembras, otra especie que también presentó esta proporción dentro del Nido I fue Rhysotritia ca. comteae con la característica de presentar tres huevos sumamente ornamentados en su interior. Por otro lado, las restantes especies determinadas en este nido fueron Hoplophorella sp., Pseudoamerioppia sp., Micreremus sp., Pilogalumna sp. 2 y Rostrozetes sp. (Franklin et al., 2004; Seniczak & Seniczak, 2006; Bernal-Rojas et al., 2009; Vázquez-González, 2012; Weigmann, 2013) las cuales se distribuyen en suelos con alta humedad, mientras que Passalozetes sp. se registra en ambientes áridos y en suelos de altitudes altas (Martínez & Herrero, 2006), tal como los nidos de águila real estudiados. En relación con el Nido II, destaca el género Eulohmannia sp. quien presentó hembras, deutoninfas, protoninfas y larvas, lo que sugiere que la longevidad de los machos es menor a la de las hembras; a su vez, los resultados obtenidos nos señalan la baja abundancia de hembras dentro de este género sugiriendo el término de su ciclo de vida dentro de este microhábitat, observándose una alta abundancia de estadios inmaduros (8 ♀, 40 D, 30 P, 171 L). Del mismo modo, Collohmannia sp. (32 ♀, 7 D, 5 P, 48 L), Archegozetes sp. 1 (23 ♀, 2 D, 4 P, 1 L) y Sphaerochthonius splendidus (16 ♀, 2 D, 2 P, 3 L) presentan el mismo patrón de estadios de desarrollo que Eulohmannia sp. (excepto machos y tritoninfas); sin embargo, este patrón se da en diferentes proporciones, siendo las hembras más abundantes que sus respectivos estados inmaduros. En relación a las demás especies dentro de este nido, la gran mayoría de ellas se distribuyen en ambientes húmedos; sin embargo, también se presentan especies con preferencias por ambientes semiáridos y áridos tales como Joshuella sp., Elliptochthonius sp. y Arcoppia sp. (Shepherd et al., 2002; Arroyo & Iturrondobeitia, 2003; Ermilov et al., 2012; Bernal-Rojas et al., 2009).
Al comparar el presente trabajo con estudios de nidos de otras aves rapaces, se observa que se comparten algunos patrones para el orden Mesostigmata, ya que los estudios publicados se basan sólo en este grupo de ácaros. Gwiazdowicz et al. (2006) analizaron 34 nidos de Haliaeetus albicilla (Linnaeus, 1758), conocida como pigargo europeo o águila marina, donde determinaron 86 especies de mesostigmados, mientras que en el presente trabajo se identificaron cinco especies para el Nido I y 14 para el Nido II, no obstante se comparten algunas especies o géneros: Alliphis sp. (Eviphididae), Asca aphidioides (Ascidae), Dendrolaelaps sp., Haemogamasus sp. (Laelapidae), Macrocheles sp., Uroobovella sp. (Urodinychidae), Vulgarogamasus sp. (Parasitidae) y Zercon sp. (Zerconidae). Dendrolaelaps y Macrocheles que, aunque se presentan en el presente estudio, son considerados géneros comunes y diversos en cualquier estudio de nidos de aves (Bloszyk et al., 2005; Gwiazdowicz et al., 2006; Bloszyk et al., 2009; Bloszyk et al., 2011; Davidova & Vasilev, 2012).
Dado que sólo fueron dos nidos de águila real recolectados, la muestra puede ser no significativa; por lo que se sugiere incrementar los estudios sobre los nidos de esta rapaz. Para incrementar el conocimiento en la relación águila real-nido-ácaro, se necesita conocer el ciclo reproductivo de la pareja de águila real objetivo; es decir, conocer la fecha de inicio de la construcción o renovación del nido; determinación taxonómica del material florístico usado para la construcción; éxito reproductivo de la pareja; fecha de abandono de los nidos por parte del juvenil o juveniles así como la fecha de recolecta del nido, esta última, deberá garantizar la no perturbación de la especie. Con estos parámetros, se contribuirá a cubrir los espacios vacios de información, y se incrementará el conocimiento de la dinámica de los nidos.
Este es el primer trabajo de ácaros asociados a nidos de águila real para México, donde la presencia de ácaros está íntimamente ligada a las actividades del ave, y a la estructura y composición de los nidos, tal y como se pudo observar en el Nido II, el cual presento un mayor número de individuos y una mayor diversidad de ácaros en comparación al Nido I.











 nueva página del texto (beta)
nueva página del texto (beta)