Introducción
La herpetofauna del estado de Chiapas destaca como una de las más ricas del país con 330 especies registradas (Johnson et al., 2015a). Al tratarse de la principal zona de transición del norte Mesoamericano, su biota herpetológica incluye numerosas especies que comparte con el núcleo de América Central (Johnson, 1989; Lee, 1996). En los últimos años se ha incrementado notablemente el conocimiento sobre los anfibios y reptiles de Chiapas, no obstante persiste un desconocimiento generalizado para muchas localidades con potencial para el manejo. Así mismo los rasgos fisiográficos estatales conforman patrones de distribución complejos que necesitan estudiarse desde un punto de vista biogeográfico.
Las zonas arqueológicas y los ecosistemas adyacentes a éstas han demostrado ser ambientes adecuados para la conservación de la biodiversidad (Somaweera et al., 2001; Báez et al., 2016). Para el caso específico de la herpetofauna, se ha determinado cierta relación positiva entre el refugio que proveen los sitios arqueológicos y el mantenimiento de algunas poblaciones de especies (Kelly-Hernández et al., 2014; Márquez-Rodríguez, 2014; Olivera et al., 2016).
México cuenta con 187 sitios arqueológicos inventariados por el Instituto Nacional de Antropología e Historia, de los cuales 10 se encuentran en el estado de Chiapas (INAH, 2017). A diferencia de lo que ocurre con las Áreas Naturales Protegidas, los sitios arqueológicos en el país rara vez cuentan con listados faunísticos y planes de manejo que regulen su papel como zonas de protección de la diversidad biológica, aunque la mayoría de estos espacios destinados a preservar el patrimonio cultural son zonificados dentro de un polígono en el que suele mantenerse a los ecosistemas originales. Considerando el elevado número de zonas arqueológicas mexicanas, son limitados los trabajos realizados para conocer a las especies de anfibios y reptiles asociados a estos espacios (Ferreira-García & Canseco-Márquez, 2006; Calderón-Mandujano et al., 2008; CONANP, 2010a; 2010b; Meave del Castillo, 2010; Kelly-Hernández et al., 2014; Mireles-Merchant et al., 2014).
El sitio de Iglesia Vieja o Tonatlán es uno de los pocos y más importantes vestigios de la cultura Mixe-Zoque en la costa de Chiapas. En los últimos años ha habido un interés de ofertar esta zona como punto de una ruta turística regional, lo cual ha implicado una mayor afluencia de visitantes y el incremento de excavaciones con fines arqueológicos (Kaneko, 2011). Debido a esto es recomendable contar con una línea base referente a la riqueza biológica que permita planificar adecuadamente el manejo del área.
Este estudio aporta información básica sobre la estructura y composición de las comunidades de anfibios y reptiles, comparando la dominancia de las principales especies en dos coberturas de vegetación. Así mismo, la lista taxonómica permite clasificar a este sitio de transición fisiográfica, contribuyendo al conocimiento de los patrones de distribución herpetofaunística a una escala regional. Se espera promover futuras investigaciones que puedan fomentar la conservación de estos organismos en el área de estudio y en consecuencia otorgarle una mayor relevancia a la región.
Materiales y métodos
Área de estudio. El sitio arqueológico Iglesia Vieja (SAIV) cuenta con una extensión aproximada de 60 ha y se localiza 4 km al norte de la ciudad de Tonalá, Chiapas (16°07´55.4´´N-93°44´53.4´´O), en la región fisiográfica de la Planicie Costera del Pacífico y las estribaciones de la Sierra Madre, a una altitud de 711 msnm (Fig. 1). Presenta un clima cálido-subhúmedo con marcada estacionalidad (lluvias: mayo-octubre; estiaje: noviembre-abril), precipitación anual de 1650 mm y temperatura media de 27.6 °C (Kaneko, 2006; INEGI, 2014). La vegetación del área se conforma por remanentes de selva mediana subcaducifolia, sabanas y pastizales inducidos por actividades agropecuarias (Pennington & Sarukhán, 2005).
Muestreo. Los muestreos contemplaron un ciclo anual (entre junio de 2014 y mayo de 2015) y se realizaron de manera mensual con una duración de ocho días cada uno (96 días en total). Así mismo se realizaron visitas adicionales durante los meses de abril, mayo, agosto y octubre de 2016 y 2017 con el fin de verificar algunos registros. La búsqueda de organismos fue al azar mediante la técnica de registros visuales con tiempo definido (Heyer et al., 1994; Lips et al., 2001). Los muestreos por jornada fueron diurnos (9:00-13:00 hrs), vespertinos (17:00-19:00 hrs) y nocturnos (21:00-23:00 hrs), con un esfuerzo de tres personas para los horarios establecidos. Se consideraron dos coberturas de vegetación para el muestreo: vegetación herbácea (incluyendo sabanas naturales y pastizales inducidos) y vegetación arbórea (incluyendo acahuales y remanentes de selva con árboles de entre 5 y 20 m de altura). En cada recorrido se buscaron organismos en microhábitats, tales como debajo de rocas y troncos, en grietas, charcas, entre la hojarasca y el follaje de la vegetación; así como en oquedades y sobre los montículos arqueológicos. La captura de lagartijas y anfibios fue manual, mientras que para las serpientes se utilizó un gancho herpetológico. Los organismos fueron fotografiados e identificados in situ a nivel de especie, para posteriormente ser liberados en el lugar de captura. La determinación taxonómica se realizó con las claves de Flores-Villela et al. (1995) y las guías de Köhler (2008; 2011). Los datos característicos biométricos, obtenidos de los ejemplares en campo, fueron corroborados con los de los organismos depositados en la Colección Herpetológica del Museo de Zoología de la Universidad de Ciencias y Artes de Chiapas (MZ-UNICACH). Los registros fotográficos fueron catalogados en la plataforma en línea NaturaLista (https://www.naturalista.mx/guides/8109).
Análisis de datos. La lista de especies se elaboró siguiendo la nomenclatura actualizada y arreglo sistemático de acuerdo a Johnson et al. (2015a; 2015b). La representatividad del muestreo para los grupos de anfibios, lagartijas y serpientes, se analizó con los estimadores Jackknife 1 y Bootstrap. El primero es recomendado cuando no se asume homogeneidad ambiental en el muestreo ( Percino-Daniel et al., 2013); mientras que el segundo se caracteriza por ser poco sensible al número de especies raras (Moreno, 2001; Magurran, 2004). El número esperado de especies [E(S)] para cada grupo de herpetozoos fue analizado duplicando (n=192) y triplicando (n=288) el número de muestras obtenidas para extrapolar a valores de riqueza teórica (Colwell et al., 2005).
El número de especies abundantes por grupo fue visualizado mediante curvas de diversidad acumulada, utilizando el número de primer orden de la serie de Hill (N1), calculado a partir del exponencial de la entropía de Shannon (Jost, 2006). Se construyeron curvas de rango-abundancia (con transformación Log10) de especies. Estas representaciones gráficas de la dominancia constituyen una alternativa robusta para describir los patrones estructurales de una comunidad (McGill et al., 2007). Las pendientes de las curvas resultantes por cobertura vegetal fueron comparadas con un análisis U de Mann-Whitney, después de haber detectado heterocedasticidad en los datos mediante una prueba de Kolmogorov-Smirnov (Sokal & Rohlf, 1981).
Para representar jerárquicamente el patrón de similitud entre la herpetofauna del SAIV y la reportada por Johnson et al. (2015a) en siete regiones fisiográficas de Chiapas, se construyó un dendrograma UPGMA utilizando el coeficiente de Kulczynski como medida de disimilitud, basado en una matriz de presencia/ausencia de especies. El coeficiente de Kulczynski recientemente se ha aplicado en estudios biogeográficos como alternativa al de Jaccard, al ser más apropiado para comparar áreas con marcadas diferencias en sus valores de riqueza específica (Hausdorf, 2002; Casazza et al., 2008). Los análisis estadísticos se realizaron utilizando los paquetes Past 3.16 (Hammer et al., 2001) y Primer 6 (Clarke & Gorley, 2006).
La lista sistemática fue anotada con el estado de conservación de las especies de acuerdo a los criterios de la NOM-059-SEMARNAT (SEMARNAT, 2010), la lista roja de IUCN (IUCN, 2016), CITES y su categoría de vulnerabilidad ambiental (EVS por sus siglas en inglés) propuesta por Wilson et al. (2013a; 2013b).
Resultados
La herpetofauna del SAIV estuvo conformada por 61 especies, de las cuales 12 fueron de anfibios y 49 de reptiles (Cuadro 1). Los anfibios se agruparon en ocho familias y 10 géneros, mientras que las lagartijas constituyeron 13 familias, 17 géneros y 20 especies; por su parte las serpientes estuvieron representadas por 7 familias, 25 géneros y 29 especies. De manera general las familias mejor representadas, tomando en cuenta el número de especies que las constituyen, fueron Colubridae con 13, seguida de Dipsadidae con ocho. De acuerdo al tipo de vegetación, 43 especies fueron registradas en pastizal, mientras que en la vegetación arbórea se registraron 56.
Cuadro 1 Lista de especies de anfibios y reptiles del sitio arqueológico Iglesia Vieja, Tonalá, Chiapas, México. Estado de conservación de acuerdo a la NOM-059-SEMARNAT-2010: (PR) Sujeta a protección especial, (A) Amenazada; Lista Roja de Especies Amenazadas (IUCN, 2015): (LC) Least Concern, (NT) Near Threatened, (VU) Vulnerable; Environmental Vulnerability Score (EVS) (Johnson et al., 2015a): (B) Baja, (M) Media, (A) Alta. Se indica la presencia de especies por tipo de cobertura vegetal.* Especie exótica.
| Taxa | Código de la especie |
Vegetación herbácea |
Vegetación arbórea |
NOM-059 | IUCN | CITES | EVS |
|---|---|---|---|---|---|---|---|
| CLASE AMPHIBIA | |||||||
| ORDEN ANURA | |||||||
| FAMILIA BUFONIDAE | |||||||
| Incilius canaliferus (Cope, 1877) | Ica | X | X | LC | B | ||
| Incilius coccifer(Cope, 1866) | Ico | X | X | Pr | LC | B | |
| Incilius marmoreus (Wiegmann, 1833) | Im | X | X | LC | M | ||
| Rhinella horribilis (Linnaeus, 1758) | Rh | X | X | LC | B | ||
| FAMILIA CRAUGASTORIDAE | |||||||
| Craugastor loki (Shannon & Werler, 1955) | Cl | X | X | LC | M | ||
| FAMILIA ELEUTHERODACTYLIDAE | |||||||
| Eleutherodactylus pipilans Taylor, 1940 | Ep | X | X | LC | M | ||
| FAMILIA HYLIDAE | |||||||
| Smilisca baudinii (Duméril & Bibrón, 1841) | Sb | X | X | LC | B | ||
| Trachycephalus typhonius (Linnaeus, 1758) | Tt | X | X | LC | B | ||
| FAMILIA LEPTODACTYLIDAE | |||||||
| Leptodactylus melanonotus (Hallowell, 1861) | Lm | X | X | LC | B | ||
| FAMILIA MICROHYLIDAE | |||||||
| Hypopachus ustus (Coper, 1866) | Hu | X | Pr | LC | B | ||
| FAMILIA RANIDAE | |||||||
| Lithobates forreri (Boulenger, 1883) | Lf | X | X | Pr | LC | B | |
| ORDEN GYMNOPHIONA | |||||||
| FAMILIA DERMOPHIIDAE | |||||||
| Dermophis mexicanus (Duméril & Bibrón, 1841) | Dm | X | Pr | VU | M | ||
| CLASE REPTILIA | |||||||
| ORDEN SQUAMATA | |||||||
| FAMILIA ANGUIDAE | |||||||
| Gerrhonotus liocephalus Wiegmann, 1828 | Gl | X | Pr | LC | B | ||
| FAMILIA CORYTOPHANIDAE | |||||||
| Basiliscus vittatus Regan, 1909 | Bv | X | X | LC | B | ||
| FAMILIA DACTYLOIDAE | |||||||
| Norops serranoi (Köhler, 1999) | Ns | X | M | ||||
| Norops unilobatus (Kölher & Vesely, 2010) | Nu | X | X | B | |||
| FAMILIA EUBLEPHARIDAE | |||||||
| Coleonyx elegans Gray, 1845 | Ce | X | X | A | LC | B | |
| FAMILIA GEKKONIDAE | |||||||
| Hemidactylus frenatus (Duméril & Bibrón, 1836)* | Hf | X | X | LC | |||
| FAMILIA HELODERMATIDAE | |||||||
| Heloderma horridum (Wiegmann, 1829) | Hh | X | A | LC | II | A | |
| FAMILIA IGUANIDAE | |||||||
| Ctenosaura pectinata (Wiegmann, 1834) | Cp | X | X | A | A | ||
| Ctenosaura similis (Gray, 1830) | Cs | X | X | A | LC | B | |
| Iguana iguana (Linnaeus, 1758) | Ii | X | Pr | II | M | ||
| FAMILIA PHRYNOSTOMIDAE | |||||||
| Sceloporus melanorhinus Bocourt, 1876 | Sm | X | X | LC | B | ||
| Sceloporus siniferus Cope, 1869 | Ss | X | X | LC | M | ||
| Sceloporus variabilis Wiegmann, 1834 | Sv | X | X | LC | B | ||
| Urosaurus bicarinatus (Duméril, 1856) | Ub | X | X | LC | M | ||
| FAMILIA PHYLLODACTYLIDAE | |||||||
| Phyllodactylus tuberculosus Wiegmann, 1834 | Pt | X | X | LC | B | ||
| FAMILIA SPHAERODACTYLIDAE | |||||||
| Sphaerodactylus glaucus (Cope, 1866) | Sg | X | X | Pr | LC | M | |
| FAMILIA SCINCIDAE | |||||||
| Scincella assata (Cope, 1864) | Sa | X | X | LC | M | ||
| FAMILIA TEIIDAE | |||||||
| Aspidoscelis deppii (Wiegmann, 1834) | Ad | X | X | B | |||
| Holcosus parvus (Barbour & Noble, 1915) | Hp | X | X | M | |||
| FAMILIA XANTUSIIDAE | |||||||
| Lepidophyma smithii Bocourt, 1876 | Ls | X | Pr | B | |||
| SUBORDEN SERPENTES | |||||||
| FAMILIA BOIDAE | |||||||
| Boa imperator Daudin, 1803 | Bi | X | A | II | M | ||
| FAMILIA COLUBRIDAE | |||||||
| Coluber mentovarius (Duméril, Bibron & Duméril, 1854) | Cm | X | X | A | LC | B | |
| Drymarchon melanurus (Duméril, Bibron & Duméril, 1854) | Dm | X | LC | B | |||
| Drymobius margaritiferus (Schlegel, 1837) | Dma | X | X | B | |||
| Lampropeltis abnorma (Bocourt, 1886) | La | X | X | A | B | ||
| Mastigodryas melanolomus (Cope, 1868) | Mme | X | LC | B | |||
| Oxybelis aeneus (Wagler, 1824) | Oa | X | B | ||||
| Oxybelis fulgidus (Daudin, 1803) | Of | X | B | ||||
| Pituophis lineaticollis (Cope, 1861) | Pl | X | LC | B | |||
| Spilotes pullatus Linnaeus, 1758 | Sp | X | X | B | |||
| Senticolis triaspis (Cope, 1866) | St | X | LC | B | |||
| Stenorrhina freminvillei Peters & Orejasmiranda, 1970 | Sf | X | X | B | |||
| Tantilla rubra Cope, 1876 | Tr | X | X | Pr | LC | B | |
| Trimorphodon biscutatus (Duméril, Bibron & Duméril, 1854) | Tb | X | X | B | |||
| FAMILIA DIPSADIDAE | |||||||
| Conophis sp. | Csp | X | |||||
| Coniophanes fissidens (Günther, 1858) | Cf | X | B | ||||
| Imantodes gemmistratus(Cope, 1861) | Ig | X | X | Pr | B | ||
| Leptodeira maculata (Hallowell, 1861) | Lm | X | X | Pr | LC | B | |
| Leptodeira nigrofasciata Günther, 1868 | Ln | X | LC | B | |||
| Leptodeira septentrionalis (Kennicott, 1859) | Lse | X | B | ||||
| Rhadinella godmani (Günther, 1865) | Rg | X | LC | M | |||
| Tropidodipsas fasciata Günther, 1858 | Tf | X | X | M | |||
| FAMILIA ELAPIDAE | |||||||
| Micrurus latifasciatus Schmidt, 1933 | Ml | X | X | LC | M | ||
| Micrurus nigrocinctus (Girard, 1854) | Mn | X | Pr | M | |||
| FAMILIA LEPTOTYPHLODIDAE | |||||||
| Epictia phenops (Cope, 1875) | Epp | X | X | B | |||
| FAMILIA SIBYNOPHIIDAE | |||||||
| Scaphiodontophis annulatus (Duméril, Bibron & Duméril, 1854) | San | X | M | ||||
| FAMILIA VIPERIDAE | |||||||
| Agkistrodon bilineatus Günther, 1863 | Ab | X | Pr | NT | M | ||
| Crotalus simus Latreille, 1801 | Csi | X | X | LC | M | ||
| Porthidium dunni (Hartweg & Oliver, 1938) | Pd | X | A | LC | A |
Para el grupo de los anfibios, los estimadores Jackknife 1 y Bootstrap predicen entre 14 y 13 especies respectivamente, lo que muestra que se registró entre el 85.7% y el 92.3% de la riqueza esperada. En el caso de las lagartijas se estimaron 23 especies con Jackknife 1 y 21 especies con Boostrap, lo cual representa entre un 87% y 95% de la riqueza esperada de acuerdo a ambos estimadores, mientras que para el grupo de las serpientes, Jackknife 1 y Bootstrap predijeron entre 29 y 28 especies potencialmente presentes, registrándose entre 89.7% y 92.9% de la riqueza esperada (Fig. 2). El número de especies observadas de anfibios (12 spp.), lagartijas (20) y serpientes (29) no fue distinto al obtenido extrapolando al doble y triple el esfuerzo de muestreo.
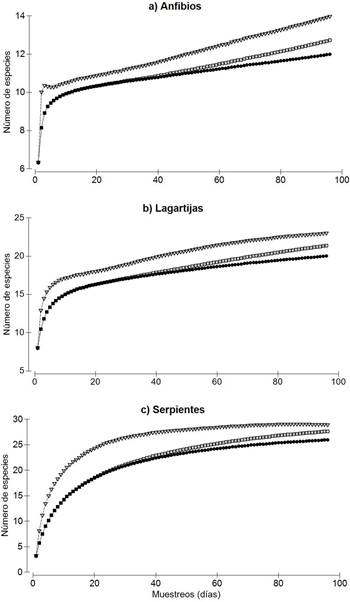
Figura 2 Curvas de acumulación de especies de anfibios, lagartijas y serpientes en el sitio arqueológico Ilesia Vieja. ●: Especies observadas,
En el caso de la diversidad (N1 de Hill) acumulada no se observa una marcada asíntota para los tres grupos de herpetozoos (Fig. 3). Los diagramas de distribución de abundancia mostraron diferencias en la composición de especies por cobertura vegetal (W=406, p<0.0001). En áreas con ausencia de cobertura arbórea se observó una mayor dominancia de especies que pueden ser favorecidas por la perturbación antrópica, como es el caso de la especie exótica Hemidactylus frenatus. Otras especies dominantes en alguna de las dos coberturas evaluadas son de hábitos generalistas, como Rhinella horribilis, Basiliscus vittatus o Aspidoscelis deppii (Fig. 4). Por otro lado, las especies menos dominantes de acuerdo con este muestreo fueron Dermophis mexicanus, Stenorrhina freminvillei y Epictia phenops.
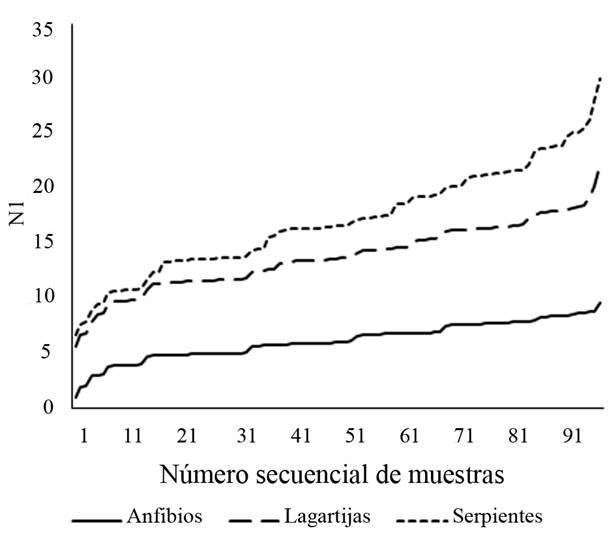
Figura 3 Curvas de diversidad acumulada expresada como números de primer orden (N1 en la serie de Hill) para los grupos de anfibios, lagartijas y serpientes en el sitio arqueológico Iglesia Vieja.
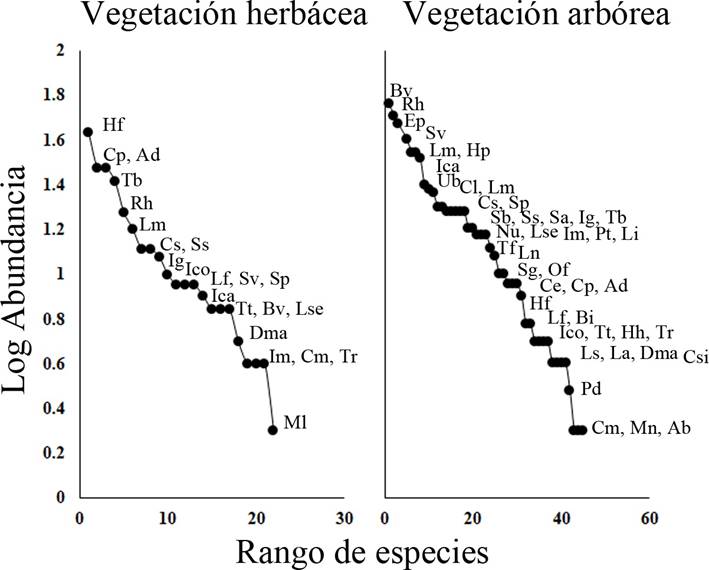
Figura 4 Diagramas de rangos de abundancia de especies de anfibios y reptiles para Vegetación herbácea y arbórea en el sitio arqueológico Iglesia Vieja. La clave de cada especie se presenta en el Cuadro 1.
De las 61 especies reportadas para el SAIV, tres especies se encuentran en el apéndice II de la CITES (Boa imperator, Heloderma horridum e Iguana iguana); tres especies mostraron ser altamente vulnerables de acuerdo al EVS (Ctenosaura pectinata, Heloderma horridum y Porthidium dunni); 21 estuvieron en alguna categoría de riesgo de la NOM-059-SEMARNAT y 36 en la lista roja de la IUCN (Cuadro 1). Finalmente, al comparar la herpetofauna del área de estudio con la reportada para las siete regiones fisiográficas de Chiapas, el SAIV tuvo mayor afinidad herpetofaunística con las regiones Planicie Costera del Pacífico (66.53%) y Sierra Madre de Chiapas (62.34 %). Las unidades regionales para las siete provincias fisiográficas y el SAIV formadas en el dendrograma se muestran en la Figura 5.
Discusión
En Chiapas se han reportado 330 especies de herpetozoos (Johnson et al., 2015a), por lo que los anfibios y reptiles registrados en el SAIV representan al 18.48% de la herpetofauna estatal. Aunque el área de influencia del SAIV es de tan solo 60 ha, la densidad especies en nuestra área de estudio fue mayor a la reportada en otras zonas de un área mucho mayor y que contemplan selva baja, tal es el caso del Cerro de Guiengola, Oaxaca (Martín-Regalado et al., 2011) y el Corredor Puerto Madero, Chiapas (Luna-Reyes et al., 2012).
En lo que respecta a las regiones fisiográficas colindantes con el área de estudio, el 46.9% y el 32.7% de las especies de la Planicie Costera de Chiapas y la Sierra Madre, respectivamente, se encuentran alojadas en esta área. Además de las regiones fisiográficas, el SAIV tiene colindancia al norte con la Reserva de la Biosfera la Sepultura (REBISE), la cual cuenta con un catálogo herpetofaunístico de 73 especies (24 de anfibios y 49 de reptiles) (INE, 1999). Treinta y dos de estas especies se registraron en Iglesia Vieja (45.2%), de las cuales siete fueron de anfibios y 25 de reptiles.
Los valores de riqueza estimada indicaron niveles adecuados en el esfuerzo de muestreo aquí propuesto para los tres grupos de herpetozoos, alcanzando estimaciones superiores al 85% de la completitud del inventario; esto considerando que se ha propuesto un 80% de representatividad mínima para efectuar comparaciones válidas entre hábitats, temporadas o inventarios (Colwell & Coddington, 1995; Pineda & Halffter, 2004). Sin embargo, para el caso de los anfibios, la riqueza representada en la curva de acumulación no alcanza una marcada asíntota, siendo esta tendencia observada en el análisis de diversidad acumulada para los tres grupos. En este contexto, el uso de los números de la serie de Hill en curvas acumuladas ofrecen una mayor certidumbre en estimaciones de la diversidad, controlando eficazmente la contribución de los taxones raros a la muestra (Kang et al., 2016). Esto permite detectar interpretaciones erróneas en las estimaciones tradicionales de riqueza, las cuales pueden depender en gran medida al protocolo de muestreo utilizado (Moreno et al., 2011).
La riqueza de anfibios tiende a ser comparativamente menor a la de los reptiles en ambientes con definida estacionalidad climática, como lo es la planicie costera del Pacífico mexicano. Las especies de este último grupo pueden presentar una distribución más homogénea durante el ciclo lluvias-estiaje (García & Cabrera-Reyes, 2008; Leyte-Manrique et al., 2016), debido principalmente a las ventajas adaptativas de muchos reptiles para tolerar eficazmente las variaciones en temperatura y precipitación. Para el caso de los anfibios, su presencia y abundancia tiende a asociarse a la disponibilidad de cuerpos de agua perennes o a la estación lluviosa; a excepción de pocas especies con un modo reproductivo que les permita cierta independencia del medio acuático, como ocurre con Craugastor loki, la cual es observable durante todo el año en el SAIV. La identificación de ambientes acuáticos efímeros en el SAIV y un mayor esfuerzo de muestreo en estas áreas, probablemente permitirá incrementar el registro de nuevas especies para el sitio. No obstante la tendencia en selvas secas es la de encontrar una menor riqueza de anfibios (Martín-Regalado et al., 2011).
Con base en el tipo de cobertura vegetal, el registro aquí de un mayor número de especies en el hábitat arbóreo (56 spp.) que en el herbáceo (43), es una tendencia descrita también en otros estudios. Luna-Reyes et al. (2012) encontraron que aunque más del 66% de las especies de herpetozoos se comparten entre pastizales y ambientes arbóreos (manglares y selvas) de la costa de Chiapas, existen marcadas diferencias en cuanto a diversidad, la cual es notablemente mayor en estos últimos. Morales-Mávil et al. (2001) reportan que para un área de borde de selva alta en Veracruz, el 47.6% de especies de reptiles ocurren tanto en hábitats arbóreos como en pastizales. Por otro lado, se ha observado que la disimilitud en la herpetofauna entre bosques de origen primario y secundario tiende a ser menor (Urbina-Cardona & Londoño-Murcia, 2003). De acuerdo con la heterogeneidad ambiental, los hábitats que estructuralmente son más complejos frecuentemente exhibirán una mayor riqueza y diversidad de especies (Stewart et al., 2000). Algunos autores consideran que la vegetación en muchos casos no contribuye a explicar la distribución y estructura de las comunidades herpetológicas, debido principalmente a los patrones de uso de hábitat de las especies (García & Ceballos, 1994). Sin embargo el tipo de cobertura vegetal si suele estar relacionado con la diversidad de microhábitats que definen la abundancia de organismos con hábitos acuáticos, terrestres, fosoriales o arborícolas (Whitfield & Pierce, 2005; Wells, 2007; Calderón-Mandujano et al., 2008). Del total de las especies reportadas en este trabajo, el 35% se encontró en alguna categoría de riesgo de la NOM-059-SEMARNAT, de las cuales una ocurre en todas las categorías de riesgo consideradas en este escrito: Heloderma horridum (Amenazada en la NOM, Least Concern en la IUCN, en el apéndice II del CITES y una puntuación Alta en el Environmental Vulnerability Score). Catalogadas en tres categorías le siguen Dermophis mexicanus, Iguana iguana, Boa imperator, Agkistrodon bilineatus y Porthidium dunni; todas ellas con evaluaciones de riesgo media a alta.
En lo que concierne a ciertas especies del SAIV, la captura de un organismo del género Conophis no pudo concretarse en este muestreo, por lo que la identificación se realizó con los rasgos observados pudiéndose tratar, de acuerdo a su distribución y características morfológicas, de Conophis vittatus. Otra especie detectada no corroborada, pero con potencial de distribución en el sitio, es Scinax staufferi, un anfibio de la familia Hylidae ya registrado a baja altitud en la Planicie Costera del Pacífico (Luna-Reyes et al., 2012).
Los patrones de similitud herpetofaunística de Chiapas explorados por Johnson et al. (2015a) mostraron que la Planicie Costera del Pacífico, la Sierra Madre y la Depresión Central, integran una misma unidad zoogeográfica. De acuerdo a nuestro estudio, el patrón de similitud del SAIV con respecto al grupo detectado por Johnson et al. (2015a) correspondería a la influencia de los ambientes subhúmedos predominantes en las tres regiones fisiográficas mencionadas. La localización del SAIV en las estribaciones de la Sierra Madre, podría ubicarla como un corredor subhúmedo para las especies entre la Planicie Costera y la Depresión Central.
La herpetofauna del SAIV presentó una riqueza de especies de selvas secas relativamente alta, considerando su reducido tamaño y fragmentación del hábitat, albergando además a varias especies catalogadas bajo alguna categoría de riesgo a nivel nacional e internacional. El presente trabajo constituye la primera línea base referente a estudios herpetológicos, y en general el primero sobre biodiversidad, en este sitio. A fin de establecer criterios para el manejo de un sitio arqueológico y sus ecosistemas naturales, es altamente recomendable continuar con investigaciones sobre la estructura de la comunidad y dinámica de sus poblaciones para este y otros grupos bióticos prioritarios.











 nova página do texto(beta)
nova página do texto(beta)




