Introducción
México cuenta con la mayor riqueza de serpientes venenosas del continente americano (Campbell & Lamar, 2004), y uno de los estados más diversos es Chiapas, con 113 especies de serpientes (Johnson et al., 2015), de las cuales 20 son venenosas (Luna-Reyes et al., 2015).
En el caso particular del área sureste de la Altiplanicie de Chiapas, existen cuatro especies de serpientes venenosas con mayor riesgo de extinción, dos elápidos Micrurus diastema (Duméril, Bibron & Duméril, 1854) y M. elegans Jan, 1858 y dos vipéridos Bothriechis aurifer (Salvin, 1860) y Crotalus simus Latreille, 1801. Además, para algunas de ellas, sus registros son escasos y se conoce poco sobre su distribución, por lo que es necesario actualizar dicho conocimiento, lo cual es fundamental para la implementación de planes de manejo y conservación (Rushton et al., 2004).
Aun cuando se han hecho algunos estudios de distribución potencial con reptiles en México, incluyendo serpientes venenosas (Ochoa-Ochoa et al., 2006), éstos no han abarcado el área de distribución completa de algunas especies, como C. simus. De igual manera, en los estudios que incluyen la distribución potencial de las especies y su representatividad en las áreas naturales protegidas (ANP) (Paredes-García et al., 2011), sólo se incluye a México, y no se evalúa su distribución en Centroamérica, ni representan la distribución completa de algunas especies.
Para implementar estrategias de conservación es necesario conocer la relación del hombre con la naturaleza, debido a que se trata de una variable que interviene en el deterioro ambiental (García-López et al., 2017). La manera en la que es conocido y percibido un animal por una comunidad humana, constituye parte del sistema del conocimiento tradicional, el cual puede ser considerado paralelo al sistema del conocimiento científico y genera determinada actitud de la gente hacia éste (Penguilly-Macías et al., 2009). Además, a partir del conocimiento ancestral de las comunidades indígenas se puede obtener información preliminar de la biota y aspectos generales relacionados con el estado de conservación de los recursos naturales en sus territorios, los cuales han sido poco explorados (Racero-Casarrubia et al., 2008). Por otra parte, las actitudes de las personas hacia las especies animales, pueden impactar de forma negativa a sus poblaciones (Enríquez-Rocha & Rangel, 2004).
Se han realizado estudios sobre percepción social hacia las serpientes del género Crotalus en el norte de México (Gatica-Colima & Jiménez-Castro, 2009), pero no para el resto de las especies de serpientes venenosas en el país, incluyendo el estado de Chiapas. En cuanto al uso medicinal de la fauna silvestre, se hizo un estudio en la parte central de la Altiplanicie de Chiapas (Enríquez et al., 2006) y en un ejido del sureste de esta región (Serrano-González et al., 2011); sin embargo, es poco lo que se conoce sobre los usos hacia las serpientes venenosas en el área.
El uso de modelos de distribución potencial proveen predicciones detalladas de la distribución al relacionar la presencia de las especies con predictores ambientales (Elith et al., 2006). Por todo lo anterior, el presente trabajo aborda el análisis de la distribución geográfica de cuatro especies de serpientes venenosas en riesgo de extinción de la Altiplanicie de Chiapas mediante el modelado de nicho ecológico y la percepción de las personas hacia estas especies con la aplicación de entrevistas a los pobladores. Además, se determinan las variables ambientales que influyen en su distribución y evalúa su representatividad en las ANP.
Materiales y métodos
La Altiplanicie de Chiapas está constituida por una superficie accidentada y representa una de las siete regiones fisiográficas de Chiapas (Fig. 1) (Müllerried, 1957). Es un macizo montañoso de 160 km de largo y 75 km de ancho, en dirección noroeste-sureste, ubicado entre los 15° 55’-17° 00’ N, 91° 30’-93° 10’O y ocupa una superficie de 6,200 km2. Los climas predominantes son templado subhúmedo y semicálido húmedo con lluvias en verano (más del 85% de la precipitación anual entre mayo y octubre) (García-Martínez, 1988). La temperatura media anual oscila entre 13-15 °C y la precipitación media anual es de 1,100-1,200 mm (García-Martínez, 1988). Los tipos de vegetación son: selva mediana y baja siempre verde, bosque deciduo, bosque de hojas planas y duras (encinar) y bosque de hojas aciculares (pinar) (Miranda, 2015).
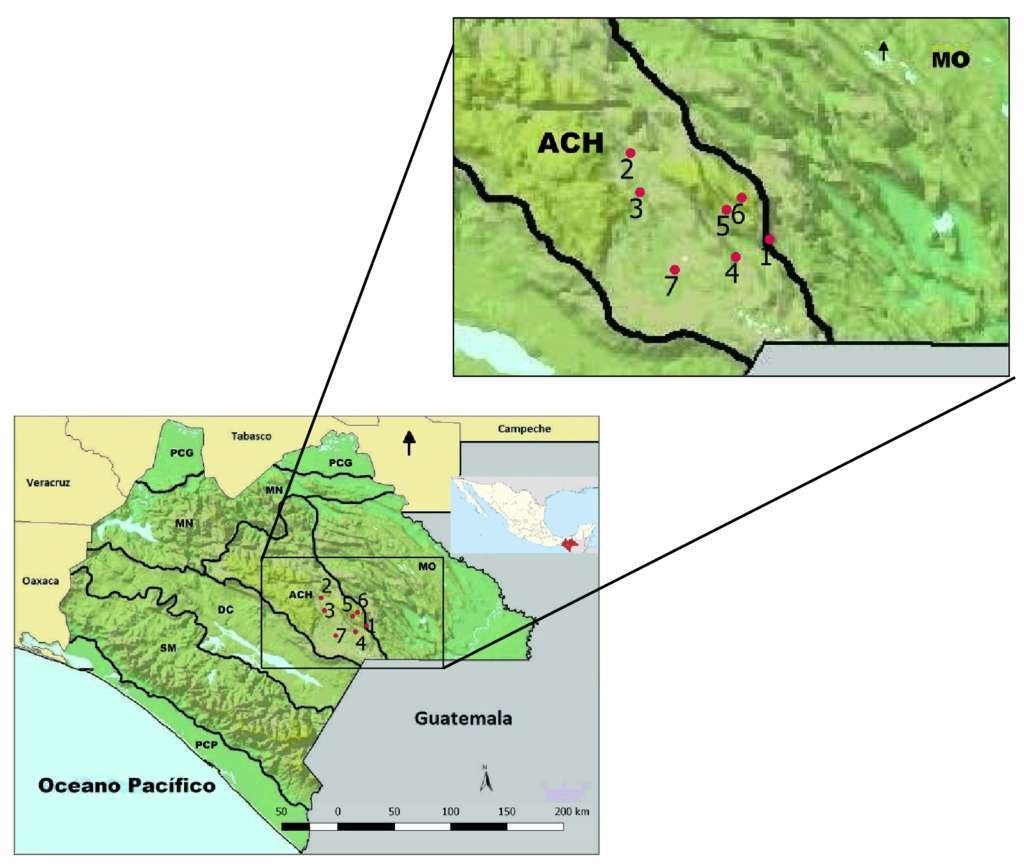
Figura 1 Área de estudio en el sureste de la Altiplanicie de Chiapas. Simbología: DC = Depresión Central, ACH = Altiplanicie de Chiapas, PCG = Planicie del Golfo, MN = Montañas del Norte, MO = Montañas del Oriente, PCP = Planicie Costera del Pacífico, SM = Sierra Madre (tomado de Johnson et al. 2015). Localidades visitadas: 1 = Cruz del Rosario, 2 = El Vergelito, 3 = Bajucú, 4 = Buenavista Pachán - El Suspiro, 5 = Santa Martha, 6 = Santiago Guelatao, 7 = Llano Grande - Tintonishac.
Se realizaron visitas mensuales (febrero-agosto de 2016), en siete localidades ubicadas en el área de estudio (Fig. 1) con duración de diez días cada una. Los ejemplares fueron colectados con el permiso de la Dirección General de Vida Silvestre (SGPA/DGVS/01609/16) y depositados en la Colección Herpetológica de El Colegio de la Frontera Sur, Unidad Chetumal (ECO-CH-H).
La asignación del tipo de endemismo y categorías de riesgo de cada especie se realizó con base en la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (SEMARNAT, 2010), complementándose con los estudios de Flores-Villela (1993) y mediante consulta de la lista roja de especies amenazadas de la IUCN (IUCN, 2017), el sistema EVS (Puntaje de Vulnerabilidad Ambiental) (Johnson et al., 2015) y la Convención sobre el Comercio Internacional de Especies Amenazadas de Flora y Fauna Silvestre (CITES, 2011).
Los registros ya existentes de serpientes venenosas se obtuvieron de las bases de datos de las siguientes colecciones nacionales e internacionales: AMNH, ANSP, BYU, CAS, CM, CUMV, CNAR, ECO-CH-H, ECO-SC-H, FMNH, IHNHERP, KU, LACM, LSUMZ, MPM, MZ-UNICACH, MCZ, MZFC, OMNH, TCWC, TNHC, UF, UMMZ, USNM, UTEP, YPM y UAEH. La confiabilidad de la identidad taxonómica de los registros fue verificada por los curadores o responsables de las colecciones y personalmente se llevó a cabo la revisión en las colecciones herpetológicas ECO-SC-H, IHNHERP y MZ-UNICACH. Los acrónimos para los museos se encuentran en Sabaj-Pérez (2014), a excepción del Centro de Investigaciones Biológicas de la Universidad Autónoma del Estado de Hidalgo (UAEH).
Los registros en línea se obtuvieron de: Vernet (http://www.vernet.org), Global Biodiversity Information Facility (GBIF, http://www.gbif.org) e iNaturalist (http://www.inaturalist.org). Además, se usaron registros de literatura obtenidos de Campbell & Smith (2000), Köhler (2001), Hidalgo-García (2008), Neri-Castro et al. (2013), del proyecto “Conocimiento y manejo sustentable de la herpetofauna para el fortalecimiento de la Red de Ecoturismo en el Área de Intervención de la Asociación de Silvicultores Región Miramar A. C.” y los registros obtenidos en campo durante este estudio.
Para georreferenciar los registros que sólo tenían localidad de colecta se emplearon los programas Geolocate 3.22 (Ríos & Bart, 2010) y Google Earth Pro 7.1.5. Para depurar las bases de datos, se trazaron todos los puntos en archivos vectoriales de México y Centroamérica, en el programa Quantum GIS 2.16 (Quantum GIS Development Team, 2016) y se comparó la ubicación de los puntos de cada especie con los mapas de Campbell & Lamar (2004), IUCN (2017) y con gráficas proyectadas en el espacio ambiental.
Los mapas de distribución fueron generados con el programa MaxEnt (Phillips et al., 2006) (http://www.cs.princeton.edu/~schapire/maxent/), el cual es un algoritmo robusto que modela la distribución potencial de las especies por medio de la relación entre los puntos de presencia conocidos y las variables ambientales incluidas en el modelo (Phillips et al., 2006). A partir de esta relación, el algoritmo extrapola la presencia de la especie a las áreas donde no se cuenta con registros (Lindenmayer et al., 1991). Las coberturas consistieron en 19 capas de información sobre temperatura y precipitación, provenientes de WorldClim (Hijmans et al., 2005), con una resolución de 0.86 km2, las cuales fueron recortadas con el programa DIVA-GIS 7.5.0.0 (Hijmans et al., 2012), con base en los mapas de distribución de Campbell & Lamar (2004) y de la IUCN (2017). Posteriormente, se eliminaron las capas que tuvieron alta correlación (r > 0.85), usando el coeficiente de Pearson. Los criterios para eliminar variables ambientales fueron dejar aquellas que pudieran interpretarse más fácilmente, tomando en cuenta el conocimiento ecológico de cada especie. El programa MaxEnt, estima además la importancia de cada variable en la distribución de las especies y el modelo generado fue validado con el área bajo la curva (AUC), derivada de la curva operada por el receptor (ROC), las cuales están implementadas en el programa (Phillips et al., 2006). Los modelos con valores entre 0.7-0.9 para los puntos de entrenamiento y prueba se consideraron razonablemente buenos y los modelos con valores > 0.9 se catalogaron como muy buenos (Peterson et al., 2011). En el proceso de evaluación de los modelos, se usó el 70% de los registros para entrenar el modelo y 30% para validar, mediante validación cruzada. Para los modelos de presencia-ausencia, MaxEnt calcula el valor estadístico para cada umbral, con base en una prueba de Chi-cuadrado. Una vez validado cada modelo, se emplearon todos los registros para obtener los mapas definitivos (Martínez-Meyer com. pers.), a excepción del modelo empleado para M. diastema en el que se usó el modelo generado con los datos de calibración (60% de los datos, 40% para su validación), esto para evitar un sobreajuste, por la gran cantidad de registros que se tenía para esta especie.
Para correr el modelo, se usaron las opciones por defecto de MaxEnt, como lo sugieren Phillips & Dudik (2008), a excepción de la ventanilla de Setting/Advanced, en donde se desactivaron las casillas “Extrapolate” y “Do clamping”, cuando se modelaron especies de zonas montañosas, como B. aurifer y M. elegans, para evitar extrapolar en valores extremos de las variables la distribución en lugares donde la especie no está presente (Elith et al., 2011). Se usó el formato logístico, debido a que es más fácil de interpretar, y es robusto cuando el área de distribución de una especie es desconocida (Phillips & Dudik, 2008).
El algoritmo MaxEnt tiene incorporado un procedimiento para la selección de las variables más importantes durante la generación de los modelos de distribución potencial de las especies. Para la evaluación de las variables en el modelo y el porcentaje que aporta cada una se utilizó la prueba Jackknife (Plasencia-Vázquez et al., 2014).
Para visualizar la representatividad de las especies en las ANP, se emplearon como puntos de corte los umbrales de presencia mínima de entrenamiento, sensibilidad máxima de entrenamiento más especificidad, prueba de máxima sensibilidad más especificidad y entropía equivalente de umbrales y distribuciones originales (Liu et al., 2005). Posteriormente, a los mapas de distribución potencial les fueron eliminadas las áreas donde se conoce que el taxón no puede estar presente o no ha sido registrado, para así obtener la distribución real o área ocupada (Peterson & Soberón, 2012), usando como criterio los mapas de Campbell & Lamar (2004), IUCN (2017) y superponiendo capas vectoriales de las ecorregiones propuestas por Olson et al. (2001). Posteriormente, se sobrepusieron mapas digitales de las ANP federales de México y Centroamérica.
Para evaluar la percepción social sobre las especies de serpientes, se hicieron 62 entrevistas semiestructuradas a los pobladores, las cuales son una de las principales estrategias para producir datos en la investigación cualitativa (Sautu, 2003). Siete entrevistas se realizaron en el municipio de La Independencia (dos localidades) y 55 en Las Margaritas (14 localidades), dirigidas a personas entre 16 y 93 años de edad. Se consideró entrevistar a un número similar de personas, tanto de la etnia tojolabal como de mestizos.
Inicialmente, se realizó un cuestionario piloto para saber si las preguntas eran claras y no dirigidas a una respuesta en particular (Enríquez-Rocha & Rangel, 2004), el cual fue aplicado a habitantes de las comunidades donde existen serpientes venenosas.
Se seleccionaron informantes clave con base en su conocimiento de la fauna local, así como personas de ambos sexos con disponibilidad para participar en el estudio, y con más de cinco años de permanencia en la localidad a fin de aumentar la confiabilidad de las respuestas (Rojano et al., 2013; Álvarez et al., 2015). Se entrevistaron a personas de las localidades donde se realizó el muestreo de serpientes y aquellas de localidades aledañas, empleando un cuestionario guía, el cual estuvo conformado por 38 preguntas, distribuidas en ocho secciones: 1) Datos del encuestado, 2) Presencia e identificación de las especies, 3) Acciones al ver a una serpiente venenosa, 4) Incidencias de accidente ofídico, 5) Medidas tomadas en caso de accidente ofídico, 6) Conocimiento sobre serpientes venenosas, 7) Uso de serpientes venenosas y 8) Protección a las serpientes venenosas. Durante las entrevistas, se mostraron fotografías, tanto de serpientes inofensivas como venenosas, con el fin de que las pudieran identificar, usando la guía de Köhler (2008). Se realizó la prueba de Chi-cuadrado de Pearson para analizar la independencia entre variables cualitativas.
Resultados
Se integró una base de datos con 918 registros de cuatro especies de serpientes venenosas: Micrurus diastema (603), M. elegans (76), Bothriechis aurifer (35) y Crotalus simus (204). La mayoría (904) corresponden a registros de la literatura, bases de datos en línea, informes técnicos de proyectos de investigación y ejemplares de museos, mientras que el resto (14 registros) fueron obtenidos mediante los muestreos de campo.
Las cuatro especies de serpientes venenosas reportadas en el presente trabajo se encuentran en distintas categorías de riesgo (Cuadro 1), y B. aurifer además tiene distribución restringida. Por su parte C. simus y M. diastema, tienen distribución más amplia, abarcando algunos países centroamericanos. Todos los modelos presentaron valores de AUC > 0.9 y p < 0.05, a excepción de M. diastema (AUC = 0.865, p < 0.05).
Cuadro 1 Serpientes venenosas con mayor riesgo de extinción del sureste de la Altiplanicie de Chiapas y su clasificación. NOM= NOM-059-SEMARNAT-2010, Pr = Sujeta a Protección Especial, A = Amenazada; IUCN = Unión Internacional para la Conservación de la Naturaleza, LC = Preocupación Menor, VU = Vulnerable; EVS = Puntaje de Vulnerabilidad Ambiental, L = Bajo, M = Medio, H = Alto; CITES = Convención sobre el Comercio Internacional de Especies Amenazadas de Flora y Fauna Silvestres, III = Apéndice III.
| Taxón | NOM | IUCN | EVS | CITES |
|---|---|---|---|---|
| Elapidae | ||||
| Micrurus diastema | Pr | LC | L(8) | III |
| M. elegans | Pr | LC | M(13) | -- |
| Viperidae | ||||
| Bothriechis aurifer | A | VU | H(14) | -- |
| Crotalus simus | A | LC | M(10) | III |
Micrurus diastema tiene una distribución extensa, principalmente en los estados de Quintana Roo y Yucatán, su límite de distribución al norte corresponde a la parte central de Veracruz y noroeste de Puebla (sur de la Huasteca y Provincia Llanuras y Lomeríos), y al sur hasta el oriente de las Montañas Chortí, en Honduras (Fig. 2 A). Se encuentra bien representada en las ANP de México, Guatemala y Belice (Fig. 2 A; Anexo 1). Para M. elegans el límite norte de su distribución es similar, desde la parte central de Veracruz y noroeste de Puebla, hacia el sureste, pasando por Oaxaca y Chiapas, hasta la parte central de Guatemala (Sierra de Santa Cruz y Chamá) (Fig. 2 C). Esta especie se encuentra mejor representada en las ANP de Chiapas (Fig. 2 C; Anexo 1). La precipitación del periodo más seco (bio14) contribuyó más a generar el mapa de distribución de M. diastema (Fig. 2 B), mientras que la temperatura media anual (bio1) lo fue para M. elegans (Fig. 2 D).
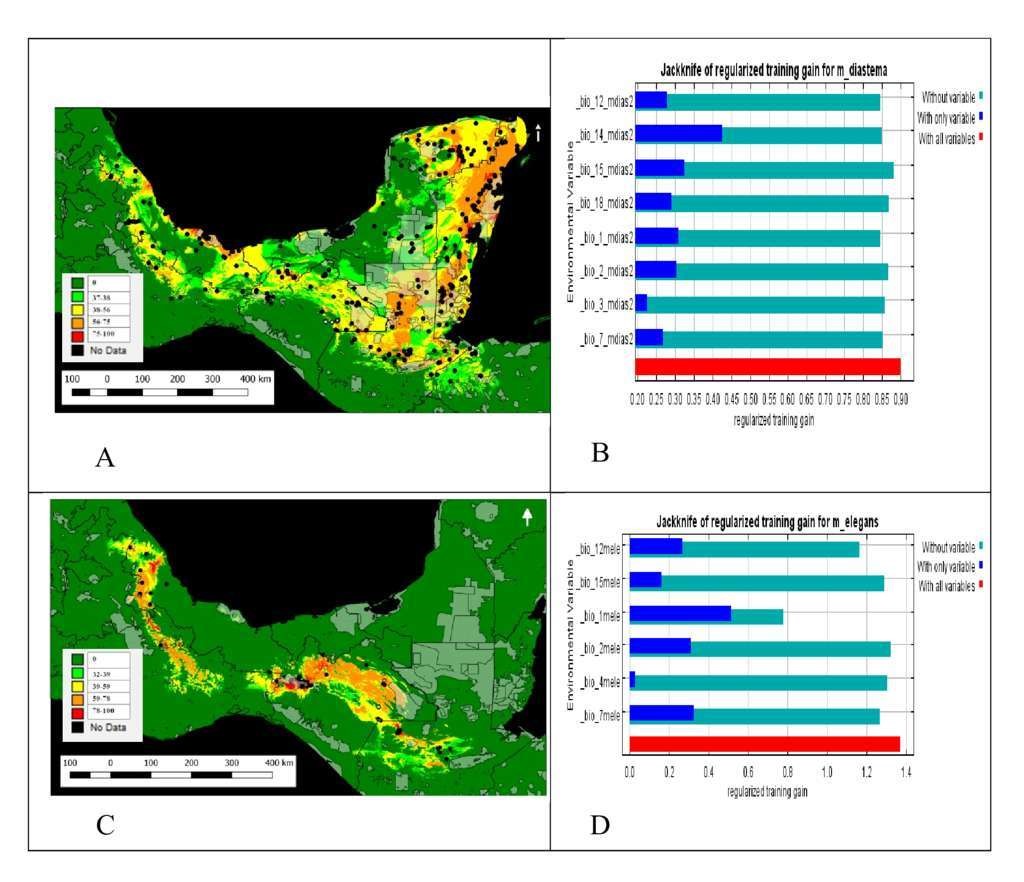
Figura 2 Área de distribución de: Micrurus diastema (A) y M. elegans (C) y su representatividad en las Áreas Naturales Protegidas de México y Centroamérica (ANP). En la escala de colores (cuadro interior), se indica la probabilidad de encontrar a la especie. Los puntos de color negro representan los registros históricos y los de color azul son las nuevas localidades de registro (registros recientes). Los polígonos de color gris son las ANP. Resultados de la prueba Jackknife para determinar la ganancia de las variables ambientales en la construcción del modelo: M. diastema (B) y M. elegans (D).
En cuanto a los vipéridos, B. aurifer se distribuye desde el límite del área sureste de la Altiplanicie de Chiapas con las Montañas del Norte de Chiapas, hasta la Sierra de las Minas, en Guatemala (Fig. 3 A), pero con poca presencia en las ANP. Crotalus simus se distribuye desde la Llanura Costera Veracruzana y el Istmo de Tehuantepec hasta Costa Rica, en la Cordillera Volcánica Central, pero mayormente hacia la costa del Pacífico, en donde tiene buena representatividad en las ANP (Fig. 3 C, Anexo 1). Para B. aurifer, la variable temperatura media anual (bio1) contribuyó más a la generación del modelo (Fig. 3 B), y para C. simus fueron la precipitación del periodo más seco (bio14) y estacionalidad de la precipitación (bio15) (Fig. 3 D).

Figura 3 Área de distribución de: Bothriechis aurifer (A) y Crotalus simus (C) y su representatividad en las Áreas Naturales Protegidas de México y Centroamérica (ANP). En la escala de colores (cuadro interior), se indica la probabilidad de encontrar a la especie. Los puntos de color negro representan los registros históricos y los de color azul son las nuevas localidades de registro (registros recientes). Los polígonos de color gris son las ANP. Resultados de la prueba Jackknife para determinar la ganancia de las variables ambientales en la construcción del modelo: B. aurifer (B) y C. simus (D).
La gran mayoría de los pobladores al ver una serpiente a la que consideran venenosa la matan o intentan matarla (89%), aunque existen diferencias significativas (X 2 = 20.72, gl = 4, p < 0.05) en la acción que realizan en función del grado de estudios que tienen, a menor grado de estudios mayor intención por matarlas. No hubo diferencias significativas analizando las respuestas por grupos étnicos (X 2 = 1.24, gl = 1, p < 0.27).
Respecto al conocimiento sobre el hábitat, 42% de los entrevistados dijeron que C. simus se encuentra en los ocotales (pinar), aunque también se mencionan milpas, zacatales, acahuales y roblares (encinar). La mayoría coincidió en que el mococh verde (B. aurifer) habita en lugares húmedos de la montaña.
El 66% mencionó que han habido mordeduras a personas y animales domésticos causadas por víboras de cascabel. Se presentó un caso por mordedura de C. simus, según refieren varios pobladores, aunque el paciente al ver fotografías de las especies la identificó como Atropoides mexicanus, por lo que se debe de tener cuidado al utilizar dicho material con fines de identificación taxonómica. El mayor número de casos de mordeduras a personas correspondieron a Atropoides mexicanus (38%) y Cerrophidion godmani (28%), mientras que Crotalus simus (14%), Bothriechis aurifer (10%), Micrurus diastema (7%) y Bothrops asper (3%) tuvieron valores menores.
En el caso de mordeduras, el tratamiento principal consiste en ingerir bebidas alcohólicas, aunque algunos toman curarina y nauyacol (plantas). Sólo una persona mencionó que sabía o tenía noción acerca de la utilidad del suero antiviperino, actualmente conocido como faboterápico.
En diferentes localidades los pobladores matan a la víbora de cascabel (Crotalus simus), por el uso medicinal que se le atribuye, o para venderlas a personas que provienen principalmente de otras comunidades, a un precio que varía desde 50 hasta 3000 pesos dependiendo del tamaño del ejemplar. El uso medicinal más frecuente fue para curar el cáncer (53%), aunque también se mencionaron “espanto” (16%), dolor en general (13%), dolor de anginas, fiebre, tos, cicatrización de heridas y para tener hijos (3% cada uno). Esta especie también es usada como alimento y su piel se emplea para hacer cinturones. Sólo una persona comentó que también la coralillo (Micrurus sp.) es usada con fines medicinales.
El 73% piensan que no se deben de proteger a las serpientes venenosas, aunque hubo diferencias significativas en las respuestas entre personas con distintos niveles de escolaridad (X 2 = 20.72, gl = 4, p < 0.05). Las que creen que se debe proteger cuentan con estudios (ej. primaria, secundaria, preparatoria, etc.). No hubo diferencias significativas analizando las respuestas por grupos étnicos (X 2 = 0.198, gl = 1, p < 0.66).
Discusión
Se obtuvieron mejores resultados en la modelación para C. simus, M. diastema y M. elegans (valores de AUC mayores a 0.9 y p < 0.05) con los que se consiguieron modelos con un alto poder predictivo. Los valores para M. diastema (AUC = 0.865, p< 0.05), son considerados “razonablemente buenos” (Peterson et al. 2011); el sustento estadístico de los modelos podría estar asociado al proceso de depuración de datos, mediante el cual fueron eliminados los registros que se encontraban fuera del área conocida y espacio ambiental de las especies estudiadas.
La distribución de M. elegans y B. aurifer hacia el sur parece estar limitada por el Valle de Motagua, en Guatemala. Este valle ha ocasionado la divergencia de serpientes de los géneros Bothriechis, Atropoides y Cerrophidion, y actúa como una barrera geográfica para las especies de serpientes que habitan en las zonas montañosas a ambos lados del valle (Castoe et al., 2009; Daza et al., 2010).
Bothriechis aurifer es una de las especies de serpientes de la Altiplanicie de Chiapas más amenazadas, por su distribución restringida y la acelerada destrucción de su hábitat. Durante el trabajo de campo, se pudo apreciar que su hábitat está siendo severamente afectado, principalmente por la práctica de roza-tumba-quema. Esta tendencia de disminución de sus poblaciones por pérdida de hábitat también ha sido reportada recientemente en Guatemala (IUCN, 2017). Su distribución al norte (límites de la Altiplanicie de Chiapas con las Montañas del Norte) se encuentra limitada por la presencia de Bothriechis rowleyi, una especie emparentada (Castoe et al., 2009) y al sur por el Valle de Motagua, el cual ha actuado como una barrera geográfica para distintas especies (Castoe et al., 2009). Cabe destacar que el ejemplar observado en Santiago Guelatao y el ejemplar colectado en Felipe Carrillo Puerto (cerca de Cruz del Rosario) en el municipio de Las Margaritas, corresponden a dos nuevos registros de localidad, con los cuales su distribución se extiende aproximadamente 43 km al noreste (Hidalgo-García, J. A., Luna-Reyes, R., Cedeño-Vázquez, J. R. & González-Solís, D., datos no publicados), tomado como referencia el registro previo más cercano reportado por Campbell & Lamar (2004) en el Parque Nacional Lagunas de Montebello. La temperatura media anual fue la variable más importante para B. aurifer, que es una especie característica de lugares fríos (generalmente por encima de los 1500 msnm); sin embargo, la humedad también parece ser un factor importante en su distribución, ya que se encuentra en bosques mesófilos de montaña y vegetación asociada (Campbell & Lamar, 2004).
La distribución de C. simus en la vertiente del Pacífico se encuentra demarcada por el Istmo de Tehuantepec, el cual ha sido una barrera geográfica para especies características de tierras bajas y altas, y separa linajes en ambos lados (Castoe et al., 2009).
Crotalus simus habita en lugares cálidos y secos y no se encuentra en las selvas húmedas (Álvarez del Toro, 1982). En este estudio, se pudo constatar que esta especie, habita en zonas más secas, a diferencia de Crotalus tzabcan, que habita en clima subhúmedo de la Península de Yucatán (Campbell & Lamar, 2004). En el área de distribución de C. simus las lluvias llegan de manera estacional, de ahí el hecho de que la variable que contribuyó más al modelo fue la estacionalidad de la precipitación.
A pesar de que C. simus es una de las especies de vipéridos mejor representadas en las ANP de México (Paredes-García et al., 2011) y Centroamérica, es perseguida por las propiedades curativas que la gente le atribuye (Enríquez et al., 2006). Además, se ha reportado que se ha vuelto escasa en algunas partes de Guatemala (Campbell & Lamar, 2004). En contraste, en Tintonishac (mpio. La Independencia) la gente adulta menciona que la población de víboras de cascabel ha aumentado en los últimos años. Esto puede deberse al cambio climático, ya que estas serpientes habitan en las regiones secas y cálidas (Álvarez del Toro, 1982) y pudieran estar encontrando condiciones más favorables en lugares que antes eran templados, debido a que son animales sensibles a los cambios de temperatura (Beaupre & Douglas, 2009).
El cambio de uso del suelo, y en particular, la deforestación, pudieran afectar la distribución de diferentes especies de serpientes venenosas, ya que dichos factores contribuyen de manera importante a la pérdida de biodiversidad (Mas & Flamenco-Sandoval, 2011). Por lo anterior, es necesario realizar un estudio para poder correlacionar a mayor profundidad el impacto que las poblaciones humanas han causado en la distribución y desplazamiento de las especies estudiadas, conforme han ido ocupando nuevas zonas y transformando el hábitat.
Se ha documentado que Crotalus simus es usada para atender la hinchazón del cuerpo, curar mordeduras de serpiente y gangrena (Serrano-González et al., 2011) en la Altiplanicie de Chiapas. También se han reportado usos medicinales de las víboras de cascabel para otras regiones de Chiapas (Barrasa-García, 2015), Oaxaca (Buenrostro-Silva et al., 2016), Veracruz (Gómez-Landa, 2015), Ciudad de México (Gómez-Álvarez & Pacheco-Coronel, 2010), Puebla (Cossío-Bayugar, 2007) y Guanajuato (Leyte-Manrique et al., 2016). Esta especie se usa con fines ornamentales y comerciales en Morelos (Reyna-Rojas et al., 2015) y alimenticios en el estado de México (Monroy-Vilchis et al., 2016) y Sinaloa (Pascual-Ramos et al., 2014). Por su parte, para las especies del género Micrurus sólo ocasionalmente se menciona su uso con fines medicinales en la parte central de la Altiplanicie de Chiapas (Enríquez et al., 2006) y Sinaloa (Pascual-Ramos et al., 2014).
A pesar de que en México la mayoría de las mordeduras de serpientes venenosas son causadas por especies de los géneros Bothrops y Crotalus (de Roodt et al., 2005), en el área de estudio la mayoría fueron ocasionadas por Cerrophidion y Atropoides, cuya mordedura es menos severa y se cura en pocos días con remedios caseros (Álvarez del Toro, 1982; Campbell & Lamar, 2004). Por su parte, la mordedura del mococh verde (Bothriechis aurifer) puede tardar hasta tres meses en curarse, según los entrevistados en este estudio. Al respecto, un habitante que había sufrido una mordedura de esta especie hizo referencia a que fue muy grave y, en otro caso, una persona de edad avanzada perdió una extremidad, lo cual probablemente se debió al mal tratamiento y una infección posterior. Campbell & Lamar (2004) mencionan que B. aurifer ha causado mordeduras fatales en Guatemala, sin embargo, en el presente estudio, no se reportaron muertes ocasionadas por esta especie.
En cuanto a las mordeduras a animales domésticos, se tiene poca certeza del número de casos. Algunos pobladores mencionan haber visto víboras de cascabel cercanas al ganado que había muerto, sin embargo, es probable que estos animales hayan muerto de alguna otra causa, ya que es común en la región que la muerte de borregos sea provocada por parásitos, como Oestrus ovis (Perezgrovas-Garza & Castro-Gámez, 2000).
Los pobladores tienen poco conocimiento sobre qué medidas tomar en caso de mordedura de serpientes venenosas. En las localidades más alejadas, las clínicas carecen de medicamentos y los pacientes tienen que viajar a los asentamientos urbanos más grandes, como la cabecera municipal. Además, la gran mayoría (94%) no sabe para qué sirve el suero antiofídico. El nivel de desconocimiento es aún mayor que el registrado por Alemán-Mejía (2011) en Honduras (82%) y por Fernandes-Ferreira et al. (2012) en Brasil, donde todos los entrevistados conocían el uso del suero antiofídico. Este desconocimiento, probablemente esté relacionado con la baja escolaridad de los pobladores o a la poca información ambiental que los pobladores reciben.
La mayoría de los lugareños mata serpientes por temor, aun cuando algunas personas piensan que se deben proteger. Esta percepción negativa de los pobladores hacia las serpientes ha sido reportada en comunidades nahuas de Cuetzalan del Progreso, Puebla (García-López et al., 2017); con pobladores del desierto de Chihuahua (Gatica-Colima & Jiménez-Castro, 2009), y en asentamientos rurales de Brasil (Santos-Fita et al., 2010).
El miedo generalizado hacia las serpientes se debe en parte a que las mordeduras por algunas especies venenosas ponen en peligro la vida o causan la muerte de las personas, no obstante, éstas no representan uno de los mayores problemas de salud pública en México (de Roodt et al., 2005) o en Chiapas (Suárez-Velázquez & Luna-Reyes, 2009). Adicionalmente, la religión judeo-cristiana (iglesia católica) ha influido en el rechazo colectivo hacia las serpientes (Sánchez-Núñez, 2006; Fernandes-Ferreira et al., 2012), por la creencia de que son “seres condenados por Dios a la eterna penitencia” (Fernandes-Ferreira et al., 2012).
La proporción de personas en el área de estudio que creen que se deben de proteger a las serpientes venenosas es menor, comparada con lo que se reporta en el norte del país (27% vs 46%) (Gatica-Colima & Jiménez-Castro, 2009). Esto puede indicar que la educación puede tener algún efecto en la percepción de las personas, y más si consideramos que Las Margaritas es uno de los municipios con mayor grado de marginación en el estado de Chiapas. Al respecto, Whitaker & Shine (2000), Alves et al. (2014) y Pinheiro et al. (2016) mencionan que la educación es importante en el cambio de actitud de las personas hacia las serpientes. Otro aspecto que vale la pena mencionar es que al evitar que la gente mate a las serpientes venenosas también disminuye el riesgo de mordedura, además de evitar la pérdida de la biodiversidad (Whitaker & Shine, 2000; Pandey et al., 2016).
Algunas creencias o mitos reflejan el desconocimiento que se tiene sobre la biología y morfología de las serpientes; por ejemplo, algunas personas que utilizan a las víboras de cascabel con fines alimenticios o medicinales seccionan a la serpiente amputándole una cuarta de longitud a partir de la punta de la cabeza y la punta de la cola antes de consumirlas, con el propósito de eliminar las partes del organismo que contienen veneno, lo cual también ha sido reportado en el norte de México (Malkin, 1962). Algunas personas entierran al animal completo porque creen también que el hueso es venenoso, lo cual es una suposición errónea, ya que las serpientes tienen las glándulas de veneno en la cabeza. Álvarez del Toro (1982), en distintas regiones de Chiapas, y Fernandes-Ferreira et al. (2012), en Brasil, reportan que la gente cree que “la coral pica por la cola”. Además, existe el mito de que las corales y nauyacas persiguen a la gente, lo cual también es falso, ya que el primer recurso de sobrevivencia que utilizan las serpientes, ante la presencia de un ser humano es huir; solamente cuando se sienten acorraladas pelean para defenderse y tienden a morder a la persona que las molesta (Casas-Andreu, 2000). La existencia de mitos puede contribuir a una fuerte aversión hacia estos animales por los pobladores locales (Ceríaco, 2012; Alves et al., 2014; García-López et al., 2017).
Conclusiones
Con el uso de los factores ambientales de WorldClim y el algoritmo Maxent, se pudo determinar con mayor precisión y actualizar la distribución de las serpientes venenosas que habitan en el sureste de la Altiplanicie de Chiapas, cubriendo vacíos en la distribución previamente conocida. Con este estudio, se amplió la distribución conocida de Bothriechis aurifer hacia el noreste, y también se obtuvieron nuevas localidades de registro para Micrurus diastema, M. elegans y Crotalus simus en la Altiplanicie de Chiapas. Al parecer algunas barreras geográficas (Istmo de Tehuantepec, México y Valle del Río Motagua, Guatemala) actúan limitando la distribución de M. elegans, B. aurifer y C. simus. En el área de estudio, la serpiente venenosa que se encuentra en mayor riesgo es B. aurifer, debido a su distribución restringida, y a que se encuentra poco representada en las ANP, además de que su hábitat sufre un grave deterioro.
La víbora de cascabel (Crotalus simus) es la especie de serpiente venenosa más perseguida, debido a las propiedades curativas que se le atribuyen, por lo que habría que hacer estudios sobre el impacto a las poblaciones de esta especie. Asimismo, el grado de escolaridad influye en la percepción de las personas hacia las serpientes venenosas. En general, los pobladores del área sureste de la Altiplanicie de Chiapas desconocen las medidas que se deben de tomar en caso de mordeduras por serpientes venenosas, por lo que es importante capacitar a las personas, así como proveer del equipo necesario para atender este tipo de accidentes en los centros de salud de la región.
Ante este panorama, es necesario incrementar los esfuerzos de conservación para las serpientes venenosas estudiadas, especialmente para Bothriechis aurifer y Crotalus simus, estableciendo estudios de monitoreo de sus poblaciones, campañas de educación ambiental y promoviendo la conservación de sus hábitats.











 nueva página del texto (beta)
nueva página del texto (beta)


