Introducción
El tiempo, espacio y el alimento son algunas de las dimensiones más abordadas en el estudio del nicho de las especies, y pueden ser estudiadas como recursos (Kronfeld-Schor & Dayan, 2003; Dias & Rocha, 2007; Navarro et al., 2013), la forma en que las especies los explotan y dividen permite comprender sus patrones de distribución, abundancia y diversidad específica (Toft, 1985). Los estudios sobre el estado y uso de los hábitats por anfibios además de brindar elementos importantes para el conocimiento de la historia natural y ecología de estas especies, han aportado elementos para entender el grado de amenaza actual del grupo; además, se ha determinado cual es la principal causa de pérdida de especies (Isaacs & Urbina-Cardona, 2011; Deichmann et al., 2012; Cortés-Gómez et al., 2013). El tiempo es otra dimensión importante en la partición del nicho, las diferencias en los patrones diarios de actividad constituye un valor adaptativo y la utilización diaria temporal permite la coexistencia exitosa de especies, ya sea entre competidores como entre presas y depredadores (Kronfeld-Schor & Dayan, 2003).
La familia Dendrobatidae es conocida por poseer productos tegumentarios tóxicos como defensa en contra de predadores en la mayoría de sus especies (Myers et al., 1991). Su alta toxicidad a menudo está asociada con coloración aposemática (coloración vistosa de advertencia) y con una dieta especializada en hormigas, al parecer los alcaloides los obtienen de hormigas y otros insectos consumidos como parte de su dieta (Lötters et al., 2007). Son generalmente de hábitos diurnos y se caracterizan por ser predadoras muy activas (Lötters et al., 2007).
Muchos estudios en anfibios indican que la disponibilidad de presas y la dieta de los anfibios, llegan a exhibir cambios espacio-temporales en diversos ecosistemas (Toft, 1981; Mac Nally, 1983; Donelly, 1991). Debido a sus hábitos terrestres de muchas de sus especies, principalmente en la hojarasca, los dendrobátidos, tienen acceso a una gran variedad de artrópodos e insectos que habitan en el sotobosque (Stork & Blackburn, 1993).
Dendrobates truncatus tiene una distribución restringida en Colombia, se distribuye en el flanco este de la cordillera occidental y el flanco oeste de la cordillera central en tierras bajas del Caribe, en el rango altitudinal se da desde los 70 hasta los 1200 msnm (Gualdrón-Duarte et al., 2016). Es una especie terrestre y diurna que tolera condiciones extremas de temperatura y humedad. Es posible encontrarla en hojarasca, debajo de piedras o troncos caídos cerca a cuerpos de agua. Los huevos son terrestres y los renacuajos son cargados por los adultos quienes los depositan en charcos temporales, bromelias, huecos con agua de árboles entre otros, para su desarrollo, la reproducción ocurre a lo largo del año con un pico en la estación seca (Lötters et al., 2007; Gualdrón-Duarte et al., 2016). Esta especie es muy utilizada como mascota debido a la relativa facilidad de su cuidado en cautiverio, por tal motivo se encuentra dentro del apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES) y presenta categoría de bajo riesgo en la lista roja de IUCN (Castro & Lynch, 2004; Gualdrón- Duarte et al., 2016).
Existen muchos vacíos de conocimiento sobre autoecología y funciones ecológicas de muchas de las especies de anfibios, si bien existen estudios que mencionen los hábitos alimenticios de ciertas especies de dendrobátidos (e.g. Silverstone, 1975; Donelly, 1991; Toft, 1995; Menéndez-Guerrero, 2001), hasta el momento no se han reportado detalles sobre la composición de la dieta y hábitos alimentarios de D. truncatus en su ambiente natural. De igual forma, los estudios correspondientes a los microhábitats utilizados por esta especie en el Caribe colombiano se limitan al trabajo realizado por Cuentas (1999). Por tal motivo, esta investigación describe el uso del espacio a nivel de microhábitats, la variación en la actividad diurna y la dinámica espacial (sitios) y temporal (épocas climáticas) en la dieta de D. truncatus. Se aborda el estudio en una escala regional para áreas con bosque seco tropical de tierras bajas (<500 msnm) del norte de Colombia, bioma que ha perdido la mayor parte de su cobertura original, donde solo quedan fragmentos aislados inmersos en una matriz antropizada (Pizano & García, 2014).
Materiales y métodos
Área de Estudio. El estudio se realizó en tres sitios de muestreo del norte de Colombia, dentro del ecosistema de bosque seco tropical. Sitio 1: Finca Kalashe Kalabia, departamento del Magdalena (11° 16.5’ N, 74° 0.5 W), en las estribaciones de la Sierra Nevada de Santa Marta, 144 m de elevación, temperatura promedio: 27.29 °C, máxima: 30 °C - mínima: 25.4 °C. La humedad relativa promedio de 83.17%, máxima: 99%; Sitio 2: Los Mameyales, municipio de Piojó- Atlántico (10º 45’ 24,80’’ N, 75º 06’ 45.83’’ W), 253 m de elevación, temperatura promedio: 26.72 °C, máxima: 34.5 °C - mínima: 23.5 °C. Humedad relativa promedio: 87.05%, máxima: 99%; Sitio 3: Reserva Campo Alegre, municipio Los Córdobas-Córdoba (8°47.9’ N, 76° 19.6’ W), 137 m de elevación, temperatura promedio: 26.28 °C, máxima: 38.1 °C - mínima: 24.2 °C. La humedad relativa promedio: 87.63%, máxima: 99% (Fig. 1).
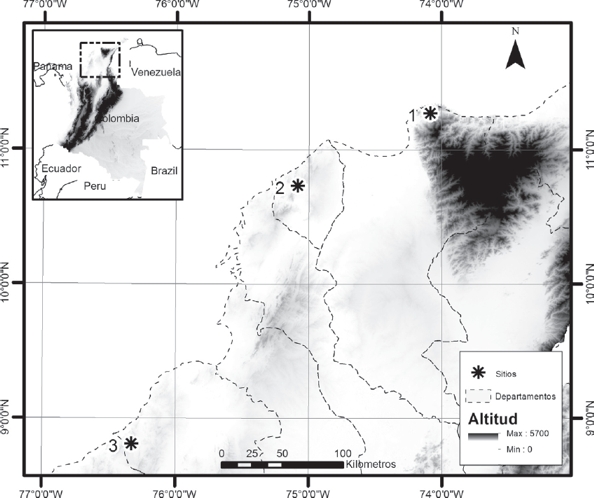
Figura 1 Ubicación de los sitios de estudio de Dendrobates truncatus en bosque seco tropical del norte de Colombia. 1=Sitio 1 Finca Kalashe Kalabia, departamento del Magdalena, 2= Sitio 2 Los Mameyales, municipio de Piojó- Atlántico, 3= Sitio 3 Reserva Natural de la Sociedad Civil Campo Alegre, municipio Los Córdobas – Córdoba.
Diseño de muestreo. Se llevaron a cabo tres muestreos por sitio (9 eventos en total); estos se ejecutaron entre marzo a noviembre de 2007, debido a que el bosque seco tropical presenta una marcada temporalidad (Pizano & García, 2014) fue posible muestrear tres épocas climáticas diferentes que correspondieron a la menor precipitación “seco” (marzo), primeras lluvias “lluvias menores” (mayo-junio) y temporada de precipitaciones más abundantes “lluvias mayores” (octubre-noviembre). Para la colecta de datos se utilizó el método de búsqueda por conteos visuales (Heyer et al., 2001; Blanco-Torres & Bonilla, 2010).
La captura de ejemplares se desarrolló mediante búsqueda activa y captura manual. En el transcurso del día se muestreó en cuatro ocasiones: mañana (8:00 a 10:00), medio día (12:00 a 14:00), tarde (16:00 a 18:00) y noche (19:00 -21:00). En cada caso con una duración de 5 días, por tanto el esfuerzo muestreal fue de 360 horas. Las tasas de encuentro se definieron como el número de individuos de la especie respecto al tiempo (horas) invertido en cada visita (Angulo et al., 2006) y fueron calculadas para cada microhábitat en los horarios diarios establecidos dentro del muestreo.
En cada sitio se seleccionaron distintos microhábitats siguiendo los criterios sugeridos por Ferrer & González (2002) y Blanco-Torres & Bonilla (2010): ausencia o presencia de cuerpos de agua (temporales o permanentes), vegetación acuática o terrestre, uso del suelo, cobertura vegetal e inclinación de terreno >15% pendiente fuerte, <15% pendiente suave. Esto permitió establecer siete microhábitats utilizados por D. truncatus: Interior de Bosque (INT. BQ) que presenta estratificación en tres niveles, en donde el dosel está representado con árboles que alcanzan alturas entre 10 y 25 m, todos los fragmentos superan las 90 ha en tamaño; Caminos de Bosque (CAM. BQ) son senderos construidos que penetran al interior del bosque para desarrollar actividades de investigación, extracción de madera, caza o simplemente senderos para transitar; Ribera de Arroyo Permanente con Pendiente Fuerte (RAPCP) riberas de pequeños arroyos que en época seca mantienen agua corriente, de suelos tipo arcilloso que mantienen una alta humedad, presentan pendientes mayores a 15% y ejemplares de árboles de gran porte y arbustos fuertemente enraizados; Ribera Arroyo Permanente de Pendiente Suave (RAPSP) a diferencia de las RAPCP los suelos son areno-arcillosos y presentan pendientes menores a 15%; Ribera Arroyo Intervenido Permanente de Pendiente Suave (RAIPSP) son riberas de arroyos permanentes fuertemente intervenidos por la actividad propia de los cultivos y el pastoreo, cuyo bosque de galería presenta alta intervención; Zona de Cultivo (ZC) utilizadas principalmente para el cultivo transitorio, en las cuales se pueden formar charcos efímeros utilizados como resguardo temporal de los anuros, presentan modificación continua por quema y preparación de tierras, generalmente no ocupan más de 2 hectáreas de terreno; Zona de Uso Intensivo (ZUI) utilizadas principalmente para vivienda, establos y todas las áreas de labores de la población local, altamente perturbadas por construcciones, la vegetación predominante son la plantas herbáceas que invaden las zonas despejadas.
Análisis de contenido estomacal. Cada individuo capturado fue debidamente identificado con un número de campo (Angulo et al. 2006), registrándosela hora de captura y actividad (canto, reposo, amplexus, entre otros). Los mismos fueron sacrificados in situ, utilizando solución de etanol al 10% aproximadamente (con el objeto de conservar contenido estomacal hasta llevar a laboratorio), para su fijación se utilizó formol al 10% y posteriormente para su preservación etanol al 75%. El contenido estomacal de cada espécimen fue separado por tipo de presa y clasificado hasta alcanzar la menor categoría taxonómica posible, en la mayoría de los casos se pudo identificar a género con ayuda de especialistas (Instituto de Ciencias naturales- Universidad Nacional de Colombia; Departamento de Biología-Universidad del Atlántico) y empleando bibliografía especializada. Se identificaron familias, géneros y morfoespecies o morfotipos además del material acompañante o indeterminado. Para aquellos insectos que presentaron metamorfosis huevo-larva-adulto, cada estadio de desarrollo fue considerado como ítem alimentario diferente debido a la marcada diferencia de hábitos y formas que presentan.
Análisis de los datos. Se determinó la abundancia relativa de la especie en cada microhábitat por temporada del año, esta es la relación de la abundancia observada en los recorridos por microhábitat respecto a la abundancia total observada por temporada. Para el análisis de uso espacial se determinaron porcentajes de número de individuos observados en cada microhábitat por época y sitio de muestreo.
Con un análisis de la estructura de la dieta se calculó la cobertura de cada tipo de presa mediante el conteo de área ocupada, este consiste en colocar cada tipo de presa sobre una cuadrícula de papel milimetrado y contar el número de cuadros que ocupa, de esta manera se obtiene una medida de área expresada en mm2 que puede ser catalogada como cobertura (Tresierra & Culquichicon, 1993). Luego se estandarizaron los datos a porcentaje, para comparar los aportes de los diferentes organismos que constituyen el contenido alimentario, según la presencia y ocurrencia lo que permite estimar el porcentaje de cada uno de ellos, estos métodos fueron aplicados individualmente en cada contenido estomacal (Tresierra & Culquichicon, 1993; Blanco-Torres et al., 2014). La frecuencia de ocurrencia se calculó como el número de veces que aparece un tipo de presa en todos los contenidos revisados.
Para explorar diferencias entre las observaciones por microhábitats, tasas de encuentro y estructura de la dieta se aplicó el método no paramétrico de Kruskall-Wallis ya que los datos no cumplieron los supuestos de normalidad (Kolmogorov-Smirnov), esto fue ejecutado en el software Past (Hammer et al., 2001).
Resultados
Abundancia y microhábitats. Se registraron 277 individuos, el Sitio 1 fue el de mayor abundancia con el 58.12% (161 individuos) del total, seguido por el Sitio 3 con el 31.41% (87 individuos) y por último el Sitio 2 con el 10.47% (29 individuos). En el Sitio 1 D. truncatus se registró en la mayor cantidad de microhábitats (57.1%), seguido por el Sitio 2 (42.8%) y el Sitio 3 presentó con el 28.5% (Cuadro 1).
Cuadro 1 Variación de la abundancia y tasas de encuentro para Dendrobates truncatus en bosque seco tropical del norte de Colombia. INT. BQ: Interior de Bosque, CAM. BQ: Caminos de Bosque, RAPCP: Ribera de Arroyo Permanente con Pendiente Fuerte, RAPSP: Ribera Arroyo Permanente de Pendiente Suave, RAIPSP: Ribera Arroyo Intervenido Permanente de Pendiente Suave, ZC: Zona de Cultivo, ZUI: Zona de Uso Intensivo.
| Microhábitat | Abundancia | Abundancia época climática | Tasa de encuentro | |||||
|---|---|---|---|---|---|---|---|---|
| Seco | Lluvias menores | Lluvias mayores | Mañana | Mediodía | Tarde | Noche | ||
| INT BQ | 118 | 25.95 | 73.68 | 60.49 | 8.5 | 5.83 | 5.33 | 0 |
| CAM BQ | 7 | 3.16 | 2.47 | 1.67 | 0.67 | 0 | ||
| RAPCP | 1 | 1.23 | 0.33 | 0 | ||||
| RAPSP | 121 | 53.80 | 18.42 | 35.80 | 12.67 | 10 | 17.67 | 0 |
| RAIPSP | 26 | 14.56 | 7.89 | 4.33 | 4.33 | 0 | ||
| ZC | 2 | 1.27 | 0.67 | 0 | ||||
| ZUI | 2 | 1.27 | 0.67 | 0 | ||||
No hubo diferencias en la abundancia durante las diferentes épocas climáticas (H=2.38, p= 0.3). El mayor registro de abundancia fue en la época seca con 57% de los registros, seguido por lluvias mayores con 29.2% y por último lluvias menores con 13.8%. Esta variación fue estadísticamente significativa entre los diferentes microhábitats (H=14.19, p= 0.02), RAPPS fue el microhábitat con mayor abundancia (43.7%) seguido por el INT. BQ. Los microhábitats ZC, ZUI y RAPCP presentaron la menor abundancia (Cuadro 1).
Tasas de encuentro y microhábitats. Las mayores tasas de encuentro se observaron en las horas de la mañana y tarde; D. truncatus no presentó actividad nocturna (Cuadro 1 y Fig 2). La mayor tasa de encuentro se presentó en RAPSP, seguida por INT. BQ, la menor tasa de encuentro se presentó en ZC y ZUI. En época seca el microhábitat con la mayor tasa de encuentro fue el RAPSP seguido por INT. BQ, en RAPCP no se obtuvo registro de individuos. Solo en esta época fue donde se registraron individuos en los microhábitats ZC y ZUI. Para lluvias menores la mayor tasa fue la de INT. BQ seguida por RAPSP y RAIPSP, los demás microhábitats no tuvieron registros para este período. Durante las lluvias mayores el mayor registro fue en el INT. BQ seguido por RAPSP, los microhábitats RAIPSP, ZC y ZUI no tuvieron registro para este período (Cuadro 1).
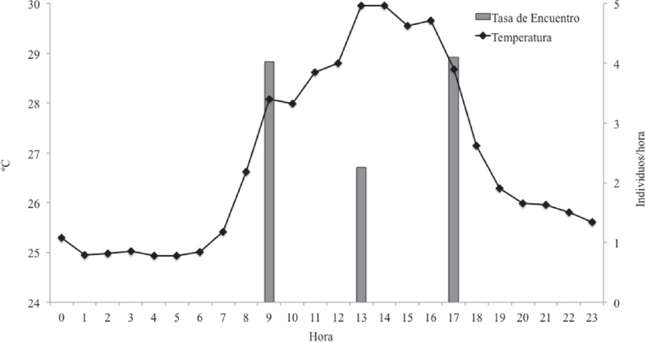
Figura 2 Comportamiento de la temperatura y actividad diaria de Dendrobates truncatus en bosque seco tropical del norte de Colombia. Los valores graficados son el promedio de todas las observaciones de cada variable en horario diario.
Dieta. Se examinaron 66 individuos, provenientes de los tres sitios de muestreos, de los cuales el 98.5% se encontraron con estómago lleno. Se identificaron 45 familias (incluidas morfofamilias) y 121 morfotipos de presas, además de material indeterminado. La clase Insecta fue la de mayor contribución a la dieta identificándose 11 órdenes (84 morfotipos), seguido por Arachnida con dos órdenes (31 morfotipos), Diplopoda (1 morfotipo), Malacostraca (1 morfotipo), Gastropoda (1 morfotipo). Con respecto al porcentaje de cobertura en la dieta los insectos aportaron el 80%, seguidos por arácnidos con 9.5%. Dentro de la clase Insecta el orden con la mayor cantidad de biomasa fue Hymenoptera con el 67.7%, especialmente la familia Formicidae con el 66.8% del aporte en cobertura a la dieta de D. truncatus. El orden Acari representa la totalidad del aporte de la clase Arácnida y el 9.5% en la dieta de la especie. Por último, el orden Coleóptera aporta con el 5.5% de cobertura de la dieta (Cuadro 2).
Cuadro 2 Composición de la dieta, cobertura y frecuencia de ocurrencia de presas consumidas por Dendrobates truncatus en bosque seco tropical del norte de Colombia.
| Categoría Presa | Frecuencia de ocurrencia | COBERTURA (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| Seco | Ll. men | Ll. may | Sitio 1 | Sitio 2 | Sitio 3 | |||
| Arachnida (Acari) | 0,72 | 7,25 | 7,81 | 4,81 | 9,84 | 7,55 | 3,82 | |
| Caraboidodea sp1 | 0,02 | 0,18 | 0,14 | |||||
| Ceratozetoidea sp1 | 0,05 | 0,42 | 0,32 | |||||
| Eremaeoidea sp1 | 0,14 | 0,60 | 1,03 | 1,26 | 0,27 | 0,18 | ||
| Eremaeoidea sp2 | 0,08 | 0,36 | 0,72 | 0,14 | 0,86 | |||
| Eremuloidea sp1 | 0,25 | 2,28 | 0,76 | 4,54 | 1,36 | 7,82 | 0,95 | |
| Eremuloidea sp2 | 0,14 | 1,86 | 1,12 | 2,20 | 0,13 | 0,36 | ||
| Eremuloidea sp3 | 0,05 | 0,12 | 0,13 | 0,23 | ||||
| Euposidae sp1 | 0,02 | 0,06 | 0,05 | |||||
| Galumnoidea sp1 | 0,09 | 0,06 | 1,07 | 0,47 | 0,66 | 0,45 | ||
| Gymnodamaeoidea sp1 | 0,03 | 0,18 | 0,14 | 0,13 | ||||
| Hermannielloidea sp1 | 0,02 | 0,04 | 0,05 | |||||
| Heterochihonoidea sp1 | 0,05 | 0,30 | 0,04 | 0,13 | 0,23 | |||
| Hydrozetoidea sp1 | 0,02 | 0,09 | 0,09 | |||||
| Lealapidae sp1 | 0,06 | 0,24 | 0,05 | 0,14 | ||||
| Liacaroidea sp1 | 0,03 | 0,12 | 0,05 | 0,13 | ||||
| Oppioidea sp1 | 0,02 | 0,06 | 0,05 | |||||
| Oribatuloidea sp1 | 0,11 | 0,18 | 1,56 | 0,17 | 1,54 | 0,66 | 0,09 | |
| Trombidiidae sp1 | 0,09 | 0,18 | 1,34 | 0,59 | 0,56 | 1,33 | 0,82 | |
| Trombidiidae sp2 | 0,02 | 0,50 | 0,27 | |||||
| Uropodidae sp1 | 0,05 | 0,24 | 0,04 | 0,23 | ||||
| Acari sp1 | 0,18 | 1,92 | 0,04 | 1,01 | 1,59 | 0,50 | ||
| Acari sp2 | 0,03 | 0,17 | 0,05 | 0,05 | ||||
| Acari sp3 | 0,05 | 0,06 | 0,34 | 0,19 | 0,05 | |||
| Acari sp4 | 0,02 | 0,17 | 0,09 | |||||
| Acari sp5 | 0,03 | 0,13 | 0,25 | 0,28 | ||||
| Acari sp6 | 0,03 | 0,36 | 0,23 | 0,05 | ||||
| Acari sp7 | 0,02 | 0,18 | 0,19 | |||||
| Acari sp8 | 0,03 | 0,06 | 0,76 | 0,80 | 0,05 | |||
| Acari sp9 | 0,02 | 1,38 | 1,08 | |||||
| Acari sp10 | 0,02 | 0,06 | 0,05 | |||||
| Arachnida(Scorpiones) | 0,03 | 0,18 | 0,14 | |||||
| Scorpiones sp | ||||||||
| Insecta (Coleoptera) | 0,47 | 6,15 | 2,60 | 3,03 | 5,88 | 0,89 | 3,41 | |
| Anobiidae sp1 | 0,02 | 0,30 | 0,23 | |||||
| Anobiidae sp2 | 0,02 | 0,06 | 0,05 | |||||
| Bostrichidae sp | 0,02 | 0,42 | 0,23 | |||||
| Carabidae sp | 0,02 | 0,27 | 0,28 | |||||
| Coccinaelidae sp | 0,05 | 0,72 | 0,23 | 0,32 | ||||
| Curculionidae sp1 | 0,02 | 0,06 | 0,05 | |||||
| Curculionidae sp2 | 0,02 | 0,34 | 0,18 | |||||
| Scolitinae sp | 0,09 | 0,48 | 0,59 | 0,23 | 0,45 | |||
| Histeridae sp | 0,02 | 0,00 | 0,40 | 0,41 | ||||
| Nitidulidae sp1 | 0,02 | 0,24 | 0,19 | |||||
| Nitidulidae sp2 | 0,02 | 0,34 | 0,19 | |||||
| Nitidulidae (Larva) | 0,02 | 0,06 | 0,05 | |||||
| Pselaphidae sp1 | 0,06 | 1,62 | 1,17 | 0,09 | ||||
| Psephenidae sp | 0,02 | 0,18 | 0,19 | |||||
| Psephenidae (Larva) | 0,02 | 1,56 | 1,18 | |||||
| Scydmaenidae sp | 0,11 | 2,58 | 0,18 | 1,96 | 0,13 | 0,18 | ||
| Staphylinidae sp1 | 0,02 | 0,06 | 0,13 | |||||
| Staphylinidae sp2 | 0,02 | 0,12 | 0,09 | |||||
| Staphylinidae sp3 | 0,02 | 0,24 | 0,53 | |||||
| Staphylinidae sp4 | 0,02 | 0,18 | 0,14 | |||||
| Staphylinidae sp5 | 0,02 | 0,25 | 0,14 | |||||
| Staphylinidae sp6 | 0,03 | 0,85 | 0,89 | |||||
| Staphylinidae sp7 | 0,03 | 0,54 | 1,09 | 1,17 | ||||
| Staphylinidae sp8 | 0,02 | 0,09 | 0,09 | |||||
| Staphylinidae sp9 | 0,02 | 0,50 | 0,27 | |||||
| Staphylinidae sp10 | 0,02 | 0,84 | 0,45 | |||||
| Staphyinidae sp11 | 0,02 | 0,25 | 0,14 | |||||
| Staphylinidae sp12 | 0,03 | 0,18 | 0,22 | 0,14 | 0,23 | |||
| Coleoptera sp1 | 0,02 | 0,13 | 0,14 | |||||
| Coleoptera sp2 | 0,02 | 0,25 | 0,14 | |||||
| Coleoptera sp3 | 0,06 | 0,96 | 0,22 | 0,23 | 0,53 | 0,54 | ||
| Insecta (Collembola) | 0,23 | 2,16 | 0,53 | 0,68 | 1,35 | 1,60 | 0,82 | |
| Dyrcitomidae sp | 0,22 | 2,52 | 0,63 | 1,09 | 1,26 | 2,39 | 1,09 | |
| Isotomidae sp | 0,03 | 0,78 | 0,51 | 0,09 | ||||
| Insecta (Diptera) | 0,13 | 2,00 | 0,53 | 0,57 | 2,16 | 0,47 | ||
| Cecidomyidae (Larva) | 0,02 | 0,12 | 0,09 | |||||
| Forcipomyia sp | 0,02 | 2,46 | 1,92 | |||||
| Ceratopogonidae sp | 0,03 | 0,63 | 0,65 | |||||
| Ceratopogonidae Larva | 0,02 | 0,06 | 0,05 | |||||
| Diptera sp1 | 0,06 | 0,12 | 0,92 | 0,59 | ||||
| Diptera sp2 | 0,02 | 0,24 | 0,19 | |||||
| Psychodidae sp | 0,02 | 0,06 | 0,05 | |||||
| Insecta (Hemiptera) | 0,05 | 1,62 | 0,05 | 3,45 | ||||
| Lygaeidae sp | ||||||||
| Insecta (Hymenoptera- Formicidae) | 0,95 | 54,96 | 74,68 | 62,75 | 58,46 | 53,73 | 73,49 | |
| Acantognathus sp | 0,02 | 0,54 | 0,41 | |||||
| Apterostigma sp | 0,05 | 0,12 | 0,13 | 0,09 | 0,14 | |||
| Atta sp | 0,02 | 0,18 | 0,18 | |||||
| Cardiocondyla sp | 0,02 | 2,61 | 1,41 | |||||
| Carebara sp | 0,03 | 0,09 | 0,09 | |||||
| Crematogaster sp | 0,25 | 2,52 | 1,48 | 8,99 | 3,13 | 0,66 | 4,99 | |
| Cyphomyrmex sp | 0,20 | 3,12 | 0,89 | 0,92 | 1,03 | 2,79 | 1,95 | |
| Discothyrea sp | 0,02 | 0,17 | 0,09 | |||||
| Gnamptogenys sp | 0,02 | 0,67 | 0,36 | |||||
| Hylomyrma sp | 0,02 | 0,04 | 0,05 | |||||
| Hypoponera sp | 0,14 | 1,48 | 3,53 | 3,45 | ||||
| Labidus sp | 0,05 | 3,00 | 1,21 | 2,99 | 1,72 | |||
| Linepithema sp | 0,03 | 0,06 | 0,04 | 0,05 | 0,05 | |||
| Monomorium sp | 0,08 | 0,90 | 0,22 | 0,13 | 0,86 | |||
| Mycocepurus sp | 0,05 | 1,08 | 0,09 | 0,91 | ||||
| Myrmicocrypta sp | 0,02 | 0,04 | 0,05 | |||||
| Neivamyrmex sp | 0,02 | 4,86 | 10,74 | |||||
| Nomamyrmex sp | 0,02 | 1,44 | 1,12 | |||||
| Octostruma sp | 0,06 | 0,18 | 0,18 | |||||
| Odontomachus sp | 0,02 | 0,04 | 0,05 | |||||
| Paratrechina sp | 0,05 | 0,06 | 0,67 | 0,33 | 0,09 | |||
| Pheidole sp | 0,77 | 29,21 | 31,16 | 25,04 | 23,11 | 17,11 | 38,94 | |
| Procryptocerus sp | 0,02 | 0,36 | 0,27 | |||||
| Pseudomyrmex sp | 0,03 | 1,68 | 0,65 | 0,27 | ||||
| Pyramica sp | 0,06 | 0,06 | 0,18 | 0,09 | 0,14 | |||
| Rogeria sp | 0,18 | 1,62 | 8,76 | 4,12 | 9,17 | 7,29 | 0,95 | |
| Solenopsis sp | 0,51 | 3,12 | 24,94 | 11,43 | 6,83 | 27,06 | 17,95 | |
| Strumigenys sp | 0,31 | 0,78 | 2,28 | 4,87 | 3,27 | 1,06 | 1,99 | |
| Tapinoma sp | 0,02 | 0,06 | 0,05 | |||||
| Trachymyrmex sp | 0,02 | 0,06 | 0,05 | |||||
| Wasmannia sp | 0,11 | 5,22 | 3,70 | 0,36 | ||||
| Myrmicinae sp | 0,03 | 0,42 | 0,40 | 0,05 | 0,14 | |||
| Formicidae Sp | 0,03 | 0,24 | 0,75 | |||||
| Insecta (Hymenoptera- No Formicidae) | 0,15 | 0,90 | 0,38 | 1,31 | 1,56 | 1,51 | 0,09 | |
| Chalcididae sp1 | 0,02 | 0,42 | 0,93 | |||||
| Chalcididae sp2 | 0,02 | 0,00 | 0,84 | 0,47 | 0,00 | |||
| Diapriidae sp | 0,08 | 0,90 | 1,09 | 0,80 | 1,33 | 0,05 | ||
| Dryinidae sp | 0,02 | 0,04 | 0,05 | |||||
| Scelionidae sp | 0,02 | 0,17 | 0,09 | |||||
| Insecta (Isoptera) | 0,10 | 4,94 | 1,77 | 0,05 | 3,65 | 2,22 | 1,45 | |
| Heterotermes sp | 0,02 | 0,22 | 0,23 | |||||
| Nasutitermes sp | 0,11 | 7,56 | 1,88 | 0,08 | 4,58 | 3,32 | 2,09 | |
| Insecta (Psocoptera) | ||||||||
| Psocoptera sp | 0,03 | 0,12 | 0,09 | |||||
| Insecta (Thysanoptera) | 0,06 | 0,30 | 0,05 | 0,18 | ||||
| Phlaeothripidae Sp | ||||||||
| Larva | 0,24 | 0,71 | 7,17 | 7,63 | 7,29 | 0,18 | 4,61 | |
| Larva sp1 | 0,02 | 0,12 | 0,09 | |||||
| Larva sp2 | 0,02 | 0,42 | 0,33 | |||||
| Larva sp3 | 0,22 | 0,54 | 8,49 | 12,27 | 9,21 | 0,27 | 6,62 | |
| Diplopoda | 0,12 | 0,78 | 1,17 | 3,24 | 1,20 | 4,17 | 1,01 | |
| Diplopoda sp | 0,12 | 1,20 | 1,39 | 5,21 | 1,59 | 6,23 | 1,45 | |
| Gastropoda sp | 0,02 | 0,42 | 0,23 | |||||
| Malacostraca (Isopoda) | 0,03 | 0,24 | 0,34 | 0,36 | ||||
| Oniscidea sp | ||||||||
| Indeterminado | 0,11 | 0,66 | 0,54 | 0,25 | 0,75 | 0,93 | 0,14 | |
La estructura de la dieta de Dendrobates truncatus no presentó variaciones marcadas a nivel de orden entre sitios y época climática, en todos los casos Formicidae aportó la mayor parte para su dieta (Cuadro 2). La subfamilia Myrmicinae fue la categoría de presa con mayor importancia a nivel de cobertura (91%) y riqueza (63.6%) de la familia Formicidae, seguida por Ponerinae con 2.5% de aporte en cobertura. Las otras subfamilias (Pseudomyrmicinae, Formicinae y Dolichoderinae) representaron menos del 1% de la cobertura. A nivel de género, Pheidole aportó el 43.5% de la cobertura aportada por la familia y el 60.8% del porcentaje total de la dieta, seguido por los individuos del género Solenopsis (21.9%) y Rogeria (9.9%) respecto a la cobertura aportada por Formicidae.
Se presentaron diferencias significativas entre sitios a nivel de morfotipo de presa consumida (H=31.77, p<0.05). Los Sitios 1 y 3 presentaron la mayor riqueza de presas consumidas con 78 y 79 morfotipos respectivamente, seguidos por el Sitio 2 con una riqueza de 30 morfotipos. El género Pheidole fue el ítem alimenticio de mayor contribución a la dieta de D. truncatus presentando porcentajes de cobertura mayores al 18% en los tres sitios y siendo aún más representativa en el Sitio 3 llegando al 34.14% de la cobertura.
Hubo diferencias significativas en la dieta de D. truncatus entre las épocas climáticas (H=17.02, p <0.05) a nivel de morfotipo de presa consumida. La época seca aportó la mayor cantidad de ítems a la dieta de D. truncatus con 81 ítems, seguida por lluvias menores (55 items) y lluvias mayores con 42 items. El ítem con mayor aporte fue Pheidole con porcentajes de cobertura mayores al 25% y fue consumido durante las tres épocas climáticas.
Discusión
La mayor complejidad en la cobertura vegetal (la cual disminuye la temperatura y exposición a la radiación solar dentro del hábitat) y la presencia de agua son factores determinantes en la dispersión y actividad de los anuros (Woolbright, 1985; Navas, 1996; Dodd, 2010), por otro lado la producción de hojarasca en ambientes boscosos y húmedos dentro del bosque aumenta la oferta de alimento respecto a las áreas intervenidas (Vásquez-Vélez et al., 2013). En bosque seco tropical, estos factores generan ambientes óptimos para el establecimiento de D. truncatus, es por esto que los microhábitats de interior de bosque y ribera de cuerpos de agua permanentes registran una mayor abundancia contrastando con microhábitats muy intervenidos. La abundancia de esta especie no está determinada por la cantidad de área ofertada, sino por la calidad de la misma, entendiendo como calidad las condiciones que oferte el microhábitat para lograr un sostenimiento de los requerimientos de la especie (humedad, calidad de agua, heterogeneidad vertical, oferta alimenticia, entre otros (Cortés-Gómez et al., 2013). La eliminación de la cobertura vegetal natural e incluso su transformación a áreas de cultivo influyen de manera directa en la disminución de la abundancia relativa de algunas las especies (Cortés-Gómez et al., 2013; Méndez-Narváez & Bolívar-G, 2016), efecto que se observa al comparar las abundancias por microhábitats de D. truncatus en este estudio.
La disminución de las tasas de encuentro en lluvias menores puede estar relacionado a la dispersión de los individuos, adicionalmente los cambios fenológicos del bosque y en especial el aumento de la vegetación herbácea disminuyen la capacidad de avistamiento (Heyer et al., 2001; Angulo et al., 2006). Esta dinámica había sido descrita por Cuentas (1999) para una población de la misma especie en una zona con bosque seco tropical del Caribe colombiano (Santuario de Flora y Fauna los Colorados, Bolívar, Colombia).
La variación climática anual del bosque seco tropical produce migraciones locales de individuos (García et al., 2014) en este caso de D. truncatus. El déficit hídrico y la exposición a la radiación solar, mediada por el fenómeno de defoliación del bosque seco tropical, serían los factores determinantes de la distribución local de las poblaciones de esta especie, produciendo fenómenos de agregación durante la época seca en microhábitats donde la cobertura vegetal y la presencia de agua generan un confort climático para el establecimiento de las poblaciones, lo cual es consistente con los registros de abundancia que se presentan durante esta época en arroyos permanentes e interior de bosques. Durante los períodos de lluvias, cuando se aumenta el área óptima debido al incremento de la humedad o disposición de agua y disminución de la exposición a la radiación por el aumento de la cobertura foliar, se presenta una dispersión de los individuos, esto concuerda con lo propuesto por Cuentas (1999) sobre que los gradientes de humedad en el sustrato son un factor determinante en la expansión (periodo de lluvias) y contracción (periodo de no lluvias) de la distribución de D. truncatus a lo largo del año en torno a los arroyos.
En el bosque seco tropical D. truncatus es una especie diurna, concordante con lo descrito para la familia (Graves, 1999; Lötters et al., 2007). Presenta dos picos de actividad, uno matinal y otro vespertino, generándose una disminución de su actividad durante el período de mayor incidencia de radiación solar diaria, que corresponde al comprendido entre las 10:00 a 14:00, esto es una adaptación comportamental para establecerse en el bosque seco tropical y así evitar altas temperaturas (Graves, 1999). Esta condición le permite coexistir con las otras especies de anuros las cuales, en su mayoría, son de hábitos nocturnos. Debido a esto, la repartición del tiempo en D. truncatus permite la segregación de su nicho, evita su extinción y sobrevivencia como especialista (Kronfeld & Dayan, 2003).
Dendrobates truncatus es un forrajero activo especialista en hormigas (especialmente la subfamilia Myrmicinae) y ácaros, lo que concuerda con lo sugerido para otras especies del género y la familia Dendrobatidae (Caldwell, 1996; Lötters et al., 2007; Cajade et al., 2010; Arce & Rengifo, 2013, Gómez-Hoyos et al., 2014). La alta contribución de hormigas en su dieta es atribuible principalmente a la bioacumulación y transformación de algunos metabolitos secundarios, las cuales han sido estudiadas durante años como posibles precursoras de los venenos producidos por las diferentes especies de la familia Dendrobatidae (Daly et al., 1987; Saporito et al., 2004), lo que ha permitido establecer la conexión entre las Decahydroquinolinas y las Pirrolizidinas, alcaloides comunes entre los myrmicinos y las ranas del género Dendrobates. Las hormigas son un recurso fácilmente disponible para predadores, ya que se encuentran en colonias y con escasas formas aladas, pero poseen un bajo contenido nutricional (Parmelee, 1999), ya que son presas quitinosas de difícil digestión (Toft, 1985) por lo que deben ser consumidas en grandes cantidades.
Las hormigas mirmicinas presentan una diversidad de hábitos muy grande, acorde con la riqueza de especies en la subfamilia. Hay formas arborícolas (como Procryptocerus, Crematogaster) que habitan el suelo y la hojarasca (Strumigenys, Pyramica, Pheidole, Solenopsis), algunas presentan asociaciones con plantas, hongos o con otras hormigas (Crematogaster) (Fernández, 2003). El género Pheidole es uno de los géneros más comunes de la Región Neotropical, habitan principalmente el estrato epígeo y resultan muy abundantes en el área de estudio (Benson & Brandão, 1987; Fowler et al., 1993).
Algunas especies de los géneros Wasmannia y Solenopsis, son conocidas con el nombre de “pequeñas hormigas del fuego” y constituyen una plaga importante en algunas zonas (Ulloa-Chacón & Cherix, 1988). Al igual que las Myrmicinae las hormigas representantes de las demás subfamilias presentes en la dieta, pueden ocupar diferentes estratos, desde el arbóreo como las especies del género Tapinoma hasta el suelo tal es el caso de Paratrechina, Hypoponera, Gnamptogenys, Odontomachus) (Fernández, 2003). Otras hormigas pertenecientes a la subfamilia Pseudomyrmicinae poseen especies habitantes obligadas de plantas myrmecófilas, tales como acacias con espinas u otras especies de leguminosas. Las hormigas de la subfamilia Ecitoninae son insectos populares en muchos lugares del Neotrópico, donde son famosas sus “incursiones de limpieza” a las casas de habitantes de áreas rurales, particularmente en climas cálidos: “Las masivas columnas de especies conspicuas como las de Labidus hacen que las actividades depredadoras de estas hormigas no pasen desapercibidas para las personas que habitan o frecuentan el campo” (Fernández, 2003). De esta forma se observa que a pesar de que D. truncatus es una especie terrestre, en su dieta posee representantes de los diferentes estratos verticales, dando muestra de la complejidad de las zonas donde habita.
El resto de la cobertura de la dieta de D. truncatus es aportada por otras familias de himenópteros como: Chalcididae, Diapriidae, Dryinidae, Scelionidae, todas ellas poseen larvas parásitas de huevos de insectos de los cuales se alimentan. Los adultos se pueden encontrar en follaje, hongos y áreas con vegetación en descomposición (Wolff, 2006), coincidiendo con el la distribución de la especie.
Los ácaros terrestres de vida libre son animales muy diversos y abundantes en medios ricos de materia orgánica, en los árboles, en el suelo y en ambientes húmedos, siendo coincidentes con los hábitos de la especie en estudio. De igual forma estudios realizados por diversos autores, por ejemplo Saporito et al. (2007), muestra que este grupo constituye una de las principales fuentes de las toxinas producidas por dendrobátidos. Por último, el orden Coleóptera también se encuentra formando parte de la dieta de D. truncatus, este es el grupo más grande y diverso de los insectos, lo que permite que se presente algunas presas disponibles para esta especie.
Tanto el régimen de lluvias, como el de sequía influyen en la composición de la dieta de D. truncatus. En zonas tropicales es evidente la variación temporal de poblaciones, algunas especies fluctúan ampliamente, mientras que otras lo hacen de una forma más restringida (Graves, 1999). Se sabe que las hormigas son muy sensibles al contenido de humedad (Levings, 1983), durante las lluvias en donde las inundaciones se hacen presentes, el agua arrastra muchos organismos del suelo o en su defecto los desplaza a zonas más altas donde esta especie no habita, mientras que en sequía se produce lo contrario, los insectos que se encuentran a nivel de suelo aumentan y son más fáciles de capturar. Todo esto influye en la estructura de la dieta de una especie de hábitos terrestres como D. truncatus.
Esta investigación identifica las condiciones específicas para el establecimiento y desarrollo de las poblaciones de D. truncatus en el bosque seco tropical por tanto, proporciona elementos importantes para la conservación de la especie. Consideramos necesario el mantenimiento de las condiciones naturales de los bosques relictuales y el aumento de la conectividad estructural entre los mismos para garantizar la supervivencia de la especie y la funcionalidad del bosque seco tropical.











 nova página do texto(beta)
nova página do texto(beta)


