INTRODUCCIÓN
La garrapata café del perro Rhipicephalus sanguineus Latreille implicada en la transmisión de Fiebre Manchada fue colectada en Tlahualilo (Hunter & Hooker, 1907), Gómez Palacio (Macías-Valadez, 1923), Pueblo Nuevo, Nazareno (Ortiz-Mariotte, 1945), Torreón (Bustamante et al., 1946; Silva-Goytia & Elizondo, 1952) y Durango (Varela & Aparicio, 1951); donde se encontró ectoparasitando perros y al interior de los hogares (Silva-Goytia & Elizondo, 1952). La presencia de R. sanguineus en esas localidades se asoció como vector de la bacteria que ocasiona la Fiebre Manchada (Bustamante & Varela, 1947). Los primeros casos positivos a Fiebre Manchada en humanos se registraron en el ejido Jimulco (Ortiz-Mariotte, 1945); posteriormente se presentaron otros casos en los ejidos Granada y Zaragoza, ocasionados por mordedura de garrapatas R. sanguineus (Bustamante et al., 1946). Durante el lapso 1975-2007, se presentaron 115 padecimientos de Fiebre Manchada (De Lara & Cárdenas, 2008), dos padecimientos humanos sucedieron en el año 2011 en Torreón y durante el periodo 2012-2014 se registraron 121 casos humanos de Fiebre Manchada para la Comarca Lagunera (SINAVE, 2015). Bustamante et al., (1946) aislaron dos cepas de rickettsia en garrapatas R. Sanguineus. Otros investigadores realizaron estudios serológicos, donde encontraron anticuerpos de R. rickettsii en sueros humanos, de perros y garrapatas R. sanguineus con similitud a la cepa Bitter Root Valley (Silva-Goytia & Elizondo, 1953). Covarrubias et al., (2007) encontraron 10 muestras positivas a Rickettsia rickettsii mediante la técnica de Inmunofluorescencia Indirecta (IFI), en los municipios de San Pedro de las Colonias y Francisco I. Madero; mientras que Castillo-Martínez et al., (2014) registraron el hallazgo de 4 muestras positivas para Rickettsia sp. en el ejido Atalaya, obtenidas mediante PCR.
MATERIALES Y MÉTODOS
La colecta de garrapatas se realizó durante junio 2015 a febrero 2016 en seis localidades rurales del municipio de Matamoros (25°31’41.77” N, 103°13’55.38” W: 1116 msnm) y dos áreas periurbanas correspondientes a Parras de la Fuente (25°26’45.09” N, 102°10’48.82” W: 1512 msnm) y Gómez Palacio (25°34’52.46” N, 103°21’21.11” W: 1128 msnm), ubicadas en los estados de Coahuila y Durango como se muestra en la Figura 1 (INEGI, 2016).
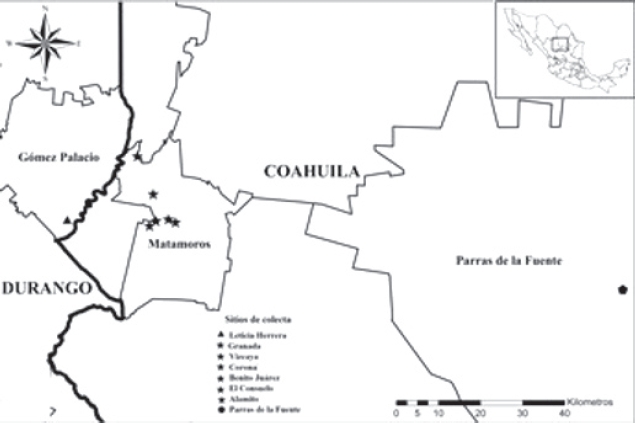
Figura 1 Áreas de la Comarca Lagunera (Coahuila y Durando) con presencia de Rhipicephalus sanguineus positivos a Rickettsia ricketsii.
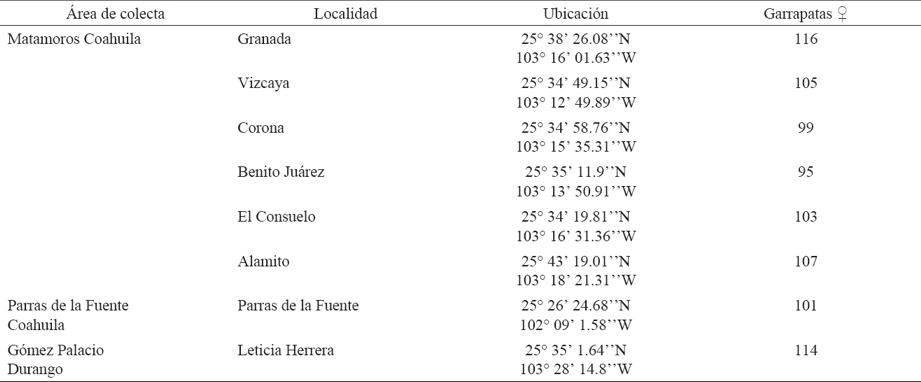
Se colectaron de manera directa e intencionada para este estudio, un total de 840 garrapatas (♀) alimentadas sobre 168 perros domésticos y peridomésticos, tomando una muestra de 5 garrapatas repletas por canino (Cuadro 1), evitando el desprendimiento del gnatosoma. Las garrapatas se colocaron en microtubos de 2 ml, se depositaron en un contenedor frío para su preservación y se transportaron al Laboratorio de Biología Molecular del Departamento de Parasitología de la Universidad Autónoma Agraria Antonio Narro Unidad Laguna. Los ixódidos colectados se lavaron con agua ultrapura, posteriormente se colocaron bajo un microscopio estereoscópico para su identificación morfométrica, siguiendo las claves taxonómicas de Walker et al., (2014).
Cuadro 1 Garrapatas (♀) Rhipicephalus sanguineus colectadas en ocho localidades de la Comarca Lagunera de Coahuila y Durango, México.
Para extraer el contenido interno de cada muestra se eligieron al azar tres ejemplares a repleción. Las garrapatas se diseccionaron con tijeras Iris de microdisección (BioQuip® No. 4715) previamente esterilizadas, realizando un corte en la parte posterior del abdomen; se sujetaron con unas pinzas entomológicas (BioQuip® No. 4522) desde la base de los palpos y con ayuda de una pinza curva (BioQuip® No. 4527) se deslizó presionando ligeramente la parte dorsal y ventral de los especímenes hasta la parte posterior del idiosoma. El contenido interno de cada muestra se depositó en un microtubo de 1.5 ml con un medio líquido de agua milli-Q (Life Invitrogen®, USA) y se maceraron usando pistilos de maceración de tejido (Thomas Scientific® No. TS0913X70). Los productos macerados (195 pools) se agruparon a razón de 1 muestra = 3♀ adultas a repleción (Cuadro 2).
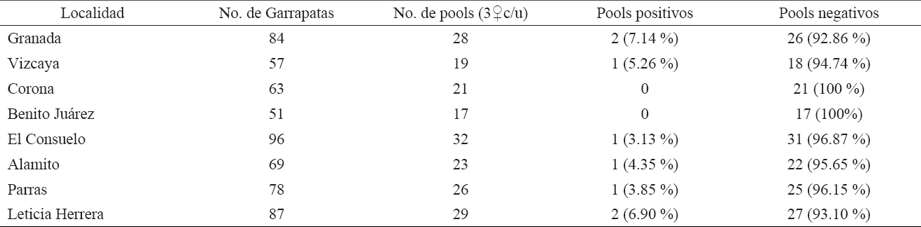
Cuadro 2 Muestras de garrapatas Rhipicephalus sanguineus, pools procesados y resultados de los análisis por PCR para la detección de Rickettsia rickettsii.
Extracción de ADN. La extracción de ADN se realizó mediante el protocolo Cetyl Trimethyl Ammonium Bromide o CTAB (Doyle & Doyle, 1987) con las siguientes modificaciones: a cada muestra macerada se agregaron 200µl de CTAB 2X, se mezclaron durante 15 seg en el vortex (Select vortexer, Select Bioproducts®, U.S.A.), en seguida se colocaron los microtubos en el termoblock (Digital block heater, Select Bioproducts® U.S.A.) a 65 °C durante 30 min; posteriormente se adicionaron 200 µl de cloroformo frío (C4425-12, Jalmek®) y se mezclaron por 10 seg en el vortex. Las muestras se colocaron en una centrífuga (Force micro 1624, Select Bioproducts® U.S.A.) durante 20 min a 13000 rpm, se transfirieron 120 µl de la fase acuosa a microtubos estériles de 1.5 ml, a las cuales se les adicionaron 200 µl de isopropanol frío (P6925-13, Jalmek®) y se dejaron reposar durante 30 min a -30 °C para precipitar los ácidos nucleicos. Las muestras nuevamente se centrifugaron durante 20 min a 13000 rpm, se decantó el isopropanol para agregar 200 µl de etanol frío (E5325-15, Jalmek®) al 70%, se realizó otra centrifugación por 10 min a 13 000 rpm; se decantó el etanol dejando secar la pastilla a temperatura ambiente durante 40 min y finalmente se resuspendió el ADN en 30 µl de agua milli-Q (Life Invitrogen®, USA).
Pruebas Moleculares. La calidad y cantidad de ADN obtenido por medio de nanodrop (Thermo Scientific® NanoDrop 2000) fue evaluada, resuspendiéndola en 20 µl de buffer TE 1X [400 µl EDTA (Life Invitrogen®, USA) + 4 ml Tris Base (Bio Basic Canada Inc ®] para almacenarla a -20 ºC. Para las pruebas de PCR se utilizó el iniciador genérico que amplifica el gen gltA en un rango de 380-397 pb (Wood et al., 1987) para Ricketssia spp: Forward: RpCS.877p GGGGGCCTGCTCACGGCGG, Reverse: RpCS.1258n ATTGCAAAAAGTACAGTGAACA (Regnery et al., 1991). La reacción de PCR se realizó con la siguiente mezcla de reacción: MgCl2 a una concentración de 1.5 mM, buffer 10X (200 mM Tris-HCl pH 8.4 Bio Basic Canada Inc ®), dNTP´s (Life Invitrogen ®, USA) a una concentración de 0.2 mM, 1.25 U de Taq DNA polimerasa (Life Invitrogen ®, USA), ADN templado concentrado a 20-25 ng/µl, 20 pmol/ µl de cada uno de los iniciadores (RpCS.877p, RpCS.1258n) y agua milli-Q (Life Invitrogen ®, USA) para completar un Rx de 25 µl.
Las condiciones del termociclador Select Cycler II (Select BioProducts ®, USA) para amplificar el gen gltA fueron las siguientes: un ciclo a 95 ºC durante un minuto, 35 ciclos conformados por tres procesos: desnaturalización a 95 ºC (20 segundos), alineación de iniciadores a 48 ºC por 30 segundos, una extensión a 60 ºC (2 minutos) y otra extensión final a 72 ºC (1 min). Como control positivo se utilizó una muestra de Rickettsia rickettsii proporcionada por el Instituto de Investigaciones en Ciencias Veterinarias (UABC) y una mezcla sin ADN para el control negativo. El marcador de peso molecular (Hyperladder 100-pb – Bioline ®, USA), el control positivo y los productos obtenidos de PCR fueron teñidos con Gel Red (Biotium TM, USA) y observados en gel de agarosa al 1%; para visualizar los resultados de los productos se empleó un fotodocumentador MiniBis Pro (Bio-Imaging Systems ®).
RESULTADOS
Todos los especímenes fueron consistentes con la descripción de R. sanguineus (Walker et al., 2014) y de estas garrapatas se obtuvieron 8 pools positivos (8/195 = 4.1%) a Rickettsia sp. La presencia de Rickettsia sp. en los pools (n=195) compuesto por órganos y contenido estomacal macerado de las garrapatas a repleción, fue determinada mediante PCR empleando los iniciadores RpCS.877p y RpCS.1258n, los cuales amplificaron satisfactoriamente el gen de la citrato sintasa (gltA) en un rango de 380-397 pb (Fig. 2). La purificación y la secuenciación de los productos positivos fueron realizados por Macrogen (USA) en dos sentidos (Forward, Reverse). Los productos secuenciados mostraron una conformación de 364 pb, que al analizarse arrojaron una identidad del 100% a Rickettsia rickettsii con la cepa Brasileña 647 (No. de acceso KJ588069.1) y 99% de similitud a las cepas del InDRE (KU587806.1 y KT881097.1) depositados en la base de datos del GenBank.
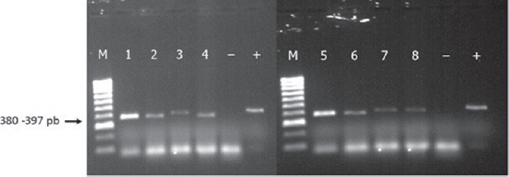
Figura 2 Productos de PCR con el gen gltA de Rickettsia sp., obtenido del ADN de pools de garrapatas R. sanguineus. Carriles: 1-2= Granada, 3= Vizcaya, 4= Consuelo, 5= Alamito, 6= Parras de la Fuente, 7-8= Leticia Herrera. M= marcador molecular 100-1000 pb., + = Control positivo, – = Control negativo sin ADN. Fragmento observado de 380-397 pb.
De los pools analizados, se encontró a la bacteria Rickettsia rickettsii manifestando frecuencias altas del 7.1% (2/28) en el ejido Granada (Matamoros, Coahuila) y 6.9% (2/29) en la colonia Leticia Herrera (Gómez Palacio, Durango). Las otras cuatro áreas muestreadas obtuvieron menor frecuencia, donde destacan tres localidades del municipio de Matamoros, Coahuila: ejido Vizcaya (1/19=5.25%), Alamito (1/23=4.35%) y ejido Consuelo (1/32= 3.13%); así como un pool positivo (1/26= 3.85%) para el municipio de Parras, Coahuila (Cuadro 2).
DISCUSIÓN
El medio rural y semiurbano presenta desplazamientos de humanos, perros y otros animales domésticos del campo al poblado; favoreciendo el transporte de garrapatas del área silvestre al hogar, donde conviven en aglomeración con otros animales domésticos, tal como lo manifiesta Bustamante (1956, 1964). Las características anteriormente descritas propician la reemergencia de rickettsiosis, cuando las condiciones ambientales de humedad y temperatura son favorables para que el vector aumente sus poblaciones y el patógeno se manifieste.
En las áreas rurales que comprenden los municipios de Matamoros (Coahuila) y Gómez Palacio (Durango), México; se encuentran cohabitando las garrapatas R. sanguineus, Otobius megnini (Dugès, 1884) y Argas persicus (Oken, 1818), donde la garrapata café del perro (R. sanguineus) es la especie más abundante y frecuente en perros domésticos y de vida libre (Hoffmann, 1962; Castillo-Martínez et al., 2015; 2016). Existen otras especies de ixódidos (Dermacentor sp., Amblyoma sp.) que pueden estar implicadas en la transmisión de R. rickettsii (Guzmán-Cornejo et al., 2011; Guzmán-Cornejo et al., 2016), sin embargo, hasta el momento solo R. sanguineus se ha visto involucrada en el ciclo de transmisión rickettsial en la Comarca Lagunera (Bustamante & Varela, 1947; Labruna et al., 2011); donde se han presentado múltiples casos de Fiebre Manchada en humanos (SINAVE, 2015). Los resultados de este estudio confirman la presencia de Rickettsia rickettsii como causante de Fiebre Manchada, en donde se señala a la garrapata R. sanguineus como vector de la bacteria R. rickettsii, por ser la especie de garrapata más ampliamente distribuida en la región. Lo anterior concuerda en parte con las investigaciones realizadas por Bustamante et al., (1946), quienes mediante serología aislaron la cepa Bitter Root Valley de rickettsia en garrapatas R. sanguineus colectadas en el Ejido Granada. Sin embargo, en esta investigación los resultados arrojaron una similitud del 100% a la cepa Brasileña 647 (No. de acceso KJ588069.1) y 99% de similitud a las cepas del InDRE (1098: KU587806.1 y 1075: KT881097.1), puesto que éstas últimas presentan una mutación en la posición 338 producto de la transición de una Citosina (GAGCAGG-C-CC) por una Timina (GAGCAGG-T-CC) observada en las cepas (1098, 1075) del InDRE.
Las modificaciones realizadas al método de obtención del pool y a la extracción de ADN, redujeron considerablemente la cantidad de sustancias inhibidoras de la PCR. La extracción y maceración de los órganos internos mostraron los mismos resultados que la trituración completa de ejemplares, pero evitando la presencia de material quitinoso en las muestras, lo cual interfiere en la centrifugación y precipitación de sólidos. Las modificaciones al protocolo del CTAB sustituyeron algunos procedimientos para acortar la metodología, se modificaron los tiempos de centrifugado y las temperaturas para la precipitación del ADN; obteniendo los mismos resultados que la técnica original de Doyle & Doyle (1987). Al someter el ADN extraído bajo ensayos de PCR, se obtuvieron ocho muestras positivas al género Rickettsia sp. utilizando los iniciadores genéricos diseñados por Regnery et al., (1991). Los resultados positivos secuenciados (8/195= 4.1%) concuerdan con las investigaciones realizadas por Demma et al., (2005), quienes mencionan que solo del 1 al 5% de las garrapatas están infectados por rickettsias en zonas de baja incidencia a Fiebre Manchada; sin embargo, las frecuencias son relativamente altas en cada localidad con presencia de R. rickettsi de acuerdo a los pools analizados.
CONCLUSIÓN
La bacteria R. rickettsii está presente en áreas rurales y periurbanas de la Comarca Lagunera de Coahuila y Durango y su principal vector hasta el momento es la garrapata café del perro R. sanguineus. El comportamiento de los casos humanos positivos a Fiebre Manchada, indican que la bacteria R. rickettsii se encuentra en los órganos internos de la garrapata y se comporta como un patógeno reemergente. Los movimientos del medio rural al urbano y las actividades que involucran el pastoreo de ganado, propician la diseminación de garrapatas y patógenos que causan enfermedades de interés en salud pública y veterinaria; por lo tanto se recomienda realizar más investigaciones para conocer la diversidad de ixódidos y patógenos presentes en los estados de Coahuila y Durango.











 nueva página del texto (beta)
nueva página del texto (beta)


