INTRODUCCIÓN
Las selvas altas perennifolia y subperennifolia (SA) son comunidades vegetales clasificadas dentro del Bosque Tropical Perennifolio (Challenger & Soberón, 2008), tipo de vegetación considerado de importancia para la conservación, ya que a pesar de cubrir sólo 7% de la superficie continental, alberga el 50% de la biodiversidad mundial (Wilson, 1988); además, este tipo de vegetación se encuentra amenazado por las actividades enfocadas a la explotación de sus especies maderables y no maderables, así como por el cambio de uso de suelo, que rápidamente reducen su extensión a nivel mundial.
En América, su distribución más septentrional se encuentra en la vertiente del Atlántico Mexicano (las planicies del Golfo de México en altitudes de hasta 1,000 msnm, el sur y este de la Península de Yucatán, y el este de Chiapas donde asciende hasta los 1,500 msnm), aunque hay una extensión importante sobre la vertiente del Pacífico, en la Sierra Madre de Chiapas y las faldas de la Sierra Madre del Sur de Oaxaca y Guerrero (Challenger & Soberón 2008; CONABIO, 1998, 1999). Además, se distribuye en el norte de Guatemala, en los departamentos del Petén, Alta Verapaz e Izabal por debajo de los 1,800 msnm (CCAD, 2015b, d), y en 62% del territorio de Belice alcanzando hasta los 1,000 msnm en las Montañas Mayas (CCAD, 2015a, c; Cherrington et al., 2010). Sin tomar en cuenta la vertiente del Pacífico Mexicano, estas áreas de distribución se ubican dentro de lo que Morrone (2001) y Morrone et al. (1999, 2002) definen como la provincia biogeográfica del Golfo de México (PBGM).
Esta provincia se ubica en el reino Neotropical en la región del Caribe, y corresponde al Neotrópico Húmedo Mesoamericano (Espinosa et al., 2008). Se extiende a lo largo de la costa del Golfo de México, desde la cuenca del Río San Fernando en el estado de Tamaulipas, hacia el sur pasando por los estados de San Luis Potosí, Veracruz, Puebla, Hidalgo y Tabasco, por debajo de los 1,500 msnm, y parte de Oaxaca y Chiapas por debajo de los 1,000 msnm, hasta llegar al Río Candelaria en Campeche, incluso abarca el sur de la región de Calakmul donde inicia la Península de Yucatán (Espinosa et al., 2008); continúa por el norte de Guatemala alcanzando los 1,600 msnm en la Sierra Madre, e incluye la totalidad de Belice (Fig. 1).
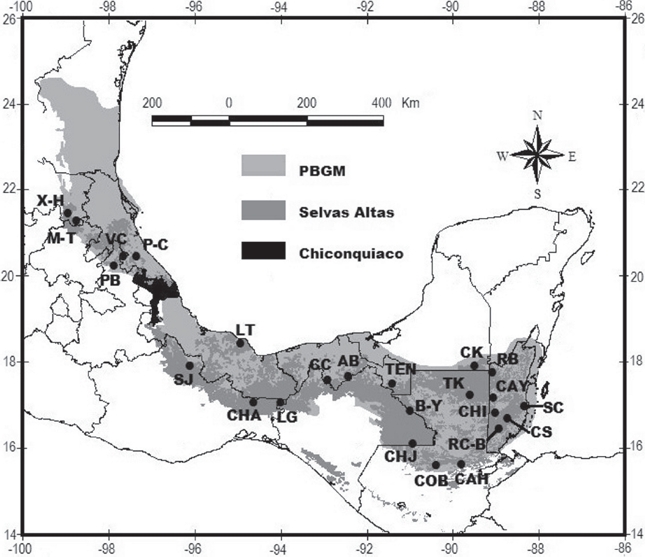
Figura 1 Ubicación de la Sierra de Chiconquiaco y los sitios de selvas altas en la provincia biogeográfica del Golfo de México (PBGM).
La obra base para el estudio de los Papilionoidea en México y Centroamérica, es la Biologia Centrali Americana, elaborada por Godman & Salvin entre 1879 y 1901. En ella se citan 418 especies en 22 localidades de Veracruz, México (Luis-Martínez et al., 1995); 460 especies en 128 localidades de Guatemala (Salinas-Gutiérrez et al., 2009), y 90 especies en seis localidades de Belice, referido como Honduras Británica (Godman & Salvin, 1879-1901); estas pueden considerarse las primeras especies reportadas para la PBGM, y en su mayoría para las SA de la provincia.
De acuerdo con Michán et al. (2005) y Luis-Martínez et al. (2011), posterior a Godman y Salvin para esta provincia destacan colecciones como las de Escalante, depositada en el Museo de Zoología de la Facultad de Ciencias, UNAM y que cuenta con 5,000 ejemplares procedentes principalmente de la región de Los Tuxtlas, Veracruz (Luis-Martínez et al., 1995). Trabajos más recientes sobre los Papilionoidea de las SA en la PBGM son los realizados por de la Maza & de la Maza (1985a, b), González-Martínez (1996), Luis-Martínez et al. (1991), Martínez (1994), Maya-Martínez et al. (2005), Pozo et al. (2003), Raguso & Llorente-Bousquets (1990), Salinas-Gutiérrez et al. (2004, 2006), Salinas-Gutiérrez (2010) y Villegas (1998); sus investigaciones abarcan desde listas regionales de Papilionoidea, su fenología, distribución altitudinal y por tipos de vegetación, hasta comparaciones de la riqueza y posibles relaciones ecológicas y biogeográficas entre localidades del sureste mexicano y Centroamérica.
Después de la publicación de la Biologia Centrali Americana, el trabajo en Guatemala es escaso y se encuentra dirigido principalmente a revisiones y compilaciones del país (Salinas-Gutiérrez et al., 2009). Sin embargo, destacan los trabajos de Welling (1973, 1975, 1977), colector comercial en bosque mesófilo y SA, el de Austin et al. (1996) en Tikal, el de Barrios et al. (2007) en Alta Verapaz, y el de Salinas-Gutiérrez et al. (2009), quienes realizaron una síntesis de las mariposas del país basada en revisiones de literatura y colecciones científicas.
En Belice los estudios se vieron limitados a las colecciones particulares como la de Gibbs (1912, 1914) quien publicó dos artículos de las mariposas de Belice y Guatemala, y Meerman (1999) quien publicó el catálogo de mariposas de Belice a partir de datos de museos y literatura. Actualmente la información derivada de trabajos como estos se resguarda en bases de datos contenidas en el Biodiversity and Environmental Resource Data System of Belize (BERDS) creado en 2005 (Meerman & Clabaugh, 2012), que permite su uso en cuestiones de estudio, aprovechamiento y conservación.
El conocimiento detallado del número y tipo de especies presentes en un área geográfica determinada es fundamental en diversos aspectos de la conservación biológica. Con el objeto de poder diseñar políticas adecuadas de estudio, uso y protección de los recursos bióticos, en los últimos años ha crecido notablemente la necesidad de contar con inventarios, que deben presentar disponibilidad, precisión y amplitud, si se espera su uso en estas tareas (Cervantes et al., 1994). Sin embargo, la mayoría de los trabajos sobre Papilionoidea de las SA en la PBGM, muestran estudios de áreas puntuales que no consideran la composición total de especies en estas comunidades vegetales de la provincia, y sólo algunos están enfocados a comparar la composición de Papilionoidea entre distintos tipos de vegetación o analizar su distribución para determinar áreas de estudio y conservación de las SA. De hecho, salvo los trabajos elaborados por Maya-Martínez et al. (2005), Salinas-Gutiérrez (2010) y Salinas-Gutiérrez et al. (2004, 2006) ninguno ha intentado analizar en conjunto la comunidad de Papilionoidea de las selvas del sureste mexicano, la región Huasteca y Centroamérica; y menos aún su relación histórica. Por ello, el presente trabajo muestra un análisis general de la riqueza de cinco de las siete familias de Papilionoidea (Nieukerken et al., 2011) de las SA en la PBGM y de las relaciones existentes entre los sitios estudiados dentro de la provincia, la cual corresponde a una unidad natural de estudio que abarca la mayor parte del área de distribución de esta vegetación en México, Guatemala y Belice, y representa su límite de distribución boreal en América.
MATERIALES Y MÉTODOS
Sitios y taxones. En este trabajo se utilizó la información de los Papilionoidea proveniente de las publicaciones de Austin et al. (1996), Barrios et al. (2007), González-Martínez (1996), González-Valdivia et al. (2016), Hernández-Baz et al. (2016), Luis-Martínez et al. (1991), Maya-Martínez et al. (2005), Raguso & Llorente (1997), Raguso & Llorente-Bousquets (1990), Salinas-Gutiérrez (2010), Salinas-Gutiérrez et al. (2004, 2006), las cuales proporcionan información obtenida de recolectas y de la revisión de bases de datos y literatura, por lo que se consideran los trabajos más completos para las áreas que representan; además, se incluyeron datos procedentes de la megabase MARIPOSA (Luis-Martínez et al., 2005) para San Luis Potosí, la Colección Nacional de Insectos Lepidoptera (CNINLEPIDOPTERA, 2010) del Instituto de Biología (UNAM), el BERDS (Meerman & Clabaugh, 2012), y de la Colección Lepidopterológica del Museo de Zoología de la FES Zaragoza (UNAM). Con base en los datos recabados se reconocieron 24 sitios ubicados en vegetación de SA de la PBGM (Fig. 1): Xilitla-Huichihuayán (X-H), Matlapa-Tamazunchale (M-T), Barranca de Patla (PB), Venustiano Carranza (VC), Papantla-Coatzintla (P-C), Los Tuxtlas (LT), Sierra de Juárez (SJ), Chalchijapa (CHA), La Gringa (LG), Cerro Cocona (CC), Agua Blanca (AB), Tenosique (TEN), Bonampak-Yaxchilán (B-Y), Chajul (CHJ) y Calakmul (CK) para México; Tikal (TK), Cobán (COB) y Cahabón (CAH) para Guatemala; y Río Bravo (RB), Cayo (CAY), Chiquibul (CHI), Stann Creek (SC), Cockscomb (CS) y Río Columbia-Bladen (RC-B) para Belice. A partir de los papilionoideos presentes en cada sitio se elaboró la lista de las especies asociadas a las SA de la PBGM y con otras vegetaciones de las cinco familias consideradas en este análisis (Papilionidae, Pieridae, Lycaenidae, Riodinidae y Nymphalidae), para definir las especies más afines o exclusivas a las SA en esta provincia. La información se registró en una hoja de cálculo de Excel (Microsoft, 2013); los nombres y la distribución de las especies se confirmaron con base en Llorente-Bousquets et al. (2006), Meerman (1999), Salinas-Gutiérrez et al. (2009) y Warren et al. (2013). Posteriormente se comparó el número total de especies reportadas en los países que conforman la PBGM, con el número de especies que presenta cada uno en las SA de la provincia.
Como parte del análisis de la riqueza, las especies se separaron en dos categorías según su incidencia en otros tipos de vegetación dentro de la provincia: 1) Exclusivas a las SA: especies registradas únicamente en las SA dentro de la PBGM, las cuales fueron agrupadas en Restringidas, si se registraron sólo en un sitio; o No Restringidas si se registraron en dos o más sitios. 2) Presentes en otros tipos de vegetación: especies registradas en SA que además han sido recolectadas en Selva Mediana, Selva Baja Caducifolia, Bosque Mesófilo, Bosque de Pino, Bosque de Encino, Manglar, y áreas de Agricultura y pastizal inducido dentro de la PBGM, agrupadas como especies de Presencia moderada si se registraron en la SA y un tipo de vegetación adicional, o generalistas si fueron recolectadas en SA y en dos o más tipos de vegetación distintos.
Similitud y Análisis de parsimonia de endemismos. El análisis de similitud permite establecer la relación entre distintas áreas mediante la comparación de los conjuntos de especies que presentan. Se utilizó el índice de Jaccard para obtener los valores de similitud entre los sitios estudiados (Jaccard, 1908; Koleff, 2005; Magurran, 1988; Moreno, 2001; Southwood & Henderson, 2000), descrito como Ij=c/(a+b-c). Este índice se basa en datos de incidencia y no toma en cuenta las ausencias compartidas, ya que considera que comparar la falta de una especie en dos áreas distintas no aporta información relevante. Con estos valores de similitud se construyeron agrupamientos por el método UPGMA (Unweighted pair-group method using arithmetic averages); tanto el Índice de Jaccard como el UPGMA fueron aplicados mediante el programa NTSYSpc 2.11T (Rohlf, 2004).
El análisis de parsimonia de endemismos o PAE (Parsimony Analysis of Endemicity), consiste en la obtención de un cladograma de áreas a partir de las especies compartidas por éstas. Cada clado formado representa áreas con taxones comunes y permite suponer una relación histórica, ecológica o geológica (Escalante & Morrone, 2003; Morrone, 1994a, b, 2004, 2014). En el PAE se empleó el programa Winclada 1.00.08 (Nixon, 1999) mediante una búsqueda heurística con el procedimiento de bisección y reconexión múltiple (Multiple TBR+TBR).
Para la aplicación del índice de Jaccard y el PAE se elaboraron matrices de incidencia de los papilionoideos que únicamente fueron registrados en la SA.
RESULTADOS
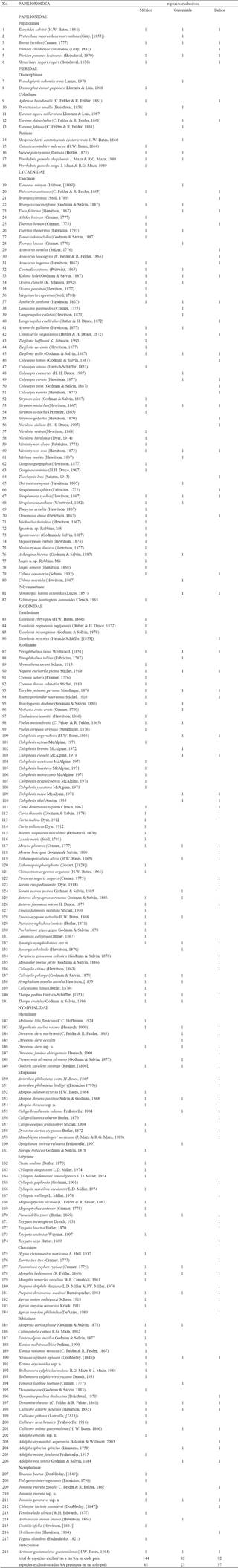
Sitios y taxones. Se obtuvo una lista (no se presenta en este trabajo) de 793 especies pertenecientes a cinco de las siete familias que conforman a Papilionoidea (Niukerken et al., 2011) para las SA de la PBGM (348 Nymphalidae, 192 Lycaenidae, 145 Riodinidae, 65 Pieridae, 43 Papilionidae). El Cuadro 1 muestra que México tiene el mayor número de especies registradas en las SA de la PBGM (709), seguido por Belice (422) y Guatemala (405); las subfamilias con mayor riqueza son Theclinae (182) y Riodininae (133). Los 24 sitios definidos a partir de las fuentes consultadas tuvieron entre 517 y 71 especies: LT (517), SJ (365), CHJ (364), X-H (332), CAY (329), PB (318), TIK (308), M-T (270), B-Y (252), RB (234), CC (210), CHI (199), COB (181), CHA (176), CK (175), TEN (160), LG (159), SC (158), RC-B (151), P-C (137), AB (129), VC (125), CAH (90) y CS (71).
Cuadro 1 Riqueza por familia y subfamilia de Papilionoidea de las selvas altas (SA) para cada país que integra la provincia biogeográfica del Golfo de México (PBGM). M: México; G: Guatemala; B: Belice.
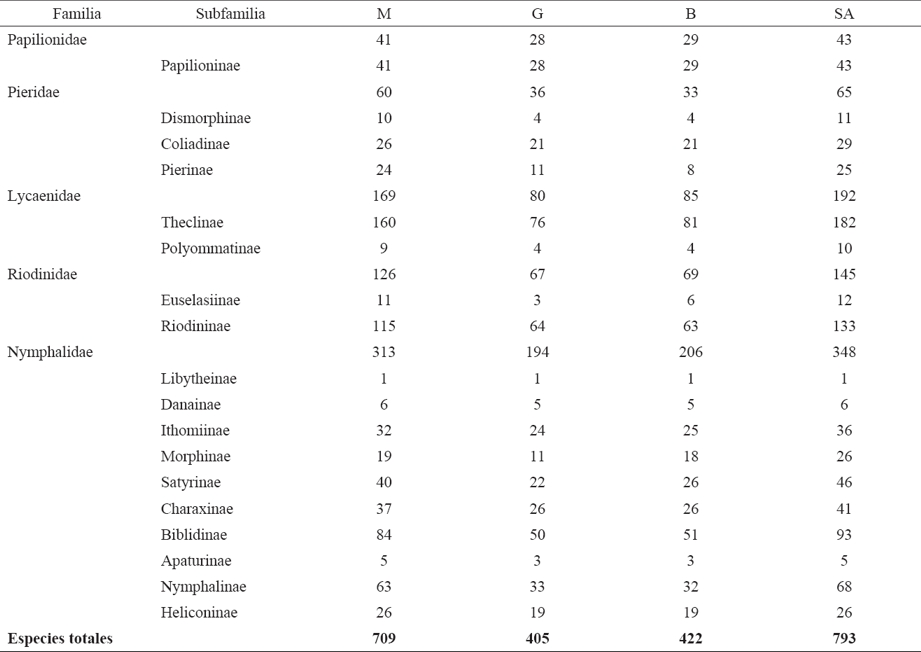
Fuente: Austin et al. (1996), Barrios et al. (2007), González-Martínez (1996), González-Valdivia et al. (2016), Hernández-Baz et al. (2016), Luis-Martínez et al. (1991), Maya-Martínez et al. (2005), Raguso & Llorente (1997), Raguso & Llorente-Bousquets (1990), Salinas-Gutiérrez (2010) y de Salinas-Gutiérrez et al. (2004, 2006), así como la base de datos de BERDS (Meerman & Clabaugh, 2012) y de las colecciones de mariposas del Museo de Zoología de la Facultad de Ciencias (Luis-Martínez et al., 2005), del Instituto de Biología (CNINLEPIDOPTERA, 2010), y del Museo de Zoología de la FES Zaragoza, todas de la UNAM.
De acuerdo con las especies registradas en cada país se encontró que Belice cuenta con el mayor porcentaje (77.43%) presente en las SA (Cuadro 2). De las 793 especies de Papilionoidea reportadas para SA en México, Guatemala y Belice, sólo 288 son comunes y 76 (de México y Belice) probablemente comunes a los tres países, lo que da un total de 364, equivalentes al 45.84 % del total reportado para las SA de la PBGM (Cuadro 3). Los valores totales del número de especies se tomaron de Llorente-Bousquets et al. (2006) para México, Salinas-Gutiérrez et al. (2012) para Guatemala y Salinas-Gutiérrez (2010) para Belice. Se encontró una diferencia de 14 especies al comparar el total de Papilionoidea de las SA en la PBGM (793) obtenido en este trabajo, con el total de especies (779) referido para la Selva Maya por Salinas-Gutiérrez (2010), aunque al final 46 de los 793 papilionoideos de las SA en la PBGM no fueron mencionados en el trabajo de la Selva Maya (Cuadro 4).
Cuadro 2 Total de Papilionoidea de México (M), Guatemala (G) y Belice (B), con el número y proporción de especies (%) presentes en las SA de la PBGM.
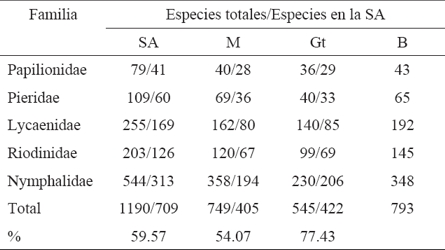
Cuadro 3 Papilionoidea de las SA de la PBGM compartidas entre México (M), Guatemala (G) y Belice (B). Porcentaje respecto al total de especies de las SA (%).
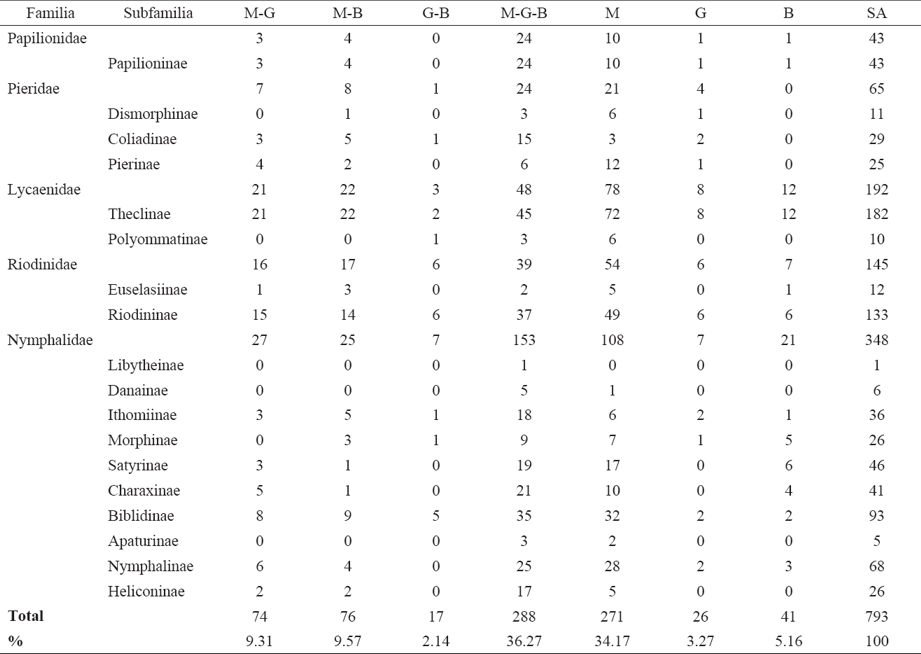
Cuadro 4 Papilionoideos de las SA en la PBGM adicionales a la lista de la Selva Maya (Salinas-Gutiérrez 2010); los nombres completos de los sitios se indican en el texto.
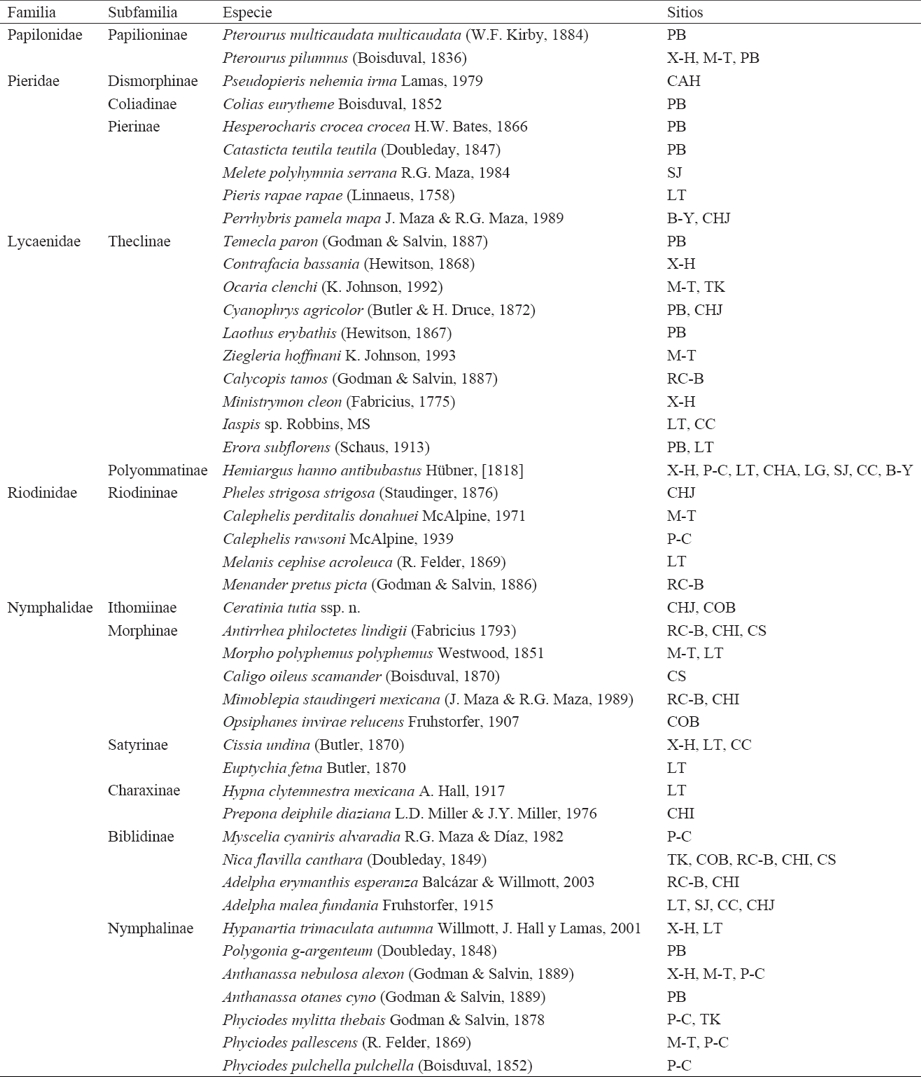
Con respecto a su categoría de incidencia, de los 793 papilionoideos se reconocieron 218 especies exclusivas a las SA (Cuadro 5), 86 de ellas como Restringidas y 132 como No Restringidas, además de 575 especies que también se distribuyeron en otros tipos de vegetación, 166 de Presencia moderada y 409 Generalistas.
Cuadro 5 Relación de mariposas exclusivas a la SA que se proponen en este trabajo para el estudio y conservación de este tipo de vegetación.
Similitud y Análisis de parsimonia de endemismos. En los análisis de similitud y PAE se utilizaron las 218 especies de Papilionoidea exclusivas de las SA; de esta manera, sólo se consideraron las especies que tienen una relación más estrecha con esta vegetación y se omitieron aquellas cuya relación o dependencia es menor o incierta. Del primer análisis se obtuvo el dendrograma de similitud (Fig. 2a) donde se observó la formación de dos grupos principales: uno conformado por los sitios ubicados al norte de la Sierra de Chiconquiaco: X-H, M-T, VC, P-C y CK (aunque éste último geográficamente se encuentra en el sur), y otro integrado por aquellos ubicados al sur (LT, SJ, B-Y, CHJ, TK, CAY, RB, SC, RC-B, CHI, CS, COB, CAH, CHA, CC, LG, AB y TEN). Con el PAE (Fig. 2b) se generó un árbol no resuelto en su totalidad (consenso de mayoría L=456, CI=48 y RI=31, a partir de 14 árboles con L=428, CI=51 y RI=39), que presentó una agrupación similar a la del grupo norte observado en el dendrograma de similitud, excepto que CK es excluido del clado que agrupa a los sitios del norte; en ambos árboles PB se mantiene separado del resto de los sitios.
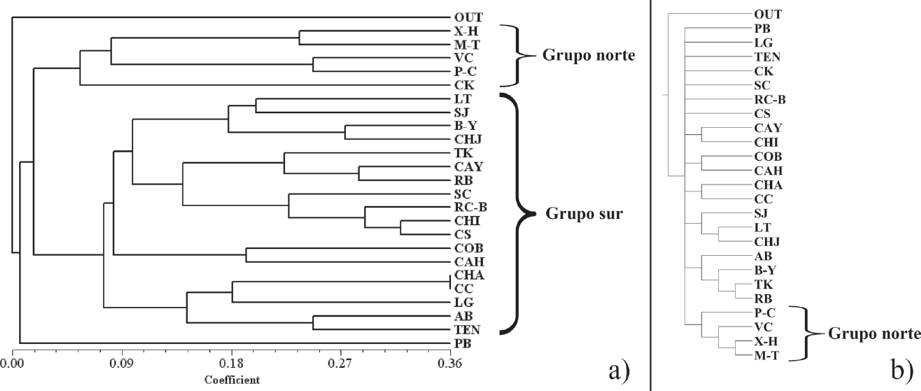
Figura 2 Dendrogramas que muestran la agrupación de los sitios con base en el Índice de Jaccard (a) y el PAE (b).
Se revisó la lista de papilionoideos para distinguir las especies que definieron las agrupaciones obtenidas en los análisis de similitud y PAE, y se encontró que de las 218 especies exclusivas de las SA, 17 fueron reportadas a ambos lados de la sierra de Chiconquiaco, ocho sólo en el norte y 193 únicamente en el sur; Finalmente, 411 del total de especies (793) están presentes tanto al norte como al sur de Chiconquiaco, otras 39 sólo se registraron al norte y 343 exclusivamente en el sur.
DISCUSIÓN
Sitios y taxones. La lista de papilionoideos para las SA de la PBGM se integró por 793 especies pertenecientes a cinco de las siete familias que conforman a Papilionoidea (Niukerken et al., 2011), con proporciones de riqueza que de manera general coinciden con los reportados en la literatura para la superfamilia a cualquier escala espacial que se estudie la región neotropical (Lamas, 2008; Llorente-Bousquets et al., 2014; Luis-Martínez et al., 2004), excepto en los casos donde existen ambientes fuertemente alterados, sitios con muestreo escaso o inadecuado, o muestreos parciales en sitios con estacionalidad muy marcada. En este trabajo Lycaenidae presentó mayor número de especies que Riodinidae, resultados que coinciden con los de la Selva Maya obtenidos por Salinas-Gutiérrez (2010). Los valores altos de riqueza de Theclinae (182) y Riodininae (133) son los esperados debido a la gran diversidad de especies vegetales que tienen las SA y a la gran especialización y diversificación de las familias a las que pertenecen estos taxones (Lycaenidae y Riodinidae, respectivamente) gracias a sus hábitos de alimentación larval monogenérica y monoespecífica con relación a varias plantas tropicales (Castillo-Guevara & Rico-Gray, 2002; Contreras-Medina et al., 2003; Coto & Saunders, 2001; de la Maza, 1987; Maes, 2004; Vargas-Carrillo, 2011), así como hábitos mirmecófilos (de la Maza, 1987; Fürst & Nash, 2010).
Algunos de los sitios más diversos (LT, 517; SJ, 365; CHJ, 364; X-H, 332; CAY, 329; PB, 318; TIK, 308) corresponden a las áreas con mayor tradición de estudio para cada país, mientras que los menos diversos (VC, 125; CAH, 90; CS, 71) están en las áreas menos estudiadas; adicionalmente, esta diferencia puede deberse a otros factores como la ubicación geográfica y al grado de perturbación de la vegetación en la zona y sus alrededores. Por ejemplo, los sitios X-H, PB y VC se localizan en el límite de distribución boreal de las SA en la PBGM y presentan parches de vegetación bien conservada rodeados por vegetación perturbada y zonas agrícolas, pero los dos primeros tienen una mayor tradición de estudio que VC; en el caso de TK respecto a CAH, TK cuenta con una vegetación más conservada y una mayor tradición de estudio que CAH. Para LT, SJ y CHJ su tradición de estudio es muy similar, aunque CHJ es el sitio de acceso más difícil por su ubicación geográfica y cuenta con una vegetación menos perturbada que los otros dos sitios, mientras que LT cuenta con un gradiente altitudinal mayor y se encuentra en una zona accesible rodeada por áreas sujetas a cambio de uso de suelo.
Al comparar el número de especies registradas en este trabajo con el total reportado para todo México (793 en SA/1190 en todo el país), Guatemala (405/749) y Belice (422/545), se observa que más de la mitad se encuentran en las SA, lo que coincide con Dirzo (1990) y Wilson (1988) cuando afirman que las selvas tropicales cuentan con la mayor biodiversidad del planeta para diversos grupos de organismos, siendo al menos del 50% (Dirzo, 1990; Wilson, 1988). El alto porcentaje de especies (77.43) que Belice presenta en las SA se debe a que gran parte de su territorio se encuentra cubierto por este tipo de vegetación; mientras que México (59.57) muestra un porcentaje superior al de Guatemala (54.07) debido a que tiene una superficie selvática más extensa.
El porcentaje elevado (45.78) de especies comunes (288 presentes en México, Guatemala y Belice) y potencialmente comunes a los tres países (76 presentes en México y Belice), puede explicarse si se considera que Belice, el norte de Guatemala y el sureste mexicano forman una unidad selvática continua dividida únicamente por las fronteras políticas (Salinas-Gutiérrez, 2010), que es la más grande de Mesoamérica y la segunda en importancia en América después de la Amazonia (Conservation International, 2004). Las especies reportadas sólo para Guatemala (26) y Belice (41), podrían ser encontradas en más de un país si se realizan más recolectas en los lugares poco estudiados de éstos y del sureste mexicano; las 271 especies presentes exclusivamente en México, se encuentran en la misma situación.
En este trabajo se agregó información para algunos de los 18 sitios de la Selva Maya analizados por Salinas-Gutiérrez (2010) y se incluyeron siete sitios adicionales, tres en Belice (RC-B, CHI y CS) y cuatro en México (M-T, PB, VC y P-C); además, al revisar y actualizar las listas de los trabajos consultados en algunos casos se identificaron especies y subespecies distintas a las que menciona este autor. Por tales motivos, 46 de los 793 papilionoideos de las SA en la PBGM no están representados en el trabajo de la Selva Maya, y dado que en el presente análisis no se tomó en cuenta el sitio del Soconusco por ubicarse fuera de la PBGM, ni sus especies exclusivas, al comparar el total de Papilionoidea de las SA en la PBGM (793) con el total reportado para la Selva Maya (779) al final sólo se obtiene una diferencia de 14 especies. Se debe considerar que los sitios estudiados por Salinas-Gutiérrez (2010) fueron la base para este análisis ya que, debido al sesgo existente en el estudio de los bosques tropicales, son las áreas que cuentan con mayor información y accesibilidad, y a que su trabajo es el más completo para este tipo de vegetación en la región.
Las especies que se clasificaron como Generalistas (409) mostraron una presencia ecológica amplia, es decir, se encontraron en ambientes muy diversos, lo que permite suponer que tienen la capacidad de aprovechar distintos recursos en diversas condiciones, característica típica de una especie generalista o de nicho amplio (Rey-Benayas, 2009). Por otro lado, las de Presencia moderada (166) mostraron una incidencia limitada en otros tipos de vegetación además de las SA; lo que puede interpretarse como una aparición puntual breve en las SA si provienen de otro tipo de vegetación, o una aparición fuera de ellas si pertenecen a las SA y se desplazaron hacia el otro tipo de vegetación, característica que corresponde a las llamadas especies turistas (Halffter & Moreno, 2005); estas suposiciones podrían respaldarse con un análisis de la abundancia de las especies registradas en cada sitio, dato que no está disponible en ninguno de los trabajos y que como consecuencia, no pudo analizarse en este estudio.
Bajo estas consideraciones, las 218 especies restantes se clasificaron como Exclusivas de las SA ya que cuentan con una mayor probabilidad de ser especies propias o características de esta vegetación, con una marcada dependencia a las condiciones ambientales de la SA (temperatura, humedad, especies vegetales, etc.), de tal manera que no sería posible su establecimiento y captura fuera de este tipo de vegetación. Entre las especies Exclusivas de las SA, 86 fueron registradas sólo en un sitio (Restringidas) por lo que podrían ser especies endémicas a un área particular dentro de la distribución total en este tipo de vegetación si se confirma que sólo están presentes en ese sitio. Es posible que algunas de estas especies tengan una distribución mayor y que incluso puedan dejar de ser consideradas Exclusivas de las SA, ya que si bien en este trabajo no fueron registradas fuera de las SA, algunas han sido reportadas por Llorente-Bousquets et al. (2006) en otras entidades mexicanas, sin precisar la vegetación en la que se encontraron.
Similitud y Análisis de parsimonia de endemismos. La agrupación de los sitios obtenida en los análisis refuerza la propuesta de separar a la PBGM en dos distritos, uno norte y otro sur a partir del extremo oriental del Eje Neovolcánico (Espinosa-Pérez & Huidobro-Campos, 2005), que corresponde con la Sierra de Chiconquiaco (Aranda-Gómez et al., 2005; Cervantes-Zamora et al., 1990; Espinosa et al., 2008; Ferrari, 2000).
Una explicación histórica de la topología presentada por los dendrogramas y su relación con el área de la Sierra de Chiconquiaco se centra en el hecho de que a finales del Eoceno y principios del Oligoceno la vegetación tropical tenía su límite de distribución boreal en el sur y sureste de los actuales Estados Unidos de Norteamérica cerca de los 32° N, y que después retrocedió hasta los 23° N como consecuencia del descenso de la temperatura iniciado en ese mismo periodo y que continuó con algunas interrupciones hasta el Mioceno superior; posteriormente, con la llegada del plioceno tardío y el inicio de las glaciaciones pleistocénicas, la distribución de la vegetación tropical se fragmentó y aisló por las condiciones húmedo-frías, seco-cálidas y seco-frías que reemplazaron a las cálidas y húmedas (González, 1998; Toledo,1976), aislamiento que se reforzó por el surgimiento del extremo oriental del Eje Neovolcánico durante el plio-pleistoceno.
Así, la agrupación de los sitios del conjunto norte en los dendrogramas, exceptuando a CK, corresponde a la porción de SA que fue aislada de las zonas tropicales del sur por el extremo oriental del Eje Neovolcánico (Sierra de Chiconquiaco), mientras que los sitios ubicados en el conjunto sur corresponden a la porción de selva que permaneció continua tras el surgimiento de la sierra durante el plio-pleistoceno (Aranda-Gómez et al., 2005). Este aislamiento y la reducción de la vegetación tropical durante las glaciaciones pleistocénicas, propiciaron que la composición de especies sea diferente en ambos lados de la sierra, ya que al terminar las glaciaciones los taxones tropicales se expandieron nuevamente a partir de los refugios pleistocénicos, todos ubicados al sur de Chiconquiaco (Toledo, 1976), excepto uno sugerido para Tamaulipas (González & Hernández, 1998), las áreas del sur pudieron entrar en contacto nuevamente e intercambiar especies con áreas más australes, cálidas y húmedas, mientras que las del norte pudieron adoptar especies provenientes de latitudes boreales y zonas más frías y secas.
A pesar que existen especies exclusivas de las SA que se comparten entre los sitios de las dos vertientes de la sierra de Chiconquiaco (por ejemplo, Ocaria clenchi, Aubergina hicetas, Beotis sulphurea macularia y Castilia ofella), la agrupación norte en los dendrogramas se basa en la presencia de aquellas que en este trabajo sólo fueron encontradas al norte de esta sierra, como Calephelis montezuma, Ministrymon cleon y Texola elada ulrica; otras que se registraron únicamente en el sur y que definieron ese grupo fueron Arawacus togarna, Ziegleria hoffmani, Nessaea aglaura aglaura, Parides panares lycimenes y Actinote guatemalena guatemalena, sin embargo, los estudios de Llorente et al. (1997, 2006) y Luis et al. (2010), mencionan una distribución más amplia para algunas de estas especies.
El caso particular de la inclusión de CK con los sitios ubicados al norte de la sierra, inicialmente se interpreta como una agrupación de las SA más secas de la provincia, los sitios del norte como consecuencia de su mayor latitud y CK por la situación orográfica particular de la Península de Yucatán; aunque al observar la lista de especies existe la posibilidad de que se trate de una distribución disyunta de aquellas que lograron establecerse en ambos lados de la sierra. CK ubicado al sur de Chiconquiaco fue asociado con los sitios del norte debido a que compartió las especies Strymon mulucha (X-H y P-C), Junonia evarete ssp. n. (X-H) y Pseudonymphidia clearista (X-H y M-T).
PB presenta vegetación fuertemente perturbada, es el sitio que se interna más y a mayor altitud dentro de la Sierra Madre Oriental, y el único próximo al punto de contacto entre tres subprovincias fisiográficas (Llanuras y sierras de Querétaro e Hidalgo, Lagos y volcanes de Anáhuac y el Carso Huasteco) de acuerdo con Cervantes-Zamora et al. (1990), factores que favorecen el flujo de especies turistas hacia las SA y viceversa, las cuales fueron excluidas del estudio al aplicar los criterios del método de selección de los taxones; en consecuencia, PB comparte únicamente tres especies con el resto de los sitios, Nicolaea velina (LT, SJ y CHJ), N. heraldica (LT y CC) y Gargina gargophia (LT). Un análisis con datos de abundancia permitiría una selección más adecuada de las especies características de las SA, y con ello posiblemente se obtendría un resultado que mostrara la pertenencia de PB a alguna de las agrupaciones.
Análisis en los que se describen e interpretan las relaciones entre los distintos sitios con SA en la provincia (Maya-Martínez et al., 2005; Salinas-Gutiérrez, 2010; Salinas-Gutiérrez et al., 2004, 2006) muestran que CHJ, SJ, LT y SLP (San Luis Potosí, equivalente en este trabajo a X-H) forman un grupo estable (obtenido mediante análisis de parsimonia y similitud). Sus conclusiones generales sugieren que el bosque tropical perennifolio formaba un continuo que se extendía sobre la vertiente atlántica de los tres países, mostrando así la relación existente entre las distintas áreas con esta vegetación. Los resultados del presente trabajo confirmaron la consistencia de la agrupación de CHJ, SJ y LT, mientras que la separación de X-H demuestra que a pesar de formar parte de la misma unidad de selvas de la provincia, pertenece a un grupo distinto; entre otras causas, esta separación se define por la diferencia en la composición de especies generada por el aislamiento del norte respecto al sur ocasionado por la Sierra de Chiconquiaco.
CONCLUSIONES
La diversidad de Papilionoidea en las selvas altas (SA) de la Provincia Biogeográfica del Golfo de México (PBGM) es de 793 especies; es el valor máximo que se ha referido para este tipo de vegetación incluso comparado con la diversidad registrada en la Selva Maya, la cual se extiende en otras provincias biogeográficas. Por primera vez se citan 46 especies y subespecies de papilionoideos para las SA.
El patrón de riqueza por familia de los papilionoideos de la PBGM es el mismo que se ha encontrado en otras áreas neotropicales para papiliónidos, piéridos y ninfálidos, aunque en cuanto a licénidos y riodínidos más bien coincide con las proporciones detectadas en la Selva Maya; las subfamilias con mayor riqueza fueron Theclinae (182 especies) y Riodininae (133).
Aproximadamente la mitad de las especies de estas selvas se compartieron o son potencialmente comunes a Belice, Guatemala y México, aunque este último contiene la gran mayoría de los papilionoideos exclusivos a un país.
Se confirmó la gran diversidad específica que albergan los bosques tropicales, y en particular las SA ya que más de la mitad de los papilionoideos presentes en los países analizados se encontraron en esta vegetación (México 59.57%, Guatemala 54.07% y Belice 77.43%), concentrados principalmente en un privilegiado grupo de sitios ubicados a lo largo de esta provincia entre los que destaca Los Tuxtlas como el más diverso (517 especies).
Se propone un conjunto constituido por 218 especies características de las SA para el estudio y conservación de este tipo de vegetación, 86 de ellas distribuidas exclusivamente en un sólo sitio dentro de la provincia del Golfo de México.
Finalmente, este análisis coincide con la propuesta de separación de la Provincia Biogeográfica del Golfo de México en dos distritos a partir de la Sierra de Chiconquiaco: el Norte (X-H, M-T, VC, P-C y CK -aunque éste último geográficamente se encuentra en el sur) y el Sur (LT, SJ, B-Y, CHJ, TK, CAY, RB, SC, RC-B, CHI, CS, COB, CAH, CHA, CC, LG, AB y TEN).











 nova página do texto(beta)
nova página do texto(beta)


