INTRODUCCIÓN
Las guacamayas son aves en categoría de riesgo a nivel mundial (IUCN, 2014). Pertenecen al orden de los Psittaciformes, a la familia Psittacidae y al género Ara, comprenden 14 especies que habitan en la región neotropical y se caracterizan por su gran tamaño y colorido plumaje (Bird Life International, 2015). En México existen dos especies, clasificadas en subespecies: Ara militaris mexicanus (guacamaya verde), se distribuye en el Océano Pacífico, desde Sonora a lo largo de la Sierra Madre Occidental y del Sur, incluyendo la región costera de Oaxaca (Monterrubio et al., 2011; Rivera et al., 2013), y Ara macao cyanoptera (guacamaya escarlata), que habita en la Selva Lacandona y la Reserva de la Biosfera Montes Azules (REBIMA), Chiapas (González, 1993; Iñigo, 1996).
Las principales amenazas por las que atraviesa el género Ara en México es la captura y comercio ilegal, así como la deforestación (Carreón-Arroyo & Iñigo, 2000; Bonilla et al., 2007), causada por la expansión de terrenos para usos agropecuarios, crecimiento demográfico, fenómenos naturales y otros (FAO, 2010; 2012), lo anterior ocasiona una reducción en el tamaño de sus poblaciones, cambios en su biología, comportamiento e interacciones con otras especies (Cerezo, 2001; Ramírez, 2006).
Se sabe que la distribución geográfica del género Ara es determinada por la disponibilidad de recurso alimenticio y sitios de anidación (Arcos-Torres & Solano, 2008; Juárez et al., 2011). La relación con el hábitat es evaluada a través de estudios de composición florística, estructura vertical, horizontal y diversidad arbórea (Vicencio, 2012; Ornelas et al., 2013; Monterrubio et al., 2014). Esta información facilita la predicción de su comportamiento ante posibles cambios del paisaje (Ríos-Muñoz & Navarro, 2009; Canales et al., 2010), lo que permite generar programas de manejo para el uso sustentable de los recursos naturales y su conservación (Contreras et al., 2010).
Ara macao cyanoptera está incluida en la categoría de menor preocupación de la lista roja (IUCN, 2014). En México según la NOM-059-SEMARNAT-2010 se encuentra en categoría de peligro de extinción, se estima que solo existen alrededor de 200 parejas en el país (Carreón-Arroyo & Iñigo, 2000). A pesar de esto las investigaciones para su conservación y reproducción son escasas. Destacan los estudios realizados por Iñigo (1996) en la Selva Lacandona, Chiapas señalando que esta especie anida en zonas riparias e inundables, en cavidades naturales de árboles dominantes; Renton (1998) en Belmopán, Belice menciona que su dieta se basa en el consumo de frutos y semillas de alrededor de 15 especies arbóreas; Carreón-Arroyo & Iñigo (2000) en la REBIMA, Chiapas y su zona de amortiguamiento (ZA) desarrollaron un programa de reproducción mediante nidos artificiales construidos con cajas de madera.
A pesar de la vulnerabilidad de esta especie aún no se ha realizado la caracterización de la vegetación de su hábitat; razón por la que el presente estudio tuvo como objetivo determinar la estructura y diversidad arbórea de los sitios que selecciona A. macao cyanoptera para sus actividades de: anidación, alimentación y descanso y dormitorio en el Ejido Reforma Agraria, Marqués de Comillas, ZA de la REBIMA, Chiapas. Con esta información se espera contribuir a la generación de propuestas de manejo y uso sustentable de las especies que prefiere A. macao cyanoptera para sus actividades.
MATERIALES Y MÉTODOS
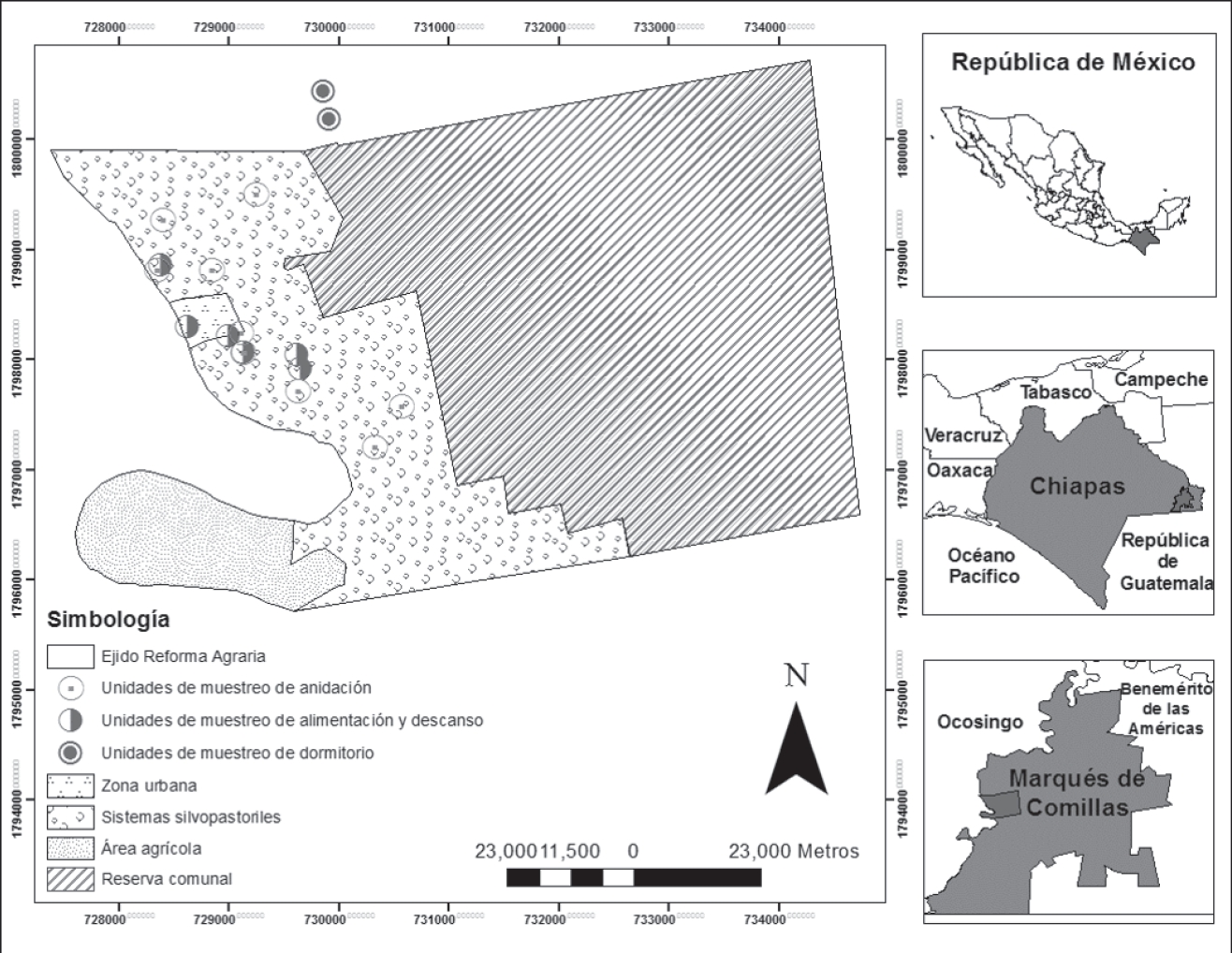
Área de estudio. Se localiza en el Ejido Reforma Agraria (16°15'24.29"N y 90°51'41.61"O; 200 a 500 msnm), municipio de Marqués de Comillas, en la zona de amortiguamiento de la Reserva de la Biosfera Montes Azules, al este de la Selva Lacandona, estado de Chiapas (Fig. 1). Forma parte de la llanura aluvial de los ríos Usumacinta y Lacantún (INEGI, 2015), con un clima de tipo (Af) (m) w” (i) g, cálido húmedo con lluvias todo el año, temperatura media anual de 24 a 26 ºC y precipitación media anual de 2500 a 3500 mm (CONAGUA, 2015). Los tipos de suelos predominantes son Fluvisol, Luvisol y Vertisol (IUSS, 2007) y la vegetación corresponde: a una selva alta perennifolia (Miranda, 1952) que generalmente presenta tres estratos verticales, en donde el estrato inferior es menor a 10 m, el intermedio de 11 a 20 m y el superior de 21 a 30 m (Maldonado-Sánchez & Maldonado, 2010; Vázquez et al., 2011). Algunas de las especies arbóreas dominantes de este tipo de vegetación son: Chicozapote (Manilkara zapota), Guapaque (Dialium guianense), Ramón (Brosimum alicastrum), Barí (Calophyllum brasiliense), Amargoso (Vatairea lundellii), Caoba (Swietenia macrophylla), Plumillo (Schizolobium parahybum), Mulato (Bursera simaruba), entre otras (Basáñez et al., 2008; Martínez et al., 2008).
Muestreo y tipo de actividad. Mediante recorridos diurnos (7:00 am a 1:00 pm) y vespertinos (5:00 a 7:00 pm) de observación en agosto de 2014 y verificación en enero de 2015, se identificaron con ayuda de guías comunitarios los árboles focales (AF) que utiliza A. macao cyanoptera para cada tipo de actividad (TA) (Fig. 1). Tomando como centro estos AF se establecieron 17 unidades de muestreo (UM), circulares de 1000 m² (radio = 17.84 m) siguiendo las recomendaciones de Carrillo (2008), distribuidas según el TA (Fig. 1): nueve para anidación (An), seis para alimentación y descanso (AyD), y dos para dormitorio (Do). En las UM An se identificaron dos nidos naturales y siete artificiales. Estos últimos fueron hechos con cajas de madera y colocados a una altura aproximada de 27 m en árboles seleccionados al azar, dentro del Ejido Reforma Agraria como parte de un proyecto que buscaba recuperar las poblaciones de esta especie; la separación entre nidos fue ≤3 km a una distancia ≤1.5 km del margen del río Lacantún. Las UM AyD son las que A. macao cyanoptera utiliza para alimentarse y descansar durante el día (7:00 am a 1:00 pm), se establecieron a una distancia ≤0.5 km del margen del río Lacantún. Las UM Do que la especie utiliza como dormitorio se establecieron una distancia ≤3 km del margen del río Lacantún.
Árboles utilizados para alimentación. Las especies arbóreas que utiliza A. macao cyanoptera para su alimentación se identificaron con tres recorridos por mes durante agosto a octubre de 2014. Los recorridos fueron diurnos (7:00 am a 1:00 pm) y vespertinos en las UM Do (5:00 a 7:00 pm), teniendo una duración de 30 minutos por UM según lo sugerido por Ramírez (2006). En cada UM se registró con ayuda de binoculares Bushnell ® 20x50 la parte vegetal consumida: corteza, hoja, flor, fruto y/o semilla, así como el nombre local (Renton, 2004; Carreón, 2006).
Estructura arbórea. En cada una de las 17 unidades de muestreo se midieron todos los árboles con diámetro normal (DN 1.30 m. del suelo) ≥3 cm para las siguientes variables: diámetro normal con cinta diamétrica, altura total con hipsómetro Suunto, y diámetro menor y mayor de copa con cinta métrica (Zamora, 2010; Zarco et al., 2010). Se registró su nombre local y se les tomaron fotografías digitales en campo, recolectando hojas, flores y frutos (Pennington & Sarukhán, 2005; Tropicos.Org, 2014), que posteriormente fueron enviados para su identificación taxonómica al herbario del Jardín Botánico Faustino Miranda, ubicado en el municipio de Tuxtla Gutiérrez, Chiapas.
Los estratos verticales fueron definidos en las UM de las tres actividades (An, AyD, Do), mediante las inflexiones de curvas acumuladas entre el número de individuos contra su altura total (López et al., 2012). Las categorías diamétricas de los árboles también se determinaron en las UM de las tres actividades (An, AyD, Do) pero, en contraste a las alturas totales, se delimitaron a intervalos de 10 cm de diámetro normal (Carreón-Santos & Valdez, 2014).
El índice de valor de importancia (IVI) se calculó para jerarquizar las especies arbóreas en las UM de las tres actividades (An, AyD, Do), considerando las siguientes variables: variables: densidad, dominancia y frecuencia (Curtis & McIntosh, 1951):
IVI = Dr + Domr + Fr
Donde:
Dr = densidad relativa
Domr = dominancia relativa
Fr = frecuencia relativa
El índice de valor forestal (IVF) se calculó en las UM de las tres actividades (An, AyD, Do), con la finalidad de incluir parámetros verticales (altura total) y horizontales a nivel de los estratos inferior (diámetro normal) y superior (cobertura de copa) (Corella et al., 2001):
IVF = DNr + Ar + Cr
Donde:
DNr = Diámetro normal relativo
Ar = Altura total relativa
Cr = Cobertura de copa relativa
Diversidad arbórea. Se calcularon los siguientes índices de diversidad en las UM de las tres actividades (An, AyD, Do): Margalef (Dα), relaciona el número de especies de acuerdo con la densidad de individuos muestreados (Basáñez et al., 2008); para contrastar la diversidad con otros estudios ya publicados, se consideró el índice de Shannon Wiener (H), mide el grado de incertidumbre para predecir la especie a la que pertenece un individuo tomado al azar dentro de las UM (Somarriba, 1999). Para el cálculo de estos dos índices se utilizó el software PAST versión 2.17c (Morales et al., 2012). La equidad se determinó con base en la proporción de la diversidad observada respecto a la máxima diversidad esperada (Magurran, 2003).
Con la finalidad de comparar la semejanza florística de las UM entre las tres actividades (An, AyD, Do) se calcularon mediante el software Bio~DAP (Magurran, 1988) los siguientes índices: Sorensen (CS), relaciona el número de especies en común con la media aritmética de las especies totales (Stiling, 1999); y Sorensen cuantitativo (CN), compara la abundancia de las especies compartidas con la abundancia total (Magurran, 1988).
Análisis estadístico. Para detectar la existencia de diferencias estadísticamente significativas de las unidades de muestreo entre los tres tipos de actividad para el índice de diversidad de Shannon Wiener se utilizó el método de “t” modificado por Hutcheson, ya que es más sensible para este tipo de comparaciones (Magurran, 2003; Villavicencio & Valdez, 2003); para la riqueza de especies, calculada mediante el índice de Margalef se realizó ANOVA así como Pruebas de Tukey, usando el paquete estadístico R Commander 3.3.1 (Ramírez & Castillo, 1985; Villalpando et al., 2001).
RESULTADOS
En los tres tipos de actividad se registraron 443 individuos de 46 especies arbóreas pertenecientes a 44 géneros y 22 familias. Las especies más abundantes son: Trophis racemosa (L.) Urb. (Ramón), Ficus cotinifolia Kunth (Amate), Spondias mombin L. (Jobo), Tabebuia rosea (Bertol.) DC. (Roble) y Schizolobium parahyba (Vell.) Blake (Plumillo); especies que representaron el 40% del total registrado. Las familias más representadas fueron: Fabaceae y Malvaceae.
Del total de especies arbóreas registradas el 33% (15 especies, distribuidas en 15 géneros y nueve familias) fueron aprovechadas por Ara macao cyanoptera para anidar, alimentarse y dormir. Se observó que esta especie utiliza áreas silvopastoriles, con presencia de árboles dispersos con una densidad promedio de 260 individuos por ha, diámetro normal promedio de 20 cm y la altura total de 8 m.
Sitios de anidación. Estos sitios presentan más del 60% de los individuos registrados, se distribuyen en 38 especies arbóreas, 36 géneros y 19 familias (Cuadro 1). Las especies más abundantes fueron: T. racemosa, S. mombin, T. rosea, Platymiscium dimorphandrum Donn. Sm. (Marimbo) y F. cotinifolia, de las familias Fabaceae, Moraceae, Bignoniaceae y Anacardiaceae.
Cuadro 1 Atributos estructurales por tipo de actividad de Ara macao cyanoptera en Marqués de Comillas, Chiapas.

Las especies arbóreas que utiliza A. macao cyanoptera para anidar son: Ceiba pentandra (L.) Gaertn (Ceiba), Calophyllum brasiliense Cambess (Barí), F. cotinifolia y Vatairea lundellii (Standl.) Killip ex Record (Amargoso), distribuidas en el estrato superior (≥15 m), con diámetro normal ≥80 cm.
Sitios de alimentación y descanso. En los sitios de alimentación y descanso se registraron 139 individuos de 32 especies arbóreas, pertenecientes a 30 géneros y 15 familias (Cuadro 1). Las especies más abundantes son: F. cotinifolia, S. parahyba, Cecropia obtusifolia Bertol. (Guarumo), Sapindus saponaria L. (Jaboncillo) y T. racemosa, de las familias: Fabaceae, Moraceae, Sapindaceae y Urticaceae.
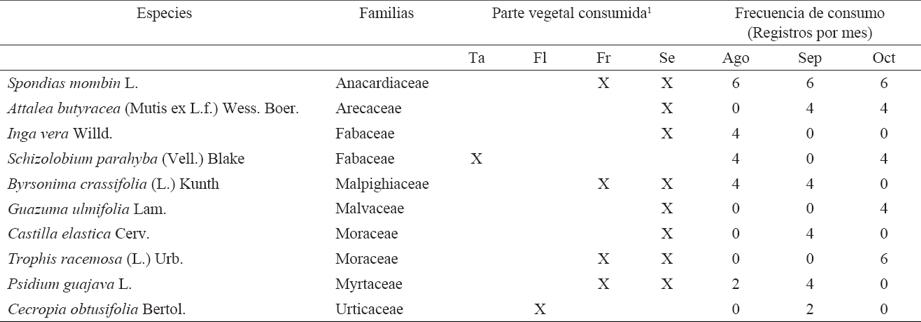
En la época de salida del nido de los juveniles: agosto a octubre, A. macao cyanoptera consume 10 especies arbóreas: Inga vera Willd. (Guatope), S. parahyba, Castilla elastica Cerv. (Hule silvestre), T. racemosa, Attalea butyracea (Mutis ex L.f.) Wess. Boer. (Corozo), S. mombin, Byrsonima crassifolia (L.) Kunth (Nance), Guazuma ulmifolia Lam. (Guácimo), Psidium guajava L. (Guayaba silvestre) y C. obtusifolia (Cuadro 2). El 80% de su dieta se basa en el consumo de frutos y semillas y el 20% de capullos de flores y tallos de hojas nuevas. Las especies arbóreas más consumidas por A. macao cyanoptera son S. mombin, A. butyracea, S. parahyba, B. crassifolia y T. racemosa, con el 28% del total de los registros (Cuadro 2).
Cuadro 2 Especies arbóreas que utiliza Ara macao cyanoptera para su alimentación de agosto a octubre en los sitios de alimentación y descanso en Marqués de Comillas, Chiapas.
Sitios de dormitorio. En los sitios de dormitorio se registraron 11 individuos de nueve especies arbóreas, nueve géneros, distribuidos en cuatro familias. Las especies más abundantes son: Gliricidia sepium Kunth ex Steud (Cocoite) y V. lundellii, de la familia: Fabaceae (Cuadro 1).
Durante los meses de agosto a octubre A. macao cyanoptera duerme en grupos con ≤30 individuos. De 5:30 a 6:30 pm todos los individuos avistados volaron a los sitios de dormitorio para alimentarse de frutos y semillas de S. mombin (Fig. 2), posteriormente se perchan para dormir, las especies arbóreas que utilizan para esta actividad son: Acacia usumacintensis Lundell. (Cantemó) y V. lundellii, distribuidas en el estrato superior (≥15 m) con diámetro normal ≥50 cm.

Figura 2 Número promedio de individuos de Ara macao cyanoptera alimentándose de frutos y semillas de Spondias mombin L. en las unidades de muestreo (UM) de dormitorio (Do) durante los meses de agosto a octubre, en Marqués de Comillas, Chiapas.
Estructura arbórea. Se reconocieron tres estratos verticales (inferior, intermedio y superior) en los tres tipos de actividad (Fig. 3): en los sitios de anidación el estrato inferior fue menor a 5 m, el intermedio de 5 a 15 m y el superior de 15 a 30 m; en los de alimentación y descanso el estrato inferior fue menor a 5 m, el intermedio de 5 a 8 m y el superior de 8 a 24 m; y en los sitios de dormitorio el estrato inferior fue menor a 5 m, el intermedio de 5 a 10 m y el superior de 10 a 30 m. Las especies arbóreas más abundantes en el estrato superior son: T. racemosa, P. dimorphandrum, S. mombin, V. lundellii y S. parahyba; en el estrato intermedio: F. cotinifolia, S. mombin, S. parahyba, T. racemosa y Lonchocarpus eriocarinalis Micheli (Marinero); y en el estrato inferior: Tabebuia rosea (Bertol.) DC. (Roble), T. racemosa, F. cotinifolia, S. mombin y Swietenia macrophylla King. (Caoba).
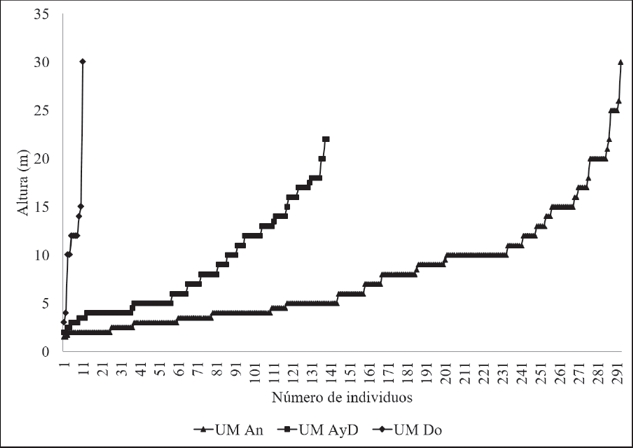
Figura 3 Distribución de las frecuencias de alturas totales de árboles en la unidades de muestreo (UM): anidación (An), alimentación y descanso (AyD) y dormitorio (Do) de Ara macao cyanoptera en Marqués de Comillas, Chiapas.
En los sitios de anidación así como en los de alimentación y descanso el 80% de los individuos se encontraron en las tres primeras categorías diamétricas. Las especies arbóreas que utiliza A. macao cyanoptera para anidar representaron el 3.5% de los individuos, distribuidos en las tres últimas categorías diamétricas. En tanto que para los sitios de dormitorio las especies que utiliza A. macao cyanoptera para este tipo de actividad (TA) representaron el 2%, ocupando las dos últimas categorías diamétricas (Fig. 4). En cada TA el número de individuos por categoría diamétrica disminuyó progresivamente sugiriendo una distribución de “J” invertida.

Figura 4 Distribución diamétrica de árboles en la unidades de muestreo (UM): anidación (An), alimentación y descanso (AyD) y dormitorio (Do) de Ara macao cyanoptera en Marqués de Comillas, Chiapas.
En los sitios de anidación las especies arbóreas con mayor Índice de Valor de Importancia (IVI) representaron el 45% del total de individuos; en los de alimentación y descanso las especies con mayor IVI ocuparon el 39% del total de individuos; mientras que en los sitios de dormitorio representaron el 70% del total de individuos (Cuadro 3).
Cuadro 3 Especies arbóreas con los mayores índices de valor de importancia (IVI) y forestal (IVF) para cada tipo de actividad de Ara macao cyanoptera en Marqués de Comillas, Chiapas.
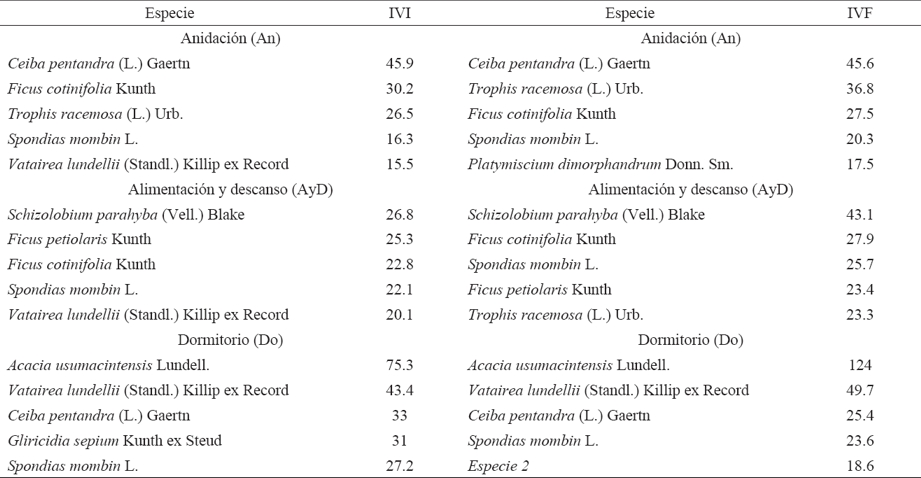
Las cinco especies con los valores más altos de IVI e Índice de Valor Forestal (IVF) coinciden en cada tipo de actividad, con excepción de P. dimorphandrum y Especie 2. Las especies arbóreas con valores superiores de IVI e IVF son utilizadas por A. macao cyanoptera para anidar, alimentarse y dormir (Cuadro 3).
Diversidad arbórea. De acuerdo con el índice de Shannon Wiener (H´) los sitios de alimentación y descanso (H´= 3.1) y anidación (H´= 3.1) son más diversos en especies arbóreas que los sitios de dormitorio (H´= 2.1), sin embargo estos últimos mostraron mayor equidad (Cuadro 4).
Cuadro 4 Valores de diversidad de especies arbóreas por tipo de actividad de Ara macao cyanoptera en Marqués de Comillas, Chiapas.

Los valores cualitativos y cuantitativos de semejanza de especies arbóreas fueron superiores entre los sitios de anidación y alimentación y descanso (CS = 75%; CN = 46%), mientras que en los de dormitorio los valores fueron inferiores con los otros tipos de actividad (CS = 29 a 39%; CN = 5 a 11%) (Cuadro 5).
Cuadro 5 Valores de semejanza de especies arbóreas, grados de libertad y t calculada entre los tipos de actividad de Ara macao cyanoptera en Marqués de Comillas, Chiapas.

Análisis estadístico. Los valores obtenidos con el método de “t” modificado por Hutcheson para anidación (An) contra alimentación y descanso (AyD) indican que no hay diferencias estadísticamente significativas (p < 0.001) en sus valores de diversidad arbórea; sin embargo en AyD contra dormitorio (Do), así como en An contra Do fueron estadísticamente diferentes (p < 0.001) (Cuadro 5).
Los valores obtenidos con las Pruebas de Tukey para An contra Do indican que son diferentes estadísticamente (p < 0.001) en sus valores de riqueza de especies arbóreas; sin embargo en AyD contra los otros dos tipos de actividad no hay diferencias significativas estadísticamente (p > 0.05) (Cuadro 6).
DISCUSIÓN
La importancia de este estudio es el presentar información sobre las características estructurales del hábitat de la Guacamaya escarlata (Ara macao cyanoptera) en un área de Chiapas con vegetación de tipo bosque tropical lluvioso y sabana (Miranda, 1952), en el Ejido Reforma Agraria, municipio de Marqués de Comillas. Los resultados mostraron que A. macao cyanoptera utiliza áreas cercanas a zonas fluviales con presencia de especies arbóreas de vegetación secundaria para su alimentación en la época reproductiva y no reproductiva, igual que otras especies del género Ara como Ara militaris mexicanus (Bonilla et al., 2008; Monterrubio et al., 2011; Rivera et al., 2013).
Estudios de composición florística en sistemas agroforestales han reportado una composición arbórea de menos de 38 especies (Ramos, 2001; Ramírez, 2009; Basáñez et al., 2008), lo cual es menor comparado con las 46 especies identificadas para el presente estudio en áreas silvopastoriles. Esta mayor riqueza seguramente condicionaría una mayor diversidad de especies arbóreas a utilizar por A. macao cyanoptera para sus actividades.
Los sitios de anidación de A. macao cyanoptera presentan mayor riqueza (38 especies arbóreas), en comparación con las seis especies en áreas de anidación de Rhynchopsitta pachyrhyncha (Psittacidae) (talla 0.38 m de longitud) (Sánchez, 2007) y las cuatro especies para Aratinga holochlora (Psittacidae) (talla 0.3 m de longitud) (Vicencio, 2012). Esto indica que A. macao cyanoptera (talla 1 m de longitud) requiere para anidar sitios de mayor riqueza arbórea en comparación a las dos anteriores debido a que es una especie de Psittacidae de talla grande (Rivera et al., 2013).
Los sitios de alimentación y descanso de A. macao cyanoptera mostraron valores más altos de riqueza de especies arbóreas (32 especies), de las cuales A. macao cyanoptera utilizó 10 especies para alimentarse; en comparación con los sitios de dormitorio con nueve especies registradas, de las cuales utilizó solo una especie: Spondias mombin (Jobo) para alimentarse antes de dormir. Esto indica que la riqueza de especies arbóreas es un factor determinante en la disponibilidad de recurso alimenticio para A. macao cyanoptera (Rivera et al., 2013).
Estudios realizados sobre la caracterización de la alimentación de A. militaris mexicanus por Contreras-González et al. (2009) y Rivera et al. (2013), así como para A. macao cyanoptera por Renton (1998) y Carreón-Arroyo & Iñigo (2000) durante la época reproductiva y no reproductiva para ambas subespecies, señalan que sus dietas incluyeron principalmente el consumo de frutos y semillas de alrededor de 15 especies arbóreas. En el presente estudio A. macao cyanoptera utilizó 10 especies arbóreas para alimentarse. Esta diferencia probablemente se deba a que solo se abarcó la época de salida del nido de los juveniles (agosto a octubre). Por lo anterior, se sugiere en futuras investigaciones sobre la dieta incluir los períodos tanto reproductivo como no reproductivo.
Arcos-Torres & Solano (2008), Juárez et al. (2011) y Villaseñor & Botello (2012) mencionan que A. militaris utilizó como dormitorio áreas encañonadas cercanas a zonas fluviales. No obstante la escasa información sobre los sitios de dormitorio de A. macao cyanoptera, los resultados del presente estudio comprueban que ambas especies del genero Ara utilizan zonas fluviales, aunque muestran comportamientos diferentes en la selección de dormitorios debido al tipo de vegetación en la que se presenta cada especie. Para A. militaris es selva baja y mediana subcaducifolia y subperennifolia (Forshaw, 1989); mientras que para A. macao cyanoptera es selva alta perennifolia (Iñigo, 1996; Carreón-Arroyo & Iñigo, 2000).
Es importante destacar que a pesar de que el estudio se realizó en áreas silvopastoriles, los tres estratos verticales de la vegetación arbórea en los sitios donde A. macao cyanoptera realiza sus actividades presentaron intervalos similares a los de estudios efectuados en selva alta perennifolia por Basáñez et al. (2008), Martínez et al. (2008), Maldonado-Sánchez & Maldonado (2010) y Vázquez et al. (2011), lo cual puede ser debido al manejo y estado de conservación de estas áreas.
Los sitios de anidación, alimentación y descanso (H´= 3.1) de A. macao cyanoptera fueron iguales en cuanto a la diversidad de especies arbóreas con los de A. militaris mexicanus (H´= 3.1) (Rivera et al., 2013). Asimismo, los valores de semejanza arbórea en los tipos de actividad de A. macao cyanoptera (Cs = 29 a 75%) fueron comparables a los reportados por Rivera-Ortiz et al. (2013) (Cs = 22 a 63%) para A. militaris mexicanus. Esto indica que ambas subespecies utilizan y requieren áreas de vegetación conservada.
CONCLUSIONES
En este estudio se presenta información sobre las actividades de anidación, alimentación y descanso, así como dormitorio de la Guacamaya escarlata (Ara macao cyanoptera), posteriormente estas actividades fueron relacionadas con las características estructurales y de diversidad arbórea de su hábitat. Los resultados obtenidos sugieren la importancia de conocer las características de la vegetación, para determinar la distribución y dinámica de especies en peligro de extinción, así como el estado de conservación de su hábitat. Esta información facilita la generación de programas de manejo para el uso sostenible del bosque, mediante acciones de reforestación con las especies arbóreas que utilizan para sus actividades, la creación de corredores biológicos, cercas vivas, arboles dispersos en potreros, entre otras. De igual forma es necesario detener el comercio ilegal de A. macao cyanoptera, para poder conservar a la única población natural de esta especie que existe en México.











 nova página do texto(beta)
nova página do texto(beta)