Introducción
Las aves de presa o rapaces son un grupo esenciales para mantener el equilibrio en las comunidades, dada su posición tope en la cadena trófica (Mañosa & Pedrocchi 1997, Rodríguez-Estrella et al. 1998, Vázquez-Pérez et al. 2009). Además, su sensibilidad a la perturbación y a cambios en el ambiente permite que sean utilizadas como especies indicadoras de la calidad del hábitat (Thiollay 1989, Rodríguez-Estrella et al. 1998, Blendinger et al. 2004, Carrete et al. 2009). En México las alteraciones antrópicas a sus hábitats han provocado que la mayoría de las especies de este grupo presenten problemas de conservación, por lo que muchas de ellas (80% del total nacional) tienen algún estatus de protección por parte del gobierno mexicano (DOF 2010a).
La presencia de las aves rapaces diurnas en un determinado ambiente depende de diferentes factores o combinación de ellos, como el estado de conservación del mismo, la disponibilidad de alimento, la presencia de fuentes de perturbación e incluso la época del año, pues tanto los movimientos migratorios como la época de reproducción influyen en la riqueza y abundancia de este grupo (Bustamante & Seoane 2004, Carrete et al. 2009, Vergara 2010).
Actualmente el cambio de uso de suelo afecta muchos de los ambientes naturales del país, por lo que en algunos casos dichos ambientes se están reduciendo a tasas elevadas (SEMARNAT 2007, López 2012), lo que es aún más notorio en lugares con diferentes actividades económicas (i.e. ganadería, agricultura, acuicultura), como Marismas Nacionales (DOF 2010b, Blanco et al. 2011).
Marismas Nacionales ha sido indicada como una de las zonas de mayor importancia biológica del país (CONANP 2005, Blanco et al. 2011), se localiza en la frontera de los estados de Sinaloa y Nayarit. Está reconocida como Área de Importancia para la Conservación de las Aves (Cervantes-Abrego 2000), sitio clave para la conservación de aves playeras (RHRAP 2015) y la porción nayarita fue designada Reserva de la Biosfera (DOF 2010b). Para la zona correspondiente a Sinaloa se están llevando a cabo las gestiones necesarias para su nombramiento (CONANP 2008).
Para Marismas Nacionales los escasos estudios ornitológicos se han enfocado principalmente a las comunidades de aves acuáticas y la información del componente terrestre está limitada, incluidas las rapaces. Recientemente fueron publicados dos trabajos en los que son mencionadas aves rapaces de la zona, en uno de ellos se informa de la presencia de Gavilanes caracoleros (Rostrhamus sociabilis Vieillot, 1817) y se analiza su distribución espacio-temporal (Carmona et al. 2013); en el otro se indica por primera vez para la zona la presencia invernal de grupos numerosos de Aguililla de Swainson (Buteo swainsoni Bonaparte, 1838) en campos agrícolas de la zona (Mendoza et al. 2016). Sin embargo no hay trabajos que aborden toda la comunidad de aves rapaces en Marismas Nacionales.
Para Nayarit, Escalante (1988) registró 22 especies de aves rapaces diurnas mientras que Howell & Webb (1995) reportan 32 especies; la plataforma de observación de aves eBrid (consultada en noviembre de 2015) registra para el estado 34 especies de aves rapaces diurnas, pero varias especies son ocasionales (e.g. Aguililla real, Milano de Misisipi). Adicionalmente en 2014 se presentó un listado de las aves de la Sierra de Vallejo, ubicada al sur de Nayarit, en él se incluyen 24 especies de aves rapaces diurnas (Figueroa-Esquivel & Puebla-Olivares 2014). Para Sinaloa existen registros de 28 especies de aves rapaces (Howell & Webb 1995). Tanto por la importancia del grupo taxonómico, como por la de Marismas Nacionales no es justificable la falta de información existente, sobre todo al considerar la serie de actividades económicas que se realizan en Marismas Nacionales (e.g. ganadería, agricultura, acuicultura), las cuales pueden ocasionar alteraciones en el entorno, sin que exista una línea base que permita comparar cambios en la comunidad de las aves rapaces de la zona.
Por lo anterior el objetivo de este trabajo fue describir la riqueza espacial y temporal de las aves rapaces diurnas en Marismas Nacionales a lo largo de ocho meses.
Materiales y métodos
Área de Estudio. Marismas Nacionales es un extenso sistema de humedales que se localiza entre el noroeste de Nayarit y el sur de Sinaloa, en la costa del Pacífico Mexicano (Fig. 1). Tiene una superficie de 300 000 ha, de las cuales 133 854 ha están incluidas dentro de la Reserva de la Biosfera homónima en Nayarit (DOF 2010b). El uso de suelo en la región es predominantemente agropecuario. La zona es una red de lagunas costeras salobres, manglares, planicies lodosas, cañadas y marismas (Saunders & Saunders 1981, Carmona et al. 2013). Marismas Nacionales incluye los bosques de manglar más extenso del Pacífico oriental mexicano (Berlanga-Robles & Ruiz-Luna 2006).

Figura 1 Área de estudio. Se indican los sitios de observación visitados (1) Zoquipan, (2) La Batanga, (3) Mexcaltitán, (4) Las Cañadas, (5) Chumbeño, (6) Las Garzas-Chahuín, (7) Zoyata, (8) La Polca y (9) Los Espejos. La línea punteada representa el área designada como Reserva de la Biosfera.
La zona presenta un clima cálido subhúmedo con lluvias en verano. Las lluvias son abundantes y rara vez inferiores a 1 000 mm anuales, se concentran de junio a octubre, época en las que en promedio se precipitan 964 mm (92%; CONAGUA 2004). La vegetación predominante es de bosque de manglar, vegetación halófita rastrera (Salicornia spp. Linnaeus, 1753 y Batis marítima Linnaeus, 1759), selva baja perennifolia, palma de aceite (Orbignya spp. Martius, 1837), selva baja caducifolia, pastizales y potreros, cultivos de frutales y hortalizas. La vegetación acuática está representada por lirio acuático (Eichhornia crassipes Solms, 1883), sauces (Salix spp. Linnaeus, 1753) y tule (Typha latifolia Linnaeus, 1753), entre otras (Carmona et al. 2013).
Se eligieron nueve áreas, tratando de incluir todos los ambientes presentes (como bosque de manglar, lagunas, planicies lodosas y marismas; Fig. 1):
Zoquipan se ubica al sur de Marismas Nacionales; incluye un canal principal y cuatro cuerpos de agua, dos de ellos estacionales. Presenta un gradiente de salinidades que va de la boca (altas salinidades) hacia el interior. La vegetación de este sitio incluye manglares (Rhizophora mangle Linnaeus, 1753) que cubren el perímetro de los canales y la mayor parte de las lagunas, donde también existen zonas de tule (T. latifolia). El lirio acuático cubre una extensa superficie del cuerpo de agua (INEGI 2000).
La Batanga es una laguna salobre estacional que se comunica con otros cuerpos de agua por medio de canales de poca profundidad. La vegetación predominante es el manglar y plantas halófitas (Salicornia spp. y B. maritima).
La zona de Mexcaltitan comprende una extensa laguna continental (902 ha), que es el cuerpo principal y otras dos más pequeñas localizadas en sus adyacencias. La profundidad es baja (menor a 1 m) en la mayor parte de su extensión. La vegetación predominante es el manglar; el lirio cubre amplias áreas del espejo de agua. La salinidad es baja en la época de lluvias y se incrementa en el estiaje.
Las Cañadas es uno de los complejos estuarinos más grande en la costa del Pacífico mexicano (Kovacs et al. 2008). Este sistema cuenta con numerosas lagunas salobres de poca profundidad, formadas por la presencia de aproximadamente 150 barras de arena semiparalelas, en las que existe vegetación de manglar (Avicennia germinans Linnaeus, 1764 y Laguncularia racemosa L. Gaetner, 1805). Las barras son utilizadas como áreas de cultivos y pastoreo.
La laguna El Chumbeño es un humedal salobre localizado a 32 km de la costa y que se interconecta a través de una red de esteros y canales al sistema lagunar Teacapán-Agua Brava (40 000 ha). A orillas de la laguna se encuentran dos poblados: Pescadero y Francisco Villa, que en conjunto cuentan con 1 700 habitantes dedicados a la pesca de camarón principalmente (Güemez-Álvarez 2011).
Las lagunas Las Garzas-Chahuin Chihua se ubican en la porción norte de Marismas Nacionales. Con un perímetro interno de aproximadamente 15 km y a una distancia de 10 km de la línea de costa (Carmona et al. 2011). Presentan llanuras arenosas y lodosas, islas artificiales creadas por el dragado de canales, una salinera usada ocasionalmente, vegetación halófita (Salicornia spp. y B. maritima) y manglar en baja densidad.
La zona de Zoyata está formada por tres lagunas continuas de escasa profundidad (menor a 1 m) en la mayor parte de su extensión, presenta canales que son utilizados para la navegación de embarcaciones menores donde la profundidad es de 2 m. La vegetación está conformada por manglares y tulares. Durante la temporada de lluvias estas lagunas presentan salinidades bajas, pero conforme se drenan la salinidad aumenta.
La Polca forma parte de un sistema lagunar al que se suman La Estacada y Puerta de México, ubicada en Sinaloa. La laguna es somera de forma rectangular y con una superficie cercana a las 1 200 ha, se ubica a 7 km de la costa y tiene comunicación al mar por la Boca de Teacapán. Hacia su porción sureste se localizan mangles (R. mangle) dispersos. En la periferia de la laguna existen áreas de cultivo y palmares.
El Embarcadero los Espejos presenta una laguna estacional y una permanente. La vegetación predominante es el mangle (A. germinans y R. mangle) y la marisma (Salicornia spp.). Existen canales artificiales que facilitan el tránsito de embarcaciones menores.
Toma de datos y Análisis. El proyecto bajo el cual se realizó la toma de datos estuvo enfocado a las aves acuáticas, sin embargo, a lo largo de los recorridos se identificaron y contabilizaron todas las aves rapaces observadas. Dado que no se aplicó una metodología propia para este grupo (e.g.Fuller & Mosher 1987) existe una alta probabilidad de que los datos cuantitativos generados estén subestimados, por lo que a este respecto los análisis realizados fueron limitados, pese a lo anterior, los datos cualitativos (riquezas por tiempo y zona) son robustos y sobre estos se centran la mayor parte de los análisis y discusión.
Los nueve sitios seleccionados se visitaron mensualmente entre noviembre de 2010 y junio de 2011. En cada visita se formaron dos equipos de trabajo, uno de los cuales recorrió el sistema norte de Marismas Nacionales (La Polca) y el otro el sur (Laguna de Zoquipan), para encontrarse en Laguna Las Garzas-Chahuín (Fig. 1). Los recorridos fueron de tres tipos: lancha, automóvil y por caminatas y su uso dependió de la naturaleza del terreno. Las observaciones empezaron a las 07:00 h y terminaron a las 17:00 h, cada visita tuvo una duración de 5 días, por lo que los datos presentados representan 80 días de trabajo de campo. Las especies se identificaron utilizando diferentes guías de campo (Howell & Webb 1995, van Perlo 2006, Dunn & Alderfer 2011). Las observaciones se realizaron con binoculares (8 y 10x) y telescopio (15-60x), además se tomaron fotografías de la mayoría de las especies. Adicionalmente se realizó una visita en enero de 2012, los registros nuevos se incluyeron únicamente en el listado, sin utilizarse en los análisis.
Se presenta la lista de aves rapaces diurnas, incluido su estatus (residente, invernal, transitorio e indeterminado; Howell & Webb 1995, Iliff & Lovitch 2007) y su estatus de conservación (amenazado y protección especial; DOF 2010a). Los nombres comunes de las aves se tomaron de Escalante et al. (2014). La nomenclatura científica y el orden sistemático son los establecidos por la AOU (1998) y suplementos posteriores.
Los análisis sobre presencia-ausencia incluyeron dos pruebas de independencia X2 con dos criterios de clasificación (Siegel & Castellan 1988), en las que se determinó si la riqueza observada por mes y por zona (por separado), puede considerase independiente de estos criterios (α=0.05, en ambos casos). Además se realizaron dendrogramas de similitud, empleando el coeficiente de Sorensen (presencia/ausencia) para los ocho meses y las nueve zonas por separado (Krebs 1989, Clarke & Warwick 2001), utilizando el análisis de unión media no ponderada (Crisci & López 1983). En ambos casos se consideró el 70% de similitud como el punto de corte para integrar grupos homogéneos, porcentaje superior al 50% indicado en algunos estudios (e.g. Fay et al. 1977).
Respecto a los datos cuantitativos únicamente se estimó para cada especie el índice de importancia relativa (Gatto et al. 2005), el cual se define como IIR = 100 (Ni/Nt ) (Mi+Ei ) / (Mt+Mt ). Donde Ni es la suma de las abundancias de las especies i en los diferentes meses, Nt es la suma total de las abundancias, Mi es el número de meses donde la especie i estuvo presente, Ei es el número de sitios donde la especie i estuvo presente, Mt y Et son el número total de meses y sitios de muestreo, respectivamente (Gatto et al. 2005). Este índice pondera las frecuencias de ocurrencia temporal y espacial de cada especie con su abundancia proporcional. La suma total de los índices para un grupo determinado de especies es 100, por lo que permite una comparación interespecífica sencilla.
Resultados
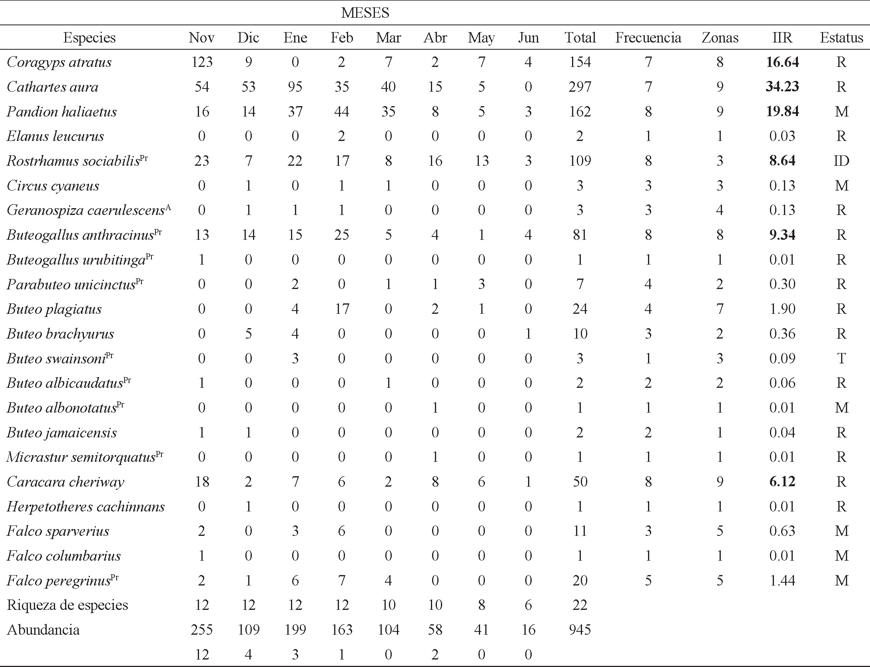
Durante ocho meses se registraron 22 especies de rapaces diurnas, de las familias Cathartidae (2 especies), Pandionidae (1), Accipitridae (14) y Falconidae (5; Cuadro 1). Para todas las especies se realizaron 945 registros (Cuadro 1), que al considerar 80 días de trabajo de campo, implicó un promedio de 11.8 aves rapaces/día. De acuerdo a la Norma Oficial Mexicana, nueve especies se encuentran listadas en la categoría de protección especial y una más como amenazada (DOF 2010a; Cuadro 1). 14 de las 22 especies fueron residentes (63%), siete migratorias (32%) y una con estatus indeterminado (5%; Cuadro 1). Esta última especie corresponde al gavilán caracolero (R. sociabilis) que presentó 109 (11.5%) registros (Cuadro 1).
Cuadro 1 Abundancia mensual de aves rapaces diurnas en Marismas Nacionales. Se indican sus registros totales, su frecuencia de ocurrencia mensual, el número de zonas en las que fueron observadas, su índice de importancia relativa (IIR) y su estatus (R = residente, M = migratorio, T = transeúnte y ID = indeterminado). Para especies en la Norma Oficial Mexicana (NOM-059) se indica su categoría al final del nombre (Pr = protección especial y A = amenazada).
A las 22 especies anteriores se adicionan cinco más que fueron registradas en enero de 2012: el Gavilán pico gancho (Chondrohierax uncinatus Temminck, 1822; 12 enero, protección especial), Gavilán de Cooper (Accipiter cooperii Bonaparte, 1828; 12 enero, protección especial), Halcón enano (Falco rufigularis Daudin, 1800; 12 enero), Gavilán pecho rufo (A. striatus Vieillot, 1808; 14 enero, protección especial) y el Aguililla ala ancha (B. platypterus Vieillot, 1823; 14 de enero, protección especial).
La riqueza específica fue dependiente del mes de observación (X2 7 = 25.2, p<0.01). Dicha variable se mantuvo estable y alta entre noviembre y febrero (12 especies), presentó valores medios en marzo y abril (10) y bajos en mayo y junio (8 y 6, respectivamente; Cuadro 1). El dendrograma de riqueza temporal agrupó los meses de invierno (diciembre a febrero), los de primavera (marzo a mayo) y con menor similitud los meses extremos, noviembre (otoño) y junio (verano; Fig. 2).

Figura 2 Dendrograma de similitud temporal. Al final de la abreviatura de los meses se indica entre paréntesis el número de especies vistas.
De forma similar a los resultados temporales, la riqueza específica tampoco pudo ser considerada independiente de la zona de observación (X2 8 = 34.2, p < 0.01). Espacialmente la riqueza fluctuó entre siete y 13 especies (Cuadro 2). La zona con mayor riqueza fue Zoquipan con 13 especies y las de menor riqueza fueron Zoyata y Los Espejos con siete especies cada una (Cuadro 2). Espacialmente el dendrograma (Fig. 3) agrupó tres zonas ubicadas en la parte central de Marismas Nacionales (La Batanga, Mexcaltitan y Los Espejos), cuatro zonas norteñas (Cañadas, Zoyata, Chumbeño y La Polca) y dos zonas que no se integraron a estos grupos, la más sureña (Zoquipan) y otra ubicada al norte del sistema (Las Garzas).
Cuadro 2 Número de registros totales por zona para las aves rapaces diurnas observadas en Marismas Nacionales. Se indica el total de registros por especie (Total). Al final de la tabla se indica la Abundancia y la riqueza totales por zona.


Figura 3 Dendrograma de similitud espacial. Al final de la abreviatura de las zonas se indica entre paréntesis el número de especies vistas.
Respecto al número de aves por salida se observan dos períodos, el de octubre a marzo con más de 100 registros por mes y el de abril a junio con una disminución notoria en éstos (Cuadro 1). Seis especies fueron las más comúnmente observadas y con los valores mayores de índice de importancia relativa (IIR); estas fueron en orden decreciente, el Zopilote aura (Cathartes aura Linnaeus, 1578; 297 registros y 34.23 IIR), el Gavilán pescador (Pandion haliaetus Linnaeus, 1578; 162 y 19.82), el Zopilote común (Coragyps atratus Bechstein, 1793; 154 y 16.64), el Aguililla negra menor (Buteogallus anthracinus Deppe, 1830; 81 y 9.34), el Gavilán caracolero (R. sociabilis; 109 y 8.64) y el Caracara quebrantahuesos (Caracara cheriway Jacquin, 1784; 50 y 6.12). Estas especies en conjunto acumularon cerca del 95% del índice de importancia relativa y poco más del 90% de los registros totales (Cuadro 1).
Con respecto a las seis especies más comunes, cuatro fueron residentes y dentro de estas, tres presentan hábitos necrófagos; una especie fue invernante y una más tiene un estatus indeterminado (Cuadro 1). La abundancia de aves rapaces varió entre las zonas, puesto que en tres de ellas se registró el 60% de los registros: Zoquipan, Mexcaltitan y Chumbeño (Cuadro 2). Este último sitio presentó 185 registros y una dominancia de especies necrófagas (91%; Cuadro 2).
Tres especies mostraron clara preferencia por alguna (s) zona (s). El 78% de los registro de la Aguililla negra menor se llevaron a cabo en Zoquipan, Mexcaltitan y Las Cañadas; el 73% de las observaciones del Gavilán pescador se realizaron en Zoquipan, Mexcaltitan y Laguna Las Garzas-Chahuín; por último el 96% de los registros del Gavilán caracolero fueron llevados a cabo en Zoquipan y Mexcaltitan (Cuadro 2).
Discusión
La riqueza registrada fue similar a lo reportado para la selva tropical de Chiapas (Ramírez-Albores 2010; 25 especies) y para la selva veracruzana (Ortiz-Pulido et al. 1995; 25 especies) y superior a los valores registrados para la selva del Ocote, Chiapas (Vázquez-Pérez et al. 2009; 16 especies), para la selva baja de Oaxaca (Vázquez et al. 2009; 11 especies) y para la sierra de Huautla, Morelos (Ramírez-Albores & Ramírez-Cedillo 2002; 16 especies). Al comparar con los registro de Sierra de Vallejo al sur de Nayarit (Figueroa-Esquivel & Puebla-Olivares 2014), la riqueza total fue semejante (27 vs 24 especies), pero en el trabajo presente se observaron especies que prefieren zonas abiertas y cuerpos de agua (como P. haliaetus y R. sociabilis); en contraste en Sierra de Vallejo se vieron especies con afinidad por bosques, como Spizaetus tyrannus Wied, 1820.
El número de especies visto en este trabajo es elevado, lo que de acuerdo a la literatura, se relaciona con dos factores; por una parte la variedad de ambientes que ofrece Marismas Nacionales y que incluyen: selva baja, manglares, planicies lodosas y campos de cultivo entre otros, esta heterogeneidad permite una mayor presencia de especies de aves en general, incluidas las rapaces (Anderson 2001). Por otra parte, la posición geográfica de Nayarit, ya que representa una zona de transición donde convergen especies rapaces del Neotrópico y del Neártico (Ferguson-Lees & Christie 2001).
Los registros del gavilán caracolero (R. sociabilis) confirman la presencia de la especie en Marismas Nacionales. Se trata de una especie tropical que basa su alimentación en caracoles dulceacuícolas (Pomacea spp. Perry, 1810), por lo que su presencia está estrechamente relacionada con la de este recurso (Sykes et al. 1995, Iliff & Lovitch 2007). En México, su distribución hasta inicios de los años noventa del siglo pasado, incluía desde la península de Yucatán hasta el centro de Veracruz, con una pequeña conexión a través del Istmo de Tehuantepec a la vertiente del Pacífico (Howell & Webb 1995). Sin embargo, recientemente se ha notado la presencia de esta especie en diferentes estados del oeste del país, se incluyen Colima, Jalisco y Nayarit (Howell 2004, Palomera-García et al. 2006, Iliff & Lovitch 2007, Hernández-Vázquez et al. 2013, Carmona et al. 2013), de hecho ya han sido registrados nidos de esta especie en Manzanillo, Colima (Palomera-García et al. 2006). Actualmente es una rapaz común en Marismas Nacionales (Carmona et al. 2013), aunque no se tienen aún evidencias de su reproducción.
Respecto al Aguililla ala ancha, es un especie que se reproduce desde la parte centro-sur de Canadá, a lo largo de los estados del este de Estados Unidos, al sur hasta Texas (Goodrich et al. 1996); en invierno, su área de presencia norteña inicia al sur de Nayarit (Howell & Webb 1995), aunque otros autores la marcan hasta Colima (Goodrich et al. 1996), independientemente de la exactitud geográfica, la parte norte de Nayarit no está incluida en dicho intervalo; por lo que este es el primer registro para Marismas Nacionales.
Las tres especies ampliamente distribuidas en tiempo y espacio correspondieron a aves necrófagas (Cathartes aura y Coragyps atratus) y al Gavilán pescador (Pandion haliaetus) y son las que presentaron los índices de importancia relativa más altos. Estas especies comparten un grado alto de tolerancia a actividades humanas, un patrón semejante se describió en la selva el Ocote, Chiapas (Vázquez-Pérez et al. 2009) y para sistemas subtropicales guatemaltecos (Vannini 1989).
Respecto a la riqueza temporal entre noviembre y febrero se presentaron números altos de especies (12), con las especies migratorias bien representadas (como B. swainsoni, F. sparverius Linnaeus, 1758 y F. peregrinus Tunstall, 1771), para las dos últimas especies se ha indicado que usan la zona para invernar (Escalante 1988, Howell & Webb 1995, Smallwood & Bird 2002). Otra especie migratoria notoria es el Aguililla de Swainson (B. swainsoni), ya que la literatura indica al noroeste de México, Nayarit incluido (e.g. Howell & Webb 1995) como un área de paso; sin embargo, recientemente se ha registrado su presencia en invierno al menos en el sur de la Península de Baja California (Rodríguez-Estrella et al. 2011) y para Marismas Nacionales (Mendoza et al. 2016), en ambos casos utiliza para su alimentación campos agrícolas.
Otro grupo temporal lo formaron los meses de primavera (marzo a mayo) con un número menor de especies y con una representación claramente a la baja de las migratorias, lo que concuerda con sus fechas de partida al norte (Ferguson-Lees & Christie 2001). En los extremos de estos períodos se ubicó noviembre, como reflejo de movimientos otoñales y junio, mes ya de verano en el que la riqueza fue muy baja. En mayo y junio sólo estuvo presente una especie migratoria, el Gavilán pescador, para la que se ha documentado el veraneo de aves juveniles y subadultas en área típicas de invernada (Henny & Van Velze 1972).
Espacialmente las nueve zonas estudiadas cubrieron prácticamente todos los ambientes naturales existentes en Marismas Nacionales. En Zoquipan los valores altos de riqueza y abundancia se relacionan con la estructura del paisaje (Hunt 1987, Vázquez-Pérez et al. 2009), dado que en el área existen bosque de manglar, profusos palmares y marismas, entre otros, los cuales además se encuentran en general poco perturbados (Berlanga-Robles & Ruiz-Luna 2006); además Zoquipan fue el único sitio que presentó registros de especies asociadas a selva como el Halcón selvático de collar (Micrastur semitorquatus Vieillot, 1817) y el Halcón guaco (Herpetotheres cachinnans Linnaeus, 1758). Por último en esta zona también se realizaron la mayor parte de los registros de Gavilán caracolero, de hecho actualmente es considerada una especie común al sur de Marismas Nacionales (Iliff & Lovitch 2007, Carmona et al. 2013).
En las Garzas-Chahuin, el segundo sitio en número de especies, fue notoria la presencia de aves con preferencia por ambientes abiertos, como el Aguililla de Swainson, el Gavilán rastrero (Circus cyaneus Linnaeus, 1766), el Milano cola blanca (Elanus leucurus Vieillot, 1818) y el Halcón peregrino (F. peregrinus). Los campos agrícolas y los extensos salitrales que bordean la laguna favorecieron la presencia de estas especies, similar a lo registrado para otros sitios, donde coinciden actividades agrícolas y áreas naturales abiertas (Collopy & Bildstein 1987, Hernández-Vázquez et al. 2000, Williams et al. 2000, Pandolfino et al. 2011).
Se ha indicado que las especies carroñeras (e.g. zopilote, caracara) son muy tolerantes a la perturbación e incluso prefieren áreas cercanas a poblados (Rodríguez-Estrella et al. 1998, Sánchez-Zapata & Calvo 1999, Zurita & Bellocq 2007, Vázquez-Pérez et al. 2009), lo que fue coincidente con las observaciones presentes, puesto que estas especies fueron particularmente comunes y abundantes en los sitios con ambientes modificados como Chumbeño y la Polca.
La escasa información existente dificulta comparar los resultados presentes para poder evaluar cambios eventuales en la composición de las especies de aves rapaces en Marismas Nacionales. Sin embargo, este trabajo registró una de las mayores riquezas indicadas para el país, por lo que es prioritario establecer planes de monitoreo que permitan detectar modificaciones de la estructura comunitaria ante la pérdida o modificación del hábitat en la región.











 nova página do texto(beta)
nova página do texto(beta)


