Introducción
Por la gran superficie de zonas boscosas que hay en México se ha generado en una amplia tradición forestal (SEMARNAT, 2000). En tiempos recientes, varias empresas forestales han generado un plan de manejo forestal certificado por el Consejo Mundial de Manejo Forestal (FSC), lo que adiciona a sus productos mayor valor y facilidad para entrar en los mercados internacionales (Merino & Segura, 2002). La aplicación de los programas de manejo forestal, independientemente de que cuenten con un certificación nacional o internacional, conlleva una afectación en la abundancia y riqueza de especies al ocasionar una alteración y transformación de la estructura física del bosque (e.g. Greenberg et al., 1994; Rodríguez-Rivera, 2014; Domínguez, 2015). Cabe señalar que los bosques son un importante reservorio de recursos biológicos, por lo que su aprovechamiento genera una modificación de la estructura de la vegetación, de las condiciones ambientales del bosque (Chen et al., 1999; Zheng et al., 2000) y también afecta la composición y estructura de la comunidad faunística (Theenhaus & Schaefer, 1995; Thompson et al., 1995; Annand & Thompson, 1997). El efecto del manejo forestal en los anfibios y reptiles no es del todo claro. Por ejemplo, se ha reportado una pérdida en riqueza de especies (Vesely & McComb, 2002), un incremento de la riqueza de anfibios (Lemckert, 1999) y de reptiles (Vonesh, 2001; Fredericksen & Fredericksen, 2002) y se ha reportado un recambio en la composición hepertofaunística entre zonas manejadas y conservadas en los bosques templados (Hanlin et al., 2000) y bosques sub-tropicales (e.g. Kanowski et al., 2006; Gardner et al., 2007).
En los bosques de Ixtlán de Juárez, no se han evaluado las consecuencias del manejo forestal sobre las especies de anfibios y reptiles, pero se sabe que la alteración del hábitat ocasiona una pérdida espacial y temporal que impacta diferencialmente a los seres vivos que lo habitan (Johnson & Cabarle, 1993; Murcia, 1995; Carvajal-Cogollo et al., 2008; Cabrera-Guzmán & Reynoso, 2012). Este fenómeno requiere mayor atención dado que Oaxaca también es reconocido por tener el mayor número de especies de vertebrados mesoamericanos y especies endémicas de México (Flores-Villela, 1993; Juárez-López et al., 2006; Ordoñez & Rodríguez, 2008; Mata-Silva et al., 2015). En la actualidad se reconocen 442 especies de herpetozoos, de los cuales 149 son anfibios y 293 son reptiles (Mata-Silva et al., 2015). La región donde se ubica la comunidad estudiada en este trabajo pertenece a la Sierra de Juárez, área considerada como un reservorio de una amplia diversidad biológica (Mittermeier & Goettsch de Mittermeier, 1992; Challenger, 1998; Zacarías-Eslava & Del Castillo, 2010). Por lo tanto es necesario evaluar la composición, diversidad, riqueza y abundancia de especies en los grupos de anfibios y reptiles presentes en hábitats sujetos a manejo forestal, como son los bosques de la comunidad de Ixtlán de Juárez.
El presente estudio tiene como objetivos: (1) Identificar la composición de especies de anfibios y reptiles de la comunidad de Ixtlán de Juárez, (2) Determinar y comparar el efecto que tiene el manejo forestal sobre la diversidad, riqueza y abundancia de reptiles y anfibios.
Materiales y métodos
La comunidad de Ixtlán de Juárez se localiza a una altitud promedio de 2,030 msnm (PDISP, 2005), en las coordenadas geográficas: 17°17´y 17°41´de latitud norte y los meridianos 96°07´y 96°32´ de longitud oeste (Fig. 1). La comunidad cuenta con una superficie territorial de aproximadamente 19,492.44 ha, de las cuales 11,896.2 ha son consideradas como aptas para el manejo forestal de clima templado-frío. La temporada de lluvia se extiende de abril a noviembre. La precipitación promedio de lluvia es de 2000 mm anuales. En el área hay tanto corrientes de agua permanente como temporales. Las áreas que se encuentran entre los 1500 a los 3200 msnm, tienen un clima predominantemente templado. La vegetación en esta zona es bosque de pino-encino y bosque de encino-pino (SmartWood, 2002). Específicamente, el área de estudio se localiza en el paraje localizado entre los 17°35' 68" y 17°35'32" de latitud norte y los meridianos 96°48'28" y 96°47'46" de longitud oeste a una elevación promedio de 2000 msnm.
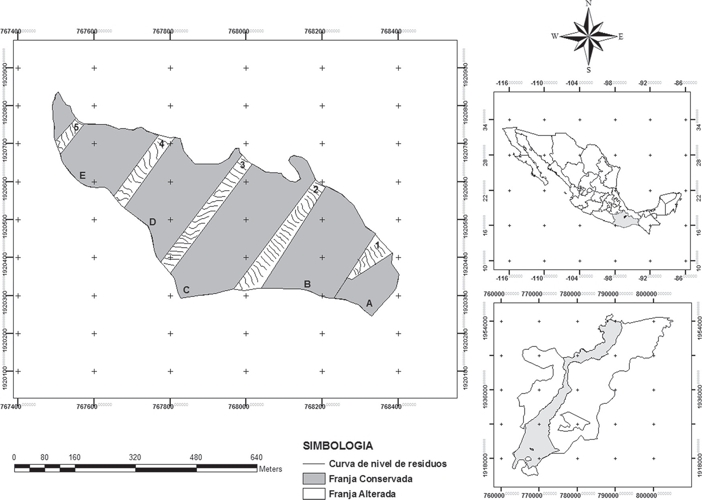
Figura 1 Recuadro superior derecho muestra la ubicación geográfica del distrito de Ixtlán de Juárez dentro del estado de Oaxaca; el recuadro inferior derecho muestra la ubicación del municipio de Ixtlán dentro del distrito de Ixtlán de Juárez; el recuadro izquierdo muestra la zona del bosque de manejo forestal dentro del municipio; los árboles predominantes en la zona son Pinus spp., Quercus spp., Alnus spp., Arbutus spp., Baccharis spp., Crateagus spp. y Cestrum spp. (Vásquez-Cortez, 2013).
El estudio se realizó en tres sitios con diferentes características estructurales: 1) áreas manejadas donde se aplicó el tratamiento de matarrasa en franja (FA); 2) áreas con bosque sin manejo en los últimos 30 año, y adyacentes a las zonas de matarrasa; estas áreas tendrán la función de sitio control (FC); y 3) áreas modificadas para uso agrícola (AM). Los sitios de FA y FC se ubicaron en la zona de bosque con manejo forestal (BMF). El BMF fue aprovechado para la extracción de madera en el año 2010 y tuvo un proceso de aclareo de hierbas en el año 2011 acorde al programa de manejo forestal de la comunidad (2003-2012). En las figuras 2a y 2b se muestran los cambios en la cubierta vegetal a causa del manejo forestal realizado durante el período 2008 al 2011. Los sitios de colecta de la AM estuvieron a 2.5 kilómetros del BMF; estas áreas fueron modificadas para uso agrícola hace más de medio siglo y tienen características de suelo, clima y vegetación similares entre sí.

Figura 2 Imágenes aéreas de la zona de estudio manejo forestal. A) Año 2008 previa al proceso de extracción de madera por el método de matarrasa en franja, B) Año 2011 después del proceso de extracción de madera por el método de matarrasa en franja.
El BMF tiene una extensión estimada de 24.2 ha (Fig. 1). Dentro de esta zona se seleccionaron cinco franjas de bosque con tratamiento de matarrasa en franjas (A:146 × 100.4 m; B:247.1 × 177.7 m; C:421.3 × 157.6 m; D:243.1 × 165.8 m; E:171.6 × 180.4 m) y cinco franjas (1:129 × 49 m; 2:345.1 × 52.7 m; 3:356.2 × 40.9 m; 4:211.7 × 40.8 m; 5: 86.4 × 30.4 m) en sitios control (FC). El área total en las franjas del bosque manejado (FA) fue de 4.47 has, mientras que el área de las franjas con vegetación (FC) fue de 19.73 has. Ambos sitios se encuentran a una altitud aproximada de 2570 msnm, con características climáticas y orográficas similares. Los árboles predominantes en la zona de estudio son Pinus spp. Quercus spp., Alnus spp., Arbutus spp., Baccharis spp., Crateagus spp. y Cestrum spp. principalmente (Vásquez-Cortez, 2013).
Durante los meses de enero a julio de 2011 dos personas realizaron 22 recorridos buscando, de manera intensiva, anfibios y reptiles. Todos los individuos fueron capturados manualmente o con ganchos herpetológicos. Los sitos revisados con mayor cuidado fueron la base de los árboles, troncos caídos, debajo de rocas y entre bromelias. El muestreo se realizó entre las 08:00 y las 18:00 hrs (Vite-Silva et al., 2010). Los ejemplares capturados fueron fotografiados e identificados taxonómicamente hasta el nivel de especie siguiendo las claves y descripciones herpetológicas especializadas de Köhler (2010), Pérez-Higareda et al. (2007), Wilson & Townsend (2007), Goyenechea & Flores-Villela (2006), Rossman & Burbrink (2005), Flores-Villela et al. (1995), Rossman et al. (1996), Campbell & Frost (1993), Casas-Andreu & McCoy (1987), Smith & Taylor (1950), Smith & Taylor (1948), Smith & Taylor (1945). A partir de la Norma Oficial Mexicana (NOM-059-SEMARNAT-2010), publicada en el Diario Oficial de la Federación (2010), y la legislación internacional (UICN) se identificaron las especies prioritarias de anfibios y reptiles. En el laboratorio de Estudios Ambientales de la Universidad de la Sierra Juárez (UNSIJ) los individuos fueron sacrificados por hipotermia, fijados con formaldehido al 10% y conservados en alcohol al 70%. Cada individuo fue etiquetado e ingresado a la base de datos de la colección de anfibios y reptiles (ICAH) localizada en la Universidad de la Sierra Juárez (Permiso de colecta SEMARNAT 08577/12).
Mediante el programa PRIMER 6 & PERMANOVA+.lnk (Clarke & Gorley, 2006), se aplicaron los índices de Margalef, Simpson, Shannon y Jaccard para estimar la riqueza, dominancia, equidad y similitud de especies (Magurran, 1988; Margalef, 1995; Moreno, 2001; Del Río et al., 2003) para cada área de trabajo. La cantidad de especies en el área fue calculada a través del índice no paramétrico Jacknife 1 el cual se basa en el número de especies únicas (Moreno, 2001). La pendiente y ordenada al origen de la curva fue calculada a partir de la ecuación de Clench (Soberón & Llorente, 1993). Mediante el programa PRIMER 6 & PERMANOVA+.lnk (Clarke & Gorley, 2006) se generaron curvas de acumulación de especies-área para el AM, y debido al bajo número de especies en las áreas FA y FC, el análisis se realizó de manera conjunta para el área del BMF.
Resultados
En Ixtlán de Juárez, la herpetofauna registrada a partir de las colectas realizadas en las áreas de estudio (AM, FA y FC) fue de 37 especies (32 reptiles y cinco anfibios), divididos en 11 familias y 25 géneros (Cuadro 1). El Área de manejo (AM) mostró diferencias significativas en la riqueza de especies (X 2 = 23.45, P = 0.05) y un porcentaje mayor de ocurrencia de especies exclusivas (60%, n = 22), con respecto a las franjas alteradas (FA = 22%) y franjas conservadas (FC = 50%) del bosque manejado.
Cuadro 1 Riqueza específica de anfibios y reptiles en Ixtlán de Juárez, Oaxaca. IJ = Ixtlán de Juárez, AM = Área Modificada (por agricultura y asentamientos humanos); FA = Franja Alterada (con manejo forestal); FC = Franja Conservada (con vegetación y sin manejo).
| Áreas de estudio | IJ | AM | FA | FC | IJ | AM | FA | FC | IJ | AM | FA | FC | IJ | AM | FA | FC |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Orden | Familia | Género | Especie | Porcentaje de especies | ||||||||||||
| Caudata (salamandra) | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 2.70 | 0 | 0 | 2.70 |
| Anura (ranas y sapos) | 2 | 2 | 1 | 0 | 3 | 3 | 1 | 0 | 4 | 3 | 1 | 0 | 10.81 | 8.11 | 2.70 | 0 |
| Squamata (sauria) | 4 | 4 | 3 | 2 | 8 | 7 | 3 | 4 | 13 | 10 | 4 | 6 | 35.14 | 32.25 | 10.81 | 16.2 |
| Squamata (serpientes) | 3 | 3 | 1 | 1 | 12 | 11 | 4 | 1 | 18 | 17 | 4 | 1 | 48.65 | 54.83 | 10.81 | 2.70 |
| Testudines | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 2.70 | 2.70 | 0 | 0 |
| TOTAL | 11 | 10 | 5 | 4 | 25 | 22 | 8 | 6 | 37 | 31 | 9 | 8 | 100 | 97.90 | 24.32 | 21.60 |
En el AM se registraron 28 especies de reptiles y tres especies de anfibios. En el bosque de manejo forestal (BMF) se tienen representantes de 13 especies de reptiles y dos de anfibios, siendo el suborden sauria el grupo más abundante (Cuadros 1 y 2). Las especies compartidas entre el BMF y el AM fueron: Sceloporus formosus (Wiegmann, 1834), Barisia imbricata imbricata (Wiegmann, 1828), Barisia imbricata planifrons (Bocourt, 1878), Abronia oaxacae (Günther, 1885), Plestiodon brevirostris (Günther, 1860), Salvadora intermedia (Hartweg, 1940), Thamnophis lineri (Rossman & Burbrink, 2005), Conopsis megalodon (Taylor & Smith, 1942) y Geophis dubius (Peters, 1861). Seis especies estuvieron únicamente presentes en el BMF, encontrándose nueve en las FA y ocho en las FC. Dentro de BMF, las especies presentes tanto en las FA como en las FC fueron S. formosus y B. imbricata planifrons (Cuadros 3 y 4).
Cuadro 2 Número estimado de especies estimado en el área de estudio, Ixtlán de Juárez, Oaxaca. IJ = Ixtlán de Juárez, AM = Área Modificada (por agricultura y asentamientos humanos); BMF = Bosque de Manejo Forestal (FA = Franja Alterada (con manejo forestal); FC = Franja Conservada (con vegetación y sin manejo)).
| Sitio | Especies observadas | Índice de Jacknife 1 | Porcentaje de especies obtenida |
|---|---|---|---|
| IJ | 37 | 48.58 | 76.16 |
| AM | 31 | 37.75 | 82.11 |
| BMF (FA+FC) | 15 | 21.68 | 69.18 |
Cuadro 3 Índices de diversidad calculados para las diferentes áreas de estudio, Ixtlán de Juárez, Oaxaca. AM = Área Modificada (por agricultura y asentamientos humanos); FA = Franja Alterada (con manejo forestal); FC = Franja Conservada (con vegetación y sin manejo).
| Parámetros ecológicos | AM | FA | FC |
|---|---|---|---|
| Riqueza | 31 | 9 | 8 |
| Diversidad (Margalef) | 6.15 | 1.46 | 1.59 |
| Dominancia (Simpson) | 0.04 | 0.73 | 0.38 |
| Equidad (Shannon) | 3.25 | 0.65 | 1.18 |
Cuadro 4 Lista de especies de anfibios y reptiles registradas en Ixtlán de Juárez, Oaxaca, se incluye la categoría de riesgo y endemismo (de acuerdo a la NOM-059-ECOL-2010). AM = Area Modificada, BMF = Bosque de Manejo Forestal (FA = Franja Alterada, FC = Franja Conservada), + presencia, A = Amenazado, Pr = Prioritario, En = endémica.
| Sitios de muestreo | Categoría de riesgo | Endemismos | |||||||
|---|---|---|---|---|---|---|---|---|---|
| BMF | |||||||||
| Familia | Género | Especie | AM | FA | FC | A | Pr | México | Oaxaca |
| Phrynosomatidae | Sceloporus | S. formosus (Wiegmann, 1834) | + | + | + | ||||
| S. grammicus microlepidotus (Wiegmann, 1828) | + | ||||||||
| S. horridus horridus (Wiegmann 1939) | + | ||||||||
| S. aureolus (Smith, 1942) | + | ||||||||
| Phrynosoma | P. braconnieri (Dumeril y Bocourt, 1870) | + | Pr | En | En | ||||
| Anguidae | Gerrhonotus | G. liocephalus (Wiegmann, 1828) | + | ||||||
| Barisia | B. imbricata imbricata (Wiegmann, 1828) | + | + | Pr | |||||
| B. imbricata planifrons (Bocourt, 1878) | + | + | + | Pr | En | ||||
| Abronia | A. oaxacae (Günther, 1885) | + | + | Pr | En | ||||
| Mesaspis | M. juarezi (Karges y Wright, 1987) | + | A | Pr | En | En | |||
| M. gadovii (Boulenger, 1913) | + | A | Pr | En | |||||
| Scincidae | Plestiodon | P. brevirostris (Günther, 1860) | + | + | En | ||||
| Dactyloidae | Anolis | A. quercorum (Fitch, 1978) | + | ||||||
| Colubridae | Pituophis | P. lineaticollis (Cope, 1861) | + | ||||||
| Salvadora | S. intermedia (Hartweg, 1940) | + | + | Pr | En | ||||
| Thamnophis | T. chrysocephalus (Cope, 1885) | + | A | En | |||||
| T. cyrtopsis (Kennicott, 1860) | + | A | |||||||
| T. lineri (Rossman y Burbrink, 2005) | + | + | |||||||
| T. godmani (Liner, 1994) | + | A | En | ||||||
| Conopsis | C. megalodon (Taylor y Smith, 1942) | + | + | En | |||||
| Trimorphodon | T. tau (Cope, 1870) | + | A | ||||||
| Geophis | G. dubius (Peters, 1861) | + | + | ||||||
| Rhadinaea | R. fulvivittis (Cope, 1875) | + | Pr | En | |||||
| R. taeniata (Peters, 1863) | + | ||||||||
| Lampropeltis | L. triangulum oligozona (Lacepede, 1788) | + | |||||||
| Leptodeira | L. septentrionalis polysticta (Günther, 1895) | + | A | ||||||
| Leptophis | L. mexicanus (Duméril, Bibron y Duméril, 1854) | + | Pr | ||||||
| Viperidae | Crotalus | C. molossus (Baird y Girard, 1853) | + | ||||||
| C. intermedius (Troschel, 1865) | + | Pr | |||||||
| C. ravus (Cope, 1865) | + | A | En | ||||||
| Elapidae | Micrurus | M. browni (Schmidt y Smith, 1943) | + | A | En | ||||
| Kinosternidae | Kinosternon | K. integrum (Le Conte, 1824) | + | Pr | En | ||||
| Hylidae | Hyla | H. euphorbiacea (Günther, 1858) | + | Pr | |||||
| Plectrohyla | P. bistincta (Cope, 1877) | + | A | En | |||||
| Bufonidae | Incilius | I. spiculatus (Mendelson, 1997) | + | A | En | ||||
| I. occidentalis (Camerano, 1879) | + | Pr | En | ||||||
| Plethodontidae | Thorius | T. c.f insperatus (Hanken y Waken, 1994) | + | Pr | |||||
La curva de acumulación obtenida con base en el estimador de Jacknife 1 mostró una tendencia asintótica en Ixtlán de Juárez (Fig. 3a) y para las AM (Fig. 3b), por lo que se estima que en el área potencialmente se pueden encontrar 49 especies de anfibios y reptiles, teniendo hasta el momento sólo el 76% de la riqueza herpetofaunística para Ixtlán de Juárez; para la AM la riqueza de especies estimada fue de 38 y para el BMF la riqueza estimada fue de 22 (Fig. 3c, Cuadro 2).
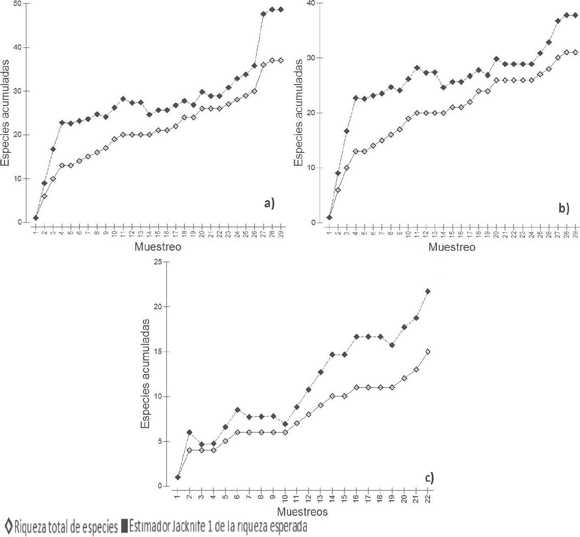
Figura 3 Curva de acumulación de especies. A) Ixtlán de Juárez, B) Área Modificada y C) Bosque de Manejo Forestal.
El índice de Margalef mostró menor diversidad de especies en las FA y FC del BMF, siendo mayor en las AM. El comportamiento de la dominancia fue diferente, siendo mayor en la FA que en la FC; la menor dominancia de herpetozoos se registró en las AM. Las especies más dominantes en el BMF fueron las lagartijas de las especies S. formosus, B. i. planifrons y P. brevirostris, y la salamandra Thorius cf. insperatus (Hanken & Waken, 1994). El índice de equidad fue mayor, siendo más uniforme la distribución de las especies en las AM. Dentro del BMF el valor de equidad en la distribución de las especies fue mayor en FC que en FA (Cuadro 3).
A partir del coeficiente de similitud de Jaccard, el cual considera la riqueza específica de cada zona de estudio, se determinó que la FA y el AM son las áreas que más se parecen (0.2), compartiendo las siguientes especies: S. formosus, B. i. imbricata, B. i. planifrons, P. brevirostris, S. intermedia, T. lineri y C. megalodon. A pesar de la cercanía entre la FC y la FA, el valor de similitud fue menor (0.13), sólo compartieron las especies S. formosus y B. i. planifrons. Las áreas que menos se parecen son la FC y la AM (0.11), que tuvieron en común a las especies S. formosus, B. i. planifrons, A. oaxacae y G. dubius.
En el BMF se encontraron nueve especies endémicas: B. i. planifrons, A. oaxacae, Mesaspis juarezi (Karges & Wright, 1987), Mesaspis gadovii (Boulenger, 1913), P. brevirostris, S. intermedia, C. megalodon, Rhadinaea fulvivittis (Cope, 1875), Incilius spiculatus (Mendelson, 1997). En esta misma área las especies B. i. imbricata, B. i. planifrons, A. oaxacae, M. juarezi, M. gadovii, S. intermedia, C. megalodon, R. fulvivittis, I. spiculatus, T. cf insperatus están en alguna categoría de riego (Cuadro 4). Del total de especies registradas para IJ, 17 son endémicas y 23 se encuentran en alguna categoría de riesgo. Dentro del AM se obtuvieron 13 especies endémicas y 18 en alguna categoría de riesgo (Cuadro 4).
Discusión
Un capital natural importante y necesario de cuantificar es la fauna natural presentes en zonas de alta diversidad, pero con pocos estudios faunísticos como es la región de la Sierra de Juárez, Oaxaca. El inventario taxonómico de la herpetofauna realizado en Ixtlán de Juárez permitió identificar la comunidad herpetofaunística en sus áreas de agricultura (AM), zonas de manejo forestal con tratamiento de matarrasa en franja (FA) y en las áreas forestales con vegetación natural (FC). La riqueza de 37 especies obtenidas (32 reptiles y 5 anfibios), representa el 8.37% de la herpetofauna a nivel estatal (Mata-Silva et al., 2015) y el 76% del ensamble herpetofaunístico para la región. El porcentaje de especies registradas en este trabajo es cercano al 80% que Soberón & Llorente (1993) sugieren como válidos para representar la riqueza de una comunidad. En particular, nuestro método de muestreo ha permitido estimar entre 65.3% y 87% de las especies de serpientes que han sido descritas para la región; cabe señalar que los individuos de este grupo son considerados como difíciles de registrar (Urbina-Cardona, 2007). Sin embargo, para aumentar la riqueza de este inventario se necesita realizar un mayor esfuerzo de colecta, particularmente hacia las especies con alta afinidad a un tipo de hábitat, como son los anfibios (Vonesh et al., 2010) y hacia las especies menos abundantes, como son las serpientes (Dodd Jr., 1993). Estas especies podrían ser encontradas en el BMF, que es también la zona donde las curvas de acumulación de especies generadas no mostraron un comportamiento asintótico.
La riqueza específica estimada en la FA fue de nueve especies y ocho en la FC. La FC presentó mayor diversidad de organismos pero fue una zona en donde la dominancia de individuos fue menor en comparación con la FA (Cuadro 3). La diferencia en representatividad de especies entre las zonas alteradas (AM y FA) y conservadas (FC) observada en este trabajo concuerdan con lo registrado por Ríos-López & Aidé (2007) en bosques secundarios de Puerto Rico y por Urbina-Cardona et al. (2006) en fragmentos de selva tropical en los Tuxtlas, Veracruz. En estos trabajos los autores han concluido que la modificación del hábitat tiene un efecto negativo sobre las poblaciones de anfibios y reptiles debido tanto a las diferencias en condiciones térmicas (espaciales y temporales) que existe en estas áreas, como a los cambios en los patrones conductuales de cada especie; los cuales se ven modificados en relación a la presencia de hábitats idóneos ya sea para termorregular o para alimentarse (Shine, 1987; Reinert & Zappalorti, 1988; Blouin-Demers & Weatherhead, 2001; González-García et al., 2009; Harvey & Weatherhead, 2010).
En el presente trabajo, el ensamble de la comunidad herpetofaunística que se observó tanto en las AM, como en el BMF (en el que están incluidas las FA y FC) no puede ser asociada a un tipo de variable específico, sin embargo, se ha documentado que en áreas abiertas similares a las FA y AM existe una mayor variabilidad en el mosaico climático, e.g. temperatura y humedad (Hertz et al., 1993), creando nuevos microhábitats (terrazas de vegetación muerta, vegetación herbácea, pastos, entre otros) y promoviendo tanto el desplazamiento como la recolonización de algunas especies (Cortes-Ávila & Toledo, 2013; Del Río et al., 2003; Hanski, 1994), pero a la vez afectando e inhibiendo la presencia de especies menos tolerantes a la desecación, tales como los anfibios (Toft, 1985; Tejedo et al., 2012). Por otro lado, es muy posible que la diferencia en diversidad registrada entre las áreas de bosque conservado (FC) y las áreas perturbadas (FA y AM) no sólo sea consecuencia de la diferencia estructural de los hábitats, sino también a la facilidad de avistar y atrapar a los organismos en las áreas perturbadas, añadido a la capacidad que tienen estos organismos de acoplarse a los cambios en las variables bióticas y abióticas debido a la fragmentación en sus microhábitats (Urbina-Cardona et al., 2008; Cortés-Ávila & Toledo, 2013).
Los resultados de diversidad en las áreas modificadas (AM) y las franjas alteradas (FA) tienden a ser diferentes a las franjas conservadas (FC) contiguas, en donde las condiciones climáticas como son la temperatura y la humedad, permanecen más constantes al haber un dosel más cerrado; en esta zona, el dosel superior llega a ser tan denso que filtra la mayor cantidad de rayos solares, lo que provoca también una inhibición en el crecimiento de nuevas plantas en el sotobosque y se genera una capa gruesa de materia orgánica. Por otro lado, las AM y FA tienden a ser zonas abiertas con mayor fluctuación de la temperatura y con una capa delgada de materia orgánica.
A pesar de que las zonas de AM y FA son estructuralmente diferentes a las FC, todavía hay interconectividad entre las tres zonas; pero el periodo transcurrido entre la perturbación en la FA y la transformación de las zonas forestales a campos de cultivo (AM) es mayor en esta última, por lo que se esperaba un mayor número de especies compartidas entre las FC y las FA. Las especies registradas tanto en las FA como en las AM pueden ser consideradas dentro del grupo de la herpetofauna tolerante a la modificación del hábitat (García et al., 2007; Cortés-Ávila & Toledo, 2013), esta capacidad de tolerar los cambios en el medio se ha utilizado para evaluar el estado de perturbación del bosque (Kühn & Klotz, 2006; Calderón-Mandujano et al., 2008; Betancourth-Cundar & Gutiérrez-Zamora, 2010).
Las especies presentes solamente en el BMF fueron: S. grammicus microlepidotus, B. i. planifrons, M. viridiflava, M. juarezi, R. fulvivitis e I. spiculatus, estas especies a pesar de no presentar sensibilidad a los cambios ambientales muestran un alto grado de especificidad en el uso de microhábitats (Boada et al. 2008), lo que limita su presencia en las áreas modificadas. Por ejemplo, en el bosque con manejo forestal se registraron dos especies de anfibios; en la FA se registró a I. spiculatus y en la FC a T. cf. insperatus. De las dos especies, Incilius spiculatus parece poseer una mayor capacidad para soportar la variabilidad ambiental presente en áreas modificadas (Vargas & Castro 1999). Por otro lado, T. cf. insperatus es una especie con una tasa de dispersión muy baja (García-Vázquez et al., 2006; Wake, 2009) y solamente habita áreas con alta cobertura vegetal (entre la hojarasca, musgo y troncos podridos) como los presentes en las FC. La cobertura vegetal genera una estabilidad ambiental y evita que la radiación solar incida directamente sobre el sotobosque, haciendo posible que haya mayor humedad y temperaturas estables en comparación con las zonas destinadas al aprovechamiento forestal (Urbina-Cardona & Londoño-Murcia, 2003; Betancourth-Cundar & Gutiérrez-Zamora, 2010; Martínez-Baños et al., 2011; Cortés-Gómez et al., 2013).
En similitud con Urbina-Cardona et al. (2008), Vidaurre et al. (2008) y Ugalde-Lezama et al. (2010), se considera que las especies dependientes del bosque pueden ser un reflejo de la estabilidad natural del hábitat ante los distintos niveles de perturbación; por lo que, en el bosque de manejo forestal, la aplicación de tratamientos silvícolas pueden ser promotoras de un desequilibrio en la comunidad herpetofaunística que puede generar un cambio en la abundancia de las especies a largo plazo y propiciar indirectamente una inestabilidad de la dinámica y diversidad herpetofaunística, lo que podría generar una drástica disminución espacial y temporal de las especies con baja habilidad de adaptación y dispersión (Sosa, 2008; Promis et al., 2010). Con base en la abundancia y riqueza de las especies en el BMF se puede considerar que la comunidad herpetofaunística es relativamente estable y sus especies aún pueden coexistir (Miñano et al., 2003; Ugalde-Lezama et al., 2010).
En términos generales, no cabe duda que se ha logrado avanzar en las técnicas silvícolas que promueven un manejo forestal sostenible desde los puntos de vista económico, político y social (FAO, 1993). Por otro lado la importancia de trabajar en áreas con manejo forestal y áreas con una alta actividad antropogénica, sirven para evidenciar la presencia de especies con alta especificidad de microhábitats, ya que el conocimiento que se tiene sobre el efecto que dicho manejo tiene sobre la biodiversidad es incompleto. El plan de manejo que lleva a cabo la comunidad forestal de Ixtlán implica no talar cerca de 7026 ha (considerando áreas forestales segregadas y áreas de protección de cauces; FSC, 2001). Actividades como estas indudablemente disminuyen los efectos de deforestación y degradación del hábitat. Finalmente, aún y con esta regulación en el manejo se hace todavía necesario continuar con el monitoreo y recopilación de información biológica en las comunidades de anfibios y reptiles presentes en las zonas forestales del país.











 nueva página del texto (beta)
nueva página del texto (beta)


