Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.29 no.3 Xalapa dic. 2013
Artículos originales
Diversidad de microartrópodos (ácaros y colémbolos) de musgos corticícolas en la selva baja de Nicolás Bravo, Quintana Roo
Microarthropods diversity (mites and springtails) from corticolous moss in the floodable lowland Nicolás Bravo, Quintana Roo
Wendy P. VÁRGUEZ-NOH & Leopoldo Q. CUTZ-POOL
Instituto Tecnológico de Chetumal. Departamento de Ingeniería Química y Bioquímica. Av. Insurgentes No. 330. C. P. 77013. Chetumal Quintana Roo, México. Tel. (983) 83 2 23 30. <priscila_ varguez@outlook.com>, <cutzpool@yahoo.com>
Recibido: 15/05/2013;
aceptado: 14/08/2013.
RESUMEN
Se compara la diversidad de los microartrópodos (ácaros y colémbolos) en musgos corticícolas de una selva baja inundable de Nicolás Bravo, Quintana Roo, para las temporadas de secas, lluvias y nortes de 2011. Se registraron 28 familias de microartrópodos corticícolas, entre las cuales Galumnidae (52.36%), Isotomidae (10.45%) y Scheloribatidae (9.68%) fueron las más abundantes, representando el 72%, además que mostraron su máxima abundancia en la temporada de lluvias. Se determinó que hay una variación temporal en la densidad de microartrópodos (F (2,27) = 10.62, p<0.05); la mayor densidad se encontró en la temporada de lluvias. La mayor diversidad se registró entre la temporada de secas y nortes. La mayor similitud se observó entre las temporadas de lluvias y nortes (71.58%). Para las familias Isotomidae, Phytoseiidae, Trombididae, Scheloribatidae y Galumnidae se encontró una correlación positiva entre la humedad del musgo y las densidades, mientras que la densidad de Anystidae y Caeculidae mostraron una correlación negativa con la humedad del musgo.
Palabras clave: Abundancia, Acarida, Collembola, diversidad, musgo, riqueza.
ABSTRACT
The diversity of microarthropods (mites and springtails) in corticolous moss was compared in the floodable lowland Nicolás Bravo, Quintana Roo, included six sampling, carried out in dry, rainy and north season of 2011. 28 families of microarthropods from corticolous moss were recorded, among which the Galumnidae (52.36%), Isotomidae (10.45 %) and Scheloribatidae (9.68%) families were the most abundant, making up 72%, further that showed their maximum abundance at rainy season. There was temporal variation in the density of microarthropods (F (2, 27) = 10.62, p<0.05); the highest density was found at rainy season. The highest diversity was recorded between dry and north season.
The highest similarity was observed between rainy and north season (71.58%). For the families Isotomidae, Phytoseiidae, Trombididae, Scheloribatidae and Galumnidae there was a positive correlation between moisture from moss and density while the density of Anystidae and Caeculidae was negatively correlated with moss moisture.
Key words. Abundance, Acarida, Collembola, diversity, moss, richness.
INTRODUCCIÓN
Las briofitas establecen microambientes muy favorables que son aprovechados por otros organismos como bacterias, algas, hongos, protozoarios, rotíferos, nemátodos, anélidos, pequeños moluscos, tardígrados y numerosos artrópodos, entre los que se encuentran los ácaros; estos últimos son precisamente los habitantes más numerosos y variados, seguidos por los colémbolos, mismos que pueden presentar la mayor frecuencia (Santos 1991; Hoffmann & Riverón 1992; Cutz-Pool et al. 2008a; Gasca & Higuera 2008).
Los ácaros constituyen un grupo numeroso de animales de dimensiones pequeñas caracterizados, principalmente, por una asombrosa capacidad para adaptarse a cualquier ambiente que les ofrezca protección, alimento, humedad o algún otro elemento importante para su supervivencia por lo que son más frecuentes y abundantes en los musgos húmedos del suelo y en los que se establecen sobre árboles y rocas (Hoffmann & Riverón 1992).
Los colémbolos son organismos principalmente fungívoros y detritívoros, ya que se alimentan principalmente de hifas de hongos y detritos orgánicos; junto con los nemátodos son los principales agentes biocontroladores de las poblaciones microbianas (Iraola 2001; Jeffery et al. 2010). Son muy sensibles a la desecación y juegan un papel importante en el ciclo de nutrientes, también tienen importancia en la fertilización de los musgos según algunos experimentos (Jeffery et al. 2010).
Las investigaciones de Cutz-Pool et al. (2008a, 2010a) sobre los microartrópodos en los musgos han reportado que las fechas de muestreo influyen en la riqueza, densidad o abundancia de organismos que se encuentran en las briofitas, y que los órdenes de la Clase Acarida (Hoffmann 1988) se encuentran abundantes para este tipo de microhábitat.
En México existen pocas investigaciones sobre riqueza y abundancia de Acarida y Collembola en briofitas (Palacios-Vargas 1985; Mejía-Recamier & Cutz-Pool 2007; Cutz-Pool et al. 2008b, 2010b, 2011, 2012). El objetivo del presente trabajo es realizar un estudio sobre la comunidad de ácaros y colémbolos que habitan los musgos de la corteza de árboles en una selva baja inundable de Nicolás Bravo, Quintana Roo durante tres temporadas: secas, lluvias y nortes, determinando si existe una relación entre las densidades de los microartrópodos con los factores físicos (temperatura y humedad de musgo).
MATERIALES Y MÉTODOS
Área de estudio. El estudio se realizó en la selva baja inundable (S.B.I.) (18° 28' 73'' N; 89° 03' 50.2" W) ubicada en el ejido de Nicolás Bravo, en el municipio de Othón P. Blanco, Quintana Roo. El clima es cálido subhúmedo con un régimen de lluvias de verano-intermedio y un alto porcentaje de lluvia invernal y presencia de sequía de medio verano, Ax' (w1) (i1) gw'' de acuerdo con la clasificación de Köppen modificada por García (1973). El suelo corresponde al tipo gleysol (INEGI 1984), con un alto contenido de arcilla (58%) por lo que existen problemas en el drenaje interno y superficial, llegando a anegarse hasta 50 cm o más en la temporada de lluvia. La vegetación está constituida por árboles que en su mayoría no sobrepasan los 10 m de altura, presentan troncos retorcidos y muchos de ellos presentan espinas (Tun-Dzul 2007).
Muestreo. Se muestreó durante los meses de abril-mayo para la temporada de secas, julio-agosto para lluvias y octubre-noviembre del 2011 para los nortes. El muestreo que se realizó fue sistemático estableciendo un cuadrante de 40 x 40 m (1,600 m2), dentro del cual se delimitaron cinco áreas de 100 m2 cada una, en las que se seleccionaron un árbol con musgo del género Bryum sp. (Delgadillo-M. & Cárdenas-S. 1990; Delgadillo-M. 2003) en la corteza de la base para tomar una muestra de 15x15 cm2. Se colectaron un total de 30 muestras, las que fueron procesadas en los embudos de Berlesse-Tullgren, durante una semana, modificados sin fuente de luz artificial en el laboratorio de Zoología del Instituto Tecnológico de Chetumal.
Análisis de datos. Los organismos fueron contabilizados y clasificados. La separación de los organismos se realizó con el microscopio estereoscópico y la identificación taxonómica se efectuó con un microscopio óptico con ayuda de claves dicotómicas a nivel familia de Dindal (1998), Balogh & Balogh (1988) y Bellinger et al. (1996-2012). Se calcularon las abundancias relativas (%), las densidades (ind/m2), los índices de diversidad de Shannon (H'), equidad de Pielou (J') y dominancia de Simpson (1/λ) (Moreno 2001). La similitud entre temporadas se realizó mediante el índice de similitud de Bray-Curtis (Brower & Zar 1984). La comparación entre la diversidad para las temporadas muestreadas se realizó por medio de una prueba t de student (Moreno 2001), posteriormente se realizó una corrección de Bonferroni. El efecto de las temporadas de muestreo en los grupos estudiados se determinó con un análisis de varianza (ANOVA) de una vía, los datos de abundancia fueron normalizados utilizando una corrección mediante  (Zar 1984). La relación entre la temperatura y la humedad del musgo con la densidad, se evaluó mediante regresiones lineales simples (Zar 1984). Las pruebas estadísticas se realizaron en el programa PRIMER 6 versión 6.1.6 (Clarke & Gorley 2006) y STARGRAPHICS Plus versión 5.0 (Manugistics Inc 1994-2001).
(Zar 1984). La relación entre la temperatura y la humedad del musgo con la densidad, se evaluó mediante regresiones lineales simples (Zar 1984). Las pruebas estadísticas se realizaron en el programa PRIMER 6 versión 6.1.6 (Clarke & Gorley 2006) y STARGRAPHICS Plus versión 5.0 (Manugistics Inc 1994-2001).
RESULTADOS
Se recolectó un total de 785 individuos, procedentes de las 30 muestras de musgos. Los ejemplares recolectados pertenen a dos clases, seis órdenes y 28 familias. La Clase Acarida representó el 89% de la proporción total de organismos. Las familias que presentaron el mayor número de organismos fueron Galumnidae con 411 (52.36%), seguida de Isotomidae con 82 (10.45%) y Scheloribatidae con 76 (9.68%) (Cuadro 1).

Durante la temporada de lluvias se registró la mayor abundancia con un total de 506 organismos y en la temporada de nortes se reportó la mayor riqueza de familias con 20; Isotomidae, Ascidae, Phytoseiidae, Trombidiidae, Terpnacaridae, Cosmochtoniidae, Eremaeozetidae y Scheloribatidae se reportaron en todas las temporadas (Cuadro 1).
La temporada de secas registró el valor de diversidad más alto con H' = 3.225, aunque es la que registró menor riqueza de familias (S = 14) (Cuadro 1), presenta un valor de equidad alto entre sus abundancias (J = 0.8471) (Cuadro 1). La temporada de nortes tuvo el segundo valor más alto de diversidad (H' = 2.927), aunque tuvo mayor riqueza de familias, presentó un valor de equidad menor comparado con el obtenido en secas, lo cual se corrobora con un valor de Simpson menor (λ = 0.2342) (Cuadro 1). Debido a una abundancia relativamente alta en una familia (Galumnidae), la temporada de lluvias presentó el valor más alto del índice de Simpson (λ = 0.4103) y el segundo valor más alto en cuanto a la riqueza de familias después de los nortes, debido a lo anterior registró el menor valor de diversidad (H' = 2.041) (Cuadro 1), en comparación con las otras dos temporadas.
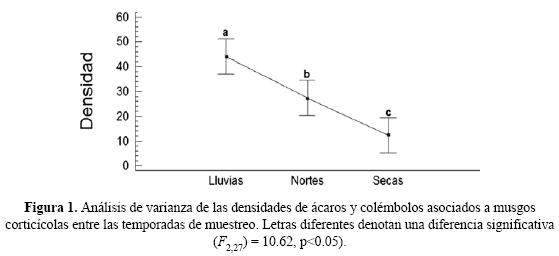
Al realizar la comparación temporal entre las diversidades se obtuvo que la temporada de lluvias presenta diferencias significativas con secas (t101 = 2.9022, p<0.05) y con nortes (t508 = 2.4763, p<0.05).
En este trabajo se colectó la mayor densidad de organismos en la temporada de lluvias (2249 ind/m2), mientras que en la temporada de secas fue donde se obtuvo la menor densidad (227 ind/ m2) (Cuadro 1).
Para las temporadas de muestro secas, lluvias y nortes se determinó que existe una diferencia estadísticamente significativa entre sus densidades, (F (2,27) = 0.62, p<0.05), esto es debido a las diferencias que se presentaron entre los meses de una temporada respecto a los de las otras en cuanto a las densidades, riqueza y familias exclusivas. Se observa que las diferencias más notorias entre las densidades registradas se presentaron para las temporadas de lluvias y secas (Fig. 1), debido a que para la primera la densidad que se registró fue mayor en comparación a las otras temporadas. En orden descendente le siguen los nortes, y de último se encuentra la de secas debido a la menor densidad de organismos obtenida.
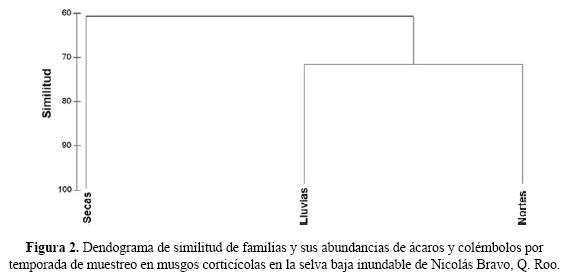
Las temporadas de muestreo presentaron una similitud del 60.72%. La de secas se separa de las otras temporadas climáticas, esto se puede deber a que es la única temporada en la que el lugar de muestreo no se encontró inundado y fue en donde se registró la menor humedad promedio (6. 40 %), influyendo en la riqueza y abundancias de los organismos. Para las temporadas de lluvias y nortes se observa una similitud del 71.58% (Fig. 2), esto se puede deber a las 13 familias que comparten y a las abundancias que se registraron en estas temporadas con más de 100 organismos recolectados (Cuadro 1).
Se determinó que no existe una relación significativa entre las densidades de los microartrópodos (ácaros y colémbolos) y temperatura (r (1,28) = 2.23; p>0.01) pero si hay una relación significativa entre las densidades de los microartrópodos y la humedad del musgo (Bryum sp.) (r (1,28)= 18.05; p<0.01). Se observa una correlación positiva, conforme aumenta la humedad, las densidades también van en aumento (Fig. 3).

Las familias que presentaron una relación estadísticamente significativa entre sus densidades con la humedad del musgo fueron: Isotomidae (r (1,28) = 4.12; p< 0.10), Phytoseiidae (r (1,28) = 3.01; p< 0.10), Anystidae (r (1,28) = 4.37; p< 0.05), Caeculidae r (1,28) = 4.52; p< 0.05), Trombidiidae (r (1,28) = 4.69; p< 0.05), Scheloribatidae (r(1,28) = 6.14; p<0.05) y Galumnidae (r (1,28) = 23.83; p< 0.01). Se observaron correlaciones positivas débiles para Isotomidae (r = 0.3582), Phytoseiidae (r = 0.3116), Trombidiidae (r = 0.3789) y Scheloribatidae (r = 0.4241) (Fig. 4a-d), para Galumnidae se observó una correlación positiva moderadamente fuerte entre sus densidades con respecto a la humedad del musgo (r = 0.6781) (Fig. 4g), lo cual indica que las densidades en estas familias aumentan conforme aumenta la humedad del musgo. La familia Anystidae (r = - 0.3674) (Fig. 4e) y Caeculidae (r = - 0.3728) (Fig. 4f) presentaron una tendencia ligeramente negativa para sus densidades con respecto a este factor del sustrato, lo cual se interpreta como a mayor humedad, menor es la densidad de organismos.
DISCUSIÓN
La alta abundancia que se presentó en este estudio para el Órden Cryptostigamata también se ha reportado en los estudios realizados en los musgos de cortezas de árboles en un bosque mesófilo de México por Cutz-Pool et al. (2008a); en un robledal de Quercus humbolditti la Reserva Bosque Macanal de Colombia por Gasca e Higuera (2008); en un gradiente altitudinal del Volcán Iztaccíhuatl, México por Iglesias-Mendoza et al. (2008) y por Cutz-Pool et al. (2010a).
La Clase Collembola (Palacios-Vargas 2004) no se encontró tan abundante ni diversa en los musgos corticícolas como se reporta para los trabajos realizados por Ardanaz & Jordana (1986a, b y c), Palacios-Vargas (2003), Traser et al. (2006), Cutz-Pool et al. (2008a; 2008b), Gasca & Higuera (2008) y Cutz-Pool et al. (2010a, 2010b). Sin embargo, se coincidió en que las familias Hypogastruridae, Entomobryidae e Isotomidae también fueron reportadas por Ardanaz & Jordana (1986a, b y c), Traser et al. (2006), Gasca & Higuera (2008) y Cutz-Pool et al. (2010b y c).
Existen factores que benefician el aumento de las abundancias, lo que se observó para los colémbolos, los que se registraron en mayor cantidad al presentarse la mayor humedad relativa (69.68%) en los musgos, lo que coincide con lo reportado por Ardanaz & Jordana (1986a) quienes mencionaron que para la mayoría de las especies de colémbolos existió una preferencia hacia los meses donde se registraron una mayor humedad (75%).
Se ha encontrado que las temperaturas bajas influyen indirectamente en la disminución de la riqueza de los taxones debido a la reducción de recursos y nichos explotables (Cutz-Pool et al. 2010a), contrario a lo que se presentó para este estudio, siendo noviembre donde se presentó la mayor riqueza y donde se registraron las temperaturas más bajas, pero debido a que el sitio se encontraba inundado, esto puede estar afectando el resultado.
Los individuos de las familias Galumnidae, Isotomidae, Scheloribatidae, Ascidae, Trombidiidae, Eremaeozetidae, Cunaxidae, Phytoseiidae, Caeculidae y Terpnacaridae pueden considerarse habitantes de este tipo de microhábitat debido a que presentaron las mayores abundancias y se encontraron frecuentes en el estudio. La mayor abundancia registrada para la familia Galumnidae (Cryptostigmata) seguida de Isotomidae (Collembola: Entomobryomorpha) durante la temporada de lluvias, indica que estos organismos requieren ambientes con cierto grado de humedad (51%). Al aumentar la humedad, la cantidad de alimento en las briofitas, como son detritos y sus propias estructuras vegetales aumentan, lo que a su vez generó un aumento en la densidad de los organismos durante la temporada de lluvias. Con esto se cumple que al existir condiciones propicias en los microhábitats, los organismos pueden presentarse en mayor número.
La mayor similitud entre las familias se registró para las temporadas de lluvias y nortes, esto debido a las condiciones similares que comparten y a las características del área para cada temporada, se encontraron diferencias significativas en la estructura, densidades y valores de diversidad. Existen familias que se adaptan o soportan mejor las condiciones críticas del microhábitat, lo cual se observó para los criptostigmados de las familias Eremaeozetidae y Scheloribatidae, debido a que se les encontró en todos los meses de muestreo.
AGRADECIMIENTOS.
A la familia Cauich-Guillén por permitir realizar el estudio en su parcela ejidal. Héctor Ortiz León Jefe de Laboratorio de Zoología del ITCH por permitir el uso del Lab. Juan Ek, Yuritza Cruz, Yareli Dzul, colaboraron en el trabajo de campo. La investigación fue realizada y desarrollada por la primera autora para la obtención del grado de licenciatura en Biología.
LITERATURA CITADA
Ardanaz, A. & Jordana, R. 1986a. Estudio ecológico sobre la fauna colembológica de las peñas de Echauri, Navarra. (Insecta, Collembola). I. Hayedo. Actas de las VII Jornadas A e E, pp. 235-243. [ Links ]
Ardanaz, A. & Jordana, R. 1986b. Estudio ecológico sobre la fauna colembológica de las peñas de Echauri, Navarra. (Insecta, Collembola). II. Encinar. Actas de las VII Jornadas A e E, pp. 244-252. [ Links ]
Ardanaz, A. & Jordana, R. 1986c. Estudio ecológico sobre la fauna colembológica de las peñas de Echauri, Navarra. (Insecta, Collembola). III. Prado-matorral. Actas de las VII Jornadas A e E, pp. 253-260. [ Links ]
Balogh, J. & Balogh, P. 1988. Oribatid Mites of The Neotropical Region I. Vol. 1. Editorial Elsevier, Budapest, Hungary. 335 pp. [ Links ]
Bellinger, P. F., Christiansen, K. A. & Jansses, F. 1996- 2012. Checklist of the Collembola of the world. http://www.collembola.org. Consultado: 10,09,2012. [ Links ]
Brower, J. E. & Zar, J. H. 1984. Field and laboratory methods for general ecology. Wm. C. Brown Co. Dubuque, Iowa. 226 pp. [ Links ]
Clarke, K. R. & Gorley, R. N. 2006. PRIMER v6: User Manual/Tutorial. PRIMER-E, Plymouth. [ Links ]
Cutz-Pool, L. Q., Bernal-Rojas, A., Palacios-Vargas, J. G. & Iglesias-Mendoza, R. 2008a. Diversidad de artrópodos en un bosque mesófilo de Puerto San Agustín, Querétaro, México, pp. 17-19. En: G. A. Quiroz-Rocha, M. Mora-Núñez, J. L. Navarrete-Heredia, M. Vásquez-Bolaños & S. Guerrero-Vázquez (Eds). Memorias X Simposio de Zoología, Cuerpo Académico de Zoología, Universidad de Guadalajara, Guadalajara. [ Links ]
Cutz-Pool, L. Q., Palacios-Vargas, J. G. & Castaño-Meneses, G. 2008b. Estructura de la comunidad de colémbolos (Hexapoda: Collembola) en musgos corticícolas en el gradiente altitudinal de un bosque subhúmedo de México. Revista Biología Tropical, 56: 739-748. [ Links ]
Cutz-Pool, L. Q., García-Gasca, A., Castaño-Meneses, G. & Palacios-Vargas, J. G. 2010a. Diversidad de Invertebrados de musgos corticícolas en la región del Volcán Iztaccíhuatl, Estado de México. Revista Colombiana de Entomología, 36: 90-95. [ Links ]
Cutz-Pool, L. Q., Castaño-Meneses, G., Palacios-Vargas, J. G. & Cano-Santana, Z. 2010b. Distribución vertical de colémbolos muscícolas en un bosque de Abies religiosa del Estado de México, México. Revista Mexicana de Biodiversidad, 81: 457-463. [ Links ]
Cutz-Pool, L. Q., Palacios-Vargas, J. G., Cano-Santana, Z. & Castaño-Meneses, G. 2010c. Diversity patterns of Collembola in an elevational gradient in the NW slope of Iztaccíhuatl volcano, state of Mexico, Mexico. Entomological News, 121: 249-261. [ Links ]
Cutz-Pool, L. Q., Mejía-Recamier, B. E., Palacios-Vargas, J. G. & Castaño-Meneses, G. 2011. Riqueza y Composición de ácaros (Prostigmata) Bdellidae en la región del Volcán Iztaccíhuatl, estado de México. In: Memoria del VII Congreso de Investigación y I de Posgrado de la FES Zaragoza. México, D.F. [ Links ]
Cutz-Pool, L. Q., Ek-Flores, J. F., Cruz, Y. N., Rosado-Martín, S., Várguez-Noh, W. P. & Dzul-Keb, Y. Y. 2012. Diversidad de la fauna de artrópodos en tres biotopos de una selva baja inundable de Nicolás Bravo, Quintana Roo, México, pp. 411-416. In: Equihua-Martínez, A., Estrada-Venegas, E. G., Acuña-Soto, J. A., Chaires-Grijalva, M. P. & Durán-Ramírez, G. (Eds). Entomología Mexicana. Vol. 11, Tomo 1. México. [ Links ]
Delgadillo-M., C. 2003. Moss Distribution in the Yucatán Peninsula, pp. 327-336. In: Gómez-Pompa, A. M., Allen, F., Fecdick, S. L. & Jiménez-Osorio, J. J. (Eds). The lowland Maya área: Three millenia at the human-wildland interface. The Haworth Press Inc. [ Links ]
Delgadillo-M., C. & Cárdenas-S., M. A. 1990. Manual de briofitas. Cuadernos del Instituto de Biología N° 8. UNAM, México, D. F., México. 135 pp. [ Links ]
Dindal, D. L. 1998. Soil biology guide. Wiley Interscience Publication, New York, USA. 1349 pp. [ Links ]
García, E. 1973. Modificaciones al Sistema de Clasificación de Köppen: (Para adaptarlo a las condiciones de la República Mexicana). Segunda edición. Instituto de Geografía. UNAM. México. 246 pp. [ Links ]
Gasca, H. J. & Higuera, D. 2008. Artrópodos asociados al Dosel de un Robledal de Quercus humbolditti Bonpl. (Fagacaeae) de la Reserva Bosque Macanal (Bojocá, Colombia). Boletín Sociedad Entomológica Aragonesa, 43: 173-185. [ Links ]
Hoffmann, A. 1988. Animales desconocidos: relatos acarológicos. Editorial Fondo de Cultura Económica. México, D. F. 129 pp. [ Links ]
Hoffmann, A. & Riverón, R. 1992. Biorrelaciones entre los musgos y su acarofauna en México. Tropical Bryology, 6: 105-110. [ Links ]
Iglesias-Mendoza, R., Palacios-Vargas, J. G. & Cutz-Pool, L. Q. 2008. Los ácaros oribátidos asociados a musgos cortícicolas en un gradiente altitudinal del Volcán Iztaccíhuatl, México. pp. 16-17. In: Quiroz-Rocha, G. A., Mora-Núñez, M., Navarrete-Heredia, J. L., Vásquez-Bolaños, M. & Guerrero-Vázquez, S. (Eds.). Memorias X Simposio de Zoología, Cuerpo Académico de Zoología, Universidad de Guadalajara, Guadalajara. [ Links ]
INEGI. 1984. Carta Edafológica, Chetumal E-16-4-7, escala 1:250,000. 1ª. Ed. México, D.F. [ Links ]
Iraola, V. 2001. Introducción a los ácaros (II): Hábitats e importancia para el hombre. Boletín Sociedad Entomológica Aragonesa, 28: 141-146. [ Links ]
Jeffery, S., Gardi, C., Jones, A., Montanarella, L., Marmo, L., Miko, L., Ritz, K., Peres, G., Römbke, J. & van der Putten, W. H. (Eds). 2010. European Atlas of Soil Biodiversity. Editorial European Commission. Luxemburgo. 129 pp. [ Links ]
Manugistics, Inc. 1994-2001. Statgraphics Plus version 5.0 user manual Rocvill: Autor. [ Links ]
Mejía-Recamier, B. E. & Cutz-Pool, L. Q. 2007. Diversidad Altitudinal de Bdelloidea (Prostigmata) de musgos cortícicolas en el Estado de México, 54-59. In: Estrada-Venegas, E. G., Equihua-Martínez, A., Luna-León, C. & Rosas-Acevedo, J. L. (Eds). Entomología mexicana. Vol. 6, Tomo 1. México. [ Links ]
Moreno, C. E. 2001. Métodos para medir la biodiversidad. M & T-Manuales y Tesis SEA. Vol. 1. Primera edición. Editorial CYTES, ORCYT-UNESCO, S.E.A. Zaragoza, España. 84 pp. [ Links ]
Palacios-Vargas, J. G. 1985. Microartrópodos del Popocatéptl (Aspectos ecológicos y biogeográficos de los ácaros oribátidos e insectos colémbolos). Tesis Doctoral. UNAM. México, D.F., 132 pp. [ Links ]
Palacios-Vargas, J. G. 2003. Los microartrópodos (Collembola) de la selva tropical húmeda, pp. 217-225. In: Álvarez-Sánchez, J. & Naranjo-García, E. (Eds.) Ecología del suelo en la Selva Tropical Húmeda de México. UNAM-Instituto de Ecología A. C., Xalapa, Veracruz, México. [ Links ]
Palacios-Vargas, J. G. 2004. Sistemática y ecología de Microartrópodos. Cuarto curso de Educación Continuada Museo Entomológico UNAB. Facultad de Agronomía UNAB, Universidad Nacional de Colombia. [ Links ]
Santos, M. 1991. Sobre la Nematofauna muscícola del Pinsabar (Abies pinsapo Boiss) de la Sierra Grazalema (España). Nematología Mediterránea, 19: 197-206. [ Links ]
Traser, G., Szücs, P. & Winkler, D. 2006. Collembola diversity of moss habitats in the Sopron Region, NW-Hungary. Acta Silvatica & Lignaria Hungarica, 2: 69-80. [ Links ]
Tun-Dzul, F. J. 2007. La estacionalidad de la Selva Baja Inundable: Su Análisis mediante Percepción Remota. Tesis de Maestría. El Colegio de la Frontera Sur (ECOSUR). 96 pp. [ Links ]
Zar, H. J. 1984. Biostatistical Analysis. Segunda edición. Prentice Hall. Englewood Cliffs. New Jersey. 605 pp. [ Links ]














