Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta zoológica mexicana
versão On-line ISSN 2448-8445versão impressa ISSN 0065-1737
Acta Zool. Mex vol.29 no.3 Xalapa Dez. 2013
Artículos originales
Parámetros biológicos de Apanteles nr. aristoteliae (Viereck) (Hymenoptera: Braconidae), parasitoide del enrollador de las hojas, Amorbia sp. (Lepidoptera: Tortricidae)
Biological parameters of Apanteles nr. aristoteliae (Viereck) (Hymenoptera: Braconidae), parasitoid of the leafroller, Amorbia sp. (Lepidoptera: Tortricidae)
Alma M. ESPINO-HERRERA,1 Ana M. MARTÍNEZ,1 Christian L. RODRÍGUEZ-ENRÍQUEZ,1 José I. FIGUEROA,1 Juan M. CHAVARRIETA YÁÑEZ,1 Sinue I. MORALES-ALONSO,1 Ángel REBOLLAR-ALVITER2 y Samuel PINEDA1*
1 Instituto de Investigaciones Agropecuarias y Forestales, Universidad Michoacana de San Nicolás de Hidalgo, Km. 9.5 Carretera Morelia-Zinapécuaro, C.P. 58880. Tarímbaro, Michoacán, México.
2 Centro Regional Universitario Centro Occidente. Universidad Autónoma Chapingo. 58170 Morelia, Michoacán, México.
* Autor para correspondencia: <spineda_us@yahoo.com>
Recibido: 10/01/2013;
aceptado: 13/06/2013.
RESUMEN
Apanteles nr. aristoteliae (Viereck) (Hymenoptera: Braconidae) es un endoparasitoide de larvas del enrollador de las hojas Amorbia sp. (Lepidoptera: Tortricidae). En este estudio se determinó, bajo condiciones de laboratorio (22 ± 2 ºC, 60 ± 5% de humedad relativa y un fotoperiodo de 16:8 h [luz: oscuridad]) el ciclo de vida, parasitismo, proporción sexual y longevidad de adultos de este parasitoide. La duración del ciclo de vida fue de 42.45 ± 0.76 días. El tiempo de desarrollo de los estados de huevo-larva, pupa y adulto fue de 14.04 ± 0.05, 9.22 ± 0.07 y 19.36 ± 0.74 días, respectivamente. A lo largo de toda su vida, cada hembra de A. nr. aristoteliae parasitó 73.33 ± 7.55 larvas del enrollador de las hojas Amorbia sp. La proporción sexual de la generación F1 fue de 95.1% machos (n = 912). La longevidad de los adultos fue significativamente distinta (U = 564, P = 0.01) entre los machos apareados (27 ± 2.55 días) y vírgenes (19.75 ± 0.70 días), pero no (U = 182, P = 0.3) entre las hembras apareadas y que fueron sometidas a parasitación durante toda su vida (26.4 ± 2.88 días) y vírgenes (23.13 ± 1.4 días). Con el fin de obtener un mejor conocimiento de los parámetros de vida del parasitoide A. nr. aristoteliae, es necesario realizar futuros estudios que incluyan diferentes condiciones de cría (ej., temperatura y espacio).
Palabras clave: Ciclo de vida, proporción sexual, parasitismo, Rubus sp.
ABSTRACT
Apanteles nr. Aristoteliae (Viereck) (Hymenoptera: Braconidae) is an endoparasitoid of the leafroller Amorbia sp. (Lepdidoptera: Tortricidae) larvae. In this study, the life cycle, parasitism, sex ratio, and longevity of adults of this parasitoid were determined under laboratory conditions (22 ± 2 ºC, 60 ± 5% relative humidity, and a photoperiod of 16:8h [light:dark]). The life cycle of this parasitoid was 42.45 ± 0.76 days. The duration of development stages of egg-larva, pupa and adult was 14.04 ± 0.05, 9.22 ± 0.07, and 19.36 ± 0.74 days, respectively. Each A. nr. aristoteliae female parasitized 73.33 ± 7.55 Amorbia sp. larvae. The sex ratio of F1 generation was 95.1% males (n = 912). Longevity of adults was significantly different (U = 564, P = 0.01) between mated males (27 ± 2.55 days) and virgins (19.75 ± 0.70 days) but not (U = 182, P = 0.3) between mated females that were exposed to parasitization during all its life (26.4 ± 2.88 days), and virgins (23.13 ± 1.4 days). In order to obtain a better understanding about life parameters of A. nr. aristoteliae, future studies that include different rearing conditions (e.g., temperature and space) are needed.
Key words: Life cycle, sex ratio, parasitism, Rubus sp.
INTRODUCCIÓN
En el año 2009 se observaron larvas de un enrollador de hojas en un cultivo de zarzamora (Rubus sp., variedad Tupi) en el Rancho Huatarillo, municipio de Peribán, en el estado de Michoacán (A. A. Rebollar, comunicación personal). Los adultos provenientes de estas larvas se identificaron como Amorbia sp. (Lepidoptera: Noctuidae) por personal del Centro Nacional de Referencia Fitosanitaria de la Dirección General de Sanidad Vegetal de la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación en el Distrito Federal, México y corroborada por personal de la Sociedad de Lepidopterología Hispano Luso en Madrid, España (Juárez 2013). Similar a otros tortrícidos, las hembras de esta especie depositan sus huevos en masas en el envés de las hojas, sobrepuestos unos a otros y cubiertos por una fina capa de cera. Las larvas de Amorbia sp. se alimentan de brotes tiernos y nunca se les ha observado alimentándose de frutos.
A pesar de que la ocurrencia del enrollador de las hojas Amorbia sp., es esporádica, los agricultores utilizan frecuentemente los insecticidas sintéticos malatión y cipermetrina y algunos agentes biorracionales tales como spinosad, extracto crudo de nim (Azadirachta indica A. Juss) y la bacteria Bacillus thuringiensis (Berliner). Debido a los riesgos que ocasionan los insecticidas sintéticos malatión y cipermetrina (contaminación ambiental, pérdida de fauna benéfica y resurgencia de plagas secundarias, entre otros), es necesario encontrar métodos alternativos que regulen las poblaciones del enrollador de las hojas Amorbia sp. El control biológico, a través del uso del parasitoide Apanteles nr. aristoteliae (Viereck) (Hymenoptera: Braconidae), puede jugar un papel importante antes de que este insecto se convierta en una plaga principal.
El género Apanteles (Foester) incluye alrededor de 1000 especies distribuidas en el continente Americano (Whitfield 1997, Yu et al. 2005). La mayoría de las especies de este género son parasitoides solitarios de larvas de microlepidópteros, aunque también existen especies gregarias que parasitan larvas de macrolepidópteros (Whitfield 1997). Dentro del género Apanteles, existen diversas especies que se consideran promisorias para el control biológico de distintas especies de lepidópteros plaga. Por ejemplo, en huertos de manzano (Malus sp.) en California, Estados Unidos de Norteamérica, Apanteles aristoteliae (Viereck) causó entre 15-20% y 30% de parasitismo sobre larvas de los enrolladores de hojas, Argyrotaenia citrana (Fernald) y Argyrotaenia franciscana (Walsingham) (Lepidoptera: Tortricidae), respectivamente (Walker & Welter 2004). Por su parte, Apanteles flavipes (Cameron) causó más del 30% de parasitismo sobre larvas del barrenador de los tallos, Diatraea saccharalis (Fabricius) (Lepidoptera: Pyralidae) en caña de azúcar (Saccharum officinarum L.) en Islas Barbados (Alam et al. 1971).
En México, existen algunos reportes sobre la presencia de especies del género Apanteles sobre larvas de lepidópteros. En cultivos de canola (Brassica napus L.), en el estado de Sinaloa, Apanteles sp. causó alrededor del 30% de parasitismo sobre la palomilla dorso de diamante, Plutella xylostella (L.) (Lepidoptera: Plutellidae) (Cortez-Mondaca & Macías-Cervantes 2007). Ruíz y Cervantes (2007) reportaron la presencia de Apanteles sp. sobre larvas de Apotoforma sp. (Lepidoptera: Tortricidae) en Uncader y Las Duelas, Veracruz. Por su parte, A. nr. aristoteliae causó 20% y 55% de parasitismo en larvas de los enrolladores de las hojas, Argyrotaenia sp. y Amorbia sp. (Lepidoptera: Tortricidae), respectivamente, colectadas en cultivos de zarzamora en Huatarillo, Michoacán (Juárez 2013). Aunque se destaca la importancia del parasitismo causado por A. nr. aristoteliae sobre el enrollador de hojas Amorbia sp., no existen estudios sobre su biología o aquellos que confirmen su efectividad en la regulación de las poblaciones de este fitófago.
En el presente estudio se determinaron algunos aspectos de la biología del parasitoide A. nr. aristoteliae, tales como ciclo de vida, parasitismo, proporción de sexos, así como la longevidad de adultos vírgenes y apareados bajo condiciones de laboratorio.
MATERIALES Y MÉTODOS
Insectos. En los meses de agosto y septiembre de 2010 se colectaron 308 larvas de diferentes estadios del enrollador de las hojas Amorbia sp., en un cultivo de zarzamora (variedad Tupi) en Huatarillo, Michoacán (19°34'07" N, 102°27' 37" W y 1350 m de altitud). Después de la colecta, estas larvas se transportaron al Laboratorio de Entomología Agrícola del Instituto de Investigaciones Agropecuarias y Forestales de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH). En el laboratorio, las larvas se individualizaron en cajas Petri (1.5 cm de altura x 9.5 cm de diámetro), se alimentaron con hojas de zarzamora y se observaron diariamente hasta la emergencia de adultos, ya sea del enrollador de las hojas o del parasitoide, en caso de estar parasitadas.
Los adultos del enrollador de las hojas (120 adultos) que resultaron de las larvas colectadas en campo, se colocaron en una jaula de oviposición de soporte de hierro (30 cm x 28 cm x 30 cm) cubierta con tela de organza. Se utilizó plástico de alta densidad de color azul como sustrato de oviposición, el cual se remplazó cada 24 h. Las larvas se alimentaron con dieta artificial a base de harina de soya y germen de trigo (Rosas-García &Villegas-Mendoza 2008), mientras que a los adultos se les ofreció una solución de miel de abeja al 15%.
La cría del parasitoide A. nr. aristoteliae se inició con 36 hembras + 56 machos, los cuales se colocaron en una jaula de cría Bugdorm® (30 x 30 x 30 cm) (Taichung, Taiwán). El proceso de cría de este parasitoide se realizó siguiendo el método reportado por Barreto (2012).
Las crías, tanto del enrollador de las hojas como del parasitoide, se mantuvieron en condiciones controladas de 25 ± 2ºC, 60 ± 5% de humedad relativa (HR) y un fotoperiodo de 16:8 h (luz: oscuridad). En la colección entomológica de la UMSNH se encuentran depositados 20 especímenes (10 hembras y 10 machos) del enrollador de las hojas Amorbia sp. y del parasitoide A. nr. aristoteliae.
Bioensayos. Todos los experimentos descritos a continuación se realizaron a 22 ± 2 ºC y las condiciones de HR y fotoperiodo fueron similares a las de la crías. Se utilizaron larvas de segundo estadio (L2) del enrollador de las hojas, Amorbia sp. Para su parasitación, estas larvas se colocaron en un vaso de plástico (4.5 cm de altura x 5.8 cm de diámetro) que contenía tres cubos de dieta artificial de 1.5 cm3 para su alimentación. Los adultos de los parasitoides se alimentaron con miel de abeja al 100%, la cual se colocó en pequeñas gotas en la pared interna del contenedor utilizado en el experimento en turno. También se les ofreció agua destilada en un bebedero de cristal (2 cm de altura x 1 cm de diámetro) cubierto con Parafilm® a través del cual se introdujo una pieza de esponja de celulosa Scotch Brite®. Al momento de iniciar los experimentos (noviembre de 2011), la cría del parasitoide contaba con 12 generaciones. Sin embargo, con el fin de aumentar la variabilidad genética, en el periodo comprendido de septiembre a diciembre de 2011, cada mes se introdujeron a la jaula de cría alrededor de 10 hembras + 14 machos provenientes de larvas del enrollador de las hojas Amorbia sp. colectadas en campo.
Ciclo biológico de A. nr. aristoteliae. Grupos de entre 15 y 20 larvas L2 del enrollador de las hojas, Amorbia sp., se expusieron por cada hembra de A. nr. aristoteliae (< 48 h de edad) presente en la jaula de cría descrita anteriormente. El periodo de exposición fue de 24 h. Después de este periodo, las larvas se individualizaron en cajas para cultivo de tejidos de 24 celdas, las cuales contenían un trozo de dieta artificial de 0.8 cm³. Diez días después de la parasitación, las larvas que no fueron parasitadas se descartaron. Estas larvas se reconocieron por ser de tamaño más grande comparado con aquellas parasitadas; además de que éstas últimas adquieren una coloración blanquecina y presentan movimientos lentos.
En total se expusieron 3,381 larvas del enrollador de las hojas Amorbia sp., de las cuales 1,100 resultaron parasitadas. Estas larvas parasitadas se observaron cada 24 h con la finalidad de determinar la duración en días, de los estados de desarrollo de huevo-larva, pupa y adulto del parasitoide. El estado de huevo-larva comprendió desde el día de la parasitación hasta que la larva del parasitoide abandonó a su larva hospedera para realizar la pupación. Después de la emergencia, los adultos del parasitoide se individualizaron en vasos de plástico (4.2 cm de altura x 6.9 cm de diámetro) y se alimentaron de la forma como se mencionó anteriormente.
Influencia de la edad de las hembras de A. nr. aristoteliae en el parasitismo y proporción sexual. En un vaso transparente (1 L de capacidad, Reyma®), abierto en sus dos extremos, se introdujeron entre 15 y 20 larvas L2 del enrollador de las hojas junto con una hembra y un macho de A. nr. aristoteliae (< 48 h de edad). La parte superior de este vaso se cubrió con tela de organza para facilitar la aireación y evitar el escape de los insectos. Después de 24 h, las larvas se retiraron y se colocaron individualmente, como se describió anteriormente, en cajas para cultivo de tejidos de 24 celdas. Este proceso de parasitación se realizó cada 48 h durante toda la vida de la hembra del parasitoide. El macho que moría, por lo general, antes que la hembra se reemplazaba por otro nuevo. Se realizaron 15 repeticiones, cada una representada por una pareja del parasitoide. Se determinó el porcentaje de parasitismo durante toda la vida de cada hembra de A. nr. aristoteliae, así como la formación de pupas inviables y viables de la descendencia proveniente de cada exposición a parasitar y de forma acumulada. Las pupas inviables (= pupas muertas) son aquellas de las cuales no existió emergencia de adultos a los 15 días después de su formación, mientras que el número de adultos emergidos representa al número de pupas viables. También se determinó el número promedio de parasitaciones de cada hembra y proporción de sexos de todos los descendientes de la primera generación (generación F1).
Longevidad de adultos de A. nr. aristoteliae apareados y sometidos a parasitación, y vírgenes. Para evaluar la longevidad de adultos apareados, se utilizaron los individuos de las 15 parejas del experimento anterior. En el caso de los adultos vírgenes, se utilizaron 95 machos y 30 hembras (<24 h de edad) (descendientes de las 15 parejas), los cuales se individualizaron, inmediatamente después de su emergencia, en vasos de plástico (4.2 cm de altura x 6.9 cm de diámetro). Para determinar la longevidad, por sexo, de los adultos del parasitoide en ambas condiciones, éstos se observaron diariamente hasta su muerte.
Análisis de datos. Los datos de longevidad de los adultos apareados y sometidos a parasitar, y vírgenes, se analizaron con la prueba U de Mann Whitney. Los datos de proporción de sexos de los adultos de la generación F1, se analizaron con una tabla de contingencia (prueba de χ2). Los análisis se realizaron con el programa estadístico SPSS versión 17.0 (Stadistical Analysis System., Inc., Cary, NC, E.U.A).
RESULTADOS
Ciclo biológico de A. nr. aristoteliae. La duración del ciclo de vida de A. nr. aristoteliae fue de 42.45 ± 0.76 (n = 85) días. Los estados de huevo-larva, pupa y adulto tuvieron una duración de 14.04 ± 0.05 (n = 267), 9.22 ± 0.07 (n = 210) y 19.36 ± 0.74 (n = 85) días, respectivamente. Cabe mencionar que la duración del estado adulto se determinó solamente con machos debido a que en este experimento se obtuvo más del 90% de este sexo; las hembras se destinaron al incremento de la cría del parasitoide.
Parasitismo y proporción sexual de A. nr. aristoteliae. Durante toda su vida, cada hembra de A. nr. aristoteliae realizó en promedio 11.66 ± 1.18 (n = 175) parasitaciones y el número de larvas parasitadas por hembra, por exposición, fue 6.29 ± 0.29 (n = 73). El número acumulado de larvas del enrollador de las hojas parasitadas por cada hembra de A. nr. aristoteliae, a lo largo de toda su vida, fue 73.33 ± 7.55 (n = 175), mientras que el número acumulado de pupas inviables o muertas fue de 12.53 ± 1.92 (n = 73).
En promedio hubo 1.07 ± 1.10 (n = 6) pupas inviables y una emergencia de adultos (pupas viables) de 5.21 ± 0.25 (n = 6) adultos por cada día de exposición y por cada hembra. De esta forma, se obtuvo una emergencia acumulada (= pupas viables) de 60.80 ± 6.09 (n = 73) adultos (incluidos machos y hembras) por cada hembra de parasitoide. En promedio, Respecto a la proporción de sexos de los adultos de la generación F1, se observó que hubo más emergencia de machos (> 90%) que hembras.
En general, el parasitismo disminuyó conforme al incremento de la edad de las hembras de A. nr. aristoteliae (Fig. 1). Entre los días 4 y 26 de edad de las hembras, hubo entre 6 y 7 larvas parasitadas por hembra; excepto en el sexto día de edad donde se registraron 9 larvas parasitadas. El número de larvas parasitadas descendió hasta 4, a los 34 días de edad de las hembras. Cabe mencionar que 3 hembras vivieron más de 40 días; sin embargo, dejaron de parasitar a los 34 días de edad, mismos que representaron 17 parasitaciones (Fig. 1).
Longevidad de adultos de A. nr. aristoteliae apareados y sometidos a parasitación, y no apareados (vírgenes). La condición de apareados y sometidos a parasitación, y no apareados o vírgenes afectó la longevidad de los adultos de A. nr. aristoteliae (Cuadro 1). Se observaron diferencias significativas (U = 564, P = 0.01) entre los machos apareados y los vírgenes a la temperatura ensayada; los primeros vivieron 7 días más que los segundos.
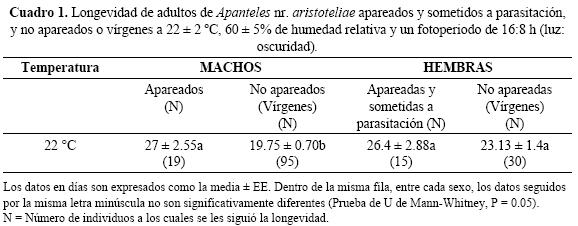
Las hembras apareadas y sometidas a parasitación durante toda su vida, vivieron 3 días más que las no apareadas o vírgenes. En este caso no se observaron diferencias significativas (U = 182, P = 0.3).
DISCUSIÓN
La temperatura es uno de los principales factores que influyen en el desarrollo, fecundidad, mortalidad y proporción de sexos, en varias especies de parasitoides (Oliveira et al. 1998, Pereira et al. 2004, Fonseca et al. 2005). En el presente trabajo la duración del ciclo de vida de A. nr. aristoteliae fue de 42 días a la temperatura ensayada (22 °C), muy similar a lo reportado para este mismo parasitoide a 20 °C (48 días) (Barreto 2012). En general, se ha reportado que la duración del ciclo biológico de los insectos es inversamente proporcional al incremento de la temperatura (Harrison et al. 1985, Grillé & Basso 1994, Marco 2001). Por ejemplo, en Apanteles gelechiidivoris (Marsh), la duración del ciclo de vida fue de 39, 34, 19 y 17 días a 14, 20, 26 y 32 ºC, respectivamente (Bajonero et al. 2008), mientras que para Cotesia plutellae (Kurdjumov) (Hymenoptera: Braconidae) fue de 20, 12, 11 y 11 días a 21, 24, 27 y 30 ºC, respectivamente (Nofemela 2004). Actualmente, están en proceso más investigaciones enfocadas a evaluar cuáles son los umbrales mínimos y máximos de temperatura en el desarrollo de A. nr. aristoteliae.
En Telenomus remus (Nixon) (Hymenoptera: Scelionidae), la duración de los estados de vida de huevo-larva y pupa fue de 4 y 6 días, respectivamente, a 26.5 °C, mientras que a 30 °C el tiempo de desarrollo disminuyó un día en cada etapa de vida (Hernández 1994). Es claro que, un incremento en la temperatura, dentro de un rango favorable, puede acelerar el metabolismo de los insectos y consecuentemente incrementar su tasa de desarrollo (Marco 2001). Por otra parte, a 20 °C la duración de los estados de huevo-larva, pupa y adulto de la misma especie de parasitoide utilizada en el presente trabajo sobre larvas del enrollador de las hojas, Argyrotaenia sp. (Lepidoptera: Tortricidae) fue de 22, 13 y 12 días, mientras que a 25 °C fue de 16, 6 y 13 días, respectivamente (Barreto 2012). Las diferencias entre los resultados obtenidos en el presente estudio y los de Barreto (2012) pueden atribuirse a las temperaturas y especies de hospedero utilizadas. Al respecto, el crecimiento y desarrollo de los estados inmaduros de los parasitoides pueden variar cuando se utilizan diferentes especies de hospederos, debido, probablemente, a que éstos aportan diferentes recursos alimenticios en cantidad y calidad (Jervis & Copland 1996).
Las hembras de A. nr. aristoteliae causaron el mayor parasitismo sobre las larvas del enrollador de las hojas, Amorbia sp., en las primeras 8 parasitaciones, lo cual corresponde a los primeros 16 días de edad (Fig. 1). Posteriormente, el parasitismo disminuyó gradualmente, a medida que la edad del parasitoide aumentó, hasta llegar a 4 larvas parasitadas a los 34 días de edad. Similarmente, el parasitismo causado por las hembras de menor edad (≤ 5 días de edad) del parasitoide Bracon hebetor (Say) (Hymenoptera: Braconidae) fue más alto (63%) comparado con el de aquellas de mayor edad (10 días de edad; 47%), sobre larvas de la palomilla de la cera, Galleria mellonella (L.) (Lepidoptera: Pyralidae) (Gündüz & Gülel 2005). La disminución del parasitismo, de acuerdo a la edad de las hembras, también se observó en Trichogrammatoidea bactrae (Nagaraja) (Riquelme & Botto 2010) y Trichogramma pretiosum (Riley) (Hymenoptera: Trichogrammatidae) (Segade & Botto 1996) sobre el gusano del tomate, Tuta absoluta (Meyrick) (Lepidoptera: Tortricidae) y el gusano peludo, Anticarsia gemmatalis (Hübner) (Lepidoptera: Noctuidae), respectivamente. Esta disminución en el parasitismo, según Hofsvang & Hagvar (1975) se debe a la falta de ovocitos, o a la calidad de éstos, en los ovarios de las hembras de los parasitoides a medida que envejecen.
La proporción de sexos de A. nr. aristoteliae fue 19.7:1 (machos: hembras), equivalentes a 95.1% de machos. En contraste, a diferentes temperaturas, la proporción de sexos (machos: hembras) fue más equitativa en Apanteles taragamae (Viereck) (1:0.9 a 30 °C) (Mohan & Sathiamma 2007), A. gelechiidivoris (1:1 a 14 ºC, 20 ºC y 26 °C) (Bajonero et al. 2008) y A. nr. aristoteliae (1.16:1 y 2.90:1 a 20 ºC y 25 ºC, respectivamente) (Barreto 2012). Las diferencias entre los resultados del presente estudio con los de todos estos autores pueden atribuirse a las metodologías utilizadas. Por ejemplo, Barreto (2012) colocó grupos de 10 parejas del parasitoide en jaulas de plástico Bugdorm®, como las descritas en el apartado de Materiales y Métodos del presente estudio, lo que pudo incrementar la probabilidad de encuentro entre machos y hembras y consecuentemente su copulación. En el presente estudio, cada pareja del parasitoide se colocó en un vaso de plástico de 1 L de capacidad, en el cual la probabilidad de encuentro y copulación pudo no tener éxito. Esta hipótesis puede ser reforzada por el modelo Local Mate Competition, el cual indica que cuando existe mayor cantidad de hembras ovipositando en un mismo sitio, la proporción de sexos de la descendencia es más equitativa que cuando éstas se encuentran solas (Hamilton 1967). Además, Damiens et al. (2003) y Fuester et al. (2003), reportaron que la obtención de más machos que hembras puede ser el resultado de varios factores tales como la cantidad y edad de los espermatozoides presentes en la espermateca, muerte y reabsorción de los mismos, número de copulaciones y mortalidad diferencial de sexos en estado larvario.
En el presente trabajo, la presencia de más machos que hembras fue un problema muy importante en la cría de A. nr. aristoteliae. De igual forma, en la cría de Hyposoter didymator (Thunberg) (Hymenoptera: Ichneumonidae), parasitoide de larvas de nóctuidos, se presentó una proporción sexual de 9:1 (machos: hembras) (Bahena et al. 1998). En este caso, los autores atribuyeron esta desproporción de sexos a la pérdida de la variabilidad genética de la población.
Jervis & Copland (1996) señalaron que la longevidad de los parasitoides está influenciada por diversos factores tales como tamaño del insecto, apareamiento, oviposición, temperatura, humedad, fotoperiodo y dieta. En el presente estudio, no se encontró ningún efecto en la longevidad entre las hembras apareadas y sometidas a parasitación con respecto a las vírgenes (Cuadro 1). En el parasitoide C. plutellae, tampoco hubo diferencias significativas en la longevidad entre hembras en ambas condiciones (apareadas y vírgenes) a 25 ºC (Mitsunaga et al. 2004). Sin embargo, estos autores reportaron que los adultos de este parasitoide alimentados con miel al 100% fueron hasta 14 días más longevos, comparado con el resto de los tratamientos ensayados (sin alimento, sólo agua y sacarosa al 20%). Esto indica que la calidad del alimento influye en la longevidad de los parasitoides (Hagley & Barber 1992, Heimpel et al. 1997). En el parasitoide Campoletis chlorideae (Uchida) (Hymenoptera: Ichneumonidae) tampoco se reportaron diferencias significativas en la longevidad entre hembras apareadas (16 días) y vírgenes (13 días) a 27 °C (Dhillon & Sharma 2011).
En general, los insectos que son sometidos al apareamiento y parasitación tienen menos tiempo de vida que los individuos vírgenes; esto debido al costo de energía de la reproducción (Carey et al. 1998). Durante el proceso del presente estudio, los individuos vírgenes (hembras y machos) de A. nr. aristoteliae se colocaron en recipientes más pequeños (150 ml de capacidad) que los apareados (1 L de capacidad). El espacio reducido pudo ocasionar estrés en estos individuos, que dejaran de alimentarse y consecuentemente morir antes que los individuos apareados, como ha sucedido en otros insectos (Vargas & Abarca 1998).
En conclusión, el porcentaje acumulado de parasitismo causado por A. nr. aristoteliae fue de 32% a 22 °C sobre larvas L2 del enrollador de las hojas Amorbia sp. y se obtuvo una emergencia de adultos de 84%. Actualmente están en proceso más estudios enfocados a determinar la temperatura óptima de desarrollo de este parasitoide, con el fin de obtener una proporción de sexos más equitativa. El conocimiento de los requerimientos de este factor ambiental sobre los diversos parámetros de vida de A. nr. aristoteliae será de gran importancia ya que se podrá usar en la previsión de su dinámica poblacional; de igual forma, está en proceso la corroboración de su identidad específica, así como la de su hospedero.
AGRADECIMIENTOS
Este trabajo fue financiado por la Coordinación de la Investigación Científica, Universidad Michoacana de San Nicolás de Hidalgo y forma parte de la tesis de Licenciatura de Alma M. Espino Herrera.
LITERATURA CITADA
Alam, M. M., Bennett, F. D. & Carl, K. P. 1971. Biological control of Diatraea saccharalis (F.) in Barbados by Apanteles flavipes (Cam.) and Lixophaga diatraea T. T. Entomophaga, 16: 151-158. [ Links ]
Bahena, F., Adán, A., González, M. & Viñuela, E. 1998. Método de cría de Hyposoter didymator (Thunberg) (Hymenoptera: Ichneumonidae), parasitoide de noctuidos de importancia agrícola. Boletín de Sanidad Vegetal Plagas, 24: 975-984. [ Links ]
Bajonero, J., Córdoba, N., Rodríguez, D. & Cure, J. R. 2008. Biología y ciclo reproductivo de Apanteles gelechiidivoris (Hymenoptera: Braconidae), parasitoide de Tuta absoluta (Lepidoptera: Gelechiidae). Agronomía Colombiana, 26: 417-426. [ Links ]
Barreto, B. O. 2012. Parasitoides de dos enrolladores de hojas de zarzamora con énfasis en la biología de Argyrotaenia montezumae (Walsingham) (Lepidoptera: Tortricidae) y de su parasitoide Apanteles nr. aristoteliae (Viereck) (Hymenoptera: Braconidae). Tesis de Maestría. Programa Institucional de Maestría en Ciencias Biológicas. Universidad Michoacana de San Nicolás de Hidalgo, Morelia, Michoacán, México. 85 pp. [ Links ]
Carey, J., Liedo, P., Müller, H. G., Wang, J. L. & Chiou, J. M. 1998. Relationship of age patterns of fecundity to mortality, longevity, and lifetime reproduction in a large cohort of Mediterranean fruit fly females. Journal of Gerontology, 53: 245-251. [ Links ]
Cortez-Mondaca, E. & Macías-Cervantes, J. 2007. Parasitismo natural de la palomilla dorso de diamante Plutella xylostella L. en canola (Brassica napus L.), en el norte de Sinaloa, México. Agrociencia, 41: 347-354. [ Links ]
Damiens, D., Bressac, C. & Chevrier, C. 2003. The effect of age on sperm stock and egg laying in the parasitoid wasp, Dinarmus basalis. Journal of Insect Science, 3: 22. [ Links ]
Dhillon, M. K & Sharma, H. C. 2011. Effect of mating and parasitism regimes on progeny production and sex ratio of Campoletis chloridae Uchida. Indian Journal of Experimental Biology, 49: 786-790. [ Links ]
Fonseca, F. L., Kovaleski, A., Foresti, J. & Ringerberg, R. 2005. Desenvolvimento e exigências térmicas de Trichogramma pretiosum Riley (Hymenoptera: Trichogrammatidae) em ovos de Bonagota cranaodes (Meyrick) (Lepidptera: Tortricidae). Neotropical Entomology, 34: 945-949. [ Links ]
Fuester, R. W., Swan, K. S., Dunning, K., Taylor, P. B. & Ramaseshiah, G. 2003. Male-biased sex ratios in Glyptapantales flavicoxis (Hymenoptera: Braconidae), a parasitoid of the Gypsy moth (Lepidoptera: Lymantriidae). Annals of the Entomological Society of America, 96: 553-559. [ Links ]
Grillé G. & Basso, C. 1994. Biology, thermal requirements and performance of Trichogramma pretiosum Riley and T. galloi Zucchi under laboratory conditions. Pp.79-82. In: E. Wajnberg (Ed.). International Symposium on Trichogramma and other egg parasitoids. El Cairo, 1994. Paris, INRA (Les colloques INRA, 73). [ Links ]
Gündüz, E. A & Gülel, A. 2005. Investigation of fecundity and sex ratio in the parasitoid Bracon hebetor Say (Hymenoptera: Braconidae) in relation to parasitoid age. Turkish Journal of Zoology, 29: 291-294. [ Links ]
Hamilton, W. D. 1967. Extraordinary sex ratios. Science, 156: 477-488. [ Links ]
Hagley, E. A. C. & Barber, D. R. 1992. Effect of food sources on the longevity and fecundity of Pholetes orornigis(Weed) (Hymenoptera: Braconidae). The Canadian Entomologist, 124: 341-346. [ Links ]
Harrison W. W., King, E. G. & Ouzts, J. D. 1985. Development of Trichogramma exiguum and T. pretiosum at five temperature regimes. Environmental Entomology, 14: 118 -121. [ Links ]
Heimpel, G. E., Rosenheim, J. A. & Kattari, D. 1997. Adult feeding and lifetime reproductive success in the parasitoid Aphytis melinus. Entomologia Experimentalis et Applicata, 83: 305-315. [ Links ]
Hernández, J. D. M. 1994. Estudio de la biología de Telenomus remus Nixon (Hymenoptera: Scelionidae) parasitoide de Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae). Tesis de Maestría, Facultad de Agronomía, Universidad Central de Venezuela. Caracas, Venezuela. 83 p. [ Links ]
Hofsvang, T. & Hagvar, E. B. 1975. Fecundity and oviposition period of Aphidius platensis (Hymenoptera: Aphidiidae) on paprika. Norwagian Journal of Entomology, 22: 113-116. [ Links ]
Jervis, M. A. & Copland, M. J. W. 1996. The life cycle, pp. 63-161. In: Jervis, M. & N. Kidd (Eds.). Insect natural enemies: practical approaches to their study and evaluation. Chapman & Hall, London. [ Links ]
Juárez, G. A. C. 2013. Identificación y biología de un enrollador de hojas de zarzamora: parasitoides asociados a dos tortrícidos. Tesis de Maestría. Programa Institucional de Maestría en Ciencias Biológicas. Universidad Michoacana de San Nicolás de Hidalgo, Morelia, Michoacán, México. 65 pp. [ Links ]
Marco, V. S. 2001. Modelización de la tasa de desarrollo de insectos en función de la temperatura. Aplicación al manejo integrado de plagas mediante el método de grados-día. Boletín de la Sociedad Entomológica Aragonesa, 28: 147-150. [ Links ]
Mitsunaga, T., Shimoda, T. & Yano, E. 2004. Influence of food supply on longevity and parasitization ability of a larval endoparasitoid, Cotesia plutellae (Hymenoptera: Braconidae). Applied Entomology and Zoology, 39: 691-697. [ Links ]
Mohan, C. & Sathiamma, B. 2007. Potential for lab rearing of Apanteles taragamae, the larval endoparasitoid of coconut pest Opisina arenosella, on the rice moth Corcyra cephalonica. BioControl, 52: 747-752. [ Links ]
Nofemela, S. R. 2004. Studies on parasitsm of the diamondback moth, Plutella xylostella (L.) (Lepidoptera: Tortricidae), in South Africa. Submitted in fulfilment of the requirements for the degree of master of science of Rhodes University, Grahamstown, South Africa. 92 p. [ Links ]
Oliveira, L., Meloy, R. & Tavares, J. 1998. Response of Glyptapanteles militaris (Walsh) (Hymenoptera: Braconidae), a larval parasitoid of the armyworm, Mythimna unipuncta (Haworth) (Lepidoptera: Noctuidae), to different temperatures. Journal of Hymenoptera Research, 7: 268-273. [ Links ]
Pereira, F., Barros, R., Pratissoli, D. & Parra, J. R. P. 2004. Biologia e exigências térmicas de Trichogramma pretiosum Riley e T. exiguum Pinto & Platner (Hymenoptera: Trichogrammatidae) criados em ovos de Plutella xylostella (L.) (Lepidoptera: Plutellidae). Neotropical Entomology, 33: 231-236. [ Links ]
Riquelme, M. B. & Botto, E. N. 2010. Estudios biológicos de Trichogrammatoidea bactrae Nagaraja (Hymenoptera: Trichogrammatidae), parasitoide de huevos de Tuta absoluta Meyrick (Lepidoptera: Gelechiidae). Neotropical Entomology, 39: 612-617. [ Links ]
Rosas-García, N. M & J. M. Villegas-Mendoza 2008. Bionomics of a novel species of Argyrotaenia (Lepidoptera: Tortricidae) presents in Mexico avocado orchards. Acta Zoológica Mexicana (n.s.), 24: 129-137. [ Links ]
Ruíz, M. C. & Cervantes, M. P. J. 2007. Reporte de una nueva plaga sobre zarzamora (Rubus sp.) en Coatepec, Veracruz, México. XXX Congreso Nacional de Control Biológico-Simposio de IOBC, Mérida Yucatán. Noviembre de 2007. 336-339 pp. [ Links ]
Segade, G. & Botto, E. N. 1996. Evaluación del parasitoide Trichogramma pretiosum (Hymenptera: Trichogrammatidae) como agente de control biológico de Anticarsia gemmatalis (Lepidoptera: Noctuidae) en condiciones de laboratorio. Ecología Austral, 6: 127-130. [ Links ]
Vargas, E. & Abarca, G. 1998. Relación entre el estrés y las bacterias entomopatógenas Pantoea (Erwinia) agglomerans (herbicola) y Bacillus cereus en jobotos (Coleoptera: Melolonthidae) (Phyllophaga spp., Anomala spp. y Cyclocephala spp.), en Costa Rica. Agronomía Mesoamericana, 9: 25-30. [ Links ]
Walker, K. R. & Welter, S. C. 2004. Biological control potential of Apanteles aristoteliae (Hymenoptera: Braconidae) on populations of Argyrotaenia citrana (Lepidoptera: Tortricidae) in California apple orchards. Environmental Entomology, 33: 1327-1334. [ Links ]
Whitfield, J. B. 1997. Subfamily microgastrinae, pp. 333-364. In: Wharthon, R. A., Marsh, P. M. & Sharkey, M. J. (Eds.). Manual of the new world genera of the family Braconidae (Hymenoptera). Special publication of the International Society of Hymenopterists No. 1. Washington, DC. [ Links ]
Yu, D. S., Achterberg, C. V. & Horstmann, K. 2005. World Ichneumonoidea 2004. Taxonomy, biology, morphology and distribution (Braconidae). Taxapad 2005 (Scientific names for information management) Interactive catalogue on DVD/CDROM. Vancouver. [ Links ]














