Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta zoológica mexicana
versão On-line ISSN 2448-8445versão impressa ISSN 0065-1737
Acta Zool. Mex vol.29 no.3 Xalapa Dez. 2013
Artículos originales
Recambio temporal de especies de lepidópteros nocturnos en función de la temperatura y la humedad en una zona de selva caducifolia en Yucatán, México
Temporal turnover of nocturnal Lepidoptera species with respect to temperature and humidity gradients in an zone of deciduous forest, in Yucatán, Mexico
Jorge L. MONTERO-MUÑOZ,1* Carmen POZO,1 M. Fernanda CEPEDA-GONZÁLEZ2
1 El Colegio de la Frontera Sur, Unidad Chetumal, Chetumal Quintana Roo, Mexico. <cpozo@ecosur.mx>, <lostrinosdeldiablo@gmail.com>
2 Capacitación y Asesorías Ambientales, Yucatán, México. <mafercepeda@hotmail.com>
*Autor de correspondencia <lostrinosdeldiablo@gmail.com>
Recibido: 12/11/2012;
aceptado: 26/06/2013.
RESUMEN
El principal objetivo de este trabajo es cuantificar el recambio temporal de mariposas nocturnas y su relación con dos gradientes ambientales: temperatura (° C) y humedad relativa (%). Utilizando una trampa de luz se realizó un muestreo por un periodo de 12 meses de una comunidad de mariposas nocturnas en la Reserva Biocultural Kaxil Kiuic (RBKK), ubicada en Yucatán, México. Se observó que el recambio de especies exhibe un marcado patrón temporal en relación con la variación de la temperatura y humedad relativa entre periodos climáticos. El periodo cálido y seco (marzo a julio) presentó la mayor disimilitud en la composición de especies, determinada principalmente por las familias: Noctuidae, Crambidae y Geometridae. Los resultados obtenidos tienen implicaciones para la conservación de la biodiversidad de mariposas nocturnas, ya que permiten establecer una línea base enfocada a detectar la influencia de las variaciones climáticas sobre la composición de especies.
Palabras clave: recambio de especies, temperatura, humedad, mariposas nocturnas, México.
ABSTRACT
The aim of this paper is to estimate the temporal of turnover pattern of moths species in relation to two environmental gradients: temperature (° C) and relative humidity(%). Using a light trap method, a community of moths were sampled for a period of 12 months, in the Kaxil Kiuic Biocultural Reserve located in Yucatán, Mexico. It was demonstrated that species turnover exhibits a strong temporal pattern in relation to temperature and relative humidity variation between climatic periods. The warm and dry period (March to July) had the highest dissimilatity in species composition, determined mainly by families: Noctuidae, Geometridae and Crambidae. This study provides information on the temporal pattern of temporal species turnover for families with high species richness of Neotropical moths. The results obtained have implications for conservation of moth biodiversity, since they allow a base line to be established, focused on detecting the effects of climatic variations on species composition.
Key words: species turnover, temperature, humidity, moths, México.
INTRODUCCIÓN
El recambio de especies (turnover) denota el cambio direccional en la composición de especies como resultado de lo que observamos en función del efecto de un gradiente físico, ambiental o temporal y mide la magnitud del cambio en la identidad, abundancia relativa, biomasa y/o cobertura de individuos entre muestras en un gradiente (Oksanen & Tonterii 1995, Nekola & White 1999, Vellend 2001, Legendre 2007, Anderson et al. 2010). Se han planteado diferentes hipótesis para explicar el cambio en la composición de especies que pueden ser interpretadas en el plano espacial y temporal, entre ellas: el efecto de la heterogeneidad ambiental, la capacidad de respuesta de las especies a los cambios ambientales, el régimen de perturbación, la competencia, los procesos neutrales y estocásticos de dispersión de las especies (Hubbell 2001, Legendre et al. 2005).
Analizar el recambio temporal de especies con relación a la variación de gradientes climáticos, permite incoporporar especies que son sensibles a los cambios a través del tiempo (Alder & Lauenronth 2003). Para las comunidades de insectos como las mariposas nocturnas, los cambios climáticos como la estación seca y humeda, afectan a las poblaciones (Wolda 1988), exhibiendo marcados patrones de variación temporal (Summerville & Crist 2005).
Los factores climáticos que influyen en el recambio de especies de mariposas nocturnas, han sido estudiados principalmente en ambientes templados (Virtanen & Neuvonen 1999, Axmacher et al. 2009, Choi 2008, Summerville & Crist 2008, Ober & Hayes 2010) y poco frecuentemente en zonas tropicales (Beck et al. 2002, Beck & Chey 2007, Beck & Chey 2008, Beck et al. 2012). Los factores que más frecuentemente han sido considerados predictores del cambio en la composición de especies son: la elevación, estructura de la vegetación y, a nivel temporal, factores climáticos como la precipitación y fotoperiodos (Kitching et al. 2000, Beck et al. 2002, Gunnar et al. 2003, Zahoor et al. 2003, Beck & Chey 2007, Aslam 2009, Axmacher & Fiedler 2008, Axmacher et al. 2009, Ober & Hayes 2010, Fuentes-Montemayor et al. 2012, Beck et al. 2012).
Entre los factores climáticos que influyen en la composición de especies de mariposas nocturnas se han reportado la temperatura y la humedad relativa, tanto en zonas templadas como tropicales (Roy et al. 2001, Gunnar et al. 2003). Axmacher & Fiedler (2008), sugieren que en zonas tropicales, los cambios de temperatura y humedad condicionan la diversidad local y el recambio de especies exhibiendo marcados patrones de variación temporal. La rápida respuesta de las mariposas nocturnas a las variaciones climáticas y su alta diversidad permiten estudiar el efecto de la temperatura y humedad sobre el cambio en la composición de especies.
En México, a pesar de que se tiene un buen conocimiento taxonómico de la fauna de lepidópteros (Michán et al. 2005), los trabajos de ecología para mariposas nocturnas son prácticamente nulos. Buscando contribuir a un mayor conocimiento de la ecología de dicho grupo, este trabajo se enfoca a estudiar el efecto de dos gradientes ambientales: temperatura (°C) y humedad relativa (%), sobre el recambio temporal en la composición de especies de una comunidad de lepidópteros nocturnos en una selva caducifolia. En este estudio se plantean los siguientes objetivos: a) describir la dinámica temporal en la composición de especies de mariposas nocturnas, b) detectar diferencias en la composición de especies entre periodos climáticos y c) establecer correlaciones entre el recambio de especies con las variaciones de temperatura y humedad relativa.
MATERIAL Y MÉTODOS
Área de estudio. El estudio se llevó a cabo en la Reserva Biocultural Kaxil Kiuic (RBKK), ubicada en el estado de Yucatán, México (20° 06' 10.8" N; 89° 33' 43.2" O) (Fig. 1). El área de estudio tiene una extensión de 1,642 hectáreas de selva baja y mediana caducifolia, donde se han registrado más de 450 especies y 98 familias de plantas. La principal característica de la vegetación caducifolia es la pérdida de las hojas de las plantas por un periodo entre 5 a 8 meses (durante la época seca). Esta pérdida afecta a la mayoría de las especies (Rzedowzki 2006).
La vegetación presenta mas de 50 años de regeneración, aunque en el pasado fue utilizada para actividades agrícolas. El clima de la región es AW0, el cual se caracteriza por ser cálido subhúmedo con lluvias en verano y 10% de lluvia invernal. La temperatura media anual es de 26° C y la precipitación media asciende a 1,100 mm al año (Flores & Espejel 1994).
Muestreo. Se muestrearon las mariposas nocturnas de forma mensual por un periodo de un año (marzo de 2009 a febrero de 2010), utilizando una trampa de luz blanca (New 2004) por cuatro noches consecutivas en la selva mediana caducifolia, por un periódo de 7 horas cada noche. Las noches de muestreo correspondieron siempre a las noches de luna nueva, con el objetivo de que la luz de la luna no influyera en la captura.
Determinación y preservación. Se llevó a cabo la identificación de los especímenes con base en sus características morfológicas. La bibliografía utilizada para la identificación fue: Carter (1992), Pescador-Rubio (1994), Gómez & Gómez (1995), Balcazar & Beutelspacher (2000), Piñas et al. (2000), Barnes (2002), Covell (2005), Mississippi Entomological Museum (2006), Janzen & Hallwachs (2009), Opler & Powell (2009), Walsh (2011), Barcode of Life Systems (2012). Sin embargo, aún existe una porción de especímenes sin identificar. Para el listado de este trabajo, se siguió la clasificación taxonómica de Lepidoptera Barcode for Life-Lepidoptera Species Checklist for North America (iBOL 2009) y Barcode of Life Systems (2012).
Los especímenes se sacrificaron por medio de morgues de vidrio y posteriormente se guardaron en recipientes con naftalina para su conservación durante la transportación. El material fue depositado en la colección de Lepidópteros del Museo de Zoología de El Colegio de la Frontera Sur (ECOSUR) Unidad Chetumal, Chetumal, Quintana Roo, México, con número de registro ante el INE: QNR.IN.018.0497.
Periodos climáticos. Para definir los periodos climáticos se tomaron datos de temperatura (° C) y humedad relativa (%). Ambos parámetros se midieron diariamente cada 30 minutos durante todo el periodo de muestreo utilizando la estación meteorológica del Centro de Investigación Científica de Yucatán (CICY), ubicada en el sitio de estudio. Para el análisis de los datos se trabajó con el promedio mensual de temperatura y humedad relativa.
Eficiencia de muestreo. Para la evaluación de la eficiencia de muestreo se utilizó la pendiente asintótica del modelo de acumulación de especies basado en la ecuación de Clech (Soberón & Llorente 1993, León-Cortés et al. 1998, Hortal & Lobo 2005). La ventaja de este método es que permite establecer un valor de referencia para determinar la tasa en que se adjuntan nuevas especies a las muestras, lo que sugiere una medida comparativa de eficiencia de muestreo (Soberón & Llorente 1993).
El modelo de Clench está recomendado para estudios realizados en largos periodos de tiempo y para áreas grandes de estudio y se prefiere sobre los estimadores no paramétricos de riqueza, debido a que no debe cumplir el supuesto de que la probabilidad de captura de la especies es constante a lo largo del periodo del estudio (Burnham & Overton 1979). En este estudio se consideró que las familias con un adecuado esfuerzo de muestreo alcanzan ≥ 80% del número de especies esperadas (González-Valdivia et al. 2012). Para eliminar la arbitrariedad en el orden de las muestras, éstas fueron aleatorizadas (Colwell & Coddington, 1994, Moreno & Halffter, 2000) usando el programa EstimateS (Colwell, 2009).
Recambio temporal en la composición de especies. El recambio temporal en la composición de especies de mariposas nocturnas entre periodos climáticos, se midió por medio de un análisis de varianza no paramétrico PERMANOVA, utilizando 999 permutaciones y la prueba de PERMDISP para evaluar la heterocedasticidad entre grupos (Anderson et al. 2008). Este análisis permite probar, para cualquier diseño de ANOVA, la respuesta simultanea de una o más variables entre uno o varios factores mediante la partición de la varianza (Anderson 2001, McArdel & Anderson 2001), creando un estadístico de distribución basado en permutaciones (Anderson & terBraak 2003). El resultado es una matriz triangular que muestra la distancia entre pares de muestras, lo cual permite evaluar la dismilitud entre factores y la distancia entre centroides de grupo (Kruskal & Wish 1978, Anderson 2001).
La medida utilizada para crear la matriz tringular fue la disimilitud del coeficiente cuantitativo asimétrico de Bray-Curtis (Legendre & Legendre 1998), utilizando el ajuste de Clark et al. (2006). Estos mismos autores, señalan las ventajas que ofrece este índice: es de fácil intrepretación ya que las muestras toman valores de cero cuando son idénticas, por otro lado, muestra su disimilitud cuando las muestras no tienen especies en común; además, es asimétrico, ya que no incluye las coausencias en las muestras.
La matriz de dismilitud se representó gráficamente en un análisis de ordenación multidimensional no métrico (NMDS). Este tipo de ordenación permite visualizar el patrón de dispersión de disimilitud entre muestras y ajustar las variables de temperatura y humedad relativa con la función envfit del paquete de cómputo para el lenguaje R (Development Core Team 2012), vegan (Oksanen et al. 2012). Dicha función relaciona los vectores (temperatura y humedad) con la ordenación resultante del NMDS. De forma adicional, la contribución de cada familia a la disimilitud en la composición de especies entre periodos climáticos, se evaluó mediante la cuantificación del número de especies exclusivas de cada periodo y número de especies compartidas.
RESULTADOS
Periodos climáticos. El análisis de los datos de temperatura y humedad relativa permitió distinguir tres periodos climáticos: a) Cálido-Seco (CS): de marzo a julio, con un promedio de temperatura de 27.11° C ± 2.01 DE, con un intervalo de 23.66 a 28.94° C y de humedad relativa promedio de 65.99% ± 2.81 DE, con un intervalo de 59.96 a 73.55%; b) Cálido-Húmedo (CH): de agosto a octubre, con un promedio de temperatura de 26.34° C ± 0.27 DE, con un intervalo de 26.03 a 26.51° C y humedad relativa promedio de 80.63% ± 1.72 DE, con un intervalo de 79.13 a 82.50% y c) Frío-Húmedo (FH): de noviembre a febrero con un promedio de temperatura de 21.82° C± 0.73 DE, con un intervalo de 20.92 a 22.53° C y una humedad relativa promedio de 80.19% ± 7.22 DE, con un intervalo de 72.00 a 86.44% (Fig. 2). El mes de febrero y julio se clasifican en épocas diferentes a pesar de presentar valores similares de humedad debido a la temperatura, la cual es mayor en julio.
Eficiencia de muestreo. Se capturaron 11,956 individuos, de 546 especies y 17 familias. Sin embargo, sólo las familias que presentaron mas de 10 especies en total, fueron considerandas para este trabajo. Por lo anterior, el número total de especies analizadas es de 322 distribuidas en 7 familias.
La eficiencia de muestreo refleja el nivel de representatividad del número de especies por familia, siendo: Noctuidae, Crambidae y Geometridae, las que presentaron, en total, el mayor número de especies y una eficiencia de muestreo mayor a 80%, por lo que fueron consideradas las mejores representadas en el muestreo. A nivel familia, en cada periodo climático se observó que: Noctuidae, Geometridae, Sphingidae y Saturniidae, presentaron el mayor número de individuos y especies en el periódo CS y el menor en el periódo FH. La familia Noctuidae mostró el mayor número de especies y especies exclusivas en cada periodo, destacando su aportación con poco más del 40% para el periodo de CS. Las familias Arctiidae y Notodontidae, son las únicas que registraron un aumento en el número de especies y especies exclusivas del periódo CH al FH. La familia Crambidae fue la única que presentó la mayor riqueza de especies en el periódo CH (Cuadro 1).
A lo largo del estudio se registraron: 200 especies (62.3%) con menos de 10 individuos; 81 especies (25.2%) con una abundancia entre 11 y 50 individuos; 17 especies (5.3%) presentaron registros entre 51 y 100 individuos y; 24 especies (7.5%) tuvieron más de 100 individuos. Las especies con mayor abundancia total fueron: Diphthera festiva (317 individuos), Hypsoropha adeona (561 individuos), Toxonphrucha diffundens (422 individuos), Eacles imperialis quintanensis (385 individuos). A nivel de géneros, los más abundantes fueron: Epidromia sp. (1,533 individuos), Iridopsis sp. (602 individuos) y Psara sp. (714 individuos) (Cuadro 2).

Recambio temporal en la composición de especies de la comunidad. Se observaron diferencias en la composición de especies de lepidópteros nocturnos entre los tres periodos climáticos (n=12, F=2.467, gl=9, p=0.0059). El promedio de disimilitud para cada periódo climático fue: a) CS 63.66 % ± 9.90 DE, con un intervalo de 46.88 a 71.04 %; b) CH 57.91 % ± 3.68 DE, con un intervalo de 53.84 a 61.01 % y c) FH 43.96 % ± 2.49 DE, con un intervalo de 40.35 a 46.05 %.
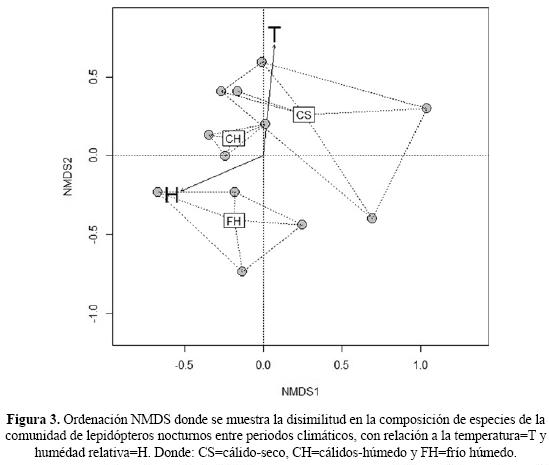
En el análisis de ordenación NMDS (Fig. 3) se muestra la disimilitud en la composición de especies de la comunidad de lepidópteros nocturnos entre periodos climáticos, con relación a los vectores de temperatura y humedad relativa. El valor de disimilitud entre centroides de los tres periodos fue: CS vs. FH=92.27%, CS vs. CH=90.64% y FH vs. CH=81.31%. El periódo CS presenta mayor disimilitud en comparación con los periódos CH y FH, que se relacionan de forma significativa con el aumento de temperatura y dismunición de la humedad relativa (r2=0.96, p=0.001). Por el contrario, el periódo FH presenta menor disimilitud que CH, la cual se relaciona de forma significativa con el aumento de la humedad relativa y disminución de la temperatura (r2=0.93, p=0.001).
Del total de especies observadas, las especies exclusivas representaron el 45% (145 especies). De esta proporción, la contribución por periodo climático fue: CS 53.10 % (77 especies), CH 25.51% (37 especies) y FH 21.37 % (31 especies); la proporción de especies compartidas entre dos o más periodos fue del 55.28% (177 especies).
DISCUSIÓN
En una zona tropical de selva caducifolia, como la RBKK, las variaciones temporales de temperatura y humedad relativa, entre periodos climáticos, son buenos predictores del recambio en la composición de especies de mariposas nocturnas. Los resultados obtenidos apoyan a Axmacher & Fiedler (2008), quienes sugieren que en zonas tropicales, los cambios de temperatura y humedad condicionan la diversidad local y el recambio de especies de mariposas nocturnas. Estos factores crean condiciones térmicas que influyen en la capacidad de respuesta ecofisiológica de las especies como la capacidad de vuelo y la tasa de crecimiento (Virtanen y Neuvonen 1999, Kitching et al. 2000). Estas características reflejan la heterogeneidad del ambiente, lo cual apoya dos de la hipótesis planteadas por Hubbell (2001) y Legendre et al. (2005) para explicar el cambio en la composición de especies.
En este estudio se observaron tres periodos climáticos basados en las variaciones de temperatura y humedad relativa, los cuales coinciden con los reportados por Capurro (2002) para la Península de Yucatán. En el periódo CS se registró la mayor temperatura y la menor húmedad relativa, y es cuando se registró la mayor riqueza de especies y abundancia, con un aumento del número de especies exclusivas, lo que se ve reflejado en el aumento en la disimilitud. Por el contrario, en el periodo FH se registró la menor temperatura y la mayor humedad relativa, y es cuando se observa una disminución en la disimilitud.
El patrón de disimilitud temporal ocurre por sustitución de especies entre los periodos climáticos, influenciado por especies que fueron registradas únicamente en el periodo CS y, que presentaron las mayores abundancias, como: Eacles imperialis quintanensi, Toxonphrucha diffundens, Hypsoropha adeona, Melipotis perpendiculari, Obrima cymbae.
Sin embargo, las diferencias en la disimilitud entre los tres periodos climáticos no sólo se deben al efecto directo de las variaciones climáticas, sino, también al efecto de la temperatura y humedad sobre la vegetación (Axmacher et al. 2009). Para la selva caducifolia, la temperatura y la humedad son factores que determina la distribución y diversidad de la vegetación (Rzedowski 2006). Los cambios en la vegetación son predictores de la diversidad de mariposas nocturnas (Beck et al. 2002); la disponibilidad de plantas hospederas y de recursos alimenticios, también influye en el recambio de especies (Gunnar et al. 2003, Fuentes-Montemayor et al. 2012).
Al análizar el patrón temporal en la composición de especies, especies exclusivas, especies compartidas y número de individuos, por familia, se observó que la Noctuidae es la mejor representada en la zona de estudio. Este resultado era de esperarse ya que es una de las más diversas del Neotrópico (New 2004). Para los noctuidos, la temperatura elevada es un factor determinante para el aumento en su diversidad y abundancia (Zahoor et al. 2003, Choi 2008), condición registrada en el periodo CS. Asimismo, para algunas especies de la familia Sphingidae también se reporta el aumento de la riqueza en temperaturas superiores a los 26.5° C (León-Cortés 2000), tal como se observó para Cautethia yucatana.
Otras familias como Crambidae y Geometridae, también bien representadas en zonas tropicales (Barlow & Woiwod 1989), registraron un procentaje de eficiencia de muestreo mayor al 80%. Así, estas dos familias, junto con los noctuidos, se registraron a lo largo de todo el año. Sin embargo, a pesar de que pueden ser encontradas en los tres periodos climáticos, también muestran una marcada temporalidad, influyendo fuertemente en el recambio temporal de la comunidad. El registro de familias con eficiencias de muestreo entre el 71 y 79%, sugiere que es posible que en la RBKK hayan más especies de las que se registron en este estudio y que un mayor recambio de especies se puede dar a una mayor escala, tal como los observaron Summerville et al. (2001).
Las especies exclusivas de cada periodo climático muestran una estrecha tolerancia a las variaciones climáticas en que pueden ocurrir, reflejando su estacionalidad. Este comportamiento se observó en las especies con mayor abundancia, principalmente en el periodo CS. Por el contrario, las especies compartidas entre dos o más periódos, presentan una mayor capacidad de tolerancia a dichas variaciones, permaneciendo de forma constante a lo largo del año y manteniendo una diversidad base en el sitio de estudio y que conforma la fauna que es más probable de encontrar en muestreos realizados en cualquiera de los tres periodos climáticos.
Considerando que por primera vez se hace un muestreo sistemático de este grupo en la región y por un periodo de muestreo de un año, y que el número de familias con menos de 10 especies es alto, se sugiere aumentar el esfuerzo de colecta para enriquecer el análisis del recambio temporal en la composición de especies de la comunidad, en función de las variaciones de temperatura y humedad relativa.
La RBKK forma parte de un agropaisaje y contribuye a la conservación de una gran cantidad de especies de lepidópteros nocturnos. Los resultados obtenidos en este trabajo pueden tener implicaciones para la conservación de la biodiversidad de mariposas nocturnas tropicales, ya que brindan información para construir una línea base enfocada en la detección de los efectos de las variaciones climáticas sobre la composición de especies y aportando una primera aproximación del comportamiento de la diversidad. En el caso particular de las mariposas nocturnas, el impacto del cambio climático sobre las poblaciones puede ser puesto en evidencia monitoreando el recambio temporal de la composición de especies de la comunidad y los gradientes ambientales de temperatura y la humedad relativa. Esta información, puede ser utilizada en el manejo y conservación de la biodiversidad, así como para la evaluación y aprovechamiento de los servicios ambientales por polinización de una gran variedad de plantas (de selva y de cultivo), que se lleva a cabo por lepidópteros nocturnos.
AGRADECIMIENTOS
El presente estudio forma parte de la tesis doctoral de Jorge Luis Montero Muñoz, la cual se realizó gracias a la beca doctoral del CONACYT no. 248216/213322. Agradecemos el apoyo de la fuente finaciadora SEP-CONACYT Proyectos de Ciencia Básica 84127 (México). Se agradece a Blanca Prado Cuellar y Estela Domínguez Mucul de ECOSUR, por su contribución en la identificación de los especímenes; a Juan Manuel Dupuy Rada del CICY por su contribución con los datos climáticos y a James Callaghan de la Reserva Biocultural Kaxil Kiuic por su ayuda en la lógistica del trabajo de campo.
LITERATURA CITADA
Alder, P.B. & Lauenronth, W.K. 2003. The power of time: spaciotemporal scaling of species diversity. Ecology Letters, 6: 749-756. [ Links ]
Anderson, M. J. 2001. A new method for non-parametric multivariate analysis of variance. Austral Ecology, 26: 32-46. [ Links ]
Anderson M. J. & terBraak, C. J. F. 2003. Permutation test for multi-factorial analysis of variance. Journal of Statistical Computation and Simulation, 73:85-113. [ Links ]
Anderson, M. J., Gorley, R. N. & Clarke, K. R. 2008. PERMANOVA+ for PRIMER: Guide to software ans statistical methods. PRIMER-E. Plymouth, UK. [ Links ]
Anderson, M. J., Crits, T. O., Chase, J. M., Velled, M., Inouve, B. D., Freestone, A. L., Sanders, N. J., Cornell, H. V., Comita, L. S., Davies, K. F., Harrison, S. P., Kraft, N. J., Stegen, J. C. & Swenson, N. G. 2010. Navigating the multiple meanings of β diversity: a roadmap for the practicing ecologist. Ecology Letters, 14:19-28. [ Links ]
Aslam, M. 2009. Diversity, species richness and evenness of moth fauna of Peshawar. Pakistan Entomology, 2: 99-102. [ Links ]
Axmacher, J.C. & Fiedler, K. 2008. Habitat type modifies geometry of elevational diversity gradients in geometrid moths (Lepidoptera Geometrdae) on Mt Kilimanjaro, Tanzania. Tropical Zoology, 21:243-251. [ Links ]
Axmacher, J.C., Brehm, G., Hemp, A., Tunte, H., Lyaruu, H. V. M., Muller-Hohenstein, K. & Fiedler, K. 2009. Determinants of diversity in afrotropical herbivorous insects (Lepidoptera: Geometridae): plant diversity, vegetation structure or abiotic factor Journal of Biogeography, 36: 337-349. [ Links ]
Balcázar, L. M. A. & Beutelspacher, C. R. B. 2000. Saturniidae (Lepidoptera), pp. 501-513. In: Llorente Bousquets ,J., González Soriano, E. & Papavero, N. (Eds.). Biodiversidad, taxonomía y biogeografía de artrópodos de México. Hacia una síntesis de su conocimiento. Volumen II. Facultad de Ciencias, UNAM, CONABIO y BAYER, México. [ Links ]
Barcode of Life Systems. 2012. International Barcode of Life. en. www.barcodinglife.com [ Links ]
Barnes, M. 2002. Moths of Belize. en www.mbarnes.force9.co.uk/belizemoths/belizehome.htm [ Links ]
Barlow, H. S. & Woiwod, I. P. 1989. Moth diversity of a tropical forest in penninsular Malaysia. Journal Tropical Ecology, 5: 37-50. [ Links ]
Beck, J., Schulze, C. H., Linsenmair, K. E. & Fieldler, K. 2002. From forest to farmland: diversity and community structure of geometridae moths along two habitat gradients on Borneo. Journal of Tropical Ecology, 17:33-51. [ Links ]
Beck, J. & Chey, V. K. 2007. Beta-diversity of geometrid moths from northern Borneo: effects of habitat, time and space. Journal of Animal Ecology, 76: 230-237. [ Links ]
Beck, J. & Chey, V. K. 2008. Explaining the elevational diversity pattern of geometrid moths from Borneo: a test of five hypotheses. Journal of Biogeography, 35: 1452-1462. [ Links ]
Beck, J., Holloway, J. D., Chey, V. K. & Kitching, I. J. 2012. Diversity partitioning confirms the importance of beta components in tropical rainforest Lepidoptera. The American Naturalist, 180: 64-74. [ Links ]
Burnham, K. P. & Overton, W. S. 1979. Robust estimation of the size of a closed population when capture probabilities vary among animals. Ecology, 60: 927-936. [ Links ]
Capurro, L. 2002. A large coastal ecosystem: the Yucatan Peninsula. Advances and Perspectives (Spanish). 22:69-75. [ Links ]
Carter, D. 1992. Manuales de Identificación. Mariposas diurnas y nocturnas. Ediciones Omega, España. [ Links ]
Clarke, K. R., Somerfield, P. J. & Chapman, M. G. 2006. On resemblance measures for ecological studies, including taxonomic dissimilarities and a zero-adjusted Bray–Curtis coefficient for denuded assemblages. Journal of Experimental Marine Biology and Ecology, 330: 55-80. [ Links ]
Covell, C. V. Jr. 2005. A Field Guide to Moths of Eastern North America. Virginia Museum of Natural History & Smithsonian Institution. 12a Edición, USA. [ Links ]
Choi, S.W. 2008. Effects of wheater factors on the abundance and diversity of moths in a temperature deciduos mixed forest of Korea. Zoological Science, 25: 53-58. [ Links ]
Colwell, R. K. & Coddington, J. A. 1994. Estimating terrestrial biodiversity through extrapolation. In: Hawksworth, D. L. (Ed.). Biodiversity: measurement and estimation. Chapman and Hall. London. [ Links ]
Colwell, R. K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User's Guide and application. http://purl.oclc.org/estimates [ Links ]
Flores, J. S. & Espejel, C. I. 1994. Tipos de vegetación de la Península de Yucatán. Etnoflora Yucatanense. Vol 3.Universidad Autónoma de Yucatán, Mérida, Yucatán, México. [ Links ]
Fuentes-Montemayor, E., Goulson, D., Cavin, L., Wallace, J. M. & Park, K. J. 2012. Factors influencing moth assemblages in wooland fragments on framland: implications for woodland management and creation schemes. Biological Conservation, 153: 265-275. [ Links ]
González-Valdivia, N. A., Arriaga-Weiss, S. L., Ochoa-Gaona, S., Ferguson, B. F., Kampicler, C. & Pozo, C. 2012. Ensamble de aves diurnas a tráves de un gradiente de perturbación en un pasisaje en el sureste de México. Acta Zoológica Mexicana (n.s.), 28: 237-269. [ Links ]
Gómez y Gómez, B. 1995. La familia Geometridae (Insecta: Lepidóptera) en Rancho Nuevo, San Cristóbal de las Casas, Chiapas, México. Tesis de Licenciatura, Universidad de Ciencias y Artes del estado de Chiapas, México. [ Links ]
Gunnar, B., Homeier, J. & Fiedler, K. 2003. Beta diversity of geometrid moths (Lepidoptera: Geometridae) in Andean montane rainforest. Diversity and Distributions, 9: 351-366. [ Links ]
Hortal, J. & Lobo, J. M. 2005. An ED-based protocol for the optimal sampling of biodiversity. Biodiversity and Conservation, 14: 2913-2947. [ Links ]
Hubbell, S. J. 2001. The Unified Neutral Theory of Biodiversity and Biogeography. Princeton University Press, New Jersey. [ Links ]
iBOL. 2009. International Barcode of Life. En www.lepbarcoding.org [ Links ]
Janzen, D. H. & Hallwachs, W. 2009. Dynamic database for an inventory of the macrocaterpillar fauna, and its food plants and parasitoids, of Area de Conservación Guanacaste (ACG), northwestern Costa Rica (nn-SRNP-nnnnn voucher codes). http://janzen.sas.upenn.edu [ Links ]
Kitching, R. L., Orr, A. G., Thalib, L., Mitchell, H., Hopkos, M. S. & Graham, A.W. 2000. Moth assemblages as indicators of enviromnetal quality in remnats of upland Australian rain forest. Journal of Applied Ecology, 37: 284-297. [ Links ]
Kruskal J.B. & Wish, M. 1978. Multidimensional Scaling. Sage Publications, Beverly Hills. [ Links ]
Legendre, P. & Legendre, L. 1998. Ecological resemblance. Developments in Environmental Modelling, 20: 247-302. [ Links ]
Legendre, P., Borcard, D. & Peres-Neto, R. 2005. Analyzing beta diversity: Partitioning the spatial variation of community composition data. Ecological Monographs, 75: 435-450. [ Links ]
Legendre, P. 2007. Study beta diversity: ecological variation partitioning by multiple regression and canonical analysis. Jourrnal of Plant Ecology, 1: 3-8. [ Links ]
León-Cortés, J. L., Soberón-Mainero, J. & Llorente Bousquets, J. 1998. Assessing completeness of Mexican sphinx moth inventories through species accumulation functions. Diversity and Distribution, 4: 37-44. [ Links ]
León-Cortés, J. L. 2000. Sphingoidea (Lepidoptera). pp. 483-500. In: Llorente-Bousquets, J., González-Soriano, E. & Papavero, N. (Eds.). Biodiversidad, taxonomía y biogeografía de artrópodos de México: Hacia una síntesis de su conocimiento. Vol II. UNAM, México, D.F. [ Links ]
McArdle, B. H. & Anderson, M. J. 2001. Fitting multivariate models to community data: a comment on distance-based redundancy analysis. Ecology, 82: 290–297. [ Links ]
Michán, L., Llorente-Bousquets, J., Luis-Martínez, A. & Castro, D. J. 2005. Breve historia de la taxonomía de lepidoptera en México durante el siglo XX. Revista de la Académia Colombiana de Ciencias, 29: 101-132. [ Links ]
Mississippi Entomological Museum. 2006. Monograph-type Plates-Moth Identification Series. Mississippi State University. http://mothphotographersgroup.msstate.edu/Plates.shtml [ Links ]
Moreno, C. E. & Halffter, G. 2000. Assessing the completeness of bat biodiversity inventories using species accumulation curves. Journal of Applied Ecology, 37: 149-158. [ Links ]
Nekola, J.C. & White, P. S. 1999. The distance decay of similarity in biogeography and ecology. Journal of Biogeography, 26: 867-878. [ Links ]
New, T. R. 2004. Moths (Insecta: Lepidoptera) and conservation: background and perspective. Journal of Insect Conservation, 8: 79-94. [ Links ]
Ober, H. K. & Hayes, J. P. 2010. Determinants of nocturnal Lepidopteran diversity and community structura in a conifer-dominated forest. Biodiversity and Coservation, 19: 761-774. [ Links ]
Oksanen, J. & Tonterii, T. 1995. Rate of Compositional turnover along gradients and total gradient length. Journal of Vegetation Science, 6: 815-824. [ Links ]
Oksanen, J. O., Kindt, R., Legendre, P., O'Hara, B., Simpson, G. L., Solymos, P., Stevens, M. H. & Wagner, H. 2012. Vegan: idem Community ecology package. R. Package Versión 2.15.1, http//CRAN.R-project.org/package=vegan. [ Links ]
Opler, A. & Powell, J. A. 2009. Moths of Western North America. University of California, USA. [ Links ]
Pescador-Rubio, A. 1994. Manual de identificación para las mariposas de la familia Sphingidae (Lepidóptera) de la estación de biología "Chamela", Jalisco, México. Cuadernos del Instituto de Biología 22, México. [ Links ]
Piñas, F. R., Rab-Green, S., Onore, G. & Manzano, I. P. 2000. Mariposas del Ecuador. Familia: Arctiidae. Subfamilias: Arctiinae & Pericopinae. Vol. 20. Museo de Zoología Centro de Biodiversidad y ambiente, departamento de Ciencias Biológicas, Pontificia Universidad Católica del Ecuador, Ecuador. [ Links ]
R Development Core Team (2012). R: A language and environment for statistical computing. R Foundation for Statistical Computing,Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org/. [ Links ]
Rzedowski, J. 2006. Vegetación de México. 1° edición. Edición digital. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México. [ Links ]
Roy, D. B., Rothery, P., Moss, D., Pollard, E. & Thomas, J. A. 2001. Butterfly numbers and weather: predicting historical trends in abundance and the future of climate change. Journal Animal Ecology, 70: 201-217. [ Links ]
Soberón, J. & Llorente, J. 1993. The use of species accumulation functions for the prediction of species richness. Conservation. Biology, 7: 480-488. [ Links ]
Summerville, K. S., Metzler, E. H. & Crist, T. O. 2001. Diversity of Lepidoptera in Ohio Forests at Local and Regional Scales - How Heterogeneous is the Fauna? Annuals of the Entomological Society of America, 94: 583-591. [ Links ]
Summerville, K. S. & Crist ,T. O. 2005.Temporal patterns of species accumulation in a survey of Lepidoptera in abeech-maple forest. Biodiversity and Conservation, 14: 3393–3406. [ Links ]
Summerville, K. S. & Crist, T. O. 2008. Structure and conservation of Lepidopteran communities in managed forests of northeastern North America: a review. Canadian Entomology, 140: 475-494. [ Links ]
Vellend, M. 2001. Do commonly used indices of beta-diversity measure species turnover?. Journal of Vegetation Science, 12: 545-552. [ Links ]
Virtanen, T. & Neuvonen, S. 1999. Climate chance and macrolepidoptera biodiversity in Finland. Chemosphera: Global Chance Science, 1: 439-448. [ Links ]
Walsh, B. 2011. The Moths of Southeastern Arizona. nitro.biosci.arizona.edu/zeeb/butterflies/mothlist.htmlLinks ]nitro.biosci.arizona.edu/zeeb/butterflies/mothlist.html" target="_blank">.
Wolda, H. 1988. Insect seasonality: why? Annual Review of Ecology and Systematics, 19: 1-18. [ Links ]
Yoccoz, N. G., Nichols, J. D. & Boulinier, T. 2001. Monitoring of biological diversity in space and time. Trends in Ecology and Evolution, 8: 446-453. [ Links ]
Zahoor, M. K., Suhail, A., Iqbal, J., Zulfaqar, Z. & Anwar, M. 2003. Biodiversity of Noctuidea (Lepidoptera) in agro-forest area of Faisalabad. International Journal of Agricultura & Biology, 4: 560-563. [ Links ]














