Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.29 no.1 Xalapa abr. 2013
Artículos originales
Uso de microhábitat y termorregulación en Sceloporus horridus horridus (Wiegmann 1939) (Sauria: Phrynosomatidae)
Microhabitat use and thermoregulation in Sceloporus horridus horridus (Wiegmann 1939) (Sauria: Phrynosomatidae)
María Guadalupe BUSTOS ZAGAL1, Javier MANJARREZ2 & Rubén CASTRO-FRANCO1†
1 Laboratorio de Herpetología, Departamento de Biología Animal, Centro de Investigaciones Biológicas, Universidad Autónoma del Estado de Morelos, Av. Universidad 1001, Chamilpa 62209, Cuernavaca, Morelos, México. (MGBZ) <bustosgu@uaem.mx>, (RCF) <castro@uaem.mx>. †Autor de correspondencia
2 Centro de Investigación en Recursos Bióticos, Universidad Autónoma del Estado de México. Instituto Literario 100. Toluca, Estado de México. CP 50000
Recibido:15/05/2012;
aceptado: 21/11/2012.
RESUMEN
En este trabajo se examina el uso que hace Sceloporus horridus de los diferentes microhábitats durante el día, año, por sexo, por edad, en diferentes intervalos de altura y sus implicaciones para la termorregulación y la conservación. El 49.5% de las lagartijas usan árboles, 32.62% rocas y 2.3% arbustos (χ2 = 216.06, gl 3,p < 0.05). El uso de microhábitat por edades, con los sexos separados, reveló diferencias significativas entre crías, subadultos y adultos. En hembras, las crías utilizan con mayor frecuencia las rocas, mientras que las subadultas y adultas utilizan árboles (χ2 = 13.38, gl 6,p < 0.05). En machos, las crías y subadultos usan rocas, y los adultos árboles (χ2 = 15.22, gl 4, p < 0.05). La distribución altitudinal tiene efectos en el uso de hábitat; en el intervalo altitudinal de 800 a 1,100 m, estas lagartijas tienden a ser más arborícolas, y entre los 1,100 y 1,400 m usan con mas frecuencia las rocas (χ2 = 36.21, gl 6, p < 0.05). En la época de sequía hubo una diferencia significativa en el uso de los microhábitats entre las 9:00 y 14:00 horas, con el mayor número de avistamientos sobre árboles y rocas. En la temporada de lluvias no hubo diferencias significativas en el uso de microhábitat entre las horas del día. La temperatura promedio del cuerpo fue 33.52 °C (22.0-39.0 °C ± 2.9). No hubo diferencias significativas de la temperatura corporal de lagartijas en diferentes microhábitats. En todos los microhábitats las temperaturas cloacales fueron entre 2 °C y 3 °C más altas que las temperaturas del aire y sustrato. La mayor cantidad de avistamientos fue entre las 10:00 y 15:00 h, por lo que se considera a estas lagartijas de hábitos diurnos con sistema de calentamiento tigmotermo y heliotermo. Hubo diferencias significativas (F1,414 = 5.0918, p = 0.024561) en la temperatura cloacal de lagartijas entre los períodos de lluvias (33.2 °C ± 3.17, n = 215) y secas (34.2 °C ± 5.4, n = 201). Los árboles son importantes para la termorregulación en esta especie; sin embargo, aunque las lagartijas podrían vivir en zonas deforestadas de selva baja caducifolia es posible que tengan problemas para termorregular por la reducción de los periodos de actividad.
Palabras clave: Termorregulación, lagartijas, Morelos.
ABSTRACT
This paper examines the use of different microhabitats throughout the day, year, by sex, by age, at different intervals of altitude and its implications for thermoregulation and conservation. Overall 49.5% of the lizards used trees, 32.62% rocks and less often 2.3% shrubs (χ2 = 216.06, gl 3, p < 0.05). The analysis of microhabitat used by sex revealed significant differences among young, female, and male (χ2 = 7.24, gl 6, p < 0.05). The young females most often used rocks, while subadults and adults preferred to use trees (χ2 = 13.38, gl 6,p < 0.05). In males, subadults and young used rocks, and adults trees (χ2 = 15.22, gl 4, p < 0.05).The altitudinal distribution has an effect on habitat use; in the altitudinal range of 800 to 1,100 m these lizards have a tendency to be more arboreal, and between 1,100 and 1,400 m more frequently used rocks (χ2 = 36.21, gl 6,p < 0.05). In the dry season there was a significant difference in the use of microhabitats between 9:00 and 14:00 hours, with the highest number of sightings on trees and rocks. In the rainy season there was no significant difference in the analysis of microhabitat use over the hours of the day. The average body temperature was 33.52 °C (22.0-39.0 ± 2.9). There were no significant differences in body temperature of lizards in different microhabitats. Cloacal temperatures in all microhabitats were 2 °C and 3 °C higher than air temperatures and substrate. Most sightings were between 10:00 and 15:00 hours so this species is considered a diurnal lizard show-ing thigmothermy and heliothermy. There were significant differences (F1,414 = 5.0918, p = 0.024561) in the lizard cloacal temperatures between the rainy (33.2 °C ± 3.17, n = 215) and dry seasons (34.2 °C ± 5.4, n = 201). Trees are important for thermoregulation in this species; however, even though these lizards could live in deforested areas, they might encounter thermoregulatory difficulties due to reduced periods of activity.
Key words: Microhabitat use, thermoregulation, conservation, lizards.
INTRODUCCIÓN
Con el uso de distintos tipos microhábitats las lagartijas controlan la temperatura del cuerpo, y la eficiencia de este proceso depende de su habilidad para buscar fuentes de calor. La exposición directa a los rayos del sol y la permanencia en diferentes intervalos de tiempo sobre la superficie caliente de las rocas, permiten aumentar la temperatura del cuerpo (Bellairs et al. 1975). Sin embargo, las condiciones térmicas varían entre los distintos microhábitats, por lo que una especie con amplia tolerancia térmica, es capaz de aprovechar todos los microhábitats posibles. No obstante, este comportamiento puede estar influenciado por la competencia, debido a que distintas especies también buscan los mismos hábitats para termorregular (Angert et al. 2002, Grover 1996, Smith & Ballinger 2001). Para reducir la competencia, algunas especies modifican sus períodos de actividad y el uso de los distintos microhábitats a lo largo del día, y entre las estaciones del año (Shine & Lambeck 1989).
Se ha observado que la temperatura del cuerpo en las lagartijas está relacionada significativamente con la temperatura del aire y del sustrato (Huey & Pianka 1977, Woolrich-Piña et al. 2006). En temporadas de frío (invierno) las lagartijas normalmente están activas sólo al mediodía, mientras que en la época de calor (verano) están activas todo el día. Sceloporus horridus horridus tiene un amplio intervalo de tolerancia térmica, con una temperatura cloacal mínima de 17 °C, una máxima de 40 °C, y temperatura óptima entre los 33 °C y 36 °C, lo que contribuye a explicar la ocupación de distintos microhábitats (Castro-Franco & Aranda 1984). En este trabajo se presenta información para responder a las siguientes preguntas: ¿hay diferencias en el uso de los distintos microhábitats a lo largo del día, entre los dos sexos y entre edades?, ¿hay variaciones en el uso de microhábitats entre los períodos de lluvias y secas?, ¿el uso de los distintos microhábitats cambia con la altitud?, y ¿el uso de los distintos microhábitats tiene efectos sobre la termorregulación?
MATERIALES Y MÉTODOS
El total de los 423 registros que forman la base de datos utilizada en este trabajo provienen de ejemplares observados y capturados en áreas de selva baja caducifolia, en la región centro sur de Morelos, en un intervalo altitudinal de 900 a 1400 m, como parte de las exploraciones de campo de Castro-Franco & Aranda (1984) y Castro-Franco & Bustos-Zagal (1992). Este tipo de vegetación se caracteriza por una marcada estacionalidad, con una temporada de secas de octubre a mayo y una de lluvias de junio a septiembre (Aguilar 1990). La temperatura media anual en esta región llega a los 22°C, la temperatura más alta ocurre en mayo (26.5°C), y la mas baja entre enero y diciembre (20.5°C).
Los datos procesados para este trabajo fueron los siguientes: fecha, sexo, tipo de microhábitat, hora de captura, temperatura cloacal (T°C), temperatura del sustrato (T°S), temperatura del aire (T°A) y altitud en metros sobre el nivel del mar. La categoría de microhábitat fue asignada a sitios específicos donde se observó por primera vez cada lagartija; entre ellos se incluyen el suelo, rocas, árboles y arbustos. Las temperaturas fueron obtenidas al momento de la captura con un termómetro cloacal tipo Schulteis (cloacal Quick-Reading Thermometers 0/50 °C) de registro rápido. Asimismo, de todos los ejemplares se obtuvieron registros de la longitud hocico-cloaca en mm (LHC). Como hembras adultas fueron consideradas aquellas con tamaño promedio de 86.32± D.E 7.94 mm de LHC (71.0-101.0 mm), machos de 90.66 ± D. E. 12.79 mm de LHC (72.0-111.0 mm), subadultos de 55.5 ± D.E 8.3 (40.0- 70.0) y crías de 30.0± D.E 8.2 mm (20.0-39.0 mm). Los especímenes y la base de datos están depositados en la Colección de Anfibios y Reptiles de la Universidad Autónoma del Estado de Morelos (CARUM, http://www.cib.uaem.mx/herpetologia_colecciones.html).
Análisis estadísticos. Los datos de frecuencia de avistamientos de lagartijas entre los distintos tipos de microhábitats (suelo, rocas, árboles y arbustos) y períodos de lluvias y secas fueron comparados con pruebas de Chi-cuadrada (x)2. Las diferencias entre la temperatura cloacal de lagartijas que viven en zonas bajas (750-1,100 m) y en zonas altas (1,100-1,400 m) entre diferentes microhábitats y entre los períodos de lluvias y secas fueron evaluadas con Análisis de Varianza (ANDEVA) de una vía. Para determinar la relación entre la temperatura cloacal (T°C) de las lagartijas con las temperaturas del aire (T°A) y sustrato (T°S) se realizaron análisis de correlación lineal por el método de Pearson.
RESULTADOS
Uso de microhábitat. El porcentaje de frecuencia de avistamientos mostró que los árboles fueron los más frecuentados (49.65 %), seguido por las rocas (32.62%), suelo (15.60%) y arbustos (2.13%) (Fig. 1). Estas diferencias en la frecuencia de uso entre los distintos microhábitats son estadísticamente significativas (χ2 =216.06, gl3, p<0.05).
Las lagartijas perchan con más frecuencia sobre árboles y rocas entre las 10:00 y 15:00 h que durante el resto de las horas del día (χ2=164.26, gl 11 p< 0.05) (Fig.2). Sin embargo cuando las frecuencias de uso de microhábitats fueron separadas por períodos de lluvias y secas, los resultados fueron diferentes. En la época de lluvias hubo diferencias en el uso de microhábitats entre las horas del día (χ2 =22.55, gl10,p<0.05); los árboles fueron utilizados con mayor frecuencia entre las 9:00 y 16:00 h. En la temporada de secas también hubo diferencias significativas (χ2=45.17, gl10,p<0.05) en el uso de microhábitat. Entre las 9:00 y 14:00 horas los árboles y rocas fueron utilizados con mayor frecuencia respecto a los otros microhabitat.
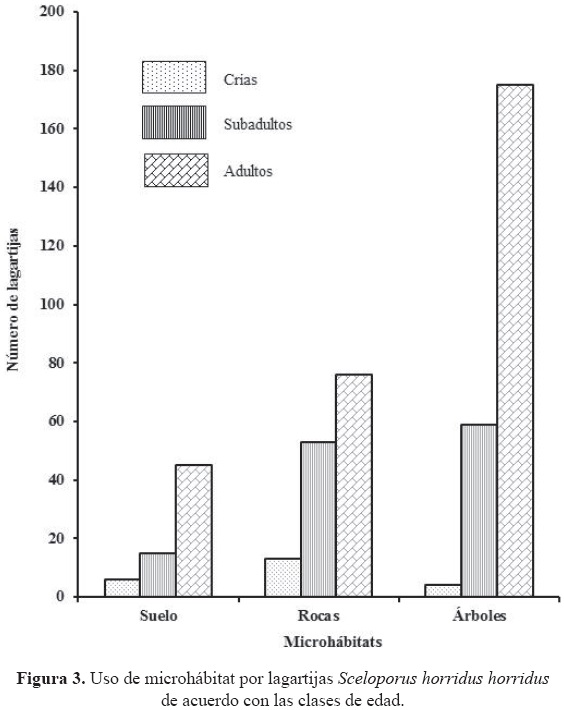
Uso de microhábitat por sexos y categorías de edad. El análisis por separado entre sexos y edades también mostró diferencias significativas. En las hembras, las crías tienen mayor preferencia por las rocas y las adultas y subadultas mayor preferencia por los árboles (χ2=13.28, gl2, p<0.05) (Fig. 3). En el caso de los machos, las crías y subadultos tienen mayor preferencia por las rocas, y los adultos prefieren los árboles (χ2=15.22, gl 2,p<0.05) (Fig. 4).
Uso de microhábitat por intervalos de altitud. Sceloporus h. horridus está ampliamente distribuida en Morelos en altitudes no mayores a los 1,400 msnm. Sin embargo, hubo diferencias significativas en el uso del microhábitat a diferentes intervalos de altitud. En el intervalo de los 750 a los 1,100 m fue mas arborícola y entre los 1,100 y 1,400 m las lagartijas se posaron más frecuentemente sobre rocas (χ2=36.21, gl1, p<0.05) (Fig. 5).
Termorregulación. En general Sceloporus h. horridus mantiene la temperatura corporal con un valor promedio de 33.52°C ± D. E. 2.9 (22.0-39.0, n= 392, CV= 8.6%). Las lagartijas que perchan sobre árboles pueden llegar a los 33.8°C ± D.E. 2.79 (22.038.0, CV=8.2%), sin variaciones significativas entre los microhábitat (Cuadro 1). Asimismo, en todos los microhábitats (suelo, rocas y árboles) se observaron relaciones positivas entre las temperaturas cloacales y las temperaturas del aire y sustrato (Cuadro 2).
Se observaron diferencias significativas (F1 328=11.59, p=0.00) del orden de 1.45° C, entre la TC de lagartijas de zonas altas (32.41° C ± 3.24, n= 46, CV= 9.9 %) y la TC de lagartijas de zonas bajas (33.86° C ± 2.71, n=285, CV= 8.0%). De manera similar, hubo diferencias entre la temperatura cloacal de lagartijas capturadas entre los períodos de lluvias y secas (F1,414= 5.09, p=0.024); en la época de secas el promedio de temperatura cloacal fue 34.2°C (±5.4°C, n= 201, CV=15.7%) y fue 1°C más alto que en la época de lluvias 33.2°C (± D. E. 3.17°C, n= 215, CV= 9.5%). En todos los diferentes microhábitats, las temperaturas cloacales de las lagartijas fueron entre 2°C y 3°C más altas que las temperaturas del aire y sustrato.
DISCUSIÓN
Aunque S. h. horridus había sido observada indistintamente en ramas de árboles, rocas, suelo y arbustos (Castro & Bustos 2003), los resultados de este estudio muestran que en realidad se trata de una especie de hábitos arborícolas que puede llegar a utilizar los distintos microhábitats disponibles. El uso de rocas y árboles es una estrategia previamente observada en varias especies de Sceloporus (Herrell et al. 2002). En zonas de poca altitud S. h. horridus es más frecuente sobre los árboles, y en las zonas altas, sobre las rocas. Esta variación revela un patrón de uso de microhábitats similar al observado en especies como Sceloporus occidentalis y Sceloporus graciosus (Adolph 1990). La variación en el uso diferencial de distintos microhábitats también ha sido observada en agámidos australianos como Pogona vitticeps, Lophognathus gilberto, Lophognathus longirostris, Ctenophorus caudicinctus y Tympanocryptis lineada (Melville & Schulte 2001) lo que se ha interpretado como un mecanismo para facilitar la termorregulación que permite a las lagartijas estar activas durante más tiempo a lo largo del día y del año. Aunque no tenemos datos referentes, sugerimos que en zonas altas y relativamente frías, las propiedades físicas de las rocas captan y retienen el calor mejor que los árboles, y en consecuencia las lagartijas frecuentan estos sitios para termorregular.
El patrón de variación en el uso de microhábitat en función de las estaciones del año también ha sido observado en agámidos como Agamis hispida (Huey & Pianka 1977). Sceloporus h. horridus en época de secas utiliza con mayor frecuencia los árboles y en temporada de lluvias utiliza todos los microhábitats de manera similar, para tener mejores oportunidades de termorregular. El uso de microhábitat asociado con la actividad diaria reveló que el avistamiento de lagartijas en el transcurso del día en los árboles fue similar al que se ha observado en otras especies como Sceloporus malachiticus (Vial 1984), Sceloporus utiformis (Gienger et al. 2002), y Agama hispida (Huey & Pianka 1977) que no tienen actividad durante la noche, lo que revela una asociación estrecha entre la actividad de las lagartijas y las horas de mayor radiación solar.
El análisis por categorías de edad mostró que los adultos de S. h. horridus perchan sobre los árboles de la misma forma como lo hacen los subadultos; en contraste, las crías usan con más frecuencia las rocas. En iguanas terrestres de las islas Galápagos, Conolophus pallidus, los adultos se encuentran con mayor frecuencia en mesetas, mientras que los juveniles se encuentran en acantilados rocosos que utilizan como refugios para evitar la depredación (Christian & Tracy 1983). Comparativamente, en el caso de S. h. horridus el uso diferencial de los microhábitats según la edad, también puede interpretarse como una manera de que las crías eviten la depredación, o reduzcan la competición interespecífica.
En todos los diferentes microhábitats, las temperaturas de cuerpo de las lagartijas fueron entre 2°C y 3°C más altas que las temperaturas del aire y sustrato; sin embargo, están estrechamente asociadas con las temperaturas de los microhábitats, como también ocurre en los agámidos semiarbóreos Lophognathus longirostris y Pogona vitticeps (Melville & Schulte 2001). Estas diferencias en las temperaturas sugieren que S. h. horridus, no es una especie termoconformista sino una especie termorreguladora activa, pero se necesitan estudios más avanzados para definir mejor la precisión en la termorregulación (Hertz et al. 1993, Shawnet al. 2002).
En síntesis, aunque los adultos de S. h. horridus tienen una preferencia por el mi-crohábitat arbóreo, las crías y jóvenes se encuentran con mayor frecuencia en rocas. El uso de microhábitat durante el día revela que es una lagartija de hábitos diurnos con cambios estacionales en el uso de micro hábitats, que también está en función de la disponibilidad de lluvia y de la altitud en la que se encuentren. La capacidad de calentarse por radiación directa y por contacto con sustratos calientes que le permite incluso superar el promedio de las temperaturas de los sustratos, indica que esta especie termorregula activamente por medio de heliotermia y tigmotermia, lo que permite explicar su presencia en varias zonas tropicales secas de México.
LITERATURA CITADA
Adolph S. C. 1990. Influence of behavioral thermoregulation on microhabitat use by two Sceloporus lizards. Ecology, 17: 315-327. [ Links ]
Aguilar B. S. 1990. Dimensiones ecológicas del Estado de Morelos. Centro Regional de Investigaciones Multidisciplinarias CRIM-UNAM. [ Links ]
Bellairs, A. D., Attridge, S. &Sanz, G. J. L. 1975. Los reptiles. Editorial H. Blume, España. [ Links ]
Castro- Franco, R. & Aranda, E. E. 1984. Estudio preliminar sobre la ecología de los reptiles del estado de Morelos. Tesis Profesional, Facultad de Ciencias Biológicas, UAEM. [ Links ]
Castro-Franco, R. & Bustos-Zagal, M. G. 1992. Herpetofauna de la zona de reserva Ajusco-Chichinautzin, México. Universidad Ciencia y Tecnología, 2:67-70. [ Links ]
Castro-Franco, R. & Bustos Z., M. G. 2003. Lagartijas de Morelos, México: distribución, hábitat y conservación. Acta Zoológica Mexicana (n.s.), 88:123-142. [ Links ]
Christian, K. &Tracy, C. R.1983.Seasonal shifts in body temperature and use of microhabitats by Galapagos land iguanas (Conolophus pallidus). Ecology, 64:463-468. [ Links ]
Gienger, C. M., Beck, D. D., Sabari, N. C. & Stumbauch, D. L. 2002. Dry season habitat use by lizards in a tropical deciduous forest of western Mexico. Journal of Herpetology, 36: 487-490. [ Links ]
Grover, M. C. 1996. Microhabitat use and thermal ecology of two narrowly sympatric Sceloporus (Phrynosomatidae) lizards. Journal of Herpetology, 30:152-160. [ Links ]
Herrel, A., Meyers, J. J. & Vanhooydonck, B. 2002. Relations between microhabitat use and limb shape in phrynosomatid lizards. Biological Journal of the Linnaean Society, 77:149-163. [ Links ]
Hertz P. E., Huey, R. B &Stevenson, R. D. 1993. Evaluating temperature regulation by field-active ectotherms: the fallacy of the inappropriate question. American Naturalist, 142:796-818. [ Links ]
Huey, R. B. & Slatkin, M. 1976. Cost and benefits of lizard thermoregulation. The Quarterly Review of Biology, 51: 363-384. [ Links ]
Huey, R. B. & Pianka, E. R. 1977. Seasonal variation in thermoregulatory behavior and body temperature of diurnal Kalahari lizards. Ecology, 58:1066-1075. [ Links ]
Melville, J. & Schulte II, J. A. 2001. Correlates of active body temperatures and microhabitat occupation in nine species of central Australian agamid lizards. Austral Ecology,26: 660-669. [ Links ]
Shawn, S., Sartorius, J., do Amaral, P. S ., Durche, R. D., Deen, C. M. & Lutterschmidt ,W. I. 2002. Thermoregulatory accuracy, precision, and effectiveness in two sand-dwelling lizards under mild environment conditions. Canadian Journal of Zoology, 80:1966-1976. [ Links ]
Smith, G. R. & Ballinger, R. E. 2001. The ecological consequences of habitat and microhabitat use in lizards: a review. Contemporary Herpetology, 3. [ Links ]
Vial, J. L. 1984. Comparative field responses to dial and annual thermal regimens among Sceloporinelizards, with specific reference to Sceloporus malachiticus. Revista de Biología Tropical, 32: 1-10. [ Links ]














