Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.27 no.2 Xalapa ago. 2011
Artículos originales
Influence de la densité animale sur la croissance et la reproduction de l'escargot Limicolariaflammea (Müller) en conditions d'elevage
Effect of animal density on growth and reproduction in the African land snail Limicolaria flammea (Müller), under breeding conditions
KARAMOKO Mamadou,* MEMEL Jean–Didié, KOUASSI KOUADIO Daniel & OTCHOUMOU Atcho
Laboratoire de Biologie et de Cytologie Animales, UFR des Sciences de la Nature, Université d'Abobo – Adjamé, 02 BP 801 Abidjan 02, CÔTE D'IVOIRE. E–mail: petyhabib@yahoo.fr, didiememel@yahoo.fr, dan_pompidou@yahoo.fr; albertameri@yahoo.fr.
Recibido: 03/08/2010.
Aceptado: 09/12/2010.
RESUME
Des escargots juvéniles de Limicolaria flammea (Müller) âgés d'environ deux mois avec un poids vif moyen de 1,20 ± 0,02 g et une longueur coquillière moyenne de 15,37 ± 2,34 mm ont été repartis en 4 densités (100, 200, 300 et 400 escargots/m2) pendant 12 mois afin d'étudier l'effet de la densité sur leur croissance et leur reproduction. Les meilleures performances biologiques sont obtenues à la densité de 100 escargots /m2 qui induit une bonne ingestion alimentaire (0,14 ± 0,002 g/j/g de poids vif), une meilleure croissance, une faible mortalité (16%) et permet aux escargots de produire plusieurs fois dans l'année, un grand nombre d'oeufs avec un taux d'éclosion élevé (70,33%) après un temps d'incubation relativement court (12 ± 1,8 jours), contrairement à la densité de 400 escargots /m2 où les animaux se nourrissent peu (0,005 ± 0,002 g/j/g de poids vif), se reproduisent faiblement avec un taux de mortalité de 60%.
Mots–clés: croissance, densité, Limicolaria flammea (Müller), reproduction.
ABSTRACT
Juvenile snails of Limicolaria flammea (Müller) of approximately two months old, with 1,20 ± 0,02 g average live weight and 15,37 ± 2,34 mm average shell length were subjected four densities (100, 200, 300 and 400 snails/m2) during 12 months in order to determine their effect on growth and reproduction. The best biological performances were obtained with the density of 100 snails/m2 which induced high food intake (0,14 ± 0,002 g/day/g of live weight), better growth and low mortality (16%). This density induced high number of laid eggs, high number of eggs per laying and a high percentage of hatching (70,33%) after a relatively short duration of incubation (12 ± 1,8 days). At a density of 400 snails/m2, snails nourished themselves little (0,005 ± 0,002 g/day/g of live weight), reproduced slightly and had 60% of mortality.
Key words: density, growth, Limicolaria flammea (Müller), reproduction.
INTRODUCTION
En Afrique au Sud du Sahara, les populations humaines rurales et urbaines trouvent une part considérable de leurs protéines en exploitant mais parfois, en surexploitant la faune sauvage, des termites aux éléphants (Aboua 1990). La disponibilité continue de ces sources de protéines de haute valeur nutritive suppose la garantie des conditions de vie et de reproduction efficaces et durables de ces animaux. Ainsi, le développement de techniques rationnelles de production de ces ressources contribue–t–il à améliorer la situation. La production en captivité de petits gibiers tels que la grenouille, les rongeurs, le cobaye et particulièrement les escargots a été instituée pour permettre, d'une part, l'exploitation contrôlée d'espèces animales locales et d'autre part, la sauvegarde d'espèces surexploitées pour divers usages humains, dans le respect de l'environnement.
L'escargot constitue un aliment fortement apprécié. Sa chair tendre, savoureuse, très riche en acides aminés, en sels minéraux et particulièrement en fer, représente une source alternative de protéines animales (Aboua 1990; Adayeye 1996). La forte pression de ramassage de ces animaux, du fait de la demande croissante pour la consommation locale et sous–régionale ainsi que la destruction de leur biotope par l'homme et les ennemis naturels sont autant de facteurs qui réduisent les stocks d'escargots en milieu naturel. Face à cette situation, l'approfondissement des connaissances sur leur biologie, leur écologie et surtout la mise au point de techniques d'élevage appropriées contribueraient à leur conservation et à leur gestion efficiente. Leur élevage apparaît ainsi nécessaire d'une part, pour compenser les déficits saisonniers d'escargots et d'autre part, pour assurer la pérennité de l'espèce en la préservant des pressions résultant des activités humaines (Otchoumou 1997). La réussite de la production et surtout la vulgarisation de l'achatiniculture passent par la connaissance des espèces d'escargots les mieux adaptées aux conditions d'élevage et la maîtrise de certains facteurs biotiques et abiotiques qui influencent directement leur production. L'un des élements importants en matière d'élevage d'escargots est le choix des densités adéquates susceptibles d'assurer à la fois une bonne croissance des individus, une reproduction optimale et une faible mortalité. Pour un éleveur, le but recherché pour rentabiliser ses installations, est de placer le plus grand nombre possible d'animaux au mètre carré d'enceinte d'élevage, à condition que cette densité n'entraîne pas de trouble chez les animaux (Chevallier 1985). Le choix de Limicolaria flammea (Müller, 1774) comme modèle biologique pour notre étude s'explique par le fait qu'à l'instar des autres achatines, cette espèce est consommée dans certaines régions du Nigeria, du Togo, du Liberia, du Bénin (Egonmwan 1988, Edjidike et al. 2004, Fagbuaro et al. 2006) et de la Côte d'Ivoire. Cependant, l'approvisionnement des consommateurs se fait essentiellement à partir de produits de ramassage dans la nature. Bien que présent autour des habitations humaines et dans les plantations, Limicolaria flammea demeure encore mal connu en Côte d'Ivoire et l'on dispose de très peu de données concernant sa biologie et son écologie. Il s'agit en fait d'une espèce d'escargot peu abondante en milieu naturel dont les vitesses de croissance et de reproduction relativement faibles constituent un obstacle à la consommation par les populations. Ainsi, étudier sa reproduction à partir de spécimens prélevés dans la nature pourrait palier cette situation. Dans cette étude, nous nous attelons à mettre en évidence les performances biologiques de l'animal, à rechercher les normes zootechniques appropriées à son élevage. La maîtrise de sa production pourrait contribuer d'une part, à combler le déficit en protéines de nombreux ménages, à améliorer les revenus financiers des acteurs de la filière escargot et d'autre part, à acquérir une banque de données scientifiques fiables nécessaires à l'étude et à la gestion durable de ces animaux.
MATERIAL ET METHODES
Cadre expérimental. Cette étude a été réalisée au centre d'achatiniculture de l'Université d'Abobo–Adjamé (Abidjan, Côte d'Ivoire). Ce centre comporte un bâtiment où l'élevage se fait sous abris et une zone d'expérimentation en plein air. La température et l'humidité relative mensuelles moyennes dans le bâtiment d'élevage ont été respectivement de 26,7 ± 1,4° C et de 82,6 ± 1,4%. La photopériode a été 12 heures de lumière et 12 heures d'obscurité.
Animaux. Les animaux utilisés dans ce travail sont des Mollusques, Gastéropodes, Pulmonés. Ils appartiennent à l'ordre des Stylommatophores, à la super famille des Achatinaceae, à la famille des Achatinidae, au genre Limicolaria et à l'espèce Limicolaria flammea. Il s'agit d'individus juvéniles ayant un poids vif moyen de 1,20 ± 0,12 g et de longueur coquillière moyenne de 15,37 ± 2,34 mm, pour un âge estimé à deux mois. Ces escargots sont nés à partir de reproducteurs issus de la ferme achati–nicole. Les critères de leur choix ont été essentiellement morphologiques: poids vif et longueur moyenne de coquille sensiblement égaux, coquille bien formée, individus exempts de traumatisme; c'est–à–dire sans blessure, ni cassure de la coquille. Ils ont été régulièrement nourris à l'aide de feuilles de papayer (Caricapapaya (Caricacae)). Ce choix a été guidé par le souci d'éviter les effets néfastes que pourrait avoir une combinaison d'aliments non encore maîtrisée. En outre, Otchoumou (1991), Odjo (1992) puis, Koudande & Ehouinsou (1995) ont montré que ces feuilles faisaient partie des fourrages verts les plus consommés par les escargots (Achatina achatina, Achatina fulica et Archachatina marginata) et leur permettaient d'obtenir de meilleures performances biologiques. Selon ces auteurs, l'analyse de la composition chimique de ces feuilles a montré qu'elles contiennent plus de calcium que les feuilles de Lactuca sativa (Asteraceae), de Brassica oleraceae (Brassicaceae), de Manihot esculenta (Euphorbiaceae) et de Xanthosoma maffafa (Araceae). Le calcium est indispensable à la confection de la coquille des escargots.
Enceintes d'élevage
Les enceintes utilisées sont des bacs en matière plastique à base carrée ayant un volume de 8600 cm3. Ces bacs sont dotés de couvercles de type moustiquaire constituant un dispositif anti–fuite. Leur fond est recouvert d'une litière de 4 cm d'épaisseur de sable fin stérilisé par chauffage.
Méthodes
Nous avons reparti 120 escargots en 4 densités à savoir, 100 escargots /m2 (soit 4 escargots /bac), 200 escargots /m2 (soit 8 escargots /bac), 300 escargots /m2 (soit 12 escargots /bac) et 400 escargots /m2 (soit 16 escargots /bac). Pour chaque densité, l'expérience est répétée trois fois. Les animaux ont été mis en observation pendant deux semaines dans des bacs similaires, selon les densités sus–indiquées, pour les habituer à la vie en captivité. L'aliment constitué de feuilles fraiches de papayer est servi ad libitum dans chaque bac à raison de 20 g pour cinq jours. Un bac témoin avec la même quantité de végétal, placé dans les mêmes conditions expérimentales, permet de faire les corrections de poids dues à la dessiccation du matériel végétal. L'entretien des enceintes d'élevage est réalisé une fois par semaine. Ils sont débarrassés des animaux malades ou morts. Ceux–ci sont remplacés par d'autres escargots actifs de dimensions similaires, préalablement placés dans les mêmes conditions expérimentales afin de maintenir les densités de départ. Aussi, le substrat d'élevage est–il débarrassé des déchets et restes d'aliments, remué pour le rendre meuble afin de faciliter l'enfouissement des animaux lors de la ponte. Un arrosage manuel régulier assure l'humidification constante du substrat. A la fin des cinq jours, les restes d'aliments sont pesés après séchage à 80°C pendant 12 heures à l'étuve, les animaux sont pesés et les longueurs de coquilles (Fig. 1) mesurées avec un pied à coulisse électronique (sensible au mm). De même, l'ingestion alimentaire, la croissance pondérale, la croissance coquillière et le taux de mortalité cumulée sont déterminés.
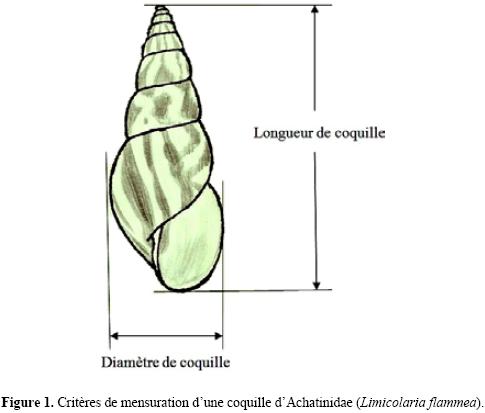
Chaque jour, le substrat d'élevage est fouillé pour en sortir les éventuels oeufs pondus. Ces oeufs sont comptés, pesés et leurs petit et grand diamètres mesurés. Ils sont mis à incuber au fur et à mesure de leur collecte. Le substrat d'incubation est constitué d'enveloppes de noix de coco [Cocos nucifera, (Arecaceae)]. Après l'éclo–sion des oeufs, les juvéniles sont comptés afin de déterminer les taux d'éclosion en fonction de la densité. Cette experience a duré douze mois.
Expression des résultats
Au terme de cette expérience, l'ingestion alimentaire, la croissance pondérale, la croissance coquillière et le taux de mortalité cumulée ont été calculés selon les formules utilisées par Daguzan (1985) et Otchoumou et al. (2003):
Ingestion alimentaire (IA): IA (g / j / g de poids vif) = Q /Pm
avec Q: quantité moyenne d'aliment quotidiennement consommé; Pm: poids moyen de l'escargot (g), sachant que: Q (g / j) = (qi – qf) / t avec qi: quantité initiale de végétaux (g); qf: quantité finale de végétaux (g); t: durée de la consommation en nombre de jour.
Croissance pondérale (CP): CP (g / j) = (P2–P1) / (T2–T1)
Croissance coquillière (CC): CC (mm / j) = (L2–L1) / (T2–T1)
Taux de mortalité cumulée (TMC): TMC (%) = Nm x 100 /Ei
Avec P1 (g) = poids moyen initial; P2 (g) = poids moyen final; T1 (j) = temps initial; T2 (j) = temps final; L1 (mm) = longueur initiale de coquille; L2 (mm) = longueur finale de coquille; Nm = nombre total d'escargots morts; Ei = effectif initial des escargots.
Analyses statistiques
Le traitement statistique des données a été réalisé à l'aide de logiciels STATISTICA version 6.0 et Microsoft Excel 2003. Les valeurs moyennes des différentes variables de croissance et de reproduction ont fait l'objet d'une analyse de variance (ANOVA) à un facteur et comparées selon le test de comparaison de moyennes multiples de Stu–dent–Newmann–Keuls au seuil de 5%. Avant l'utilisation de l'ANOVA, la normalité de la distribution des données a été vérifiée avec le test de Shapiro–Wilk (Shapiro et al. 1968). L'homogénéité des variances a été testée à l'aide du test de Brown et For–sythe (Brown & Forsythe 1974).
RÊSULTATS
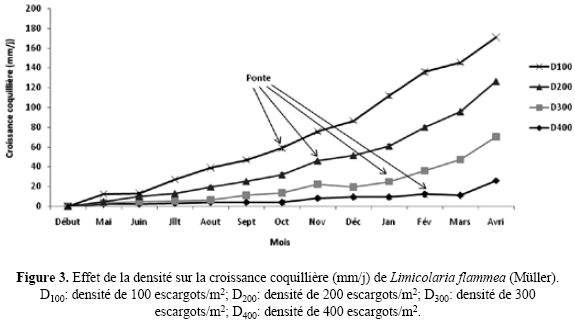
Croissance. Après 12 mois d'expérimentation, ils ont acquis un poids vif moyen de 5,18 ± 0,03 g; 4,47 ± 0,11 g; 4,16 ± 0,18 g; 2,34 ± 0,21 g avec un gain de poids respectif de 3,97 g; 3,27 g; 2,96 g et 1,14 g respectivement pour les densités de 100, 200, 300 et 400 escargots /m2 (tableau I). Les courbes d'évolution des croissances pondérale et coquillière en fonction du temps et des densités (Figs. 2 et 3) présentent dans l'ensemble une croissance irrégulière à pente moyenne pour les densités de 100 et 200 escargots /m2 et à pente faible pour les densités de 300 et 400 escargots /m2. Les faibles densités d'élevage favorisent la croissance, contrairement aux fortes densités où ce phénomène est retardé. Le test de Student–Newmann–Keuls indique qu'il y a une différence significative entre les croissances pondérale et coquillière, les poids vifs, les longueurs de coquilles, les ingestions alimentaires et les mortalités cumulées; ce qui n'est pas le cas pur les croissances pondérales induites par les densités 200 et 300 escargots /m2. La longueur coquillière, la croissance coquillière, le poids vif et la croissance pondérale sont fortement corrélés (r > 0,9) avec l'ingestion alimentaire (tableau II). Le taux de mortalité cumulée est fortement, mais négativement corrélé (r < – 0,8) avec l'ingestion alimentaire. Aussi, la longueur coquillière et le poids vif sont–ils fortement corrélés (r > 0,9) tandis que les croissances coquillière et pondérale sont moyennement corrélées (r = 0,66).



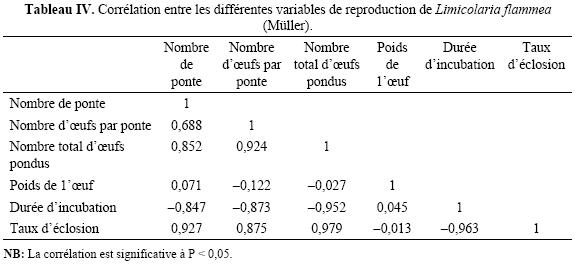
Reproduction. Les animaux soumis aux différentes densités ont pondu à différentes dates. Le nombre de ponte varie de 2 à 6 alors que le nombre moyen d'oeufs par ponte varie de 17 ± 1,4 oeufs à 31 ± 2,8 oeufs selon les densités (tableau III). Le test de Student–Newmann–Keuls indique une différence significative entre les nombres totaux de pontes, les durées d'incubation et les taux d'éclosion des différentes densités (p < 0,05). Quant au nombre de pontes et au nombre d'oeufs par ponte, la différence n'est significative qu'entre les densités 100 et 400 escargots /m2. Il n'y a pas de différence significative entre les densités 200 et 300 escargots /m2 (p > 0,05) pour les valeurs de ces deux variables. En outre, le test ne révèle aucune différence significative (p > 0,05) entre les poids et les dimensions de l'oeuf quelle que soit la densité. Le tableau IV révèle que la quantité d'oeufs produite est fortement corrélée avec la durée de l'incubation (r = – 0,95) et le taux d'éclosion (r = 0,97). De même, il existe une forte corrélation entre la durée de l'incubation et le taux d'éclosion (r = – 0,96).

DISCUSSION
L'effet de la densité sur la croissance a retenu l'attention de nombreux chercheurs. Leurs recherches étaient centrées sur les Pulmonés aquatiques et celles orientées vers les Pulmonés terrestres concernaient quelques espèces de pays tempérés appartenant aux genres Hélix et Cepaea (Oosterhoff 1977, Cameron & Carter 1979, Lucarz & Gomot 1985). Les effets de la densité englobent, d'une part, les facteurs de stimulation de la croissance tels que les polypeptides, les glycoprotéines, les lipoprotéines, les acides aminés et les ionophores qui sont probablement produits par l'escargot lui–même à travers les micro organismes de ses voies digestives (Thomas et al. 1975). D'autre part, les effets de la densité englobent également des facteurs inhibiteurs de croissance comme l'ammoniaque, les métabolites provenant des aliments ou des fèces. Il a été montré qu'en état de captivité, le fait que les fortes densités perturbent la croissance et la reproduction était aussi dû à la réduction de la quantité et de la qualité de l'aliment mis à la disposition des escargots (Thomas ét al. 1983) ou à une production excessive de mucus ou encore à tous autres facteurs inhibiteurs (les phéromones par exemple) (Dan & Bailey 1982). Le but recherché par l'éleveur, pour rentabiliser ses installations, est de placer le plus grand nombre possible d'animaux au mètre carré d'enceinte d'élevage, à condition que cette densité n'entraîne pas de trouble chez les animaux. Nos résultats indiquent que pour des animaux de taille et de poids similaires en début d'expérience, il apparaît une différence notable entre les valeurs de ces deux variables après 12 mois d'expérimentation. Les valeurs d'ingestion alimentaire, de croissances pondérale et coquillière diminuent lorsque la densité augmente. Ainsi, ressort–il qu'une température de 26,7 ± 1,4 °C, une humidité relative de l'air de 82,6 ± 1,4% et une densité de 100 escargots /m2 favorisent la croissance chez L. flammea. Cette densité induit une bonne ingestion alimentaire, une faible mortalité, contrairement aux densités relativement élevées de 300 et de 400 escargots /m2. En effet, Tanner (1966) admet que la croissance d'une population est une fonction décroissante de la densité. Nos résultats s'accordent avec ceux de Codjia (2001) sur Archachatina marginata (Swainson) et ceux de Otchoumou (1997) sur Achatina achatina (Linné), Achatina fulica (Bowdich) et Archachatina ventricosa (Gould). Ces espèces d'escargot qui ont un gabarit supérieur à celui de L. flammea ont présenté de meilleures performances de croissance à la densité de 50 escargots /m2 pour les reproducteurs et de 300 juvéniles /m2 pour les individus plus jeunes. Cette expérience montre que L. flammea, élevé à une forte densité, croît lentement même si les individus sont placés dans un environnement bien entretenu avec une quantité et une qualité convenables de nourriture et d'humidité. Les quantités d'aliments ingérées sous les fortes densités sont moindres par rapport à celles des faibles densités. Cette situation pourrait s'expliquer par une baisse de la qualité de l'aliment (Thomas et al. 1975) résultant d'une accumulation de fèces sur l'aliment et aussi de mucus (Dan & Bailey 1982). Les fortes densités rendent difficile l'accès à la nourriture. En effet, l'augmentation de la densité animale entraîne une augmentation de la quantité de mucus sécrétée par les escargots. Ainsi, le mucus devenu abondant rend–il difficile la locomotion des animaux pour la recherche de nourriture et l'exploitation de leur milieu. Le fait d'être dans un environnement clos peut aussi affecter négativement le taux d'oxygène disponible dans le milieu comme l'ont remarqué Chernin & Michelson (1957) chez Australorbis glabratus, Cameron & Carter (1979) chez Helix aspersa. Le cumul de mucus et le manque d'oxygène peuvent créer des stress et un dysfonctionnement physiologique, car certains animaux se nourrissent peu ou pas du tout. Cette situation a amené Thomas et al. (1983) à suggérer que pour des escargots placés sous fortes densités, fournir de la nourriture ad libitum conduit à la longue à les affamer, puisque leur nombre affecte la qualité de l'aliment. La croissance et la reproduction dépendent de la qualité de l'aliment.
Les courbes d'évolution du poids vif et de la longueur de coquille en fonction du temps pour les différentes densités d'élevage révèlent un ralentissement des croissances pondérale et coquillière durant les semaines qui suivent la ponte et cela, pour toutes les densités d'élevage. Cette situation pourrait s'expliquer par le fait qu'au–delà de l'influence de la densité d'élevage sur la croissance, nous avons remarqué une faible consommation de l'aliment par les escargots pendent la période de ponte au cours de nos expériences. Des observations similaires chez A. marginata et L. flammea ont permis à Egonmwan (1988) d'affirmer qu'en période de ponte, l'escargot arrête de s'alimenter et utilise ses réserves intérieures pour assurer ses besoins physiologiques. Cette faible ingestion alimentaire pourrait donc être la cause du ralentissement constaté au niveau des croissances coquillière et pondérale. En outre, la production progressive d'oeufs avait contribué à une augmentation conséquente de la masse des individus. La ponte, caractérisée par une expulsion de ces oeufs, a entraîné une diminution de cette masse car la masse des oeufs s'est soustraite de celle de l'animal qui devient alors plus léger, juste après l'oviposition. Ces courbes présentent également une tendance générale tendance générale vers un plateau au bout des 12 mois d'expérimentation, comme si l'on s'avançait vers un arrêt de croissance des escargots. Cette situation s'explique d'une part, par le rabougrissement des individus engendré par les fortes densités et d'autre part, par le fait que les individus élevés aux faibles densités s'acheminent effectivement vers un arrêt de croissance après avoir atteint une certaine taille, étant donné que la longueur coquillière et le poids vif caractéristiques de cette espèce d'escargot sont respectivement d'environ 6 cm et de 6 g (Crowley & Pain 1970).
Pour L. flammea, une augmentation progressive de la densité induit de fortes mortalités. Egonmwan (1988), après avoir soumis L. flammea et A. marginata à des densités de 256, de 400 et de 929 individus /m2, a montré que les fortes densités ralentissent ou même arrêtent la croissance chez ces deux espèces, mais, qu'à ces fortes densités, les mortalités était plus élevée chez L. flammea que chez A. marginata. Cette forte mortalité pourrait s'expliquer d'une part, par une relative fragilité de la première espèce par rapport à la seconde et d'autre part, par une accumulation importante d'urine et de fèces très toxiques, du fait de la surcharge biotique. L'accumulation d'excréments et de déchets entretenus par ce surnombre défavorable, augmente le pH du sol d'élevage. Ce changement dans la composition chimique du sol retarde la croissance et augmente la mortalité (Chevallier 1982). Toutefois, une partie des mortalités pourrait être attribuée aux compétitions intra spécifiques qui éliminent les individus les plus faibles (Dajoz 1974).
La densité de 100 escargots /m2 améliore relativement les performances de reproduction chez L. flammea. Cette densité permet aux escargots de produire, plusieurs fois dans l'année, un grand nombre d'oeufs avec un taux d'éclosion élevé après un temps d'incubation relativement court. Les différences observées au niveau du nombre de pontes, du nombre d'oeufs par ponte, du nombre total d'oeufs pondus, de la durée d'incubation et du taux d'éclosion ne peuvent être attribuées qu'aux différentes densités utilisées. Oosterhoff (1977) a montré que la densité influence directement la reproduction chez Arion ater et chez Cepaea nemoralis. Nos données sont en accord avec ceux de Hodasi (1979) qui a observé des variations de ces différentes variables chez A. achatina élevé à différentes densités. Des observations similaires ont été faites par Otchoumou (1997) aussi bien chez A. achatina que chez A. fulica et A. marginata.
Lorsqu'il est élevé à une densité de 100 escargots /m2, L. flammea produit en moyenne 31 ± 2,08 oeufs par ponte. L'incubation des oeufs dure en moyenne 12 ± 1,08 jours avec un taux d'éclosion de 70,33 ± 1,06%. Otchoumou (1997) a enregistré un nombre moyen d'oeufs de 69,28 ± 33,66 chez A. achatina, 117,04 ± 39,63 chez A. fulica et 4,80 ± 0,50 chez A. marginata. Kouassi et al. (2007) ont enregistré 3 à 12 oeufs par ponte chez A. ventricosa. La durée moyenne de l'incubation des oeufs est de18,42 ± 5,15 jours chez A. achatina, 15,65 ± 1,33 jours chez A. fulica et 29,40 ± 1,01 jours chez A. marginata avec un taux d'éclosion respectif de 64,60 ± 24,05 %; 68,41 ± 22,40 % et 62,50 ± 11,18 %. Nous pouvons dire que lorsque les escargots sont élevés à une densité convenable dans des conditions de température et d'humidité adéquates, L. flammea produit un nombre d'oeufs inférieur à celui de A. fulica et de A. achatina, mais supérieur à celui de A. marginata et A. ventricosa. Nos résultats ne montrent aucune différence entre les tailles et les poids des oeufs quelles que soient les densités chez L. flammea, comme l'ont déjà observé Marche–Marchard (1977), Hodasi (1979) et Zongo et al. (1990) chez A. achatina et chez A. fulica. Les oeufs issus des différentes pontes présentent les mêmes caractéristiques d'une densité à l'autre. Par contre, ces oeufs ayant subi les mêmes conditions expérimentales présentent des durées d'incubation et des taux d'éclosion différents d'une densité à l'autre. Différents auteurs affirment que ces différences seraient liées au mois de ponte, à l'âge des reproducteurs, aux conditions atmosphériques et à la nature du substrat d'incubation (Hodasi 1975, Egonmwan 1991, Otchoumou 1997, Kouassi et al. 2007).
La densité influence fortement le nombre total de ponte, la durée d'incubation et le taux d'éclosion des oeufs, alors qu'elle n'a pas d'effet sur le poids et les dimensions de l'oeuf.
CONCLUSION
Au terme de cette étude, nous pouvons retenir que la densité influence notablement la croissance et la reproduction chez L. flammea. Ces deux phénomènes sont des fonctions décroissantes de la densité. Les fortes densités entraînent un retard dans la croissance, perturbent la reproduction et induisent une mortalité élevée, contrairement aux faibles densités. La densité de 100 escargots /m2 représente une norme zootechnique idéale pour un élevage efficient de cet escargot.
BIBLIOGRAPHIE
Aboua F. 1990. Chemical composition of Achatina fulica. Tropicultura, 8: 121–122. [ Links ]
Adeyeye I. E. 1996. Waste yield, proximate and mineral composition of three different types of land snails found in Nigeria. International Journal of Food Science & Nutrition, 47: 111–116. [ Links ]
Brown M.B. & A.B. Forsythe. 1974. Robust test for the equality of variance. Journal of the American Statistical Association, 69: 264–267. [ Links ]
Cameron R. A. D. & M A. Carter. 1979. Intra– and interspecific effects of population density on growth and activity in some Helicidae land snails (Gastropoda: Pulmonata). Journal of Animal Ecology, 48: 237–246. [ Links ]
Chernin E. & E. H. Michelson. 1957. Studies on the biological control of Schistosoma–bearing snails. The effects of population density on growth and fecundity in Australorbis glabratus. American Journal of Hygiene, 65: 57–70. [ Links ]
Chevallier H. 1982. Facteur de croissance pour l'escargot petit–gris en élevage. Escargot–écologiste, 13: 9–14. [ Links ]
Chevallier H. 1985. L'élevage des escargots. Production et préparation du petit–gris. Êditions du point vétérinaire, Paris, 128 pp. [ Links ]
Codjia J. T. C. 2001. Alimentation et croissance des escargots géants africains Archachatina (cala–chatina) marginata (Swainson) et Achatina fulica (Bowdich) en captivité. Annales des Sciences Agronomiques du Bénin, 2: 141–152. [ Links ]
Crowley T. E. & T. Pain. 1970. A monographic revision of the African land snails of the genus Limicolaria Schumacher (Mollusca–Achatinidae). Musée Royal de l'Afrique centrale – Tervuren, Belgique Annales– serie In – 8e– Sciences Zoologiques, 177 : 1–61. [ Links ]
Daguzan J. 1985. Contribution à l'élevage de l'escargot petit–gris: Helix aspersa Müller (Mollusque Gastéropode Pulmoné Stylommatophore). Elevage mixte (reproduction en bâtiment contrôlé et engraissement en parc extérieur): activité. Annales de Zootechnie, 34: 127–148. [ Links ]
Dajoz R. 1974. Dynamique des populations. Massson et Cie Editeurs, Paris, 301 pp. [ Links ]
Dan N. & s.E.R. Bailey. 1982. Growth, mortality and feeding rates of the snail Helix aspersa at different population density in the laboratory and the depression of activity of helicid snails by other individualism or their mucus. Journal of Molluscan Studies, 48: 257–265. [ Links ]
Edjidike B. N., T. A. Afolayant & J. A. Alokan. 2004. Observations on some climatic variables and dietary influence on the performance of cultivated African giant land snail (Archachatina margi–nata): notes and records. Pakistan Journal of Nutrition, 3 (6): 362–364. [ Links ]
Egonmwan R. I. 1988. Reproductive Biology and growth of Land snails Archachatina marginata ovum and Limicolaria flammea. D. Phil. Thesis. Department of Zoology, Oxford University, 367 pp. [ Links ]
Egonmwan R. I. 1991. Effect of temperture and photoperiod on growth and maturation rate of Limi–colaria flammea Müller (Gasteropoda, Pulmonata, Achatinidae). Journal of African Zoology, 105: 69–75. [ Links ]
Fagbuaro O., J. A. Oso, J. B. Edward & R. F. ogunleye. 2006. Nutritional status of four species of giant land snails in Nigeria. Journal of Zhejiang University SCIENCE B, 7: 686–689. [ Links ]
Hodasi J. K M. 1975. Preliminary studies on the feeding and burrowing habits of Achatina achatina. Ghana Journal of Science, 15: 193–199. [ Links ]
Hodasi J. K. M. 1979. Life history studies of Achatina achatina (Linné). Journal of Molluscan Studies, 45: 328–339. [ Links ]
Kouassi K. D., A. Otchoumou & H. Dosso. 2007. Effet de l'alimentation sur les performances biologiques chez l'escargot géant africain: Archachatina ventricosa (Gould, 1850) en élevage hors sol. Livestock Research for Rural Development, 19: 16–20. [ Links ]
Koudande O. D. & M. Ehouinsou. 1995. Influence de l'alimentation sur la production chez Archachatina sp. WAR/RMZ, 83: 60–63. [ Links ]
Lucarz A. & L. Gomot 1985. Influence de la densité de population sur la croissance diamétrale et pondérale de l'escargot Helix aspersa Müller dans différentes conditions d'élevage. Journal of Molluscan Studies, 51: 105–115. [ Links ]
Marche–Marchard J. 1977. L'Achatine. In: Le Monde animal en Afrique Intertropicale. Êditions de l'Êcole, 296–305. [ Links ]
Odjo M. G. 1992. Croissance, développement et composition chimique de l'escargot Achatina achatina (Linné). Mémoire de DEA, Université Nationale de Côte d'Ivoire (F.A.S.T.), 52 pp. [ Links ]
Oosterhoff L. M. 1977. Variation in growth rate as an ecological factor in the landsnail Cepaea nemo–ralis (L.). Netherlands Journal of Zoology, 27: 1–132. [ Links ]
Otchoumou A. 1991. Contribution à l'étude de l'escargot géant africain: Achatina achatina (Linné); Mémoire de DEA; Université Nationale de Côte d'Ivoire, 59 pp. [ Links ]
Otchoumou A. 1997. Etude de trois espèces d'escargots comestibles de Côte d'Ivoire: [Achatina achatina (Linné), Achatina fulica (Bowdich) et Archachatina ventricosa (Gould)]; reproduction et croissance en milieu naturel et en élevage. Thèse de Doctorat 3e cycle, Université de Cocody, 140 pp. [ Links ]
Otchoumou A., H. Dosso. & A. Fantodji. 2003. Elevage comparatif des escargots juvéniles Achatina achatina (Linné, 1758), Achatina fulica (Bowdich, 1820) et Archachatina ventricosa (Gould, 1850): influence de la densité animale sur la croissance, l'ingestion alimentaire et le taux de mortalité cumulé. Revue africaine de santé et Productions animales, 1: 146–151. [ Links ]
Scheerboom J. E. M. 1978. The influence of food quantity and food quality on assimilation, body groth and egg production in the pond snail Lymnaea stgnalis (L.) with particular reference to the haemo–lymph–glucose concentration. Peoceedings Koninklijk Nederlandse Akademie van Wetenschappen, C 81: 184 –197. [ Links ]
Tanner J. T. 1966. Effects of population density on growth rates of animal population. Ecology, 47: 733–745. [ Links ]
Thomas J. D., G. J. Goldsworthy & M. Benjamin. 1975. Studies on the chemical ecology of Biom–phalaria glabrata: The effects of chemical conditioning by the snails kept at various densities on their growth and metabolism. Journal of Zoology, 175: 421–437. [ Links ]
Thomas J. D., B. Grealy & C. F. Fennel. 1983. The effects of varying the quantity and quality of various plants on feeding and growth of Biomphalaria glabrata (Say) (Gasteropoda). Oikos, 41: 77–90. [ Links ]
Shapiro S. S., M. B. Wilk & H. J. Chen. 1968. A comparative study of various tests of mortality. Journal ofthe American Statistical Association, 63: 1343–1372. [ Links ]
Zongo D., M. Coulibaly, O. H. Diambra & E. Adjiri. 1990. Note sur l'élevage de l'escargot géant africain Achatina achatina. Nature et faune, 6: 32–44. [ Links ]














