Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.27 no.2 Xalapa ago. 2011
Artículos originales
Ciclo de vida y parámetros poblacionales de Sympherobius barberi Banks (Neuroptera: Hemerobiidae) criado con Dactylopius opuntiae Cockerell (Hemiptera: Dactylopiidae)
Life cycle and population parameters of Sympherobius barberi Banks (Neuroptera: Hemerobiidae) reared with Dactylopius opuntiae Cockerell (Hemiptera: Dactylopiidae)
Iliana PACHECO–RUEDA,*1 J. Refugio LOMELÍ–FLORES,1 Esteban RODRÍGUEZ–LEYVA1 y Manuel RAMÍREZ–DELGADO2
1 Colegio de Postgraduados, Instituto de Fitosanidad, Montecillo, 56230 Texcoco, Estado de México, MÉXICO.
2 INIFAP, Campo Experimental La Laguna, Centro, 27440 Matamoros, Coahuila, MÉXICO. *Autor para correspondencia: atta_mexicana@yahoo.com.mx.
Recibido: 29/04/2010.
Aceptado: 01/11/2010.
RESUMEN
El nopal verdura, Opuntia ficus–indica, es una hortaliza de importancia económica, social y ambiental en México, y una de sus plagas más importantes es la cochinilla silvestre del nopal, Dactylopius opuntiae. De sus enemigos naturales nativos el hemeróbido depredador Sympherobius barberi es una posible alternativa para su control. El objetivo de esta investigación fue estudiar la biología de S. barberi alimentado con D. opuntiae. Para establecer las crías en laboratorio tanto de la presa D. opuntiae y el depredador S. barberi, se colectaron insectos durante 2008 y 2009 de la zona productora de nopal verdura de Tlalnepantla, Morelos. S. barberi completó su ciclo biológico en 28 días. Las hembras tuvieron un periodo de preoviposición de cuatro días; el promedio de huevos por hembra por día fue de 1.98. Adicionalmente, S. barberi presentó una tasa neta de reproducción (Ro) de 36.6, una tasa intrínseca de crecimiento (rm) de 0.081, un tiempo de generación (T) de 44.27 días y una tasa finita de reproducción (λ) de 1.084.
Palabras clave: nopal verdura, Opuntia ficus–indica, plagas nativas, control biológico.
ABSTRACT
Prickly pear Opuntia ficus–indica, is consumed in Mexico as young pads which are called "nopalitos". It is a horticultural crop of great economical, social, and environmental importance. One of its most important pests is the wild cochineal insect, Dactylopius opuntiae. Amoung natural enemies of the latter are Sympherobius barberi, a predaceous brown lacewing that is considered one of the control alternatives. The objective of this research was to assess the biology of S. barberi reared on D. opuntiae. All the specimens used to establish laboratory colonies of both, pest and the predator, were collected during 2008 and 2009 from the nopalitos producing zone in Tlalnepantla, Morelos. S. barberi completed its life cycle in 28 days. Females had a four day preovipositional period, while daily average eggs per female was 1.98. Also, S. barberi had a net reproductive rate (Ro) of 36.6; a daily intrinsic rate of increase (rm) of 0.081; a generation time (T) of 44.27 d, and a finite reproductive rate (λ) of 1.084.
Key words: Prickly pear, Opuntia ficus–indica, native pests, biological control.
INTRODUCCIÓN
El nopal verdura Opuntia ficus–indica (L.) Miller, es una hortaliza de gran importancia económica, nutricional, ambiental e industrial en México, incluso se usa como hospedero para la cría de la grana cochinilla Dactylopius coccus Costa, de la cual se obtiene un colorante apreciado en la industria farmacéutica, alimentaria y cosmética (Portillo & Vigueras 2001). México es el principal productor y consumidor de nopal verdura en el mundo, con una superficie de 11,950 ha destinadas a este cultivo. Las principales zonas de producción de esta hortaliza son Milpa Alta, en el sur de la ciudad de México y Tlalnepantla en Morelos, donde se genera más del 80% de la producción del país (SIAP 2010).
Al igual que muchas hortalizas, el cultivo de nopal verdura presenta una serie de problemas fitosanitarios que disminuyen su producción y pueden ocasionar pérdidas en el cultivo (Badii & Flores 2001). En México se han registrado al menos 11 especies de insectos plaga del nopal verdura, dentro de las cuales la cochinilla silvestre del nopal, Dactylopius spp., junto con el picudo del nopal,Metamasius spinolae (Gyllenhal), son las más importantes en Milpa Alta y Tlalnepantla (Mann 1969, Colegio de Postgraduados 2005, Vanegas–Rico et al. 2010). Dentro del género Dactylopius se agrupan 10 especies registradas en América y se les conoce como "cochinilla silvestre del nopal" (Portillo & Vigueras 2001), de ellas cinco se encuentran en México. Algunas especies, como D. ceylonicus (Green) y D. opuntiae (Cockerell), se localizan en la mayoría de los estados de la República Mexicana (MacGregor & Sampedro 1984), de las cuales esta última es la plaga más común e importante en la producción del nopal verdura en el estado de Morelos (Colegio de Postgraduados 2005, Vanegas–Rico 2009, Vanegas–Rico et al. 2010).
La cochinilla silvestre del nopal causa un daño directo, al succionar la savia para alimentarse, esto ocasiona clorosis en cladodios y frutos, debilita la planta, y puede provocar la caída prematura tanto de frutos y cladodios y favorecer la infección por agentes patógenos (Vanegas–Rico et al. 2010, GIIN 2008). Así mismo, se ha reportado que altas densidades poblacionales de esta plaga pueden causar la muerte de la planta (MacGregor & Sampedro 1984). En el cultivo del nopal verdura no existen insecticidas autorizados (CICOPLAFEST 2009); sin embargo, el control químico es la herramienta que más se emplea para el manejo de esta plaga en las principales zonas de producción (Badii & Flores 2001). Existen otras opciones de manejo, como control físico mediante el cepillado de cladodios, uso de jabones (Palacios et al. 2004) o bioinsecticidas (Vigueras et al. 2009) pero su uso no es frecuente. Una alternativa al control químico de esta plaga es el control biológico mediante el uso de depredadores nativos. En algunos estudios, como el de Goeden et al. (1967), Portillo y Vigueras (1998) y Vanegas–Rico et al. (2010), se ha señalado la presencia de enemigos naturales asociados a la cochinilla silvestre del nopal.
En Tlalnepantla, Vanegas–Rico et al. (2010) encontraron que el hemeróbido Sympherobius barberi (Banks) fue uno de los depredadores más frecuentes en colonias de cochinilla silvestre del nopal. Por otro lado, Portillo y Vigueras (1998) observaron en Perú que larvas de Sympherobius spp., eliminaban hasta un 40% de estados inmaduros de la grana cochinilla en cultivos industriales.
Las larvas de hemeróbidos son depredadoras voraces de varios artrópodos, principalmente áfidos, cóccidos, psílidos y ácaros (New 1975, Oswald et al. 2002). Aunque los géneros Hemerobius, Micromus y Sympherobius son cosmopolitas (Meléndez 2009), se tiene poca información de su biología. Ya que hasta el momento no hay ningún trabajo relacionado con la biología de S. barberi, y que se ha señalado como un agente potencial de control biológico, en el presente estudio se planteó el objetivo de conocer el ciclo de vida y los parámetros poblacionales de S. barberi cuando se alimenta de D. opuntiae.
MATERIALES Y MÉTODOS
Área de estudio. La recolección del material biológico y algunas observaciones cualitativas de comportamiento en campo se realizaron de mayo de 2008 a mayo de 2009, en huertas comerciales de nopal verdura ubicadas en el municipio de Tlalnepantla, Morelos (18° 57' N y 98° 14' W, de 1,740 a 2,400 m snm). El estudio de la biología de Sympherobius barberi se llevó a cabo en el laboratorio de Control Biológico del Colegio de Postgraduados, Campus Montecillo. Las crías de Dactylopius opuntiae y Sympherobius barberi se establecieron por separados en cámaras de cría a 26 ± 2 °C, 55 ± 10% HR, y un fotoperiodo de 12:12 (luz: obscuridad). El fotoperiodo incluyó luz crepuscular (luz incandescente) de una hora de duración cada 12 horas.
Colecta y manipulación de material biológico
Dactylopius opuntiae. La colonia de cochinilla silvestre del nopal se inició con hembras colectadas en Tlalnepantla, de mayo a agosto de 2008. La cría se mantuvo siguiendo la propuesta metodológica de Tekelenburg (1995). Se utilizaron nopales (cladodios) individuales de aproximadamente un año (35 cm de largo), los cuales se perforaron en la parte basal y se dejaron cicatrizar para ser colgados dentro de una cámara de cría. Posteriormente, la infestación se realizó con hembras ovígenas en bolsas de papel glasé de 3 × 5 cm. Los cladodios se infestaron cada 35 a 45 días, tiempo que se requiere para obtener una nueva generación de la cochinilla silvestre del nopal en las condiciones de laboratorio ya descritas. De esta forma se aseguró obtener una infestación uniforme en el cladodio y se tenía control en la edad de las ninfas de D. opuntiae.
Sympherobius barberi. La colonia de S. barberi se estableció con larvas y adultos colectados directamente de cladodios infestados en campo de mayo a agostos de 2009. Los adultos se atraparon con un aspirador entomológico y se colocaban en tubos de plástico de 50 ml acondicionados con tela organza para ventilación. Las larvas se colectaron con un pincel de cerdas de camello del No. "00", y se colocaron individualmente en cajas Petri. Durante el desarrollo de S. barberi en condiciones de laboratorio se alimentaron con ninfas de primer y segundo ínstar de D. opuntiae hasta la emergencia de los adultos.
Los adultos capturados en campo y los que emergieron en laboratorio se colocaron en jaulas de plástico de 30 × 40 × 40 cm. Las jaulas tenían dos orificios; uno de 15 cm de diámetro, por donde se introdujeron y manipularon los ejemplares, y el otro de 30 × 40 cm, para manipular trozos de cladodios (20 × 15 cm aproximadamente) infestados con hembras y machos de la cochinilla silvestre del nopal, los cuales servían como sustrato de oviposición; ambos orificios fueron cubiertos con tela organza para facilitar su manejo y evitar el escape de insectos. En el interior de la jaula se colocaron dos vasos de plástico de 50 ml, con una solución de miel al 10%, se les adaptó una mecha de algodón para permitir la absorción de líquidos y estos se cambiaban cada tercer día, la cual sirvió como fuente de carbohidratos en caso de que fueran necesarios para la oviposición como se señaló para Micromus posticus (Miller & Cave 1987). Como no hay dieta comercial para adulto de S. barberi, se les ofreció dieta artificial utilizada para la cría masiva de crisopas preparada a base de levadura de cerveza, azúcar y agua (Vargas 2007).
Identificación de las especies. Se realizaron preparaciones de Dactylopius opuntiae de acuerdo a la metodología de Hamon y Kosztarab (1979). Los ejemplares de la cría del hemeróbido se montaron en alfiles entomológicos y ambas especies fueron identificadas por el M.C. Juan M. Vanegas Rico (Colegio de Postgraduados) con las claves de De Lotto (1974) y Smith (1939), respectivamente. Algunos hemeróbidos se enviaron al Dr. John Oswald, de la Universidad de Texas, para la corroboración de la especie.
Observaciones cualitativas de comportamiento en campo y laboratorio. Cada semana, de mayo a agosto de 2009, se realizaron observaciones cualitativas del comportamiento de depredación de S. barberi en campo. En cada visita, durante una hora se examinaron nopales con mayor incidencia de cochinilla silvestre del nopal en tres parcelas. Se localizaban larvas y adultos del hemeróbido y se registraba el comportamiento de depredación. Así mismo, se hicieron algunas anotaciones de la preferencia por ínstares larvales sobre ninfas y/o hembras de D. opuntiae, y los sitios de pupación. Parte del material se colectó y transportó al laboratorio para realizar observaciones de comportamiento de apareamiento y oviposición.
Las larvas de S. barberi se mantuvieron en jaulas, como las descritas previamente en la sección de cría. A la emergencia de los adultos se permitió el libre apareamiento y oviposición, registrando los principales componentes de estos eventos. Con ayuda de un microscopio estereoscópico se buscaron los sitios de oviposición de las hembras de S. barberi cada 24 horas.
Ciclo y tablas de vida de Sympherobius barberi en condiciones de laboratorio. El experimento se inició con 258 huevos de S. barberi de menos de 16 horas de edad. Cada individuo se consideró una unidad experimental. Los huevos se colocaron individualmente en cajas Petri de plástico de 5 cm de diámetro por 2 cm de altura, con una perforación en la tapa y cubierta con tela organza para permitir ventilación. Las cajas se rotularon con el número de ejemplar y fecha, y se colocaron en una jaula de plástico de 30 x 40 x 40 cm. En el interior de la jaula se colocaron trozos de papel filtro humedecido con agua para incrementar la humedad relativa. Para determinar el tiempo de incubación se realizaron observaciones cada 24 horas.
Al emerger las larvas se alimentaban con ninfas de primer y segundo ínstar de cochinilla silvestre del nopal, la cantidad de alimento que se ofrecía era la que se alcanzaba a colectar con un pincel No. "00". Cada 24 horas se realizaron observaciones y se cambió el alimento hasta la obtención de las pupas. Se tomó en cuenta la presencia de la exuvia de las larvas para estimar la duración de cada etapa biológica en días, también se registraba la sobrevivencia. Los datos que se consideraron fueron: total de huevos eclosionados, larvas que pasaron al segundo y tercer ínstar, larvas que llegaron a pupar y adultos que emergieron. Los datos se analizaron a través de técnicas demográficas con el programa Excel, de acuerdo con la metodología descrita por Vera et al. (2002) y Bravo et al. (2000).
Tabla de fecundidad de Sympherobius barberi en condiciones de laboratorio. Se eligieron alrededor de 60 pupas de S. barberi que fueron colocadas individualmente en cajas Petri hasta que emergieron los adultos. Estos se identificaron por su sexo y se formaron 20 parejas, cada pareja se consideró una unidad experimental y se colocó en recipientes de plástico de 15 × 15 × 15 cm, en el momento que se detectaba la muerte de un macho era sustituido por otro. A los adultos se les ofrecía dieta artificial utilizada en la cría de crisopas (Vargas 2007) y ninfas de primer y segundo ínstar de la cochinilla silvestre del nopal. Cada pareja se colocó junto a un trozo de nopal de 10 × 7 cm que tenía hembras y pupas de cochinilla silvestre que sirvieron como sustrato de oviposición. Cada 24 horas se sustituía el trozo de nopal y se remplazaba por uno nuevo. El nopal que se retiraba diariamente se revisaba al microscopio estereoscópico para cuantificar los huevos. Este procedimiento se repitió en todas las unidades experimentales hasta la muerte de las hembras.
Para determinar la fecundidad de cada hembra, se registró diariamente el número de huevos depositados en el sustrato de cada unidad experimental. Los datos se analizaron con el programa Lifetable (Maia et al. 2000, SAS 2000). Los parámetros poblacionales estimados fueron: fecundidad (mx), que se define como el número total de huevos que deposita una hembra; la tasa neta de reproducción (Ro), que se refiere al número de hembras que una hembra produce en una generación; la tasa intrínseca de crecimiento (rm) definida como la capacidad de multiplicación de una población en el lapso de una generación, el tiempo de generación (T), que es el tiempo promedio entre dos generaciones sucesivas y la tasa finita de reproducción (λ), que es el número de individuos por día (Rabinovich 1982).
Para determinar la longevidad de adultos, se tomaron en cuenta las 20 parejas formadas en el experimento anterior y se registró la longevidad de machos y hembras cada 24 horas. Los datos de longevidad se compararon mediante una prueba t–Student (Castillo 2003). Adicionalmente se realizó una curva de sobrevivencia sólo para el grupo de hembras.
RESULTADOS
Ciclo de vida de Sympherobius barberi en condiciones de laboratorio. De los 258 huevos observados para determinar el ciclo de vida, sólo 41 llegaron a adultos; de estos ejemplares 20 fueron hembras y 21 machos, lo que representa una proporción sexual de 1:1. El ciclo de vida de S. barberi consta de huevo, tres ínstares larvales, pupa y adulto. El desarrollo de huevo a adulto se completó en 28 ± 0.53 días, con un máximo de 34 y un mínimo de 20 días. El huevo eclosionó en 3.84 ± 0.05 días, con un máximo de 6 y un mínimo de 2 días. El estado de desarrollo que llevó más tiempo fue el larval con 14 ± 0.54 días; mientras que el estado pupal tuvo una duración de 9.82 ± 0.12 días (Cuadro 1).
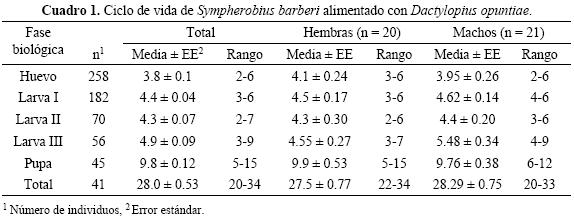
El tiempo de desarrollo de adultos desde que emergieron hasta que murieron fue ligeramente mayor para los machos, aunque esta diferencia no fue estadísticamente significativa (t = 1.38; P = 0.18); sólo la duración del estado larval presentó diferencias significativas entre sexos (t = 2.20; P = 0.04), las larvas que se convirtieron en machos, tardaron un día más que el desarrollo larval de las hembras (Cuadro 2).
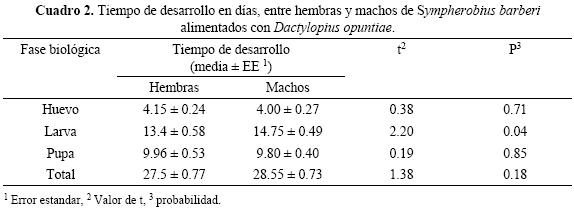
Longevidad de adultos. La longevidad promedio de adultos de S. barberi fue de 38.7 ± 3.1 días, con un máximo de 72 y un mínimo de 10 días. Las hembras presentaron una longevidad de 39 ± 3.42 días, con un mínimo de 10 y un máximo de 72 días; por su parte, los machos vivieron 38.3 ± 2.74 días, con un mínimo de 26 y un máximo de 62 días.
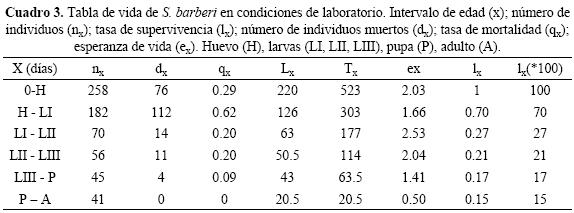
Sobrevivencia de Sympherobius barberi. En todos los estados de desarrollo biológico S. barberi presentó mortalidad, sólo el 15.9% de los organismos observados desde huevo llegaron a adulto. En el estado de pupa se presentó la mayor sobrevivencia, ya que el 91.1% alcanzó al estado adulto. El menor porcentaje de sobrevivencia se presentó en larva I donde sólo 38.5% logró pasar a larva II.
La curva de sobrevivencia de S. barberi (Fig. 1) se ajustó al tipo III (Rabinovich 1980). No todos los organismos se desarrollaron a la misma velocidad, por lo que hubo traslape en los diferentes estados de desarrollo. En la curva de sobrevivencia se observaron tres fases particulares. La primera fue del día uno al cuatro, ésta correspondió a la incubación de la mayoría de los huevos y presentó una sobrevivencia cercana al 80%. La fase dos comprendió básicamente el desarrollo de larva I y el inicio de larva II, la curva presentó un pendiente pronunciada del día cinco al nueve, en este intervalo se registró una sobrevivencia de 30 a 60%. La fase tres se caracterizó por una sobrevivencia reducida y similar desde el día 10 hasta el 36, que correspondió al desarrollo biológico de larva II hasta adulto.

Tabla de vida y parámetros poblacionales de Sympherobius barberi. El huevo y la larva I fueron los que presentaron la mayor mortalidad 29 y 62% respectivamente (Cuadro 3). La menor tasa de mortalidad sucedió en el ínstar II y III con 0.20% y en la fase de pupa con 0.09%. La esperanza de vida (ex) fue alta para el instar larval II con 2.53, en cambio para larvas I y III fue de 1.66 y 2.04, respectivamente.
La fecundidad para S. barberi (Fig. 2) fue de 1,684 huevos. El número de huevos promedio por hembra por día fue de 1.98 ± 2.0, con un máximo de 32 y un mínimo de 3. El comportamiento reproductivo según la dieta y condiciones en las que se desarrolló este estudio, se caracterizó por diferentes fases. La primera fase correspondió al periodo de preoviposición, que duró 4 ± 3.4 días, en la cual más del 90% de las hembras comenzaron a poner huevos a los cinco días, aunque se registró un 10% de hembras que iniciaron la oviposición hasta el día seis. La segunda fase fue del día 6 al día 60, en la cual se presentó la mayor oviposición pero con una gran variación. En el día siete se registró un máximo de 4.3 huevos por hembra, posteriormente la fecundidad fluctuó con promedio de 2 a 4 huevos diarios; del día 35 al 38 se presentó otro pico, con un promedio de 4.4 huevos por hembra por día. La fecundidad disminuyó del día 67 hasta el día 70, cuando se presentó la última oviposición.

Con los ciclos de vida, proporción sexual y fecundidad se estimaron los parámetros poblacionales de S. barberi alimentados con D. opuntiae. La tasa neta de reproducción (Ro) fue de 36.6 ± 0.10; la tasa intrínseca de crecimiento (rm) fue de 0.081; el tiempo de generación (T) fue 44.27 ± 2.1 días; y la tasa finita de reproducción (λ) fue de 1.084.
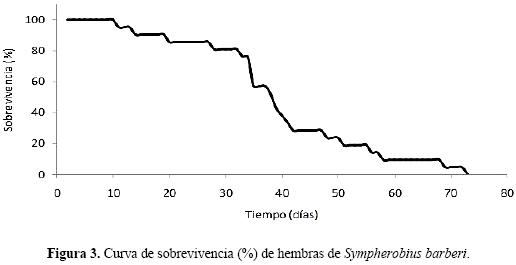
Curva de sobrevivencia de hembras de Sympherobius barberi. La sobrevivencia en los primeros 10 días después de la emergencia fue del 100%. Posteriormente, del día 10 al 32 la sobrevivencia se mantuvo entre 80 y 90%. A partir del día 32 había 16 hembras vivas que representaron la sobrevivencia del 60%. Desde el día 42 hasta el día 50 sobrevivieron el 30% (6 hembras). A los 60 días, menos del 10% de las hembras continuaba vivas (Fig. 3).
Aspectos biológicos de S. barberi. En campo se observó que tanto adultos como larvas tienen capacidad para depredar todos los estados de desarrollo de D. opuntiae. Los adultos depredaron preferentemente las ninfas y hembras jóvenes, y las larvas prefirieron alimentarse de huevos y ninfas. Las larvas son voraces y se desplazaban de una a otra colonia para encontrar su presa. Por lo general las pupas se observaron a un lado de la colonia de D. opuntiae o debajo de ésta, ocasionalmente utilizaban capullos abandonados de coccinélidos y pirálidos para pupar al lado de ellos.
En laboratorio se observó que las larvas y adultos se alimentaron de huevos, ninfas y hembras jóvenes de D. opuntiae. Durante las horas de observación el apareamiento sólo se detectó durante las horas crepusculares, el macho inició el cortejo de la hembra extendiendo sus alas y caminando alrededor de ella. Las hembras tuvieron marcada actividad de búsqueda de alimento en las horas del crepúsculo. Durante este mismo tiempo ocurría comúnmente la oviposición, las hembras ovipositaron en sitios protegidos, como en los capullos de las pupas de los machos de la cochinilla silvestre del nopal, en areolas de las espinas del nopal y en los bordes de los nopales. Durante el proceso de oviposición las hembras extendieron sus alas y las separaron para doblar el abdomen ventralmente y depositar los huevos. Las hembras depositaron los huevos en forma aislada o en grupo adheridos perpendicularmente al sustrato. Los huevos son de color blanco y se tornaban de pardo claro a pardo más obscuro conforme el desarrollo embrionario progresaba. Las larvas neonatas inmediatamente activas mueven la cabeza en búsqueda de presas, alimentándose vorazmente. Con frecuencia las larvas de segundo ínstar se desplazaron arqueando el abdomen, haciendo palanca sobre el sustrato con el extremo de éste, para localizar a su presa; este comportamiento fue más notorio en larvas del tercer ínstar. Después de un periodo de alimentación de 11 a 12 días el último ínstar larval redujo su actividad para dar paso a la formación de la pupa. Antes de esta fase se presentó una fase de prepupa en la cual las larvas arqueaban el cuerpo y quedaban en esta posición con las piezas bucales y antenas dirigidas hacia la parte ventral, posteriormente la prepupa empezó a secretar seda del extremo apical del abdomen para formar su capullo.
DISCUSIÓN
En la presente investigación se aportan los primeros registros de la biología de Sympherobius barberi alimentada con D. opuntiae. La información generada es relevante considerando que Vanegas–Rico et al. (2010) señalan a S. barberi como la segunda especie más abundante de enemigos naturales de D. opuntiae para la zona productora de nopal verdura de Tlalnepantla. Esto contrasta con lo reportado por Gilreath y Smith (1988), quienes consideran a S. barberi como un depredador poco frecuente de la cochinilla silvestre del nopal en Texas, EE.UU. Otros autores también afirman que los hemeróbidos se presentan como visitantes ocasionales (Goeden et al. 1967, Zimmermann et al. 2007).
Ciclo de vida de Sympherobius barberi. El ciclo biológico de S. barberi, en las condiciones en que se desarrolló el presente estudio, se completó en 28 días, lo cual es similar al de Nusalala uruguaya (Navás), que requirió 24 días a 25 °C, con Dactynopus sp., como alimento; mientras que Hemerobius humulinus Linnaeus completó su ciclo en 35 días a 18 °C (McEwen et al. 2001). Para Sympherobius amicus Navás la duración del ciclo biológico está también dentro del mismo rango, 32 días a 23 °C (Attia & El–Arnaouty 2008). Por otro lado, Lara y Perioto (2003) reportaron que entre 23 a 28 °C varias especies de hemeróbidos completan su ciclo biológico en un rango de 23 a 40 días.
Al comparar el desarrollo larval y el ciclo biológico de S. barberi con algunas especies de crisopas, se observan comportamientos similares. Silva et al. (2007) observaron que el desarrollo de Chrysopodes lineafrons Adams requirió 26 días a 28 °C. De acuerdo con Vargas (2007) Chrysoperla carnea Stephens, completó su ciclo en 23 días a 26 °C. De acuerdo a este mismo autor, la duración del primer ínstar larval de C. carnea fue de 3 días, para el ínstar II fue 2.5 días y para el ínstar III fue de 2.7 días; mientras que el periodo de desarrollo de pupa requirió 8 días. Lo anterior indica que la duración del ciclo biológico de S. barberi se encuentra en promedio de otros hemeróbidos, ligeramente mayor comparativamente al de otras crisopas. Cabe destacar que el desarrollo de los insectos en general, se ve afectado por las condiciones de laboratorio, principalmente por la temperatura, humedad relativa y fotoperiodo (McEwen 2001).
Sobrevivencia de larvas y adultos. La curva de sobrevivencia de S. barberi determinada en el presente estudio, fue de tipo III. De acuerdo con Rabinovich (1982) este tipo de curva indica un sistema en el cual hay una fracción constante de los organismos vivos que muere en cada uno de los intervalos de edad, y a medida que la población envejece la mortalidad es cada vez menor. Como sucede con otros estudios de ciclo de vida, en la presente investigación no todos los organismos se desarrollaron a la misma velocidad, lo cual provocó traslape entre algunos estados de desarrollo. Aunque se obtuvieron altos porcentajes de sobrevivencia en el periodo de incubación (90%), el total de organismos que se desarrolló de huevo hasta adulto representó sólo 16%, donde la sobrevivencia disminuyó conforme iban mudando los organismos. Estos datos de sobrevivencia en el periodo de incubación son similares con otros hemeróbidos, por ejemploMicromus tasmaniaea (Walker) que tiene una sobrevivencia en este periodo de 88 a 100% (Miller & Cave 1987), pero son contrastantes con el porcentaje de sobrevivencia de Chrysoperla comanche Banks en condiciones de laboratorio, el cual fue de 1.9% por cada día que transcurriría, y el factor clave fue la humedad relativa (Vargas 2007).
En cuanto a la longevidad de los adultos de S. barberi, en las hembras hubo una sobrevivencia del 80% en los primeros días y una longevidad de 10 a 72 días. Este último aspecto es semejante a otras especies de hemeróbidos reportadas en trabajos previos, por ejemplo Miller y Cave (1987) señalan que la hembra de Micromus posticus (Walker) tiene una longevidad de 25 a 86 días a 28°C. Attia y EL–Arnaouty (2008) mencionan que Sympherobius amicus Návas presenta, dependiendo de la dieta, una longevidad de 32 a 41 días. Adicionalmente, Souza y Ciociola (1997) indican que la dieta afecta la longevidad de Nusalala uruguaya (Navás).
Tabla de vida y de fecundidad. Los parámetros poblacionales de S. barberi mostraron que la mayor mortalidad (dx) en larvas se presentó durante el primer ínstar (62%), mientras que la menor mortalidad se presentó en larva II y III; por otro lado, el estado de pupa fue el que tuvo el menor nivel de mortandad (9%). Este comportamiento es característico de la curva de sobrevivencia tipo III que se presenta en la mayoría de los insectos (Rabinovich 1982). Algunos individuos mueren durante el proceso de muda; lo cual puede ser consecuencia de varios factores que influyen en la cría de insectos, como temperatura, fotoperiodo, humedad y dieta (Arredondo 2004, Rodríguez–del–Bosque y Arredondo–Bernal 2007). Se sugiere estudiar detalladamente los factores que afectan más la sobrevivencia en todos los estados de desarrollo para mejorar la cría de S. barberi.
Cada hembra de S. barberi ovipositó un promedio de 80 huevos, lo cual equivale a una fecundidad de 1.98 ± 2 huevos por hembra por día siendo el máximo de 4.37 huevos. Este valor es bajo comparando con otras especies de hemeróbidos, como Micromus spp., el cual tiene un promedio de 8.5 a 18 huevos por hembra por día (McEwen et al. 2001, Sato & Takada 2004, Vidya et al. 2008). También es inferior a la registrada para Micromus posticus (Walker), que en promedio llega a ser de 144 huevos por hembra y de 14 a 30 huevos por hembra por día (Miller & Cave 1987).
Sympherobius barberi presentó un periodo de preoviposición de 3 a 4 días, similar al de otras especies de hemeróbidos como Micromus posticus, con un promedio de 3 a 5 días (Miller & Cave 1987). Como se indica en la metodología, al no haber dietas artificiales para adultos de S. barberi, en este estudio se utilizó la dieta artificial para cría masiva de crisopas más ninfas de D. opuntiae. Debido a que no se presentó una diferencia en el periodo de preoviposición de S. barberi, comparado con otras especies de hemeróbidos, se considera que la dieta no influyó de manera importante en la duración de este periodo.
La baja fecundidad de S. barberi en relación con otras especies de hemeróbidos, como Micromus tasmaniae (Walker) y Hemerobius pacificus Banks (McEwen et al. 2001), podría atribuirse a que su presa (D. opuntiae) produce ácido carmínico característico de los dactilópidos. La producción de ácido carmínico es variable entre especies y se ha señalado que este compuesto actúa como un mecanismo de defensa de los dactilópidos contra sus depredadores (Portillo & Vigueras 2001, Vigueras et al. 2009) . Al parecer, esta sería parte de la explicación del por qué D. opuntiae tiene menos de 10 depredadores y no se han registrado parasitoides (Rodríguez–Leyva et al. 2010) . Muralibaskaran et al. (2002) señalan que depredadores como el coccinélido Cryptolaemus montrouzieri Mulsant, al ser alimentados con Dactylopius tomentosus Lam., presentó una tasa neta de reproducción baja (Ro = 58), comparada cuando se alimentaron con Maconellicoccus hirsutus (Green) (Ro = 100). Estos mismos autores también se refieren al periodo de desarrollo de C. montrouzieri, el cual se prolongó cuando se alimentó con D. tomentosus comparado con M. hirsutus. Previamente estos autores (Muralibaskaran et al. 1999) determinaron que el tiempo de desarrollo de C. montrouziere tardó más cuando se alimentó con el dactilópido D. tomantosus que con Planococcus citri Risso. Hasta ahora se ha presentado poca evidencia experimental sobre el ácido carmínico como mecanismo de defensa de los dactilópidos contra sus depredadores, pero los resultados de biología de C. montrouziere sobre dactilópidos parecen soportarla. Para entender este mecanismo, se sugiere continuar con estudios similares en S. barberi, utilizando diferentes presas como fuente de alimento.
Los parámetros poblacionales como la tasa neta de reproducción (Ro), el tiempo de generación (T), la tasa intrínseca de crecimiento (rm) y la tasa finita de reproducción (λ), permiten inferir el potencial reproductivo de una especie, y al comparar estos parámetros con los de otras especies se pueden predecir las posibles interacciones entre ellas. Los parámetros poblacionales estimados en el presente trabajo para S. barberi (Ro = 36.6, T = 44.27 días, rm = 0.081 y λ = 1.08) son similares a los reportados para otras especies de hemeróbidos, como M. posticus (Ro = 46.1; T = 56.3 días, rm = 0.153 y λ = 1.17) (Miller & Cave 1987). Sin embargo, estas comparaciones deben tomarse con reserva, debido a que las especies depredadoras con las que se compara a S. barberi se han desarrollado sobre diferentes presas.
Algunos autores como Miller y Cave (1987), McEwen et al. (2001) y Attia y EL–Arnaouty (2008), mencionan que la fecundidad se ve influenciada por las diferentes dietas que se ofrecen a los insectos benéficos. Debido a que S. barberi es una especie polífaga (Oswald et al. 2002), se sugiere realizar estudios con diferentes presas para comparar sus parámetros demográficos con otros organismos. Esta información es relevante, considerando que ya existen metodologías de reproducción masiva de algunos neurópteros (hemeróbidos y crisópidos), las cuales pudieran adaptarse rápidamente para continuar con los estudios de S. barberi.
Algunos de los atributos deseables de un agente de control biológico son su capacidad de búsqueda, buena reproducción, alta fecundidad y fertilidad (De Bach 1964, Arredondo 2004). Al considerar que S. barberi presentó ciertos atributos como: a) poder completar su ciclo en D. opuntiae pues cumple con los requerimientos nutricionales, b) ser el segundo enemigo natural más abundante de la cochinilla silvestre del nopal en una de las principales zonas de producción de nopal verdura en México, y c) mostrar adaptación a una variedad de ambientes, incluso a la presencia de insecticidas, todo lo cual hace que esta especie debería recibir más atención para determinar su potencial como agente de control biológico de la cochinilla silvestre del nopal.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por haber otorgado una beca completa de estudios de maestría para la autora. Se agradece el apoyo al Grupo Interdisciplinario de Investigación del Nopal (GIIN) del Colegio de Postgraduados, y al Consejo Municipal de Nopaleros en Tlalnepantla, A.C. (COMUNOTLA) de Morelos.
LITERATURA CITADA
Arredondo, H. C. 2004. Manejo y producción de Chysoperla carnea (Stephens) (Neuroptera: Chrysopidae), pp. 177–195. In: N. Bautista, H. Bravo y C. Chavarin (Eds.). Cría de Insectos Plaga y Organismos Benéficos. CONABIO, Instituto de Fitosanidad y Colegio de Postgraduados. [ Links ]
Attia, A. R. & S. A. EL–Arnaouty. 2008. Effect of different type of preys on the bioactivity of the predator Sympherobius amicus Navas (Neuroptera: Hemerobiidae). Egyptian Journal of Biological Pest Control, 18: 61–64. [ Links ]
Badii, M. H. & A. E. Flores. 2001. Prickly pear cacti pest and their control in Mexico. Florida Entomologist, 84: 503–505. [ Links ]
Bravo, M. H., M. H. Badii & A. E. Flores. 2000. Artrópodos depredadores, pp. 120–125. In: M.H. Badii, A. E Flores y L. J. Galán (Eds.). Fundamentos y perspectivas de control biológico. Universidad Autónoma de Nuevo León, México. [ Links ]
Castillo, M. L. E. 2003. Introducción a la estadística experimental. Universidad Autónoma Chapingo, México. 277 pp. [ Links ]
Colegio de Postgraduados. 2005. Diagnóstico fitosanitario del nopal verdura (Opuntia ficus–indica) en Tlalnepantla, Morelos. Memoria de la primera reunión del Grupo Interdisciplinario de Investigación en Nopal. Colegio de Postgraduados. Campus Montecillo, Texcoco, Estado de México. 78 pp. [ Links ]
CICOPLAFEST. 2009. Comisión Intersecretarial para el Control del Proceso y Uso de Plaguicidas y Sustancias Tóxicas. Consultado en línea el 30 de junio de 2009. http://www.sagarpa.gob.mx/v1/cicoplafest/. [ Links ]
De Bach, P. 1964. Control biológico de las plagas de insectos y malas hierbas. Compañía Editorial Continental S.A. de C.V. México. 949 pp. [ Links ]
De Lotto, G. 1974. On the status of the cochineal insects (Homoptera: Coccoidea: Dactylopiidae). Journal of the Entomological Society of South Africa, 37: 167–193. [ Links ]
Gilreath, M. E. & J. W. Smith. 1988. Natural enemies of Dactylopius confusus (Homoptera: Dactylopiidae): exclusion and subsequent impact on Opuntiae (Cactaceae). Environmental Entomology, 17: 731–738. [ Links ]
GIIN Grupo Interdisciplinario de Investigación del Nopal. 2008. El picudo del nopal en Tlalnepantla, Morelos. Monitor del órgano de comunicación del Comité Estatal de Sanidad Vegetal del estado de Morelos, A.C. 1: 4–8. [ Links ]
Goeden, R. D., C. A. Fleschner & D. W. Ricker. 1967. Biological control of prickly pear cacti on Santa Cruz Island, California. Hilgardia, 38: 579–606. [ Links ]
Hamon, A. B. & M. L. Kosztarab. 1979. Mophology and systematic of the first instar of the genus Ceroccus (Homoptera: Coccoidae). Virginia Polytechnical Institute and State University Research Division Bulletin, 146: 1–122. [ Links ]
Lara, R. I. R. & N. W. Perioto. 2003. Bioecologia de Hemerobiideos (Neuroptera: Hemerobiidae). Arqivos do Instituto Biológico, Sao Paulo, 70: 517–523. [ Links ]
MacGregor, L. R. & R. Sampedro. 1984. Catálogo de cóccidos mexicanos I. Familia Dactylopiidae (Homoptera: Dactylopiidae). Anales del Instituto de Biología de la Universidad Nacional Autónoma de México, 1: 217–223. [ Links ]
Maia, A. H. N., A. J. Liuz & C. Campanhola. 2000. Statistical inference on associated fertility life table parameters using jackknife technique: computational aspects. Journal of Economic Entomology, 93: 511–518. [ Links ]
Mann, J. 1969. Cactus–feeding insects and mites. Smithsonian Institution. United States Natural Museum Bulletin, 256: 1–158. [ Links ]
McEwen, P. K., T. R. New & A. E. Whittington. 2001. Lacewings in the crop environment. Cambridge University Press. Cambridge. 546 pp. [ Links ]
Meléndez, O. E. 2009. Diversidad de Hemerobiidae (Insecta: Neuroptera) del Rancho Santa Elena, Huasca, Hidalgo. Tesis de Licenciatura en Biología. Universidad del estado de Hidalgo. 70 p. [ Links ]
Miller, L. G. & R. D. Cave. 1987. Bionomics of Micromus posticus (Walker) (Neuroptera: Hemerobiidae) with descriptions of the immature stages. Proceedings of the Entomological Society of Washington, 89: 779–789. [ Links ]
Muralibaskaran, B. R. K., L. Geetha & S. Uthamasamy. 1999. Comparative biology and predatory potential of Australian ladybird beetle (Cryptolaemus montrouzieri) on Planococus citri and Dactylopius tomantosus. Journal of Agricultural Sciences, 69: 605–606. [ Links ]
Muralibaskaran, B. R. K., T. R. Srinivasan, K. Muthumeena, S. Muthulakhmi & N. R. Mahadevan. 2002. Life–table of Australian ladybird beetle (Cryptolaemus montrouzieri) feeding on mealybugs (Maconellicocus hirsutus and Dactylopius tomentosus). Journal of Agricultural Sciences, 72: 54–56. [ Links ]
New, T. R. 1975. The biology of Chrysopidae and Hemerobiidae (Neuroptera), with reference to their usage as biocontrol agents: a review. Transaction of the Entomological Society of London, 127: 115–140. [ Links ]
Oswald, J., A. Contreras & N. D. Penny. 2002. Neuroptera (Neuropterida), pp. 559–581 In: J. LLorente Bousquets & J. J. Morrone (Eds.). Biodiversidad, taxonomía y biogeografía de artrópodos de México: Hacia una síntesis de su conocimiento, Vol. III. Universidad Nacional Autónoma de México, México, D.F. [ Links ]
Palacios, C., R. Nieto, C. Llanderal & H. González. 2004. Efectividad biológica de productos biodegradables para el control de la cochinilla silvestre Dactylopius opuntiae (Cockerell) (Homoptera: Dactylopiidae). Acta Zoológica Mexicana (n.s.), 20: 99–106. [ Links ]
Portillo, L. & A. L. Vigueras. 1998. Natural enemies of cochineal (Dactylopius coccus Costa): importance in Mexico. Journal of the professional Association for Cactus Development, 3: 43–49. [ Links ]
Portillo, L. & A. L. Vigueras. 2001. Dactylopius (Homoptera: Dactylopidae) and its hosts in Jalisco, México. Bollettino di Zoologia Agrarian e di Bachicoltura, 33: 249–251. [ Links ]
Rabinovich, E. J. 1982. Introducción a la ecología de poblaciones animales. Compañía Editorial Continental S.A. de C.V., México. 312 pp. [ Links ]
Rodríguez–del–Bosque, L. A. & H. C. Arredondo–Bernal. 2007. Teoría y aplicación del control biológico, Sociedad Mexicana de Control Biológico, México. 303 pp. [ Links ]
Rodríguez–Leyva, E., J. R. Lomeli–Flores & J. M. Vanegas–Rico. 2010. Enemigos naturales de la grana cochinilla del nopal Dactylopius coccus Costa (Hemiptera: Dactylopiidae), pp. 1–12. In: L. Portillo y A. L. Vigueras (Coord.). Conocimiento y aprovechamiento de la grana cochinilla. Publicación FAO, CACTUS–NET. (En prensa). [ Links ]
SAS Institute Inc. 2000. SAS/STAT user's guide, version 9. SAS Institute, Cary, NC. [ Links ]
Sato, T. & H. Takada. 2004. Biological studies on three Micromus species in Japan (Neuroptera: Hemerobiidae) to evaluate their potential as biological control agents against aphids: 1. Thermal effects on development and reproduction. Applied Entomological Zoology, 39: 417–425. [ Links ]
SIAP. 2010. Servicio de Información Agroalimentaria y Pesquera. Consultado en línea el 26 de marzo de 2009. http://www.siap.gob.mx/. [ Links ]
Silva, P. S., G. S. Albuquerque, C. A. Tauber & M. J. Tauber. 2007. Life history of widespread neotropical predador, Chrysopodes (Chrysopodes) lineafrons (Neuroptera: Chrysopidae). Biological Control, 41: 33–41. [ Links ]
Smith, R. C. 1939. Notes on the Neuroptera and Mecoptera of Kansas, with keys for the identification of species. Journal Kansas Entomological Society, 7: 120–145. [ Links ]
Souza, B. & A. I. Ciociola. 1997. Efeito de diferentes dietas sobre a fecundidade e longevidade de Nusalala uruguaya (Navás, 1923) (Neuroptera: Hemerobiidae). Pesquisa Agropecuaria Brasileira, 32: 27–32. [ Links ]
Tekelenburg, I. A. 1995. La producción de la cochinilla (Dactylopius coccus Costa) en ambiente semi–controlados: El objetivo ecológico–productivo, limitaciones (a) bióticas técnicas y perspectivas, pp. 48–55. In: Pimienta, E., C. Neri, A. Muños y F. Huerta (Comp.) Memorias del VI Congreso Nacional y IV Congreso Internacional sobre el conocimiento y aprovechamiento del nopal. Universidad de Guadalajara, Jalisco, México. [ Links ]
Vanegas–Rico, J. M. 2009. Dinámica poblacional de Dactylopius opuntiae (Cockerell) y sus enemigos naturales en Tlalnepantla, Morelos. Tesis de Maestría en Ciencias. Colegio de Postgraduados, Montecillo, Texcoco, México. 96 p. [ Links ]
Vanegas–Rico, J. M., J. R. Lomeli–Flores, E. Rodríguez–Leyva, G. Mora–Aguilera & J. M. Valdez. 2010. Enemigos naturales de Dactylopius opuntiae (Cockerell) en Opuntia ficus–indica (L.) Miller en el centro de México. Acta Zoológica Mexicana (n.s), 26: 415–433. [ Links ]
Vargas, E .U. 2007. Desarrollo, supervivencia y fecundidad de Chrysoperla carnea Stephens y Chrysoperla comanche Banks criadas con huevecillos de Sitotroga cerealella (Olivier). Tesis de Maestría. Universidad Autónoma Chapingo. Chapingo, México. 84 pp. [ Links ]
Vera, G. J., V. M. Pinto & R. R. Robles. 2002. Ecología de poblaciones de insectos. Colegio de Post–graduados, Montecillo, Texcoco, México. 136 pp. [ Links ]
Vidya, M., S. Lingappa, R. K Patil & G. K Ramegowda. 2008. Biology and feeding potential of Micromus australis Hagen on sorghum aphid, Melanaphis sacchari (Zehntner). Journal of Biological Control, 22: 467–470. [ Links ]
Vigueras, A. L., J. Cibrian–Tovar & C. Pelayo–Ortíz. 2009. Use of botanical extracts to control wild cochineal (Dactylopius opuntiae Cockerell) on cactus pear. Proceedings of the VI International Congress on Cactus and Cochineal. Acta Horticulturae, 811: 229–234. [ Links ]
Zimmermann, H., S. Bloem & H. Klein. 2007. Biología, historia, amenaza, monitoreo y control de la palomilla del nopal, Cactoblastis cactorum. Join FAO/IAEA Division of Nuclear Techniques in Food and Agriculture. Transcontinental Reproducciones Fotomecánicas S.A. de C.V. México, D.F. 93 pp. [ Links ]














