Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta zoológica mexicana
versão On-line ISSN 2448-8445versão impressa ISSN 0065-1737
Acta Zool. Mex vol.26 spe 2 Xalapa Jan. 2010
Artículos originales
Populações de minhocas amostradas por diferentes métodos de coleta (elétrico, químico e manual) em ecossistemas da região de Londrina, Paraná, Brasil
Poblaciones de lombrices de tierra muestreadas por diferentes métodos de coleta (eléctrico, químico y manual) en ecosistemas de la región de Londrina, Paraná, Brasil
Priscila T.M. AZEVEDO,1 George Gardner BROWN,2 Dilmar BARETTA,1 Amarildo PASINI3 & Daiane Heloisa NUNES4
1 Universidade de São Paulo (ESALQ/USP), Departamento de Ciência do Solo, Av. Pádua Dias, 11, CEP 13418–900, Piracicaba, SP, Brasil. E–mail: priscilatm@gmail.com, dilmarbaretta@gmail.com
2 Embrapa Florestas, Estrada da Ribeira, Km 111, Caixa Postal 319, CEP 83411–000, Colombo, PR, Brasil. E–mail: browng@cnpf.embrapa.br
3 Universidade Estadual de Londrina, Departamento de Agronomia, CP 6001, CEP 86051–990, Londrina, PR, Brasil. E–mail: pasini@uel.br
4 Universidade de São Paulo (ESALQ/USP), Departamento de Entomologia, Fitopatologia e Zoologia Agrícola, Av. Pádua Dias, 11, CEP 13418–900, Piracicaba, SP, Brasil. E–mail: nunesdaiane@gmail.com
Recibido: 16/05/2008.
Aceptado: 08/01/2010.
RESUMO
A coleta de minhocas demanda tempo, mão–de–obra e trabalho intenso. Para reduzir o tempo e esforços necessários na amostragem, pode–se usar solução química irritante ou impulsos elétricos para extrair minhocas do solo. No presente trabalho comparou–se o uso de dois métodos comportamentais para coleta de minhocas (formol diluído e eletricidade) e sua eficiência na extração de minhocas do solo em fragmento de mata secundária, margem de um pântano, área agrícola de cultivo anual e pastagem. A coleta com eletricidade (método Octeto de Thielemann) foi realizada usando um aparelho elétrico que extrai minhocas sobre uma área de aproximadamente 0,4 m2. Exatamente abaixo e imediatamente após o método elétrico, realizou–se a escavação e triagem manual de monólitos de 0,16 m2, até 30 cm de profundidade. A extração química foi realizada usando uma solução de formol (0,5%) aplicada em área de 1 m2, distante 5 m das outras amostragens. O método elétrico não apresentou diferença significativa da extração com solução de formol, enquanto à densidade e biomassa de minhocas coletadas. Amynthas gracilis e Urobenus brasiliensis predominaram na mata e responderam aos métodos comportamentais. Pontoscolex corethrurus foi mais encontrada no brejo, onde os métodos manual e químico foram mais eficientes. Nos sistemas agrícolas, destacou–se a presença de Dichogaster spp. (não responsivos aos métodos comportamentais), sendo a maioria das minhocas coletada pelo método manual. A utilização do aparelho elétrico e da solução de formol foi eficiente na coleta de minhocas adultas e de maior biomassa, enquanto que o método manual extraiu mais indivíduos menores e juvenis.
Palavras chave: Fauna do solo, biodiversidade, métodos de amostragem, Oligochaeta.
RESUMEN
La recolección de lombrices exige tiempo, mano de obra y trabajo intenso. Para reducir el tiempo y los esfuerzos necesarios en el muestreo, se puede usar una solución química irritante o impulsos eléctricos para extraer lombrices del suelo. En el presente trabajo se comparó el uso de dos métodos de comportamiento para recolección de lombrices (formol diluido y electricidad) y su eficiencia en la extracción de lombrices en un fragmento de bosque secundario, margen de un pantano, área agrícola de cultivo anual y pastizal. La recolección con electricidad (método Octeto de Thielemann) fue realizada usando un aparato eléctrico que extrae lombrices sobre un área de aproximadamente 0.4 m2. Exactamente debajo e inmediatamente después del método eléctrico, se realizó la excavación y selección manual de monolitos de 0.16 m2, hasta una profundidad de 30 cm. La extracción química fue realizada usando una solución de formol (0.5%) aplicada en área de 1 m2, distante 5 m de los demás muestreos. El método eléctrico no presentó diferencia significativa de la extracción con solución de formol, con respecto a la densidad y biomasa de lombrices recolectadas. Amynthas gracilis y Urobenus brasiliensis predominaron en el bosque y respondieron a los métodos de extracción comportamental. Pontoscolex corethrurus fue encontrada principalmente en la muestra cerca del pantano, donde el método manual y químico fueron más eficaces. En los sistemas agrícolas, se destacó la presencia de Dichogaster spp. (no responsivos a los métodos comportamentales), recolectadas más por el método manual. La utilización del aparato eléctrico y de la solución de formol fue eficaz en la recolección de lombrices adultas y de mayor biomasa, mientras que el método manual extrajo mayor cantidad de individuos menores y juveniles.
Palabras clave: Fauna del suelo, biodiversidad, métodos de muestreo, Oligochaeta.
INTRODUÇÃO
A amostragem de minhocas pode ser realizada por métodos diretos, como a escavação de monólitos e posterior triagem manual dos organismos ou por métodos comporta–mentais, nos quais as minhocas respondem a estímulos (soluções irritantes, impulsos elétricos, calor, vibrações) e saem para a superfície do solo (Garceau & Coderre 1991). Atualmente, os métodos mais utilizados pelos pesquisadores são a escavação e triagem manual de monólitos, especialmente o método TSBF (Tropical Soil Biology and Fertility; Anderson & Ingram 1993) e a extração de minhocas por solução de formol (Zaborski 2003), combinados ou não (Römbke et al. 2006).
Em geral, a triagem de monólitos obtém maior densidade (no. indivíduos) e bio–massa de minhocas na camada amostrada em relação à extração por meios químicos. Dessa forma, constitui o meio de amostragem mais preciso (Bouché & Gardner 1984). Entretanto, as minhocas que habitam camadas inferiores à amostrada podem escapar rapidamente pelos túneis permanentes em direção a camadas mais profundas e não são bem coletadas por este método (Baretta et al. 2007). Além disso, a retirada de monólitos pode causar destruição física do solo, e a presença de barreiras físicas como um sistema radicular denso pode torná–lo impraticável (Zaborski 2003, Baretta et al. 2007). O método é trabalhoso, necessitando de maior período de tempo e mão–de–obra para sua conclusão (Nelson & Satchell 1962, Lee 1985).
A utilização de solução química extratora, como o formol, visa diminuir os efeitos negativos do método de escavação, mas também apresenta desvantagens por ser um produto fitotóxico e carcinogênico (Caballero 1974, Schmidt et al. 2001, Eichinger et al. 2007, Coja et al. 2008).
A expulsão de minhocas por estímulos elétricos foi descrita pela primeira vez em 1933, por Walton e Johnstone–Wallace (Edwards & Bohlen 1996). Na década de 50 e 60, vários trabalhos foram publicados utilizando eletrodos no solo para estimular a saída de minhocas. A principal dificuldade encontrada na época era delimitar a área e volume de solo amostrado (Nelson & Satchell 1962). O problema foi reduzido quando Rushton & Luff (1984) utilizaram vários eletrodos dispostos em um círculo de área 0,105 m2. Esse método ainda não foi estudado na América Latina e pode ser uma alternativa aos métodos convencionais. Atualmente, o método utilizado é baseado no Octeto de Thielemann (Thielemann 1986), no qual oito eletrodos são arranjados na forma de um octógono, inseridos no solo, e uma corrente elétrica alternada é descarregada entre os diferentes pares de eletrodos durante todo tempo de coleta (Rabello & Brown 2005). Esse método foi eficiente para coleta de minhocas em solos na Inglaterra, Alemanha e Áustria (Satchell 1955, Thielemann 1986, Coja et al. 2008). Todavia, o método demanda maior investimento inicial, pela aquisição do aparelho e gerador, e sua eficiência tem sido questionada (Vetter 1996), pois está diretamente relacionada com o teor de água no solo, limitando as coletas em diferentes épocas e regiões amostradas (Rushton & Luff 1984).
Diante da importância de se escolher um método adequado de amostragem de minhocas para os estudos ecológicos, e da escassez de trabalhos científicos que abordam o assunto na América Latina, o presente estudo teve como objetivo avaliar a eficiência e as diferenças na abundância (densidade populacional e biomassa) e diversidade obtidas pelos métodos comportamentais de coleta de minhocas em diferentes ecossistemas.
MATERIAL E MÉTODOS
O estudo foi conduzido no município de Londrina, Paraná, Brasil (23°23'30" S e 51°11'30" W), em quatro ecossistemas distintos, com altitude média de 566 metros acima do nível do mar. O clima da região é definido como subtropical úmido (Cfb, segundo a classificação de Kõppen). A precipitação média anual é de 1.614 mm e a temperatura média do mês mais quente superior a 22 °C e a do mês mais frio inferior a 18 °C (Corrêa et al. 1982). O solo dos locais de amostragem foi classificado como Latossolo Vermelho eutroférrico, textura muito argilosa (Tabela I).
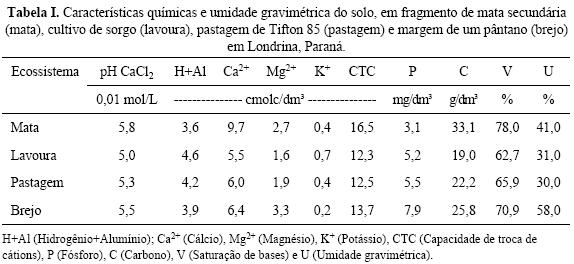
Os ecossistemas selecionados incluíram: 1) fragmento de mata Atlântica secundária (mata); 2) cultivo de sorgo (Sorghum spp.) e milho (Zea mays L), introduzidos há 15 anos, semeados com plantio convencional (arado de disco) e sem histórico de práticas conservacionistas (lavoura); 3) pastagem de Tifton 85 (Cynodon spp.) para eqüinos há 10 anos (pastagem); e 4) margem de um pântano (brejo). As três primeiras áreas se localizam na Fazenda Escola, no campus da Universidade Estadual de Londrina (UEL), e a última a aproximadamente 5 km da Embrapa Soja.
Para a avaliação das populações de minhocas, foram usados dois métodos com–portamentais (elétrico e formol) e um método de coleta direta (triagem manual) do solo. Para cada método, de acordo com o tamanho e a representatividade das áreas, foram amostrados, ao acaso, oito pontos nas áreas de mata e brejo e cinco pontos nas áreas de lavoura e pastagem. Os pontos de amostragem apresentavam distância mínima de 10 metros entre si. As avaliações foram realizadas nos meses de abril e maio de 2005.
O octeto de Thielemann (Thielemann 1986) foi utilizado no método elétrico. O aparelho foi disposto sobre o solo e acoplado a uma bateria de 12 amperes (de automóvel). As oito hastes foram inseridas no solo até 30 cm de profundidade, formando um círculo de 52 cm de diâmetro. Selecionou–se a voltagem e freqüência dos impulsos elétricos, sendo que a cada 4 minutos houve variação de corrente elétrica e freqüência dos impulsos entre os eletrodos, para que ocorresse mudança do campo elétrico do solo e afetasse as minhocas em diferentes intensidades e orientações. A voltagem média foi de 200 V, variando de 100 a 400 V. Delimitou–se área de 0.4 m2 para a coleta das minhocas, por ponto amostrado. O tempo total de coleta foi de 20 minutos para cada ponto de amostragem.
O método manual correspondeu à escavação e triagem manual de monólitos de 40x40 cm, até a profundidade de 30 cm. A escavação dos monólitos foi feita após a extração elétrica e exatamente abaixo do ponto onde foi realizado o método elétrico, para cálculo da eficiência do aparelho elétrico e para se conhecer quais espécies estavam no local de amostragem e não foram coletadas pelo método elétrico. Uma sub–amostra de solo (0–10 cm de profundidade) foi retirada de cada monólito para determinação de algumas variáveis ambientais: umidade gravimétrica, matéria orgânica (MO), pH CaCl2 (pH) e teores de N, C, P, K, Ca e Mg.
Para o método químico (formol), foram usados 20 litros de solução extratora de formaldeído na concentração de 0,5% (Raw 1959, Baker 1985). Determinou–se o ponto de amostragem, distante 5 metros da coleta pelo método elétrico, e foi delimitada área de 1 m2. Os resíduos da superfície do solo foram retirados com uma enxada, 20 minutos antes do início da coleta. A solução extratora foi aplicada lentamente, para completa absorção pelo solo. O tempo de coleta manual das minhocas que saíam para a superfície foi de 25 minutos. Todas as espécies de minhocas coletadas foram mortas em álcool (20%) e fixadas em formol (4%).
As minhocas foram contadas, pesadas e separadas em indivíduos juvenis e adultos. Para obtenção da biomassa fresca total, as minhocas foram lavadas em água corrente e secadas ao ar livre com papel toalha por três minutos. Os adultos foram identificados segundo Righi (1990) e Blakemore (2002). Os resultados de densidade populacional e biomassa foram transformados em indivíduos por metro quadrado (ind/m2) e peso por metro quadrado (g/m2), respectivamente.
Os dados obtidos não apresentaram distribuição normal, pelo teste de Kolmogorov–Smirnov. Realizou–se, então, análise estatística não–paramétrica usando o método de Kruskal–Wallis para análise de variância dos dados obtidos. O teste de Mann–Whitney foi utilizado para comparar os tratamentos (métodos elétrico, manual e formol) entre si. Análises multivariadas de correlação canónica (ACC) e de componentes principais (ACP) foram realizadas entre as variáveis de resposta (espécies de minhocas) e as variáveis ambientais explicativas: biomassa fresca total das minhocas, abundância total de minhocas, índice de diversidade de Shannon (H), pH CaCl2 e teores de MO, N, C, P, K, Ca e Mg no solo. As análises multivariadas foram realizadas no programa CANOCO versão 4.0 (Ter Braak & Smilauer 1998). As variáveis ambientais foram utilizadas posteriormente na ACP, como variáveis explicativas das modificações das populações de minhocas (Baretta et al. 2007).
Para o cálculo da eficiência (%) dos métodos comportamentais empregados (elétrico e formol) em cada ponto de amostragem, foi realizada em base à soma dos indivíduos obtidos com o método elétrico e o método manual. Para o cálculo, foi utilizada a seguinte fórmula:
Ef método (%) = (nmétodo/(nele+nman))*100
Onde, nmétodo = densidade (ind/m2) de minhocas coletadas com cada método comportamental, podendo ser nele (elétrico) ou nfor (formol), sendo que:
nele = densidade (ind/m2) obtida pelo método elétrico
nman = densidade (ind/m2) obtida pelo método manual
nfor = densidade (ind/m2) obtida pelo método formol
O valor da eficiência média de cada método nas diferentes áreas foi obtido pela média dos valores das eficiências em cada ponto de amostragem.
RESULTADOS
Densidade, biomassa e diversidade de minhocas
O método manual obteve a maior densidade populacional de minhocas em todos os ecossistemas avaliados, diferindo estatisticamente dos outros métodos na mata, pastagem e lavoura (Tabela II). Nestes ecossistemas, a maioria das minhocas coletadas pelo método manual foram indivíduos jovens (Tabela III) e pequenos, com 1 a 3 cm de comprimento. As minhocas adultas responderam melhor aos métodos comporta–mentais (elétrico e formol), que o método de catação manual.
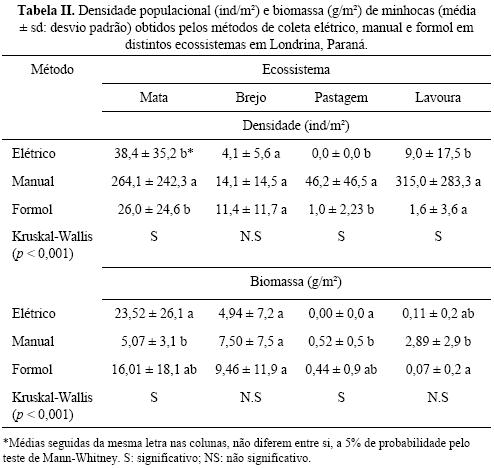
Os métodos elétrico e formol extraíram a maior quantidade de minhocas na mata, onde predominam espécies que responderam bem a estes métodos (Tabela III): Amynthas gracilis (Kinberg 1867), e a nativa Urobenus brasiliensis (Benham 1887), ambas espécies epi–endogêicas. Para as variáveis densidade e biomassa, não houve diferença significativa entre os métodos elétrico e formol (Tabela II).
A espécie peregrina Pontoscolex corethrurus (Müller 1857) foi principalmente amostrada pelo método manual (Tabela III). Esta espécie foi mais encontrada nas áreas de brejo e mata, onde o solo estava muito úmido (Tabela I). No brejo, a solução de formol expulsou maior número dessa espécie que o aparelho elétrico (Tabela III).
Considerando todos os métodos de coleta, foram identificadas nove espécies de minhocas, sendo quatro delas exóticas, Dichogaster affinis (Michaelsen 1890), D. saliens (Beddard 1892), D. bolaui (Michaelsen 1891) e A. gracilis, uma peregrina (P. corethrurus) e pelo menos quatro nativas (U. brasiliensis, Belladrilus sp., Fimoscolex sp. e Glossoscolex sp.). Coletaram–se, também, vários espécimes da família Ocnerodrilidae não identificáveis em nível de espécie. A maior diversidade de minhocas (oito espécies) foi obtida na mata e pelo método manual em todos os ecossistemas (Tabela III). Nos outros ecossistemas a diversidade de minhocas foi menor, tanto em número de espécies como usando o índice de Shannon (Tabela III). As minhocas exóticas do gênero Dichogaster foram as mais abundantes, e ocorreram principalmente na lavoura (Tabela III).
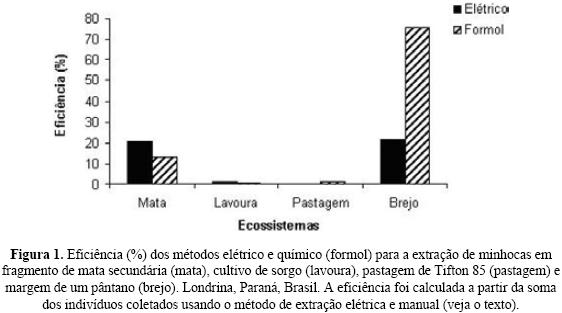
Eficiência dos métodos
Nas áreas agrícolas, onde predominaram as espécies do gênero Dichogaster e da família Ocnerodrilidae (Tabela III), os métodos comportamentais foram pouco eficientes (Fig. 1). O único lugar onde houve boa eficiência (>75%) de um dos métodos compor–tamentais foi com o formol no brejo. Na pastagem, nenhuma minhoca saiu à superfície do solo com a coleta elétrica. Na mata, a eficiência média dos métodos elétrico e formol foi de 20,7 e 13,1%, respectivamente (Fig. 1), mas de todos os indivíduos da espécie A. gracilis coletados na mata, 88% e 60% foram coletados pelo método elétrico e formol, respectivamente. A espécie U. brasiliensis também respondeu aos métodos comportamentais, sendo que 46 e 31% dos dados de densidade populacional desta espécie foram obtidos pelos métodos elétrico e formol, respectivamente (Tabela III).
Análise de componentes principais (ACP)
Evidenciou–se por meio da relação entre as componentes principais 1 (CP 1) e 2 (CP 2) que os métodos de coleta e os ecossistemas ficaram separados uns dos outros; especialmente o método manual dos métodos comportamentais (elétrico e formol) (Fig. 2). A variabilidade dos dados foi explicada em 35,2% pela CP1 e 14,5% pela CP2, totalizando 49,7% da variabilidade dos dados referentes às espécies de minhocas (variáveis de resposta). A terceira componente principal (CP 3) explicou menos do que 10% da variabilidade total e foi desconsiderada.
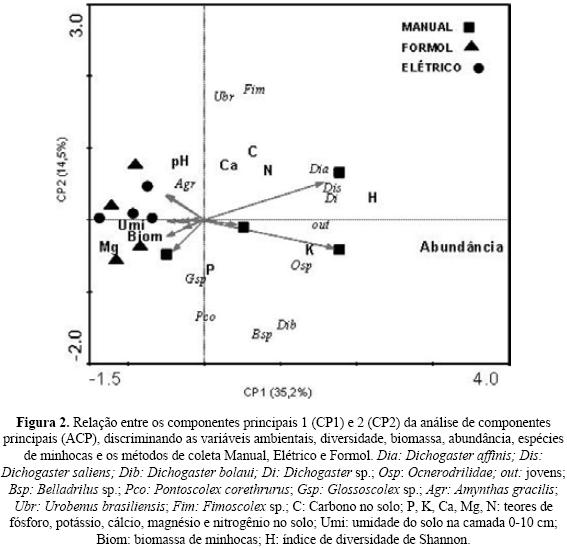
As espécies do gênero Dichogaster (Dia, Dis, Dib, Di), da família Ocnerodrilidae (Osp), os indivíduos jovens (out), o índice de diversidade de Shannon (H) e a abundância total de minhocas foram às variáveis que mais contribuíram (Fig. 2) na CP1 para separar o método manual dos métodos comportamentais (elétrico e formol), especialmente quando o método manual foi usado nas áreas de mata, pastagem e lavoura. Nesse sentido, quando se adotou o método manual, obteve–se uma maior abundância e diversidade de minhocas (H) do que nos demais métodos. Já na CP2, as variáveis biomassa fresca de minhocas (Biom), umidade (Umi), e a espécie A. gracilis (Agr) contribuíram mais para separar os métodos comportamentais do método manual. As espécies nativas U. brasiliensis e Fimoscolex sp. se associaram fortemente aos teores de carbono (C), nitrogênio (N) e Cálcio (Ca) no solo, especialmente na área de mata (Fig. 2).
DISCUSSÃO
Alguns fatores ambientais e comportamentais influenciaram a coleta de minhocas pelos diferentes métodos: a) a composição específica da comunidade de minhocas presente; b) a reação de indivíduos adultos vs. juvenis; c) o tipo de cobertura vegetal presente no local; d) as condições edáficas do local, especialmente o teor de umidade; e) o hábito/categoria ecológica das minhocas presentes no local. Ainda que alguns desses fatores estejam relacionados entre si (por ex., a cobertura vegetal influencia a composição específica da comunidade de minhocas), evidencia–se que os métodos de coleta devem ser escolhidos segundo as condições locais para que haja uma coleta adequada, tanto da diversidade quanto da abundância das minhocas.
As espécies A. gracilis e U. brasiliensis responderam bem ao método de extração com formol. Essas minhocas são bem maiores que as do gênero Dichogaster e da família Ocnerodrilidae, e habitam as camadas mais superficiais do solo, tendo, portanto, maior facilidade para sair quando estressadas. Baretta et al. (2007) também demonstraram que o método formol foi mais eficiente e adequado para coleta das espécies Amynthas corticis (Kinberg 1867) e U. brasiliensis, em relação à triagem manual do solo.
A espécie P. corethrurus foi principalmente amostrada pelo método manual, sendo pouco responsiva aos métodos comportamentais, especialmente o elétrico. No brejo, onde o solo estava mais úmido, esta espécie foi mais coletada pelo método do formol que pelo método elétrico, resultado esperado para uma espécie endogêica. A maior parte dos indivíduos coletados no brejo eram dessa espécie, sendo que apenas algumas A. gracilis foram coletadas usando os métodos comportamentais. Nunes et al. (2006) também verificou que a maioria (95%) das minhocas amostradas em área de várzea úmida, cultivada com pastagem antiga, pertencia a P. corethrurus.
No presente estudo foram encontradas apenas quatro espécies nativas; a maioria das espécies coletadas eram exóticas ou peregrinas, de ampla distribuição. Estas espécies são mais adaptadas às mudanças edáficas do que as minhocas nativas devido a diferenças na ecologia, no hábito de alimentação e nas características fisiológicas (Nahmani et al. 2003). Elas são beneficiadas pela adoção de sistemas agrícolas, podendo se tornar dominantes nestas áreas, como é o caso de minhocas do gênero Dichogaster (Fragoso et al. 1999, Brown et al. 2004). Brown et al. (2004, 2008) relataram indivíduos deste gênero em várias áreas de plantio direto no Paraná. Neste estudo, a área não tinha histórico de utilização do sistema de plantio direto, mas no dia da coleta a área continha restos vegetais da colheita anterior, o que indica que não foi utilizado implemento pesado (grade e/ou escarificador) meses antes da amostragem. Desta forma, os dados confirmam a capacidade destas espécies de se manterem mesmo em áreas degradadas pelo manejo intensivo, como os sistemas agrícolas convencionais.
As minhocas adultas responderam melhor aos métodos comportamentais (elétrico e formol), pois seus corpos são maiores e, de alguma forma, possuem força para saírem para a superfície do solo em resposta ao extrator, enquanto que minhocas juvenis, principalmente as pequenas, não conseguem sair e morrem (Dash & Patra 1972). Essas últimas predominaram nas áreas agrícolas, (principalmente as Dichogaster spp. e indivíduos da família Ocnerodrilidae), e não responderam aos métodos comportamentais, sendo mais bem coletadas usando o método manual. A menor eficiência da coleta com os métodos comportamentais poderia também estar relacionada à menor umidade (Tabela I) e maior compactação (não medida, mas verificada empiricamente ao cavar) do solo nessas áreas. Esses fatores afetam a condutividade elétrica e, conseqüentemente, a eficiência do aparelho elétrico. Portanto, quando há baixa umidade no solo, ou o mesmo se encontra compactado, não é recomendável o uso dos métodos comportamentais (elétrico, formol), devendo–se priorizar o método manual de coleta.
A eficiência do método elétrico foi baixa (< 25%) e a amostragen química foi eficiente somente no brejo. Sabe–se que a eficiência do método elétrico depende de vários fatores edafoclimáticos e das espécies presentes (Coja et al. 2008). Por exemplo, Vetter (1996) e Rushton & Luff (1984), trabalhando em solo de clima temperado, obtiveram eficiência média do método elétrico de aproximadamente 53% e 49%, respectivamente, para as espécies da família Lumbricidae encontradas nas suas áreas de estudo. Vetter (1996) também comparou a eficiência do método formol e demonstrou que este foi mais eficiente que o método elétrico, ao expulsar 70% do total de minhocas. Já Coja et al. (2008) obteve melhores resultados com o método elétrico do que com formol em diferentes concentrações; contudo, o aparelho elétrico expeliu menor número de adultos e maior número de juvenis. Nos estudos de Rushton & Luff (1984), o aparelho elétrico expulsou 80,5% da espécie Lumbricus castaneus (Savigny 1826), enquanto que para Aporrectodea longa longa (Ude 1895), a eficiência do aparelho elétrico foi de apenas 22,8%, assemelhando–se mais aos resultados obtidos no presente estudo. Finalmente, Thielemann (1986), autor do método do Octeto obteve 88,1% de eficiência média com o método elétrico.
O conhecimento sobre o hábito das espécies é fator determinante para explicar as respostas das minhocas aos métodos comportamentais. De acordo com a classificação em grupos ecológicos de Bouché (1971, 1977), as espécies epi–endogêicas habitam a camada superficial do solo e as anécicas os horizontes mais profundos, formando galerias verticais permanentes ou semi–permanentes no solo. Estas espécies são as que melhor respondem aos métodos comportamentais, pois ao serem estimuladas, saem para a superfície do solo por meio de galerias. Embora Fragoso & Lavelle (1992) mostraram que espécies epigêicas ou anécicas predominam em algumas comunidades de minhocas nas florestas úmidas tropicais, na região dos trópicos, a maior velocidade de decomposição da matéria orgânica pelos microorganismos tende a favorecer as espécies endogêicas (Lavelle 1983, Grisi et al. 1998). Estas espécies normalmente têm maior dificuldade em sair do solo e dificilmente são coletadas pelos métodos formol e elétrico, justificando a baixa eficiência destes métodos no Brasil em relação aos trabalhos na Europa, onde a ocorrência das espécies endogêicas é menor (Lavelle 1983). É importante ressaltar que no Brasil existem regiões onde a presença de certas espécies anécicas ou endoanécicas é conhecida, como alguns minhocuçus no Centro–Oeste e Norte do país (Brown & James 2007). Para essas situações e espécies a utilização de formol como solução extratora é recomendada (ISO/DIS 23611–1, 2004), pois são minhocas maiores que escapam facilmente na retirada dos monólitos (Römbke 2007).
Nas condições de solo, clima e vegetação do estudo, o aparelho elétrico pode ser uma alternativa a solução de formol, mas devem–se tomar os devidos cuidados em relação à umidade do solo e a diversidade de espécies presentes no local. As espécies A. gracilis e U. brasiliensis responderam aos métodos comportamentais enquanto que as espécies do gênero Dichogaster spp., da família Ocnerodrilidae e os indivíduos jovens foram melhor amostrados pelo método manual. De maneira geral, pode–se inferir que a combinação do método manual com um método comportamental é a metodologia ideal para uma adequada amostragem de minhocas, conforme recomendado pela ISO (2004). Caso a combinação dos métodos não seja possível, recomenda–se utilizar o método manual (escavação e triagem manual de monólitos).
AGRADECIMENTOS
Os autores agradecem o apoio financeiro da Embrapa e do CNPq (Bolsa de pesquisa e Profix ao George Brown, IC à Priscila T. M. Azevedo e doutorado ao Dilmar Baretta), a ajuda do taxonomista Samuel James nas identificações e dos técnicos da Embrapa Soja (Sérgio Henrique da Silva, Gustavo Garbelini e Antônio Pavão) e demais colegas (Antonio Alberto dos Santos, Bruce Motte, Vanesca Korasaki e Mateus Azevedo) no trabalho de campo. Finalmente, agradecemos a Hubert Hõfer e Jõrg Römbke pelo empréstimo do aparelho elétrico de Thielemann usado nesse trabalho.
LITERATURA CITADA
Anderson, J. M. & J. I. Ingram. 1993. Tropical soil biology andfertility, a handbook of methods. 2ed. CAB International, Wallingford. [ Links ]
Baker, G. H. 1985. Formalin–expulsion of earthworms (Lumbricidae) from Irish peat soils. Soil Biology and Biochemistry. 17: 113–114. [ Links ]
Baretta, D., G. G. Brown, S. W. James & E. J. B. N. Cardoso. 2007. Earthworm populations sampled using collection methods in atlantic forests with Araucaria angustifolia. Scentia Agricola. 64: 384–392. [ Links ]
Blakemore, R. J. 2002. Cosmopolitan earthworms – an eco–taxonomic guide to the peregrine species of the world. VermEcology, Kippax. CD–Rom. [ Links ]
Bouché, M. B. 1971. Relations entre les structures spatiales et fonctionelles des écossystemes, ilustrées par le role pédobiologique des vers de terre. Pp. 189–209. In: P. Pesson (Ed.). La vie dans les sols. Aspects noveaux, etudes expérimentales. Gauthier–Villars, Paris. [ Links ]
Bouché, M. B. 1977. Stratégies lombriciennes. In: T. Persson and U. Lohm. Soil organisms as components of ecosystems. Ecological Bulletins. 25: 122–132. [ Links ]
Bouché, M. B. & R. H. Gardner. 1984. Earthworms functions. VIII – Population estimation techniques. Revue d'Ecologie et de Biologie du Sol. 21: 37–63. [ Links ]
Brown, G. G., N. P. Benito, A. Pasini, K. D. Sautter, M. de F. Guimarães & E. Torres. 2003. No–tillage greatly increases earthworm populations in Paraná State, Brazil. Pedobiologia. 47: 764–771. [ Links ]
Brown, G. G., S. W. James, K. D. Sautter, A. Pasini, N. P. Benito, D. H. Nunes, V. Korasaki, E. F. Santos, C. Matsumura, P. T. Martins, A. Pavão, S. H. Silva, G. Garbelini & E. Torres. 2004. Avaliação das populações de minhocas como bioindicadores ambientais no Norte e Leste do Estado do Paraná. Pp. 33–46. In: O. F. Saraiva (Ed.). Resultados de pesquisa da Embrapa Soja 2003. Manejo de solos, plantas daninhas e agricultura de precisão. Embrapa Soja, Londrina, Série Documentos, N° 253. [ Links ]
Brown, G. G., S. W. James, K. D. Sautter, A. Pasini, N. P. Benito, D. H. Nunes, V. Korasaki, E. F. Santos, C. Matsumura, P. T. Martins, A. Pavão, S. H. Silva, G. Garbelini & E. Torres. Avaliação de populações de minhocas (Annelida: Oligochaeta) em sistemas agrícolas e naturais, e seu potencial como bioindicadores ambientais. Pp. 17–29. In: O. F. Saraiva (Ed.). Resultados de pesquisa da Embrapa Soja 2008. Manejo do solo. Embrapa Soja, Londrina, Série Documentos N° 296. [ Links ]
Brown, G. G. & S. James. 2007. Ecologia, biodiversidade e biogeografia das minhocas no Brasil. Pp. 291–375. In: G. G. Brown and C. Fragoso. (Eds.). Minhocas na América Latina: biodiversidade e ecologia. Embrapa Soja, Londrina. [ Links ]
Caballero, M. E. S. 1974. Bionomia dos Oligochaeta terrestres da região norte ocidental do Estado de São Paulo. PhD Thesis, Universidade Estadual Paulista Júlio de Mesquita Filho, São José do Rio Preto. [ Links ]
Coja, T., K. Zehetner, A. Bruckner, A. Watzinger & E. Meyer. 2008. Efficacy and side effects of five sampling methods for soil earthworms (Annelida, Lumbricidae). Ecotoxicology and Environmental Safety. 71:552–565. [ Links ]
Corrêa, A. R., H. Godoy & R. L. M. Bernardes. 1982. Características climáticas de Londrina. Circular Técnica IAPAR, No. 5, 2a ed. [ Links ]
Dash, M. C. & U. C. Patra. 1972. A comparision of extraction methods for Megascolecidae and Ocnerodrilidae from agricultural soils of Berhampur, Orissa. Current Science. 41: 254–255. [ Links ]
Edwards, C. A. & P. J. Bohlen. 1996. Biology and ecology of earthworms. Chapman & Hall, London. [ Links ]
Eichinger, E., A. Bruckner & M. Stemmer. 2007. Earthworm expulsion by formalin has severe and lasting side effects on soil biota and plants. Ecotoxicology and Environmental Safety. 67: 260–266. [ Links ]
Fragoso, C. & P. Lavelle. 1992. Earthworm communities of tropical rain forests. Soil Biology and Biochemistry. 21: 1397–1408. [ Links ]
Fragoso, C., J. Kanyonyo, A. Moreno, B. K. Senapati, E. Blanchart & C. Rodriguez. 1999. A survey of tropical earthworms: taxonomy, biogeography and environmental plasticity. Pp. 1–26. In: P. Lavelle, L. Brussaard and P. Hendrix (Eds.). Earthworm management in tropical agroecosystems. CABI, Wallingford. [ Links ]
Garceau, C. & D. Coderre. 1991. Efficacité d'une méthode d'extration éthologique des lombriciens d'une plantation recente de feuillus. Pedobiologia. 35: 27–34. [ Links ]
Grisi, B., C. Grace, P. C. Brookes, A. Benedetti & M.T Dell'abate. 1998. Temperature effects on organic matter and microbial biomass dynamics in temperate and tropical soils. Soil Biology and Biochemistry. 30: 1309–1315. [ Links ]
ISO/DIS 23611–1–International Organization for Standardization. 2004. Soil Quality – sampling of soil invertebrates. Part 1: hand–sorting and formalin extraction of earthworms. International Organization for Standardization, Geneva. [ Links ]
James, S. W. & G. G. Brown. 2006. Earthworm ecology and biodiversity in Brazil. Pp. 56–116. In: F. M. S. Moreira, J. O. Siqueira and L. Brussaard (Eds.). Soil biodiversity in Amazonian and other Brazilian ecosystems. CAB International, Wallingford. [ Links ]
Lavelle, P. 1983. The structure of earthworm communities. Pp. 449–466. In: J. E. Satchell (Ed.). Earthworm Ecology: from Darwin to Vermiculture. Chapman and Hall, London. [ Links ]
Lee, K. E. 1985. Earthworms: their ecology and relationships with soils and land use. Academcic Press, New York. [ Links ]
Nahmani, J., P. Lavelle, E. Lapied & F. Van Oort. 2003. Effects of heavy metal soil pollution on earthworm communities in the north of France. Pedobiologia. 47: 663–669. [ Links ]
Nelson, J. M. & J. E. Satchell. 1962. The extraction of Lumbicidae from soil with special reference to the hand–sorting method. Pp. 294–299. In: P. W. Murphy (Ed.). Progress in soil zoology. Butterworths, London. [ Links ]
Nunes, D. H., A. Pasini, N. P.Benito & G. G. Brown. 2006. Earthworm diversity in four land use systems in the region of Jaguapitã, Paraná State, Brazil. Caribbean Journal of Science. 42: 331–338. [ Links ]
Rabello, L. M. & G. G. Brown. 2005. Sistema eletrônico para extração de minhocas através de corrente elétrica. Embrapa Instrumentação Agropecuária, Circular Técnica No. 31, São Carlos. [ Links ]
Raw, F. 1959. Estimating earthworm populations by using formalin. Nature. 21:1661–1662. [ Links ]
Righi, G. 1990. Minhocas de Mato Grosso e de Rondônia. Programa Pólo Noroeste. Relatório de pesquisa No. 12. SCT/PR–CNPq. Programa do Trópico Úmido. CNPq/AED, Brasília. [ Links ]
Römbke, J. 2007. Searching for a standardization of quantitative terrestrial oligochaete sampling methods: The ISO methodology. Pp. 497–505. In: G. G. Brown and C. Fragoso (Eds.). Minhocas na América Latina: biodiversidade e ecologia. Embrapa Soja, Londrina. [ Links ]
Römbke, J., J. P. Sousa, T. Schoueten & F. Riepert. 2006. Monitoring of soil organisms: a set of standardized field methods proposed by ISO. European Journal of Soil Biology. 42(1): S61–S64. [ Links ]
Rushton, S. P. & M. L. Luff. 1984. A new electrical method for sampling earthworm populations. Pedobiologia. 26: 15–19. [ Links ]
Satchell, J. E. 1955. An electrical method of sampling earthworm populations. Pp. 356–364. In: D. K. Kevan (Ed.). Soil Zoology. Butterworth, London. [ Links ]
Schimdt, O., J. P. Curry, R. A. Hackett, G. Purvis & R. O. Clements. 2001. Earthworm communities in conventional wheat–clover monocropping and low–input wheat–clover intercropping systems. Annals of Applied Biology. 138: 377–388. [ Links ]
ter Braak, C. J. F. & P. Smilauer 1998. CANOCO reference manual and user's guide to Canoco for Windows: software for canonical community ordination (version 4). Microcomputer Power, New York. [ Links ]
Thielemann, U. 1986. Elektrischer regenwurmfang mit der oktett–methode. Pedobiologia. 29: 296-302. [ Links ]
Vetter, F. 1996. Methoden zur Regenwurm–Extraktion: Vergleich der Formalin–, Senf– und Elektro–methode. Bundesamt für Umwelt, Wald and Landschaft (BUWAL), Bern. Umweltmaterialien n. 62. 45 pp. [ Links ]
Zaborski, E. R. 2003. Allyl isothocyanate: an alternative chemical expellant for sampling earthworms. Applied Soil Ecology. 22: 87–95. [ Links ]














