Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.26 no.2 Xalapa ago. 2010
Artículos originales
Distribución altitudinal de hormigas (Hymenoptera, Formicidae) en la vertiente noroccidental de la Sierra Nevada de Santa Marta (Colombia)
Altitudinal distribution of ants (Hymenoptera, Formicidae) in the northwest slope of the Sierra Nevada de Santa Marta (Colombia)
Roberto J. GUERRERO1 & Carlos E. SARMIENTO 2
1 Grupo de Investigación en Insectos Neotropicales. Instituto de Investigaciones Tropicales. Universidad del Magdalena. Carrera 32 N° 22–08. San Pedro Alejandrino. Santa Marta, COLOMBIA Dirección actual: Programa de Doctorado en Zoología. Instituto de Zoología Tropical. Universidad Central de Venezuela. Caracas, VENEZUELA. E–mail: robertojoseguerreroflorez@yahoo.es
2 Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá D.C., COLOMBIA. E–mail: cesarmientom@unal.edu.co
Recibido: 17/08/2009
Aceptado: 15/04/2010
RESUMEN
Se determinó la composición y distribución de las hormigas en un gradiente altitudinal dentro de la vertiente noroccidental de la Sierra Nevada de Santa Marta. Se recolectaron 40 géneros y 136 especies de hormigas; Myrmicinae fue la subfamilia con mayor número de géneros y especies para cada altitud. La riqueza total y la de hormigas epigeas disminuyeron significativamente con el incremento de la altitud, mientras que la riqueza de las hormigas que habitan en la hojarasca se concentró en las altitudes intermedias. Sólo la diversidad del ensamble de hormigas epigeas y tanto la diversidad como la equidad de las especies de la hojarasca, tendió a disminuir significativamente al incrementar la altitud. A pesar del alto recambio de especies a lo largo del gradiente, el predominio de taxones con baja abundancia en todas las altitudes, sugiere elementos ecológicos similares en el gradiente, especialmente en las tres últimas altitudes. Por otra parte, los valores de recambio de especies, similitud basada en la abundancia y la incidencia de las especies, muestran que la fauna de hormigas a lo largo del gradiente está dividida en dos grupos, el primer grupo entre 835 y 968 SNMS, el segundo entre 1198 y1395 SNMS. La composición y la distribución de la fauna de hormigas que habitan a lo largo de la cuenca media de la vertiente Noroccidental de la SNMS, pueden ser explicadas a través de la regla de Rapoport y lo planteado en el efecto de altitudes intermedias.
Palabras clave: Hormigas, gradiente altitudinal, riqueza de especies, recambio de especies, Colombia.
ABSTRACT
The composition and altitudinal distribution of ants along the northwestern slope of the Sierra Nevada de Santa Marta is described. A total of 40 genera and 136 species were collected; Myrmicinae was the richest subfamily at the generic and specific levels at all altitudes. Total ant richness and epigaeic ant richness decreases with altitude while the richness of litter ants was higher at intermediate altitudes. Despite the high level of species turnover along the altitude gradient, the dominance of taxa with low abundance at all altitudes suggests similar ecological elements along the gradient but especially in the three higher altitudes. On the other hand, species turnover, abundance–based similarity, and incidence–based similarity suggest that ant fauna is divided into two major groups along the gradient, the first one is between 835 and 968 masl, and the second group is found between 1198 and 1395 masl. Ant fauna composition and distribution along the northwestern slope could be explained by Rapoport's rule and the mid–domain effect.
Key Words: Ants, elevational gradient, species richness, species turnover, Colombia.
INTRODUCCIÓN
La alta diversidad y ubicuidad de las hormigas está unida a procesos ecológicos claves como la herbivoría, depredación, carroñería, relaciones mutualistas con otros organismos y la recirculación de los nutrientes en el suelo (Hölldobler & Wilson 1990, Chacón et al. 1996, Schultz & McGlynn 2000, Ramírez et al. 2001). A su vez, tanto la riqueza y abundancia de las hormigas como los procesos ecológicos mencionados se ven influenciados por la humedad, la disponibilidad de energía, el estado de la vegetación, la temperatura, la precipitación y la perturbación humana entre otros factores ambientales (Levings 1983, Estrada & Fernández 1999, Kaspari & Weiser 2000, Kaspari et al. 2003, 2000, Floren & Linsenmair 2001, Gibb & Hochuli 2002). Es así como los patrones de composición y riqueza de especies tanto de hormigas como de otros taxones pueden explicarse en términos de gradientes ambientales (MacCoy 1990).
El gradiente altitudinal limita la distribución espacial y temporal de muchos organismos ya que incluye variaciones climáticas que implican cambios en la productividad, competencia y depredación dentro de un sistema (Rahbek 1995, Lieberman et al. 1996, Lomolino 2001). A lo largo de un gradiente altitudinal pueden presentarse al menos dos patrones generales: el decrecimiento en la riqueza al aumentar la altitud, o la concentración de especies en altitudes intermedias. El primer patrón plantea que el clima varía fuertemente en altitudes elevadas y algunas especies pueden tolerar tales variaciones y así alcanzar un rango altitudinal mayor, mientras que las altitudes bajas concentran mayor cantidad de especies, debido sobre todo, a la estabilidad de las condiciones climáticas. Este patrón denominado regla de Rapoport, ha sido reportado para diferentes taxones (Folgarait et al. 2005, Almeida–Neto et al. 2006, Brehm et al. 2007). El segundo patrón se soporta en la idea que en altitudes intermedias se concentra la mayor cantidad de especies debido a las condiciones ecológicas presentes en estas alturas (Rahbek 1995) y al efecto del área; esta segunda hipótesis es mejor explicada por el planteamiento de Colwell & Lees (2000) los cuales sugieren que la máxima concentración de especies en altitudes medias puede estar dada por condiciones favorables tanto para especies de altas como de bajas altitudes, en este caso el efecto de ecotono es más importante que el área, presentándose un incremento en la riqueza de especies por simple solapamiento entre dos ensambles que podrían estar limitados por fronteras geográficas (Colwell & Hurtt 1994, Lomolino 2001).
Aunque estos dos patrones rigen fuertemente la variación de la riqueza de especies en los gradientes altitudinales en diferentes latitudes, la riqueza de especies en altitudes bajas o medias puede diferir entre taxones así como también dentro de los taxones entre regiones y dentro de la misma región, en al menos en una escala regional. En este sentido, es importante discriminar entre los patrones que reflejan una diversificación reciente y aquellos que reflejan acumulación de especies a largo plazo (Fjeldsá 1994). Para insectos hay evidencia tanto para el patrón de alta riqueza en las altitudes bajas (Fernandes & Price 1988, McCoy 1990, Stevens 1992, Olson 1994, Sparrow et al. 1994), como para el patrón de alta riqueza en altitudes intermedias (McCoy 1990, Olson 1994, Escobar et al. 2005).
A pesar de la alta riqueza de especies de hormigas en Colombia, hay poca información local sobre factores tales como la altitud que pueden limitar la distribución de estos insectos; a nivel de los Andes colombianos, sólo se conocen los resultados proporcionados por Fagua (1999) para la cordillera Oriental. Aunque la Sierra Nevada de Santa Marta presenta ciertas cualidades como la existencia de un espeso y complejo mosaico ecológico debido a sus características geográficas, climáticas y geomorfológicas (Fundación Pro–Sierra 2000) que han conllevado a cualidades únicas como la alta riqueza de especies y los posibles altos niveles de endemismos (Rangel et al. 1997), en la actualidad no se cuenta con un inventario estructurado que permita dar una visión real de la diversidad de su fauna de hormigas y de aquellos procesos ecológicos que puedan estar moldeando su distribución a lo largo del paisaje. Debido a esto, se estudió la composición y distribución de las hormigas a lo largo de un gradiente altitudinal situado entre los 835 y 1395 m, dentro de un sector de este complejo montañoso.
MATERIALES Y MÉTODOS
Área de estudio
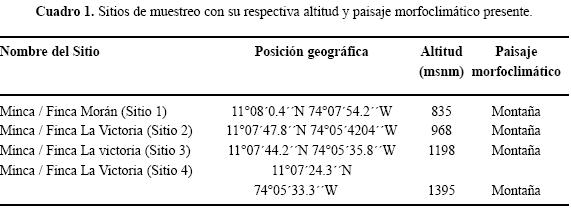
El área de estudio corresponde a la zona media de la cuenca del río Gaira dentro de la vertiente noroccidental del Macizo Sierra Nevada de Santa Marta. La cuenca comprende 10464.3 Ha y su posición geográfica está comprendida entre los 11° 52' –11° 10' Norte y 74° 46' –74° 01 Este, con altitudes desde los 0 hasta los 2750 m. Dentro de la cuenca se escogieron cuatro sitios entre los 835 y los 1395 m de altitud (Fig. 1). En cada estrato se escogió un punto representativo atendiendo a las características fisiográficas presentes (Cuadro 1); aunque esta franja altitudinal está ubicada en la zona más poblada en cuanto a desarrollo rural se refiere (cuenca media), todos las estaciones de muestreos fueron situadas en zonas densamente boscosas con alto grado de conservación (e.g., Sitio 2 ubicado en bosque primario, clasificado como bosque húmedo subtropical sensu Tamaris–Turizo & López (2006); Fig. 1).
Muestreo de especímenes
El muestreo se realizó en julio de 2004. Para la captura de las hormigas se utilizaron trampas de caída y recolección de hojarasca. Estas dos técnicas son efectivas en la recolección de muchas especies de hormigas de una gran variedad de hábitats y generan datos de riqueza y abundancia útiles en análisis estadísticos rigurosos (Olson 1991, Agosti & Alonso 2000). Para cada altitud se aplicó una modificación a la propuesta de Fisher (2002) empleando 50 trampas de caída y 10 muestras de hojarasca en transectos lineales de 250 m de longitud, dispuestos paralelamente y separados por 5 m de distancia. Las trampas de caída fueron vasos de polipropileno de 77 mm de diámetro interno y 81 mm de largo, a los que se les adicionó una solución de detergente y alcohol etílico al 70% en proporción 2:1. Las trampas se recogieron después de 48 horas. La hojarasca se recolectó de cuadrantes de 1 m2 distribuidos cada 25 m a lo largo del transecto. El material se tamizó utilizando un cernidor con ojo de malla c.a 10 mm. Antes de cernir la hojarasca, ésta fue picada con un machete para perturbar los nidos y poder capturar las hormigas que anidaban en ramas y troncos podridos. Se tomaron 2 L de hojarasca fina, posteriormente llevadas a los sacos "mini–Winkler" (Fisher 1996) para extraer las hormigas por 72 horas.
Todo el material coleccionado en trampas de caída y hojarasca se preservó en etanol al 75% para luego ser limpiado, rotulado e identificado. El material de referencia se encuentra depositado en la Colección de Insectos de la Universidad del Magdalena (Santa Marta, Colombia).
Análisis de datos
Se elaboraron matrices de Presencia–Ausencia (P/A) de especies para cada altitud y método de muestreo (Fagua 1999). Con estas matrices se elaboraron curvas acumuladas y curvas de estimación de riqueza de especies. Las curvas de estimación se construyeron usando la media de los estimadores Jacknife–1 y Chao–2 con un orden de 100 aleatorizaciones en las muestras. Todas las curvas se construyeron utilizando el programa EstimateS 8 (Colwell 2006). También se construyeron matrices de abundancia por cada sitio; estas matrices se alimentaron teniendo en cuenta la frecuencia de captura de una especie como estimación de la abundancia de dicha entidad en cada altitud. Para la estimación de la abundancia de especies de hormigas se debe tener en cuenta que las hormigas presentan comportamiento eusocial y esto introduce sesgos al estimar la abundancia relativa como número de organismos colectados, ya que una colonia puede estar cerca de una trampa y ser colectada parcial o totalmente. En este sentido, la frecuencia de captura estima de mejor manera la abundancia de la especie en el sitio, y definiéndose como la presencia de una especie n–veces dentro del transecto (Romero & Jaffé 1989) de 250 m para este estudio; esta medida de la abundancia carece de unidades (e.g. individuos), debido a la forma intrínseca de estimación. Basados en esta medida de la abundancia relativa, se establecieron a priori categorías de abundancia como sigue: especies con frecuencias de captura mayor a cero y menor a 0.4, corresponden a especies poco frecuentes o de abundancia baja; mientras que la categoría de especies frecuentes o de alta abundancia corresponden a valores mayores a 0.5 hasta uno. Sólo las obreras fueron utilizadas en el análisis de los datos ya que la presencia de reinas o alados reproductores en una muestra no significa necesariamente que una colonia está establecida dentro del transecto (Fisher 1996).
La diversidad alfa se caracterizó para cada estrato altitudinal, mediante la riqueza de especies, el índice de diversidad de Shannon–Weanner y el índice de equidad de Shannon como medida de la equidad de la abundancia de las especies (Magurran 2004). Se usó el coeficiente de correlación de Spearman para establecer asociaciones entre los índices de diversidad alfa y la altitud, trabajando con un intervalo de confianza de 0.05. Estos análisis se hicieron con el programa STATISTICA 6.0 (StatSoft 2004).
Siguiendo a Fisher (1996), el recambio de especies entre elevaciones (diversidad beta) se estimó utilizando el índice desarrollado por Whittaker (Magurran 2004), bw = (S/a) – 1, donde S corresponde al número de especies registradas para ambas altitudes y a corresponde al número promedio de especies dentro de una altitud; para el desarrollo de este índice se utilizaron las matrices de presencia/ausencia combinada (i.e., las matrices P/A de trampas de caída más la de hojarasca, consolidadas en una sola para contabilizar el total de las entidades recolectadas en cada sitio). Este índice de recambio de especies fue implementado porque permite elucidar posibles límites naturales (agrupamientos faunísticos) dentro de un gradiente (Magurran 2004). La similitud se midió aplicando el índice simplificado de Morisita–Horn, el cual incluye datos de abundancia (Magurran 2004); para este caso se calculó el índice para cada método de muestreo. Adicionalmente se obtuvo un dendrograma de similitud aplicando el índice de Jaccard a las matrices de presencia/ausencia combinada, y el método de ligamiento completo, utilizando el programa STATISTICA 6.0 (StatSoft 2004).
RESULTADOS
Se recolectaron 4.037 individuos agrupados en siete subfamilias, 40 géneros y 136 especies de hormigas (Apéndice 1). La menor altitud (835 m) registró la mayor riqueza, 88 especies, mientras que el sitio más alto (1395 m) fue el menos rico, 40 especies (Fig. 2). En general, las trampas de caída y hojarasca capturaron 104 y 82 especies respectivamente. Tanto para la riqueza en las trampas de caída como para la riqueza total la disminución con la altitud fue estadísticamente significativa (rs = –1.000, P= 0.00001), mientras que la riqueza de especies en la hojarasca no mostró una tendencia estadísticamente significativa (rs = –0.752, P= 0.2). Por otro lado, el sito más bajo registró el mayor número de especies únicas dentro del gradiente con una proporción de hasta aproximadamente 6 veces mayor que el resto de estratos, c.a 33% con respecto al total de especies recolectadas (Fig. 2).
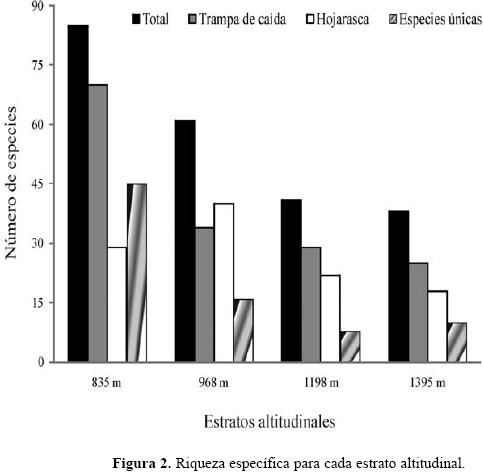
La abundancia medida como frecuencia de captura para cada especie, se presenta en el apéndice 1. Para el ensamble de hormigas recolectados con las trampas de caída, el promedio de la abundancia por estrato fue mayor en el sitio más alto (0.095 ± 0.093; n= 25), seguido por el primer estrato altitudinal con una abundancia relativa promedio de 0.084 ± 0.104 (n= 70); los estratos intermedios del gradiente, 968 m y 1198 m, registraron abundancias promedios de 0.068 ± 0.088 (n= 40) y 0.079 ± 0.097 (n= 22), respectivamente. Para el ensamble de hormigas que habita en la hojarasca se registraron máximos de abundancia promedio en el primer estrato altitudinal (0.352 individuos ± 0.145; n= 29), mientras que el menor valor promedio de abundancia fue registrado en el estrato más alto (0.194 ± 0.173; n= 18); las abundancias promedios en los estratos intermedios fueron similares, 0.255 ± 0.231 (n= 40) para 968 m, y 0.223 ± 0.207 (n= 22) para la altitud 1198 m. De todas las especies colectadas, únicamente seis especies (c.a 5%) fueron encontradas en todas elevaciones, pero sus frecuencias relativas de captura no mostraron diferencias considerables entre sitios cercanos (Apéndice 1).
Para la altitud 835 m, los estimadores Chao–2 y Jack–1 estiman 78 y 87 especies respectivamente, lo que indica una eficiencia en el muestreo con trampas de caída de 91 y 87%, según cada estimador (Fig. 3). El estrato altitudinal con menor número de especies capturadas con este método, fue 968 m con 79% para Chao–2 y 75% para Jack–1 (Fig. 3). En cuanto a las estimaciones de riqueza para la fauna de hormigas que vive en la hojarasca, la riqueza observada en el estrato 835 m es cercana a la estimada, Sobs= 30, Chao–2 ≈30 y Jack–1≈32 especies (Fig. 4), alcanzando eficiencias de muestreo cercanas a 100 y 94% respectivamente. Por el contrario, para la altitud 1395 m los estimadores muestran valores elevados por lo que se considera muy bajo el muestreo de la fauna de hormigas que vive en la hojarasca para este lugar, 28.7 y 60.1% respectivamente (Fig. 4).
El índice de Shannon–Wienner generado a partir de las trampas de caída fue mayor en la altitud 835 m (3.77 nats), mientras que el menor valor (2.85 nats) se registró en la altitud 1395 m, esta disminución de la diversidad en el gradiente fue significativa (rs= –0.8339, P= 0.0427; Fig. 5). La equidad fluctuó entre 0.89 (835 y 1395 SNMS) y 0.87 (968 y 1198 SNMS), sin mostrar un patrón definido entre los sitios (rs= 0.4, P= 0.6; Fig. 5). Para las hormigas de la hojarasca, los índices de diversidad presentan resultados parecidos a los de las trampas de caída. Para el primer estrato altitudinal Shannon–Wienner fue de 3.47 nats mientras que para la última altitud fue de 2.63 nats (Fig. 5) presentándose una correlación opuesta y significativa a lo largo del gradiente altitudinal (rs= –0.9794, P= 0.0206); así mismo la equidad se correlacionó significativamente con la altitud (rs= –0.9561, P= 0.0439; Fig. 5).
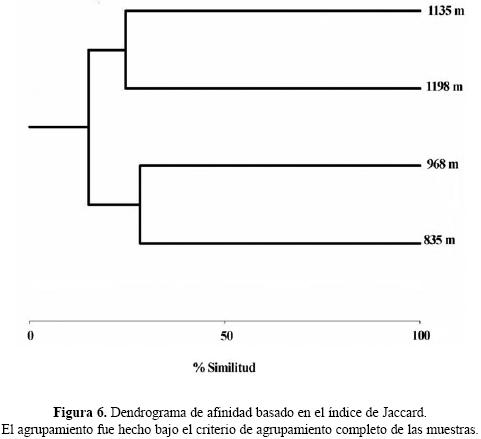
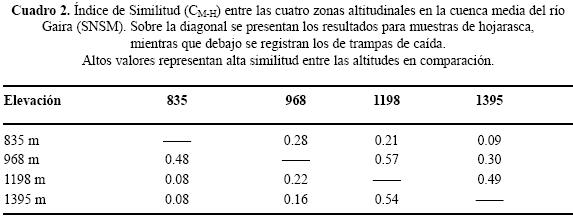
El mayor recambio de especies entre altitudes cercanas se presentó entre 968 y 1198 SNMS (βw = 0.615) con 20 especies compartidas, mientras que el par de elevaciones cercanas con menor recambio fue entre 835 y 968 m (βw = 0.517), con 36 especies compartidas; el mayor valor recambio de especies entre las cuatro elevaciones se dió entre 835 y 1395 m (βw = 0.672). La similitud (CM–H) más elevada para altitudes cercanas, estimada con los datos de abundancia de las trampas de caída, se presentó entre las altitudes 1198 y 1395 m (0.54); por el contrario, el valor más bajo fue entre 968 y 1198 m (Cuadro 2). El patrón en la similitud basada en la abundancia de las hormigas de la hojarasca, discrepa del anterior, ya que la mayor similitud entre altitudes cercanas se presenta entre los estratos 968 y 1198 m (0.57), y el menor valor de similitud es para 835 y 1395m (Cuadro 2), no obstante las altitudes 1198 y 1395 m también registran un alto valor de similitud (0.49). Esta similitud entre pares de altitudes cercanas se ve apoyada, sobre todo con las abundancias estimadas a partir de las trampa de caída, en la formación de dos grupos, las altitudes 835 – 968 m y 1198 – 1395 m (Fig. 6).
DISCUSIÓN
Variación taxonómica y numérica a lo largo del gradiente
El gradiente altitudinal mostró una fauna considerable de hormigas en cuanto a subfamilias, géneros y especies. El 50% de las subfamilias neotropicales fueron capturadas, destacándose Myrmicinae como la subfamilia con mayor número de géneros y especies para cada altitud. Esta alta riqueza en Myrmicinae concuerda con lo registrado en otros estudios (Fisher 1996, 1999a, Fagua 1999, Kaspari & Weiser 2000, Ward 2000, Robertson 2002). Otras subfamilias ricas en este estudio son Ponerinae y Formicinae debido a la alta riqueza de Hypoponera, Pachycondyla y Camponotus. La cuenca media del río Gaira posee un 35% de los 120 géneros y 5% de las especies registradas para la fauna de hormigas neotropicales (Fernández & Sendoya 2004).
Sólo seis de las 136 especies (Cyphomyrmex salvini, Labidus coecus, L. praedator, Pheidole sp3, Solenopsis sp2, Wasmannia auropunctata) fueron capturadas en las cuatro altitudes. Este amplio rango altitudinal está acompañado por lo general de su alta a moderada frecuencia de captura haciéndolas taxones dominantes, sin embargo la dominancia de estos taxones a lo largo del gradiente, puede estar mediada por el hábitat que ocupen (la hojarasca) o el estrato de forrajeo (hormigas epigeas). Otros factores que se suman al anterior, son comportamientos específicos tales como nomadismo para las especies del género Labidus (Palacio 1999) cuyas colonias abarcan una gran área de forrajeo; agresividad y oportunismo para especies del grupo Solenopsis y Wasmmania auropunctata (Roger), que además pueden tener más de una reina (poliginia) propiciando establecimiento exitoso de las colonias en muchos sitios (Hölldobler & Wilson 1990); así como, el comportamiento generalista presente en Pheidole sp3, que además de tener amplio rango de distribución a lo largo del gradiente fue capturada por ambos métodos lo cual indica su presencia dentro de cualquier estrato de forrajeo, tanto epigeo como en la hojarasca.
Es posible que Acropyga sp2, Atta columbica, Atta sp2, Pheidole sp1, Pheidole sp13, Solenopsis sp3, Solenopsis sp5 y Solenopsis sp6, se encuentren en todo el gradiente ya que se capturaron en la primera y última altitud; no obstante pueden estar interactuando factores tanto abióticos como bióticos que limitan el asentamiento de sus colonias en cada sitio o simplemente el muestreo no fue suficientemente fuerte para colectarlas.
El mayor número de especies únicas se obtuvo en el estrato 835 m (45 especies). La especie Pogonomyrmex mayri incrementó su rango altitudinal ya que sólo estaba registrada en altitudes menores a 400 m (Kugler & Hincapié 1983). Thaumatomyrmex atrox extendió su rango hacia elevaciones menores de 1400 m ya que para Colombia sólo se había recolectado por encima de los 1500 m (Jiménez com. pers., IAvH). Las dos altitudes restantes también presentaron especies únicas pero en menor proporción (< 10%).
Del total de 104 especies que forrajean sobre el suelo (especies recolectadas con trampas de caída) ninguna se mantuvo con altos valores de abundancia en los cuatro estratos altitudinales; no obstante, Solenopsis sp7 presenta un comportamiento de especie dominante en las tres primeras altitudes ya que su abundancia relativa se mantiene casi constante en valores altos fluctuando entre 0.6 a 0.8. Para el caso de las entidades con abundancia relativa baja, tres entidades se mantienen con dicha característica, Cyphomyrmex costatus, Labidus coecus y L. praedator. Aunque las especies del género Labidus presentan abundancias relativas bajas en los estratos 835, 968 y 1395 m, el comportamiento es diferente en la altitud 1198 m ya que ambos taxones registran abundancias moderadas a altas (0.6 y 0.8 respectivamente), tendencia que también ha sido reportadas para bosques tropicales de altitudes más bajas (Quiroz–Robledo et al. 2002). Para el caso de las especies que integran al ensamble que habita en la hojarasca, solamente tres taxones (Pheidole sp3, Solenopsis sp2, Wasmannia auropunctata) fueron registrados en las cuatro altitudes; a pesar de su presencia a lo largo del gradiente, las abundancias de estos taxones fue fluctuante y sólo para el primer estrato, Solenopsis sp2 y W. auropunctata, registran abundancias relativa muy altas.
Estimación de la riqueza
En general, la mayor tasa de acumulación de especies a lo largo del gradiente se presentó para las trampas de caída, esto difiere de otros trabajos donde el método más eficiente en término de capturas de especies, es el muestreo de hojarasca (Olson 1991, Fisher 1996, 1999 a b, Ward 2000, Fisher 2002, Fisher & Robertson 2002, Robertson 2002). Sin embargo, en la hojarasca se capturaron posibles nuevas especies y especies únicas en una sola altitud (Megalomyrmex sp1, Pheidole sp9, Camponotus sp4) ratificando lo propuesto por varios autores sobre la alta posibilidad de capturar entidades nuevas y raras al analizar la hojarasca de un sitio (Olson 1991, Ward 2000, Fisher 2002).
Al evaluar la eficiencia de los métodos de inventario utilizados se observa que todas las curvas (Figs. 4 y 5) tienden a crecer sin alcanzar una asíntota. Para grupos hiperdiversos con gran número de especies raras como las hormigas, este tipo de curvas no logran aplanarse completamente y lo esperado es un decrecimiento lento con un mayor muestreo (Colwell & Coddington 1994, Fisher 2002). En este estudio entre 70 y 86% de las especies estimadas por Chao–2 y Jack–1 fueron capturadas. Fisher (1996, 1999b) utilizó también Jack–1 alcanzando en promedio 84% de las especies estimadas. Colwell & Coddington (1994) concluyen que estos dos estimadores son muy sensibles al tamaño de muestreo y por lo tanto recomiendan al igual que Fisher (1999b), usar el estimador Chao–2 para muestras pequeñas. Con base en Chao–2, la primera altitud fue la que más se aproximó al número estimado de especies; contrario a esto, las muestras de hojarasca en 1395 m registraron menos del 30% estimado, indicando la necesidad de aumentar el esfuerzo de muestreo para añadir más especies al total acumulado.
Diversidad alfa y beta a lo largo del gradiente
La riqueza de hormigas a lo largo del gradiente disminuyó a medida que incrementó la altitud, a excepción de las hormigas que habitan en la hojarasca. Este comportamiento de decrecimiento monótono con la altitud también es registrado para hormigas en otras latitudes y gradientes parecidos (Olson 1994, Fisher 1996, 1999a, Fagua 1999, Robertson 2002); sin embargo Sanders et al. (2003) reportan una relación positiva con el incremento de la altitud (900 a 2500 SNMS) para ecosistemas áridos de latitudes templadas (Spring Mountains, Nevada, E.E.U.U), lo que difiere de los patrones generales reportados. Esta discrepancia indica posiblemente, que el gradiente altitudinal no actúa por sí solo en la distribución de las especies sino que el efecto de la latitud también influye sobre estos patrones (Rahbek 1995, Ward 2000).
Como se mencionó anteriormente, la tendencia de las hormigas que habitan en la hojarasca no se ajusta al patrón generalizado de disminución de la riqueza de especies con la altitud. En este ensamble de hormigas se observa un incremento de especies desde el primer estrato altitudinal hacia el estrato altitudinal siguiente, en donde se registra la mayor concentración de especies, posteriormente la riqueza tiende a disminuir gradualmente en las últimas dos alturas. Esta máxima riqueza de especies cerca al centro del gradiente altitudinal estudiado, puede ser explicado a través del efecto de "dominio medio" (Colwell & Lees 2000, Colwell et al. 2004), el cual postula que las altitudes intermedias de un gradiente, tal como el estrato 968 m, puede presentar condiciones favorables tanto para especies de altitudes bajas como altas; en este caso, las especies de hormigas de la altitud 968 m estarían influenciadas por un efecto de ecotono, es decir por la confluencia de condiciones ecológicas favorables tanto para especies de altas altitudes como de altitudes bajas, resultando en un traslape de dos ensambles que podrían estar limitados por fronteras históricas propias del sitio (Colwell & Hurtt 1994, Lomolino 2001).
En cuanto a la abundancia relativa de las especies, este atributo medido como la frecuencia de captura de cada especie y estimada en primera instancia, para las hormigas recolectadas con las trampas de caída, no presentó un patrón claro con relación al gradiente altitudinal, es decir, la abundancia relativa de las especies fluctuó irregularmente independiente del incremento de la altura. La frecuencia de captura promedio fue mayor en los extremos del gradiente mientras que para las alturas intermedias se registró un descenso desde el estrato dos (968 m) al estrato tres (1198 m). Esta carencia de tendencia es contraria al reportado para hormigas altoandinas en Colombia (Fagua 1999) y al reportado para otros bosques tropicales de latitudes diferentes (Fisher 1996, 1999a), donde la abundancia general de las especies decrece a medida que la altitud aumenta. A pesar que el promedio de las abundancias de las especies reveló una tendencia contrastante con la reportada en la literatura para otros bosques tropicales, para cada estrato altitudinal se registró un mayor número de especies de hormigas con frecuencias de captura igual o inferior a 0.4, el cual fue decreciendo progresivamente a lo largo del gradiente altitudinal; así mismo, el número de las especies de hormigas con frecuencias de captura moderada a alta, declinó con el incremento de la altitud. Estos resultados muestran que en el ensamble de hormigas que forrajean sobre el suelo, hay predominio de las especies poco abundantes (c.a. 70% del total de las especies en cada estrato), reflejando la posible repartición equitativa de los recursos en cada estrato, a pesar del recambio de especies que existe entre los estratos altitudinales.
Para las hormigas que habitan en la hojarasca, el promedio de las abundancias presentó una tendencia negativa lo largo del gradiente altitudinal, lo cual concuerda con Fisher (1999a) cuyos datos muestran que hay mayor concentración de individuos en altitudes cercanas a 800 m, decreciendo hacia los 1300 m; de manera complementaria, este mismo autor plantea que desde los 1300 SNMS, se presentan incrementos en la frecuencia de captura de algunos pocos taxones que pueden llegar a dominar numéricamente dentro de la estructura de la comunidad de un sitio, esto concuerda con los resultados aquí mostrados ya que para la altitud 1395 m sólo se registraron dos especies con abundancia relativa moderadamente alta (c.a., 11% del total de las especies para este estrato altitudinal), lo cual tuvo un efecto negativo sobre la equidad del ensamble de este estrato con respecto a las otras altitudes.
Aunque el promedio de las abundancias de las hormigas de la hojarasca, disminuyó a lo largo del gradiente, el número de especies con frecuencias de captura tanto baja como alta, siguió el mismo patrón que tuvo la riqueza de especies de este ensamble de hormigas, es decir hubo concentración de la mayoría de las especies con baja frecuencia de captura en el estrato 968 m, y menor número de especies en los estratos altitudinales restantes. De manera general, tanto para las hormigas que forrajean en el suelo como las que habitan en la hojarasca, la variación en la abundancia relativa (= frecuencia de captura) de las especies con baja y alta abundancia dentro del gradiente altitudinal estudiado, puede estar relacionado con la disponibilidad de nutrientes (Olson 1994) y/o fluctuaciones de las condiciones ambientales (Frith & Frith 1990) dentro y entre estratos altitudinales.
Al igual que para la riqueza general y de las hormigas epigeas, la diversidad y la equidad reporta un decrecimiento a medida que aumenta el gradiente (excepto la equidad de las hormigas que forrajean sobre el suelo). Este comportamiento negativo es similar al encontrado por Fagua (1999) para hormigas andinas en Colombia. Esta variación en la diversidad y la equidad a lo largo del gradiente puede deberse a la presencia de ciertas especies abundantes desde el estrato 968 m hasta 1395 m, las cuales pueden influir notablemente en la repartición y aprovechamiento de los recursos. Las altitudes 968 y 1198 m son dominadas numéricamente por especies del género Solenopsis, Wasmannia auropunctata, entre otras, mientras que en la altitud 1395 m predomina Octostruma balzani, Pheidole sp1, y tres especies del género Solenopsis. A pesar que la equidad del ensamble de hormigas de la hojarasca disminuyó a lo largo del gradiente, este atributo estimado para las hormigas que forrajean sobre el suelo no siguió esta tendencia; para este ensamble, la variación entre la tres últimas altitudes es pequeña, mostrando así una tendencia diferente a lo esperado, en este sentido es posible que exista redundancia ecológica entre las especies de estas tres altitudes, ya que a pesar del cambio que pueda estar dándose en el ensamble de hormigas de cada altitud, existe la posibilidad de que algunos factores ecológicos sean similares entre las tres altitudes facilitando así la continuidad de las funciones ecológicas entre estos sitios (Brown et al. 2001) dentro de las hormigas que forrajean en el suelo.
Las medidas de similitud con sólo los datos de trampas de caída (la similitud estimada con los datos de hojarasca no muestran dicha tendencia, ver sección de resultados), el recambio de especies y el agrupamiento de Jaccard, dividen a la fauna de hormigas de la cuenca media del río Gaira en dos grupos, el primero entre 835 y 968 SNMS y el otro entre 1198 y 1395 SNMS. Este patrón también se presenta en otros sitios: Fagua (1999) encuentra que la estructura de la comunidad entre 600 y 1200 SNMS es similar, mientras que el ensamble de 1800 SNMS se aparta totalmente. Olson (1994) observa el mismo patrón en Panamá, en donde las tierras bajas tienen su propia fauna y tierras por encima de 1400 m estructuras diferentes. De igual forma para Kenya (Robertson 2002) y Madagascar (Fisher 1999a, 2002), muestran que los bosques de altitudes cercanas a 800 m y los bosques montanos por encima de 1250 m poseen ensambles diferentes.
A pesar que la similitud basada en la abundancia no define claramente la formación de los grupos (excepto para los datos de abundancia provenientes de las trampas de caída), la riqueza si ratifica este agrupamiento. El mayor recambio de especies se presenta entre las altitudes 968 y 1198 m mientras que el menor valor es entre 835 y 968 m, compartiéndose para este último grupo 32 especies, el resto de grupos comparten menos de 19 especies. Adicionalmente, el índice de Jaccard muestra los grupos de mayor similitud entre aquellos que comparte mayor número de especies. Por lo tanto, los sitios pertenecientes a altitudes medias dentro del gradiente estudiado, guardan una relación estrecha en su fauna de hormigas tal como se ha demostrado para hormigas de otras latitudes (Fisher 1996, 1999a, 2002) y otros taxones (McCain 2004).
Los patrones a los cuales se ajusta la riqueza y otros atributos cuantificados en la fauna de hormigas que habita a lo largo de la cuenca media de la vertiente Noroccidental de la SNMS, pueden presentarse debido a la confluencia de factores ambientales que reúne el gradiente altitudinal y que moldean la distribución de las especies y sus poblaciones, tal como se contempla en la regla de Rapoport (Folgarait et al. 2005, Almeida–Neto et al. 2006) y lo planteado en el efecto de altitudes intermedias dentro de un gradiente (Colwell & Lees 2000, Colwell et al. 2004). Así mismo, la fauna de hormigas que habita en la cuenca media puede estar afectada tanto por la estructura de la vegetación y sus cualidades, como por factores abióticos y físicos propios; altitudes como 1198 y 1395 m pertenecen a la misma zona de vida y comparten muchas entidades vegetales, haciendo de esto un posible corredor biológico para la fauna de hormigas. No obstante, a pesar de pertenecer a la misma zona de vida, la vegetación y sus características son diferentes para 835 y 968 m pero factores como la temperatura, humedad relativa y pendientes son similares, siendo cada uno de estos elementos determinantes en la distribución de las hormigas (Kaspari & Weiser 2000).
AGRADECIMIENTOS
Los autores agradecen al grupo de investigación en Insectos Neotropicales de la Universidad del Magdalena por la financiación parcial de esta investigación y la visita al Instituto Humboldt. A Damián Ramírez, Cesar Valverde, Erick Perdomo y Wilson Polo por la asistencia en campo. Los más sinceros agradecimientos a Mickey y Claudia Weber, y a todos los moradores de la Hacienda cafetera La Victoria (SNSM) por su generosa y desinteresada hospitalidad. Fernando Fernández, Elizabet Jiménez, Jeffry Sosa–Calvo contribuyeron en la identificación de muchas de las hormigas. Los autores expresan sus agradecimientos al comité editorial y a dos revisores anónimos por sus comentarios y sugerencias que coadyuvaron en el mejoramiento de la versión inicial de esta contribución. Este trabajo hace parte del proyecto "Insectos de la Sierra Nevada de Santa Marta" adscrito al grupo de investigación en Insectos Neotropicales de la Universidad del Magdalena.
LITERATURA CITADA
Agosti, D. & L.E. Alonso. 2000. The ALL protocol: a standard protocol for the collection of ground–dwelling ants. Pp. 204–206. In: D., Agosti, J. Majer, L. Alonso & T. Schultz (Eds.). Ants Standard Methods for Measuring and Monitoring Biodiversity: Smithsonian institution press, Washington, E.U. [ Links ]
Almeida–Neto, M., G. Machado, R. Pinto–da–Rocha & A.A. Giaretta. 2006. Harvestman (Arachnida: Opiliones) species distribution along three Neotropical elevational gradients: an alternative rescue effect to explain Rapoport's rule?. Journal of Biogeography, 33: 361–375. [ Links ]
Brehm, G., R.K Colwell & J. Kluge. 2007. The role of environment and mid–domain effect on moth species richness along a tropical elevational gradient. Global Ecology and Biogeography, 205–219. [ Links ]
Brown, J., S. Morgan, J. Parody & J. Haskell. 2001. Regulation of diversity: maintenance of species richness in changing environments. Oecologia, 126: 321–332. [ Links ]
Chacón, P., M.L. J. Baena, R.C. Bustos, Aldano, J.A. Aldano & M.A. Gamboa. 1996. Fauna de hormigas del departamento del Valle del Cauca (Colombia). Pp.413–451. In: M. G. Andrade, G. Amat, G. y F. Fernández (Eds.). Insectos de Colombia. Estudios Escogidos. Academia Colombiana de Ciencias Exactas, Física y Naturales. Colección Jorge Álvarez Lleras N° 10. Bogotá, Colombia. [ Links ]
Colwell, R.K 2006. EstimateS, Version 8.0: Statistical estimation of species richness and shared species from samples (Software and User's Guide). Freeware for Windows and Mac OS. [ Links ]
Colwell, R.K. & J.A. Coddington. 1994. Estimating terrestrial biodiversity trough extrapolation. Philosophical Transactions of the Royal Society of London, Biological Sciences, Serie B, 345: 101–118. [ Links ]
Colwell, R.K., & G.C. Hurtt. 1994. Nonbiological gradients in species richness and a spurious Rapoport effect. American Naturalist, 144: 570–595. [ Links ]
Colwell, R.K., & D.C. Lees. 2000. The mid–domain effect: geometric constraints on the geography of species richness. Trends in Ecology and Evolution, 15:70–76. [ Links ]
Colwell, R.K, C. Rahbek & N.J. Gotelli. 2004. The mid–domain effect and species richness patterns: what have we learned so far?. The American Naturalist, 163: E1–E23. [ Links ]
Escobar, F., J.M. Lobo, & G. Halffter. 2005. Altitudinal variation of dung beetle (Scarabaeidae: Scarabaeinae) assemblages in the Colombian Andes. Global Ecology and Biogeography, 14: 327–337. [ Links ]
Estrada, C., & F. Fernández. 1999. Diversidad de hormigas (Hymenoptera: Formicidae) en un gradiente sucesional del bosque nublado (Nariño, Colombia). Revista de Biología Tropical, 47(1): 189–201. [ Links ]
Fagua, G. 1999. Variación de las mariposas y hormigas de un gradiente altitudinal de la cordillera oriental (Colombia). Pp: 319–355. In: M. G. Andrade, G. Amat y F. Fernández (Eds.) Insectos de Colombia II. Estudios Escogidos. Academia Colombiana de Ciencias Exactas, Física y Naturales. Colección Jorge Álvarez Lleras N° 10. Bogotá, Colombia. [ Links ]
Fernandes, G.W. & P.W. Price. 1988. Biogeographical gradients in galling species richness. Oecologia, 76: 161–167. [ Links ]
Fernández F. & S. Sendoya. 2004. Lista de las hormigas neotropicales. Biota, 5(1): 3–109. [ Links ]
Fjeldsá, J. 1994. Geographical patterns for relict and young species of birds in Africa and South America and implications for conservation priorities. Biodiversity and Conservation, 3: 207–226. [ Links ]
Fisher, B.L. 1996. Ant diversity patterns along an elevational gradient in the reserve naturelle integrale d'andringitra, Madagascar. Fieldiana Zoology, 85: 93–108. [ Links ]
Fisher, B.L. 1999a. Ant diversity patterns along an elevational gradient in the réserve naturelle intégrale d'andohahela, Madagascar. Fieldiana Zoology, 94: 129–147. [ Links ]
Fisher, B.L. 1999b. Improving inventory efficiency: a case study of leaf litter ant diversity in Madagascar. Ecological Applications, 9: 714–731. [ Links ]
Fisher, B.L. 2002. Ant diversity patterns along an elevational gradient in the réserve spéciale de manongarivo, Madagascar. Págs.311–327. In: Gaultir, L. & S. M. Goodman (Eds.). Inventarie Floritique et Faunistique de la Réserve Spéciale de Manongarivo (NW Madagascar). [ Links ]
Fisher, B.L. & H. Robertson. 2002. Comparison and origin of forest and grassland ant assemblages in the high plateau of Madagascar (Hymenoptera: Formicidae). Biotropica, 34(1): 155–167. [ Links ]
Floren, A. & K. Linsenmair. 2001. The Influence of anthropogenic disturbances on the structure of arboreal arthropod communities. Plant Ecology, 3: 153–167. [ Links ]
Folgarait, P.J., O. Bruzzone, S.D. Porter, M.A. Pesquero & L.E. Gilbert. 2005. Biogeography and macroecology of phorid flies that attack fire ants in south–eastern Brazil and Argentina. Journal of Biogeography, 32(2): 353–367. [ Links ]
Frith, D. & C. Frith. 1990. Seasonality of litter invertebrate populations in an Australian upland tropical rainforest. Biotropica, 22:181–190. [ Links ]
Fundación Pro–Sierra Nevada de Santa Marta. 2000. Bases técnicas para la formulación de una estrategia de conservación ecorregional. Proyecto Conservación y uso sostenible de la biodiversidad en la Sierra Nevada de Santa Marta. Documento técnico. Colombia. 57 pp. [ Links ]
Gibb, H. & G. Hochuli. 2002. Habitat fragmentation in an urban environment: Large and small fragments support different arthropod assemblages. Biological Conservation, 106: 91–100. [ Links ]
Hölldobler, B. & Wilson, E.O. 1990. The ants. The Belknap Press of Harvard University Press, Cambridge, Massachusetts, E.U. 896 pp. [ Links ]
Kaspari, M., & M. Weiser. 2000. Ant activity along moisture gradients in a Neotropical forest. Biotropica,. 32(4): 703–711. [ Links ]
Kaspari, M., S. O'Donnell & J. Kercher. 2000. Energy, density and constraints to species richness: ant assemblages along a productivity gradient. American Naturalist, 155: 280–293. [ Links ]
Kaspari, M., M. Yuan & L. Alonso. 2003. Spatial grain and the causes of regional diversity gradients. American Naturalist,. 161(3): 459–77. [ Links ]
Kugler C. & M. Hincapie. 1983. Ecology of the ant Pogonomyrmex mayri: Distribution, abundance, and diet. Biotropica, 15(3): 190–198. [ Links ]
Levings, S.C. 1983. Seasonal, annual, and among–site variation in the ground ant community of a deciduous tropical forest: Some causes of patchy species distributions. Ecological Monographs, 53(4): 435–455. [ Links ]
Lieberman, D., M. Lieberman, R. Peralta & G.S. Hartshorn. 1996. Tropical forest structure on a large–scale altitudinal gradient in Costa Rica. The Journal of Ecology, 84(2): 137–152. [ Links ]
Lomolino, M.V. 2001. Elevation gradients of species–density historical and prospective views. Global Ecology and Biogeography,. 10: 3–13. [ Links ]
Magurran, A.E. 2004. Measuring Biological Diversity. Blackwell Publishing Company, U.K. 256 p. [ Links ]
McCain, C. 2004. The Mid–Domain effect applied to elevational gradients: Species richness of small mammals in Costa Rica. Journal of Biogeography, 31: 19–31. [ Links ]
MacCoy, E.D. 1990. The distribution of insects along elevational gradients. Oikos, 58: 313–332. [ Links ]
Olson, D.M. 1991. A Comparison of the efficacy of litter sifting and pitfall traps for sampling leaf litter ants (Hymenoptera: Formicidae) in a Tropical Wet Forest, Costa Rica. Biotropica, 23: 166–172. [ Links ]
Olson, D.M. 1994. The distribution of leaf litter invertebrates along a Neotropical altitudinal gradient. Journal of Tropical Ecology, 10: 129–150. [ Links ]
Palacio, E. 1999. Hormigas legionarias (Hymenoptera: Formicidae: Ecitoninae) de Colombia. Pp.117189. In: M. G. Andrade, G. Amat & F. Fernández (Eds.). Insectos de Colombia II. Estudios Escogidos. Academia Colombiana de Ciencias Exactas, Física y Naturales. Colección Jorge Álvarez Lleras N° 10. Capítulo XI. Bogotá, Colombia. [ Links ]
Quiroz–Robledo, L.N., J. Valenzuela–González & T. Suárez–Landa. 2002. Las hormigas ecitoninas (Formicidae: Ecitoninae) de la estación de biología tropical "Los Tuxtlas", Veracruz, México. Folia Entomológica Mexicana, 41(3): 261–281. [ Links ]
Rahbek, C. 1995. The elevational gradient of species richness: A uniform pattern?. Ecography, 18(2): 200–205. [ Links ]
Rahbek, C. 1997. The relationship among area, elevation, and regional species richness in neotropical birds. American Naturalist, 149: 875–902. [ Links ]
Ramírez, M., P. Chacón, I. Armbrecht & Z. Calle. 2001. Contribución al conocimiento de las Interacciones entre plantas, hormigas y homópteros en Bosques Secos de Colombia. Caldasia, 23(2): 523–536. [ Links ]
Rangel, O., P. Lowy, M. Aguilar & A. Garzón. 1997. Tipos de vegetación en Colombia. Diversidad Biótica II. Ed. Guadalupe. Bogotá, Colombia. 436 p. [ Links ]
Robertson, H. 2002. Comparison of leaf litter ant communities in woodlands, lowland forest and montane forest of North–Eastern Tanzania. Biodiversity and Conservation, 11: 1637–1652. [ Links ]
Romero, H. & K, Jaffé. 1989. A comparison of methods for sampling ants (Hymenoptera, Formicidae) in savannas. Biotropica, 21: 48–352. [ Links ]
Sanders, N.J. 2002. Elevational gradients in ant species richness: Area, geometry and Rapaport's rule. Ecography, 25: 25–32. [ Links ]
Sanders, N.J, J. Moss & D. Wagner. 2003. Patterns of ant species richness along elevational gradients in an arid ecosystem. Global Ecology and Biogeography, 11: 93–102. [ Links ]
Schultz, T.R. & T.P. McGlynn. 2000. The interactions of ants with others organism. Pp.35–44. In: Agosti, D., J. Majer, L. Alonso y T. Schultz. (Eds.). Ants Standard Methods for Measuring and Monitoring Biodiversity. Smithsonian institution press. Washington, E.U. [ Links ]
Sparrow, H. R., T.D. Sisk, P.R. Erlich, & D.D. Murphy. 1994. Techniques and guidelines for monitoring from neotropical butterflies. Conservation Biology, 8: 800–809. [ Links ]
StatSoft. 2004. STATISTICA, version 6. Statsoft. [ Links ]
Stevens, G.C. 1992. The elevational gradient in altitudinal range: an extension of Rapoport's latitudinal rule to altitude. American Naturalist, 140: 893–911. [ Links ]
Tamaris–Turizo, C. & H.J. López. 2006. Aproximación a la zonificación climática de la cuenca del río Gaira. Intropica, 3(1):52–59. [ Links ]
Ward, P.S. 2000. Broad–scale patterns of diversity in leaf litter ant communities. Pp.99–121. In: D., Agosti, J. Majer, L. Alonso y T. Schultz (Eds.). Ants Standard Methods for Measuring and Monitoring Biodiversity: Smithsonian institution press. Washington, E.U. [ Links ]














